Abstract
目的
比较地西他滨(DAC)联合半量CAG方案(D-CAG)与CAG方案治疗骨髓增生异常综合征伴原始细胞增多(MDS-EB)和急性髓系白血病伴骨髓增生异常相关改变(AML-MRC)的临床疗效及安全性。
方法
回顾性分析2011年5月至2017年3月42例初治MDS-EB和AML-MRC患者临床资料,21例接受D-CAG治疗,21例接受CAG方案治疗,诱导缓解后患者继续巩固化疗或进行allo-HSCT。比较两组患者的CR率、总有效率(ORR)、总生存(OS)率、无病生存(DFS)率和不良反应发生率。
结果
42例MDS-EB和AML-MRC患者中,男27例,女15例,中位年龄52.5(18~65)岁;MDS-EB 21例,AML-MRC 21例。D-CAG组和CAG组年龄、性别、疾病类型、基因突变类型和染色体核型差异均无统计学意义。D-CAG组2个疗程CR率为81.0%(17/21),高于CAG组的52.4%(11/21)(χ2=3.857,P=0.050)。D-CAG组与CAG组2个疗程后ORR分别为85.7%(18/21)与76.2%(15/21),差异无统计学意义(χ2=1.273,P=0.259)。D-CAG组和CAG组的中位随访时间分别为13(6~32)个月和15(2~36)个月,D-CAG组10例患者接受了allo-HSCT,CAG组7例患者接受了allo-HSCT。D-CAG组非移植患者的中位LFS时间为18.0(95%CI 6.6~29.4)个月,CAG组非移植患者的中位LFS时间为11.0(95%CI 0~23.9)个月,两组1年累积LFS率分别为(63.6±14.5)%和(50.0±13.4)%,差异无统计学意义(χ2=0.049,P=0.824)。D-CAG组11例非移植患者中2例死亡,CAG组非移植的14例患者中7例死亡,D-CAG组与CAG组非移植患者的1年累积OS率为(90.9±8.7)%对(61.5±13.5)%,D-CAG组高于CAG组,但差异无统计学意义(χ2=1.840,P=0.175)。D-CAG组主要的不良反应为骨髓抑制所致的感染,化疗后肺部感染发生率为42.9%,与CAG组(38.1%)差异无统计学意义(P=0.753)。
结论
DAC联合半量CAG方案治疗初治MDS-EB和AML-MRC患者的CR率高于CAG方案,且不良反应与CAG方案相当,对患者长期生存的影响有待进一步观察。
Keywords: 地西他滨, CAG方案, 骨髓增生异常综合征, 治疗结果
Abstract
Objective
To evaluate the clinical efficacy and safety of decitabine in combination with lower-dose CAG regimen (G-CSF, cytarabine and aclarubicin; D-CAG regimen) in the treatment of myelodysplastic syndromes with excess blasts (MDS-EB) and acute myeloid leukemia with myelodysplasia-related changes (AML-MRC), compared to standard CAG regimen.
Methods
A total of 42 patients with newly diagnosed MDS-EB and AML-MRC from May 2011 to March 2017 were included in the retrospective study. 21 cases were initially treated with G-CSF for priming, in combination with cytarabine of 10 mg/m2 q12h for 14 days and aclarubicin of 20 mg/d for 4 days (CAG regimen) and the other 21 cases were initially treated with decitabine of 20 mg/m2 for 5 days and lower-dose CAG regimen (cytarabine of 10 mg/m2 q12h for 7 days, aclarubicin of 10 mg/d for 4 days, and G-CSF for priming (D-CAG regimen). After two cycles of induction chemotherapy, the patients who obtained complete remission (CR) received consolidation chemotherapy or hematopoietic stem cell transplantation (HSCT).
Results
Among a total of 42 patients, the median age was 52.5 years (18–65 years) and 64.3% of them were male. Baseline characteristics of patients between D-CAG group and CAG group showed no significant differences. The CR for patients in D-CAG group was 81.0% (17/21), compared to 52.4% (11/21) in CAG group after 2 cycles of therapy (χ2=3.857, P=0.050). The overall response rate (ORR) for patients in D-CAG group and CAG group was 85.7% (18/21) and 76.2% (15/21) respectively, without significant difference (χ2=1.273, P=0.259). By December 2017, the median follow-up of D-CAG group and CAG group was 13(6–32) months and 15(2–36) months respectively. Finally, 10 patients in D-CAG group and 7 patients in CAG group received HSCT respectively. Except patients receiving HSCT, the median leukemia-free survival (LFS) time for patients in D-CAG group and CAG group was 18.0 (95%CI 6.6–29.4) months and 11.0 (95%CI 0–23.9) months respectively. Probabilities of 12 months LFS for D-CAG group and CAG group were (63.6±14.5)% and (50.0±13.4)% respectively, without difference (χ2=0.049, P=0.824). Except patients receiving HSCT, there were 2 deaths in D-CAG group and 7 deaths in CAG group respectively. The cumulative probabilities of 12 months OS for non-HSCT patients in D-CAG group and CAG group were (90.9±8.7)% and (61.5±13.5)% respectively, without significant difference (χ2=1.840, P=0.175). The incidences of side effects between D-CAG group and CAG group did not show significant differences (P=0.479), and the main side effects included cytopenias, pneumonia, infections of skin and soft tissues, neutropenic patients with fever, liver dysfunction.
Conclusion
The decitabine in combination with lower-dose CAG regimen improved CR for patients with MDS-EB and AML-MRC, and was a promising choice.
Keywords: D-CAG regimen, CAG regimen, Myelodysplastic syndromes, Treatment outcome
骨髓增生异常综合征(MDS)是起源于造血干/祖细胞的一组异质性髓系克隆性疾病,表现为无效造血、难治性血细胞减少、造血功能衰竭和高风险向急性髓系白血病(AML)转化。MDS和AML伴骨髓增生异常相关改变(AML-MRC)对常规化疗不敏感。单药地西他滨(DAC)治疗MDS和AML-MRC 2~3个疗程的完全缓解(CR)率为20%~64%,CAG方案(阿克拉霉素+阿糖胞苷+G-CSF)治疗1~2个疗程的CR率为35%~60%[1]–[4]。DAC联合半量CAG方案治疗初治MDS和AML的CR率为34.9%~100.0%[2],[5]–[7],尚未有针对骨髓增生异常综合征伴原始细胞增多(MDS-EB)和AML-MRC患者的报道。本文我们回顾性比较了我所采用DAC联合半量CAG和CAG方案治疗MDS-EB和AML-MRC的临床疗效及安全性,现报道如下。
病例与方法
1.病例:回顾性分析2011年5月至2017年3月北京大学人民医院收治的分别接受DAC+半量CAG(D-CAG)方案和CAG方案初治的MDS/AML患者各21例。接受以上两种治疗的患者均为MDS-EB和AML-MRC患者,MDS-EB和AML-MRC各21例。其中男27例,女15例;中位年龄52.5(18~65)岁,一般临床特征见表1。
表1. 地西他滨联合半量CAG方案(D-CAG)及CAG方案组MDS/AML患者基本情况比较.
| 临床特征 | D-CAG组(21例) | CAG组(21例) | 统计量 | P值 |
| 中位年龄[岁,M(范围)] | 52(18~65) | 56(26~64) | 0.710 | 0.482 |
| 性别(男/女) | 12/9 | 15/6 | 0.933 | 0.334 |
| 疾病类型[例(%)] | 0.382 | 0.537 | ||
| MDS-EB | 12(57.1) | 10(47.6) | ||
| AML-MRC | 9(42.9) | 11(52.4) | ||
| 基因突变[例(%)] | 6.453 | 0.265 | ||
| NPM1 | 0(0.0) | 1(4.8) | ||
| CEBPA双突变 | 0(0.0) | 1(4.8) | ||
| MLL-PTD | 4(19.0) | 3(14.3) | ||
| EVI | 3(14.3) | 0(0.0) | ||
| DEK-NUP214 | 1(4.8) | 0(0.0) | ||
| 无特异性基因 | 13(61.9) | 16(76.2) | ||
| 染色体核型[例(%)] | 4.800 | 0.091 | ||
| 正常核型 | 7(33.3) | 13(61.9) | ||
| 高危核型 | 9(42.9) | 3(14.3) | ||
| 其他核型 | 5(23.8) | 5(23.8) | ||
| IPSS预后分组[例(%)] | 2.741 | 0.433 | ||
| 中危-1 | 0(0.0) | 2(20.0) | ||
| 中危-2 | 5(41.7) | 3(30.0) | ||
| 高危 | 6(50.0) | 4(40.0) | ||
| 不能分组 | 1(8.3) | 1(10.0) | ||
| IPSS-R预后分组[例(%)] | 3.792 | 0.285 | ||
| 中危 | 1(8.3) | 0(0.0) | ||
| 高危 | 1(8.3) | 4(40.0) | ||
| 极高危 | 9(75.0) | 5(50.0) | ||
| 不能分组 | 1(8.3) | 1(10.0) |
注:MDS:骨髓增生异常综合征;AML:急性髓系白血病;CAG:阿克拉霉素+阿糖胞苷+G-CSF;AML-MRC:急性髓系白血病伴骨髓增生异常相关改变;MDS-EB:骨髓增生异常综合征伴原始细胞增多;IPSS:国际预后积分系统;IPSS-R:修订版国际预后积分系统
2.治疗方法:D-CAG方案:DAC 20 mg·m−2·d−1,静脉滴注>1 h,连用5 d;阿克拉霉素10 mg/d,静脉滴注,连用4 d;阿糖胞苷10 mg/m2每12 h 1次,静脉滴注,连用7 d;G-CSF 300 µg/d,皮下注射,连用7 d。CAG方案:阿克拉霉素20 mg/d,静脉滴注,连用4 d;阿糖胞苷10 mg/m2每12 h 1次,静脉滴注,连用14 d;G-CSF 300 µg/d,皮下注射,连用14 d。
3.疗效评价标准:参考MDS 2006年修订的IWG疗效标准,完全缓解(CR)定义为骨髓中原始细胞≤5%且所有细胞系成熟正常;部分缓解(PR)定义为骨髓原始细胞较治疗前减少≥50%,但仍>5%;有效定义为CR+PR。
4.不良反应的发生及处理:治疗期间定期检测血常规、肝肾功能和电解质,化疗后骨髓受抑,给予输注成分血纠正贫血或补充血小板,使用G-CSF刺激粒细胞生成等支持治疗,粒细胞缺乏期合并感染者给予抗生素治疗。
5.随访:通过电话、医院登记系统等方式对所有42例患者进行随访,随访截至2017年12月28日。总生存(OS)时间指患者确诊至随访截止或患者死亡的时间。无病生存(DFS)时间指患者达CR至复发、死亡或随访截止的时间。
6.统计学处理:采用SPSS 21.0软件进行统计分析。各组间CR率和总有效率(ORR)的比较采用χ2检验。Kaplan-Meier法估计OS时间,组间比较采用Log-rank检验。以双侧P≤0.05为差异有统计学意义。
结果
1.临床疗效:21例D-CAG组患者,1个疗程后CR 12例(57.1%),有效16例(76.2%),2个疗程后CR 17例(81.0%),有效18例(85.7%)。21例CAG组患者,1个疗程后CR 10例(47.6%),有效15例(71.4%),2个疗程后CR 11例(52.4%),有效15例(71.4%)。D-CAG组2个疗程CR率优于CAG组,差异有统计学意义(χ2=3.857,P=0.050)。
2.生存分析:截至随访终点,D-CAG组和CAG组的中位随访时间分别为13(6~32)个月和15(2~36)个月。21例D-CAG组患者中10例接受allo-HSCT,移植前9例达CR,1例疾病复发;11例非移植患者中2例死于原发病,移植患者中1例死于疾病复发,2例死于移植相关并发症。21例CAG组患者中7例接受allo-HSCT,移植前6例达CR,1例NR;14例非移植的患者中7例死于原发病,移植患者中1例死于疾病复发,2例死于移植相关并发症。
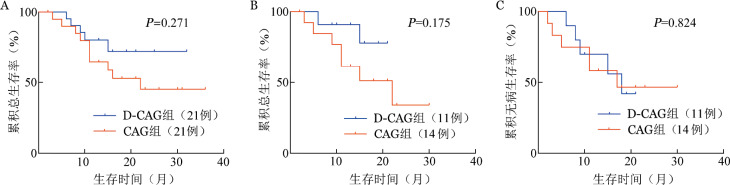
包括移植患者在内,D-CAG组和CAG组的累积OS率为(72.3±11.0)%对(45.6±12.1)%,D-CAG组高于CAG组,但差异无统计学意义(χ2=1.212,P=0.271)(图1A)。除外移植患者外,D-CAG组与CAG组患者的1年的累积OS率为(90.9±8.7)%对(61.5±13.5)%,D-CAG组高于CAG组,但差异无统计学意义(χ2=1.840,P=0.175)(图1B)。
图1. 地西他滨联合半量CAG方案(D-CAG)治疗骨髓增生异常综合征伴原始细胞增多和急性髓系白血病伴骨髓增生异常患者生存分析.
A:全部患者总生存;B:非移植患者总生存;C:非移植患者无病生存
D-CAG组非移植患者的中位DFS为18.0(95%CI 6.6~29.4)个月,CAG组非移植患者的中位DFS为11.0(95%CI 0~23.9)个月,两组6个月DFS率为(81.8±11.6)%对(64.3±12.8)%,累积DFS率为(38.2±16.4)%和(40.0±13.9)%,差异无统计学意义(χ2=0.049,P=0.824)(图1C)。
3.不良反应:所有患者化疗后均出现了血液系统的不良反应。其他常见不良反应包括肺部感染、皮肤软组织感染、粒细胞缺乏期发热而未发现明确感染灶、低血压、肝功能受损等,D-CAG组与CAG组之间各不良反应发生率差异均无统计学意义(P值均>0.05)(表2)。
表2. 地西他滨联合半量CAG方案(D-CAG)及CAG方案组MDS/AML患者不良反应比较.
| 不良反应 | D-CAG组 | CAG组 | P值 |
| 血液系统不良反应 | 21(100.0) | 21(100.0) | 1.000 |
| 非血液系统不良反应 | |||
| 肺部感染 | 9(42.9) | 8(38.1) | 0.753 |
| 皮肤和软组织感染 | 2(9.5) | 0(0.0) | 0.147 |
| 粒细胞缺乏期发热无明确感染灶 | 8(38.1) | 10(47.6) | 0.533 |
| 真菌感染 | 5(23.8) | 5(23.8) | 1.000 |
| 颅内感染 | 1(4.8) | 0(0.0) | 0.311 |
| 急性胆囊炎 | 1(4.8) | 0(0.0) | 0.311 |
| 低血压a | 0(0.0) | 1(4.8) | 0.311 |
注:MDS:骨髓增生异常综合征;AML:急性髓系白血病;a:继发性肾上腺皮质功能不全发生的低血压
讨论
MDS-EB对常规化疗不敏感,IPSS评分中危-2及高危的MDS向AML转化的风险极高。AML-MRC目前被认为是一种特殊类型的白血病,与AML-MRC相似,鉴于此类型患者多存在不良因素(如高龄、预后不良核型、一般状态差、常合并心肾等重要脏器疾病、耐药率高等),不能耐受标准剂量的化疗,且CR率低,因此对于不能耐受移植的MDS和AML-MRC患者,寻找低毒、高效的治疗方案非常重要。尽管一些新药相继出现,包括核苷类似物氟达拉滨和沙帕他滨、去甲基化药物DAC和阿扎胞苷等,但目前尚无这些药物治疗MDS-EB和AML-MRC的深入研究,NCCN及中国专家共识[17]均未给出特殊治疗方案。
DAC是一种脱氧胞苷类似物,通过降低DNA甲基化水平,使得沉默的抑癌基因恢复活性,刺激肿瘤细胞分化或凋亡,从而达到治疗肿瘤的目的。小剂量DAC主要用于治疗MDS,可改善生活质量[8]–[10],延迟向白血病转化[11],但对OS率无影响[10]。DAC单药用于治疗AML的报道有限。超小剂量DAC(10 mg/d×10 d)用于治疗中高危MDS和难治性AML的ORR为40%[2]。2016年Welch等[12]报道了使用20 mg·m−2·d−1×10 d或5 d DAC治疗116例具有不良遗传学异常和分子学异常或TP53异常的AML或MDS患者结果,其缓解率要高于低中危(71例)的AML/MDS患者,其中高危患者(43例)有效率为67%,TP53异常患者(21例)的有效率为100%,而中低危患者有效率为34%。DAC无法清除这些患者中所有的白血病特异性突变,因此维持缓解的时间有限。而后又有研究将DAC与其他化疗方案结合以期获得更高疗效[18]–[19]。
CAG方案在亚洲广泛使用,日本Yamada等[13]报道CAG方案用于治疗难治性AML的CR率为62%~86%,中位生存期为8~17个月。一项Meta分析收集了1995–2010年间发表的35个临床试验结果,共1 029例患者,其中CAG方案治疗初治AML的CR率为56.7%,治疗MDS-RAEB的CR率为45.7%[1]。
本研究中,DAC联合半量CAG治疗MDS-EB、AML-MRC的CR率为81.0%、ORR为85.7%,CR率明显高于CAG组(52.4%,P=0.050)。而且,D-CAG组累积OS率和6个月DFS率高于CAG组,虽然无统计学意义,但初步结论仍提示着DAC联合半量CAG可提高患者OS和DFS率。目前发表的小剂量DAC联合半量CAG、改良CAG或全量CAG方案的研究见表3,较大型报道为Qian等[14]报道的85例和王萍[2]报道的60例,二者CR率分别为64.7%和20%。王萍使用10 mg/d×5 d DAC+全量CAG方案,Qian等使用15 mg·m−2·d−1×5 d DAC+半量CAG方案,后者的CR率明显高于前者。而本研究数据又高于Qian等的报道,考虑原因可能由于本组患者中位年龄(52.5岁)明显低于Qian等研究中患者中位年龄(68岁),且Qian等研究中MDS-RAEB2患者约占一半。Wang等[16]多中心MDS患者移植数据显示,接受HSCT患者13个月的累积OS率为70%~80%,而本研究D-CAG组非移植患者中位随访13个月的OS率为77.9%,与Wang等[16]HSCT患者OS水平相当;但Wang等[16]研究中高危MDS患者移植后4年累积OS率仍可接近60%,而本研究随访时间较短,D-CAG方案能否改善非移植患者长期生存情况,尚需追踪长期随访结果。
表3. 小剂量地西他滨(DAC)联合CAG方案治疗MDS和AML文献资料.
| 参考文献 | 例数 | 疾病类型 | 治疗方案 |
疗效 |
||||
| DAC剂量 | 联合化疗方案 | CR例数 | CR率(%) | 有效例数 | 有效率(%) | |||
| 王萍[2] | 60 | 中高危MDS和难治性AML | 10 mg/d×5 d | 全量CAG | 12 | 20.0 | 19 | 44.0 |
| 高苏等[3] | 23 | MDS/AML | 20 mg·m−2·d−1×3~5 d | 半量CAG | 8 | 34.9 | 13 | 56.5 |
| 乔爱国[5] | 9 | 中高危MDS | 14 mg·m−2·d−1×5 d | 小剂量CAG | 4 | 44.4 | 8 | 88.9 |
| 吕茹迪等[6] | 16 | 中高危MDS | 25 mg·m−2·d−1×3 d | 半量CAG | 6 | 37.5 | 12 | 75.0 |
| 张云平等[7] | 12 | 中高危MDS | 15 mg·m−2·d−1×5 d | 半量CAG | 9 | 75.0 | 12 | 91.7 |
| Li等[14] | 85 | AML | 15 mg·m−2·d−1×5 d | 半量CAG | 55 | 64.7 | 70 | 82.4 |
| 杨梨等[15] | 9 | 中高危MDS | 15 mg·m−2·d−1×5 d | 半量CAG | 9 | 100.0 | 9 | 100.0 |
注:MDS:骨髓增生异常综合征;AML:急性髓系白血病;半量CAG:阿糖胞苷10 mg/m2每12 h 1次×7 d,阿克拉霉素10~20 mg/d×3~4 d,G-CSF 300 µg/d×14 d;小剂量CAG:阿糖胞苷10 mg/m2每12 h 1次×7 d,阿克拉霉素10 mg·m−2·d−1×4 d,G-CSF 200 µg·m−2·d−1×14 d
DAC治疗后的主要不良反应为骨髓抑制及其所致的肺部感染,经过积极的抗感染治疗及输血、G-CSF等对症支持治疗后,不良反应得到了有效控制。ADOPT临床试验中,使用DAC的患者中肺部感染的发生率为11%,低于我本研究D-CAG组患者的42.9%,不除外粒细胞缺乏期患者共用病房等客观因素所致差距。本研究中,D-CAG组与CAG组患者的不良反应发生率差异无统计学意义。
本研究初步表明DAC联合半量CAG方案治疗MDS-EB及AML-MRC有效,但由于样本量小,研究结果在统计学上可能存在偏倚,DAC是否能改善此群患者的生存有待多中心前瞻性大样本临床研究进一步证实。
Funding Statement
基金项目:首都临床特色应用研究基金(Z181100001718126)
Fund program: Capital Characteristic Clinic Project Foundation (Z181100001718126)
References
- 1.Wei G, Ni W, Chiao JW, et al. A meta-analysis of CAG (cytarabine, aclarubicin, G-CSF) regimen for the treatment of 1029 patients with acute myeloid leukemia and myelodysplastic syndrome[J] J Hematol Oncol. 2011;4:46. doi: 10.1186/1756-8722-4-46. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.王 萍. 超小剂量的地西他滨联合CAG方案治疗中高危骨髓增生异常综合征及难治性白血病的效果分析[J] 中国继续医学教育. 2016;8(5):146–147. [Google Scholar]
- 3.高 苏, 仇 惠英, 金 正明, et al. 地西他滨单药及联合半程和全程CAG方案治疗骨髓增生异常综合征和急性髓系白血病疗效观察[J] 中华血液学杂志. 2014;35(11):961–965. doi: 10.3760/cma.j.issn.0253-2727.2014.11.001. [DOI] [Google Scholar]
- 4.Blum W, Garzon R, Klisovic RB, et al. Clinical response and miR-29b predictive significance in older AML patients treated with a 10-day schedule of decitabine[J] Proc Natl Acad Sci U S A. 2010;107(16):7473–7478. doi: 10.1073/pnas.1002650107. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.乔 爱国. 地西他滨联合小剂量CAG方案治疗骨髓增生异常综合征疗效观察[J] 世界最新医学信息文摘(连续型电子期刊) 2015;15(98):20–21. [Google Scholar]
- 6.吕 茹迪, 杨 艳丽, 李 佳佳, et al. 地西他滨治疗骨髓增生异常综合征的临床疗效和不良反应观察[J] 当代医学. 2017;23(31):36–40. [Google Scholar]
- 7.张 云平, 吴 文忠, 崔 国兴. 地西他滨联合CAG方案与单纯CAG方案治疗中、高危骨髓增生异常综合征的疗效比较[J] 中国实验血液学杂志. 2014;22(5):1341–1344. doi: 10.7534/j.issn.1009-2137.2014.05.030. [DOI] [PubMed] [Google Scholar]
- 8.Kantarjian H, Issa JP, Rosenfeld CS, et al. Decitabine improves patient outcomes in myelodysplastic syndromes: results of a phase III randomized study[J] Cancer. 2006;106(8):1794–1803. doi: 10.1002/cncr.21792. [DOI] [PubMed] [Google Scholar]
- 9.Steensma DP, Baer MR, Slack JL, et al. Multicenter study of decitabine administered daily for 5 days every 4 weeks to adults with myelodysplastic syndromes: the alternative dosing for outpatient treatment (ADOPT) trial[J] J Clin Oncol. 2009;27(23):3842–3848. doi: 10.1200/JCO.2008.19.6550. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Lübbert M, Suciu S, Baila L, et al. Low-dose decitabine versus best supportive care in elderly patients with intermediate- or high-risk myelodysplastic syndrome (MDS) ineligible for intensive chemotherapy: final results of the randomized phase III study of the European Organisation for Research and Treatment of Cancer Leukemia Group and the German MDS Study Group[J] J Clin Oncol. 2011;29(15):1987–1996. doi: 10.1200/JCO.2010.30.9245. [DOI] [PubMed] [Google Scholar]
- 11.Silverman LR, Demakos EP, Peterson BL, et al. Randomized controlled trial of azacitidine in patients with the myelodysplastic syndrome: a study of the cancer and leukemia group B[J] J Clin Oncol. 2002;20(10):2429–2440. doi: 10.1200/JCO.2002.04.117. [DOI] [PubMed] [Google Scholar]
- 12.Welch JS, Petti AA, Miller CA, et al. TP53 and Decitabine in acute myeloid leukemia and myelodysplastic syndromes[J] N Engl J Med. 2016;375(21):2023–2036. doi: 10.1056/NEJMoa1605949. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Yamada K, Furusawa S, Saito K, et al. Concurrent use of granulocyte colony-stimulating factor with low-dose cytosine arabinoside and aclarubicin for previously treated acute myelogenous leukemia: a pilot study[J] Leukemia. 1995;9(1):10–14. [PubMed] [Google Scholar]
- 14.Li J, Chen Y, Zhu Y, et al. Efficacy and safety of decitabine in combination with G-CSF, low-dose cytarabine and aclarubicin in newly diagnosed elderly patients with acute myeloid leukemia[J] Oncotarget. 2015;6(8):6448–6458. doi: 10.18632/oncotarget.3361. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.杨 梨, 罗 红春, 汪 晶, et al. 地西他滨单药或联合半量CAG方案治疗骨髓增生异常综合征的临床研究[J] 检验医学与临床. 2016;13(12):1601–1602,1605. [Google Scholar]
- 16.Wang Y, Wang HX, Lai YR, et al. Haploidentical transplant for myelodysplastic syndrome: registry-based comparison with identical sibling transplant[J] Leukemia. 2016;30(10):2055–2063. doi: 10.1038/leu.2016.110. [DOI] [PubMed] [Google Scholar]
- 17.中华医学会血液学分会. 骨髓增生异常综合征诊断与治疗中国专家共识(2014年版)[J] 中华血液学杂志. 2014;35(11):1042–1048. doi: 10.3760/cma.j.issn.0253-2727.2014.11.023. [DOI] [Google Scholar]
- 18.Wu W, Lin Y, Xiang L, et al. Low-dose decitabine plus all-trans retinoic acid in patients with myeloid neoplasms ineligible for intensive chemotherapy[J] Ann Hematol. 2016;95(7):1051–1057. doi: 10.1007/s00277-016-2681-3. [DOI] [PubMed] [Google Scholar]
- 19.郝 杰, 王 黎, 王 艳煜, et al. 地西他滨联合DAG方案等三种方案治疗复发、难治急性髓系白血病疗效的比较分析[J] 中华血液学杂志. 2014;35(6):481–485. doi: 10.3760/cma.j.issn.0253-2727.2014.06.001. [DOI] [Google Scholar]