Abstract
目的
探索γ射线照射诱导胸腺损伤后胸腺内IL-22表达水平的变化趋势,并研究IL-22在胸腺损伤后T细胞免疫重建中的作用。
方法
建立非致死剂量γ射线照射诱导的小鼠胸腺损伤模型,分别设置正常对照组和全身照射(TBI)组,ELISA法检测小鼠胸腺及血浆中IL-22的含量;分别给予TBI组小鼠PBS或重组小鼠IL-22腹腔注射处理,设为TBI+PBS组和TBI+IL-22组,计数胸腺内总细胞和外周血白细胞含量,同时使用流式细胞术分析胸腺上皮细胞(thymic epithelial cells,TEC)、各阶段胸腺细胞以及外周血T细胞的含量,实时定量PCR分析胸腺中与TEC功能相关的基因Foxn1、Ccl25、Aire和Dll4的mRNA表达水平。
结果
①照射后小鼠胸腺内IL-22表达水平高于未经照射处理的正常对照小鼠(P值均<0.05);②给予TBI组小鼠IL-22腹腔注射后,TBI+IL-22组小鼠胸腺内IL-22含量高于TBI+PBS组(P值均<0.05);③照射后第14天,TBI+IL-22组胸腺内Foxn1、Ccl25、Aire和Dll4 mRNA表达水平均高于TBI+PBS组(P值均<0.05),同时,TBI+IL-22组胸腺总细胞计数[(5.93±3.19)×106/ml对(1.42±0.46)×106/ml,t=3.128,P=0.033]和外周白细胞计数[(3.08±0.94)×106/ml对(1.43±0.30)×106/ml,t=3.730,P=0.015]均高于TBI+PBS组。流式细胞术分析示,照射后第14天TBI+IL-22组小鼠胸腺内TEC和各胸腺细胞亚群含量均高TBI+PBS组(P值均<0.05),照射后第7天和14天TBI+IL-22组外周血T细胞含量均高于TBI+PBS组(P值均<0.05)。
结论
γ射线照射处理可导致小鼠胸腺内IL-22的含量升高,注射外源性IL-22可增加胸腺内IL-22含量。输注外源性IL-22可促进受损胸腺内TEC功能的修复,并增加各胸腺细胞亚群以及外周血中T细胞的数量。
Keywords: 白细胞介素22, 胸腺, 全身照射, T细胞免疫重建
Abstract
Objective
To explore the levels of IL-22 in thymus damaged by γ-ray total body irradiation (TBI), and to study the role of IL-22 in T cell reconstitution after thymic injury induced by TBI.
Methods
To induce thymic injury, mice were treated by sub-lethal TBI. Levels of intra-thymic and circulatory IL-22 were detected by using ELISA assay. Untreated mice were used as control. After receiving sub-lethal TBI, mice were intraperitoneally injected with PBS or recombinant mouse IL-22, which were marked as TBI+PBS or TBI+IL-22, respectively. Mice were monitored for counts of total thymic cells and circulatory white blood cells. Flow cytometry was applied to analyze percentages of thymic epithelial cells (TEC), thymocyte subsets and circulatory T cells. Real-time PCR assay was applied to analyze the mRNA expression levels of Foxn1, Ccl25, Aire and Dll4 in thymus.
Results
①Sub-lethal TBI treated mice expressed higher levels of intra-thymic and circulatory IL-22, compared with untreated ones (all P<0.05). ②After injection of recombinant IL-22, TBI+IL-22 mice had higher levels of intra-thymic IL-22 than TBI+PBS mice (all P<0.05). ③On day 14 after irradiation, real-time PCR assay showed that TBI+IL-22 mice had higher mRNA levels of Foxn1, Ccl25, Aire and Dll4 in thymus compared with TBI+PBS ones. Meanwhile, the TBI+IL-22 mice had higher counts of total thymic cells[(5.93±3.19)×106/ml vs (1.42±0.46)×106/ml, t=3.128, P=0.033] and circulatory white blood cells[(3.08±0.94)×106/ml vs (1.43±0.30)×106/ml, t=3.730, P=0.015] than those of TBI+PBS mice. Flow cytometry analysis indicated that TBI+IL-22 mice had higher counts of TEC and thymocytes than TBI+PBS mice on day 14 after irradiation (all P<0.05). On days 7 and 14 after irradiation, TBI+IL-22 mice had higher counts of circulatory white blood cells and T cells than TBI+PBS mice (all P<0.05).
Conclusion
Sub-lethal TBI induces upregulation of intra-thymic IL-22, and injecting of recombinant IL-22 increases level of IL-22 in thymus. Injecting of recombinant IL-22 improves recovery of TEC and increases numbers of thymocyte subsets and circulatory T cell after thymic injury.
Keywords: IL-22, Thymus, Total body irradiation, T cell reconstitution
胸腺作为机体的中枢免疫器官,是T细胞发育成熟的场所,胸腺上皮细胞(thymic epithelial cells,TEC)为胸腺细胞的发育提供生长因子和信号刺激,构成T细胞发育依赖的首要微环境[1]。胸腺对放化疗敏感,allo-HSCT预处理可严重损害TEC功能,减少胸腺细胞和外周成熟T细胞的数量,继而增加感染及自身免疫性疾病发生的风险[2]–[3]。近期有研究发现,IL-22具有促进TEC受损后修复的作用。IL-22是IL-10家族细胞因子,主要来源于αβT细胞、γδT细胞、NKT细胞和天然淋巴样细胞(innate lymphoid cells,ILC)[4]–[6],通过结合IL-22受体发挥作用,具有促进上皮细胞增殖和维持上皮细胞稳态的作用[7]。本研究中,我们观察了小鼠胸腺受损后胸腺内IL-22表达水平变化趋势,并分析输注IL-22对胸腺损伤后TEC修复和T细胞免疫重建的影响。
材料与方法
1.实验动物:BALB/c小鼠,雌性,SPF级,10~12周龄,体重20~24 g,购自北京维通利华实验动物技术有限公司,饲育于屏障环境中。
2.主要试剂:DMEM培养基、胎牛血清均购自美国Gibco公司;重组小鼠IL-22购自美国Peprotech公司;10×溶血素购自美国BD公司,经蒸馏水稀释为1×溶血素工作液;LightCycler 480 SYBR Green I Master定量PCR试剂盒、CollagenaseⅣ、DNase I及DispaseⅡ均购自瑞士Roche公司;IL-22 ELISA试剂盒购自美国eBioscience公司;流式细胞术检测所用小鼠单克隆抗体购自美国BD及Biolegend公司;TRIzol试剂购自美国Life Technlogies公司;M-MLV购自美国Invitrogen公司。
3.小鼠胸腺损伤模型的建立与分组:将BALB/c小鼠分为4组:正常对照组(n=30)、全身照射(TBI)组(n=25)、TBI+PBS组(n=15)和TBI+IL-22组(n=15)。TBI:除正常对照组外,其他各组小鼠照射前7天起改饮含320 µg/ml庆大霉素的无菌酸化水(pH 3.0~4.0),每只小鼠TBI总剂量为5.5 Gy,照射率为0.5 Gy/min。照射前1天、照射当天、照射后第1天对TBI+PBS组小鼠腹腔注射0.01 mol/L PBS溶液0.2 ml,对TBI+IL-22组小鼠腹腔注射重组小鼠IL-22 200 µg·kg−1·d−1。正常对照组不作任何处理。
4.外周血白细胞计数及T细胞比例分析:分别取10只TBI+PBS组和TBI+IL-22组小鼠,随机分为2组,每组5只,分别于照射后第7及14天取小鼠的外周血10 µl,2.5%醋酸溶液稀释20倍,计数白细胞;使用小鼠CD4、CD8、CD45及CD3单克隆抗体标记外周血标本,经1×溶血素裂解红细胞后,流式细胞术分析T细胞比例,根据白细胞计数计算T细胞计数。每个样本设2个复管。
5.ELISA法分析血浆和胸腺中IL-22浓度:分别取15只正常对照组和TBI组小鼠,随机分为5组,每组3只,分别于照射当天及照射后第1、3、5、7天,麻醉后经眼眶取血500 µl,EDTA抗凝,离心后保留血浆;随后处死小鼠,取胸腺,置于1 ml无血清DMEM培养基中,轻柔研磨分散胸腺组织,离心细胞悬液后,保留上清。根据ELISA试剂盒说明书检测血浆和胸腺组织研磨上清中的IL-22浓度。每个样本设3个复孔。
6.胸腺组织单细胞悬液的获取:分别取10只TBI+PBS组和TBI+IL-22组小鼠,随机分为2组,每组5只,分别于照射后第7及14天取胸腺组织,置于1 ml无血清DMEM培养基中,轻柔研磨分散胸腺组织后使用含Collagenase Ⅳ(1 mg/ml)和DNase Ⅰ(0.5 mg/ml)的无血清DMEM培养基重悬细胞,37 °C消化20 min,每5 min振荡1次;离心后,使用上述消化液再次消化。消化结束后,将细胞悬液合并,离心弃上清;使用含DispaseⅡ(1 mg/ml)的无血清DMEM培养基重悬细胞,37 °C消化5 min,立即加入8~10 ml含10%胎牛血清DMEM培养基终止消化;离心后,使用含EDTA(0.01 mol/L)的PBS液重悬细胞,获得胸腺单细胞悬液。获取的细胞一半用于定量PCR分析,一半用于胸腺内细胞的计数。
7.定量PCR分析mRNA表达量:采用TRIzol试剂提取小鼠胸腺总RNA,经M-MLV逆转录获得cDNA。使用定量PCR试剂盒检测Foxn1、Ccl25、Aire及Dll4 mRNA的相对表达水平,以Actb为内参,反应体系及反应条件按照试剂盒说明书进行操作。采用2−ΔΔCt计算mRNA相对表达水平。每个样本设3个复孔。
8.胸腺总细胞、胸腺上皮细胞及各胸腺细胞亚群的计数:吸取5 µl胸腺单细胞悬液,2.5%醋酸溶液稀释100倍,计数胸腺总细胞;使用小鼠CD4、CD8、Lin、CD25、CD44、CD45及EpCAM单克隆抗体标记胸腺单细胞悬液,流式细胞术分析各细胞亚群的比例,根据胸腺总细胞计数计算各亚群的计数。每个样本设2个复管。
9.统计学处理:采用SPSS 16.0软件进行统计学分析,计量资料采用均数±标准差表示,两组间比较采用t检验(数据符合正态分布)。P<0.05表示差异有统计学意义。
结果
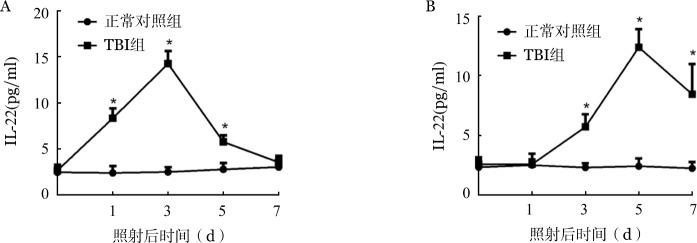
1.TBI对胸腺内和血浆中IL-22表达水平的影响:照射前,TBI组小鼠胸腺内IL-22含量为(2.45±0.66)pg/ml,照射后IL-22含量均迅速上升,照射后第1、3、5天IL-22含量均高于正常对照组(P值均<0.05),并于照射后第7天恢复至较低水平(图1A)。照射后TBI组小鼠血浆中IL-22含量亦高于正常对照组(P值均<0.05)(图1B)。
图1. 全身照射(TBI)前后小鼠胸腺内(A)及血浆(B)中IL-22表达水平变化(设3个复孔,*P<0.05).
为进一步明确给予外源性IL-22是否可以增加胸腺IL-22的含量,我们在照射前1天、照射当天及照射后1天给予小鼠腹腔注射重组小鼠IL-22 200 µg·kg−1·d−1,以腹腔注射PBS溶液小鼠为对照。结果显示,TBI+IL-22组小鼠胸腺IL-22含量在照射后第3天为(62.80±29.76)pg/ml,第5天为(10.36±1.12)pg/ml,TBI+PBS组分别为(14.25±1.36)pg/ml和(5.76±0.72)pg/ml,两组比较差异有统计学意义(第3天:t=3.938,P=0.004;第5天:t=12.351,P<0.001)。提示注射IL-22可增加照射后胸腺IL-22含量。
2.注射IL-22对TEC修复的影响:照射后第14天,TBI+IL-22组小鼠胸腺内总细胞计数为(5.93±3.19)×106/ml,TEC计数为(6.05±1.56)×104/ml,均高于TBI+PBS组(P值均<0.05)(表1)。定量PCR结果显示,照射后TBI+IL-22组小鼠胸腺内与TEC功能相关的基因Foxn1、Ccl25、Aire及Dll4 mRNA表达上调,均高于TBI+PBS组(P值均<0.05)(表2)。
表1. 注射外源性IL-22后小鼠胸腺总细胞和胸腺上皮细胞(TEC)计数变化(x±s).
| 组别 | 鼠数 | 胸腺总细胞计数(×106/ml) |
TEC计数(×104/ml) |
||
| 照射后第7天 | 照射后第14天 | 照射后第7天 | 照射后第14天 | ||
| TBI+PBS组 | 5 | 1.42±0.90 | 1.42±0.46 | 1.27±0.70 | 3.00±0.61 |
| TBI+IL-22组 | 5 | 3.71±2.46 | 5.93±3.19 | 3.12±1.59 | 6.05±1.56 |
| t值 | 1.958 | 3.128 | 2.390 | 4.066 | |
| P值 | 0.107 | 0.033 | 0.058 | 0.009 | |
注:TBI:全身照射;TEC的表型为CD45−EpCAM+,设2个复管
表2. 注射外源性IL-22后小鼠胸腺上皮细胞功能相关基因的表达(x±s).
| 组别 | 鼠数 | Foxn1 | Ccl25 | Aire | Dll4 |
| TBI+PBS组 | 5 | 1.40±0.60 | 0.99±0.33 | 0.95±0.19 | 2.16±0.67 |
| TBI+IL-22组 | 5 | 7.06±2.68 | 5.91±3.51 | 11.31±9.58 | 14.64±5.39 |
| t值 | 4.609 | 3.118 | 2.416 | 5.134 | |
| P值 | 0.008 | 0.035 | 0.042 | 0.006 | |
注:TBI:全身照射;设3个复孔
3.注射IL-22对胸腺细胞和外周T细胞重建的影响:照射后第7和14天,TBI+IL-22组双阳性胸腺细胞(double positive,DP)计数和双阴性胸腺细胞(double negative,DN)计数均高于TBI+PBS组(P值均<0.05)。照射后第14天,TBI+IL-22组单阳性胸腺细胞(single positive,SP)计数高于TBI+PBS组(P=0.016)。照射后第7天,TBI+IL-22组和TBI+PBS组的SP细胞计数差异无统计学意义(表3)。
表3. 注射外源性IL-22后小鼠胸腺中各亚群细胞计数(x±s).
| 组别 | 鼠数 | DP计数(×106/ml) |
SP计数(×105/ml) |
DN计数(×105/ml) |
|||
| 照射后第7天 | 照射后第14天 | 照射后第7天 | 照射后第14天 | 照射后第7天 | 照射后第14天 | ||
| TBI+PBS组 | 5 | 0.89±0.46 | 0.96±0.44 | 4.99±4.45 | 3.82±0.73 | 0.24±0.20 | 0.79±0.98 |
| TBI+IL-22组 | 5 | 1.69±0.09 | 5.91±1.52 | 3.72±1.31 | 10.68±3.89 | 0.95±0.38 | 3.76±1.01 |
| t值 | 3.825 | 6.987 | 0.612 | 3.867 | 3.674 | 4.720 | |
| P值 | 0.016 | 0.001 | 0.569 | 0.016 | 0.006 | 0.002 | |
注:TBI:全身照射;DP:双阳性胸腺细胞,表型为CD45+CD4+CD8+;SP:单阳性胸腺细胞,表型为CD45+CD4+CD8−和CD45+CD4−CD8+;DN:双阳性胸腺细胞,表型为CD45+Lin−CD8−CD4−。设2个复管
外周血白细胞计数显示,TBI+IL-22组小鼠外周血中白细胞计数在照射后第14天时为(3.08±0.94)×106/ml,高于TBI+PBS组(t=3.730,P=0.015);TBI+IL-22组外周血中T细胞计数在照射后第7天为(4.07±2.20)×105/ml,第14天时达到(6.16±2.25)× 105/ml,均高于TBI+PBS组(P值均<0.05);其中,TBI+IL-22组CD4+和CD8+T细胞计数在照射后第7和14天时均高于TBI+PBS组(P值均<0.05)(表4)。
表4. 注射IL-22后小鼠外周血白细胞、T细胞、CD4+ T细胞和CD8+ T细胞计数(x±s).
| 组别 | 鼠数 | 白细胞计数(×106/ml) | T细胞计数(×105/ml) | CD4+T细胞计数(×105/ml) | CD8+ T细胞计数(×105/ml) | ||||
| 照后第7天 | 照后第14天 | 照后第7天 | 照后第14天 | 照后第7天 | 照后第14天 | 照后第7天 | 照后第14天 | ||
| TBI+PBS组 | 5 | 0.93±0.30 | 1.43±0.30 | 0.86±0.21 | 2.87±1.11 | 0.68±0.11 | 2.17±0.78 | 0.14±0.09 | 0.54±0.24 |
| TBI+IL-22组 | 5 | 1.28±0.33 | 3.08±0.94 | 4.07±2.20 | 6.16±2.25 | 3.19±1.71 | 4.69±1.73 | 0.64±0.38 | 1.32±0.57 |
| t值 | 1.774 | 3.730 | 3.244 | 2.938 | 3.288 | 2.976 | 2.860 | 2.802 | |
| P值 | 0.114 | 0.015 | 0.031 | 0.027 | 0.030 | 0.027 | 0.041 | 0.035 | |
注:TBI:全身照射;设2个复管
讨论
TEC功能受损可引起成熟T细胞数量减少和自身反应性T细胞的释放,表现为免疫功能低下或自身耐受的缺失。放化疗、应激和allo-HSCT预处理等因素可严重损害胸腺功能[8]–[9],并增加感染及自身免疫性疾病的发生率。Allo-HSCT后,T细胞免疫功能缺陷主要体现在两个方面:①T细胞数量减少导致机体免疫防御功能减弱,增加了巨细胞病毒(CMV)机会性感染的可能;②T细胞自身耐受性的缺失可导致移植物抗宿主病(GVHD)的发生。促进allo-HSCT后T细胞重建的途径有两条:一方面通过直接刺激外周T细胞增殖而快速提高T细胞数量,但存在加重GVHD的风险;另一方面,促进胸腺修复,加速胸腺内T细胞发育,既能增加外周T细胞数量,又能促进T细胞自身耐受[10]。促进胸腺修复是实现良好T细胞免疫重建的理想策略。
已有研究提示,角质细胞生长因子(KGF)可在胸腺受损时保护TEC,体内研究中发现KGF可以促进TEC的增殖,IL-7由TEC和成纤维细胞产生并作用于前体T细胞,通过PI3K/Akt和JAK/STAT通路促进其增殖和分化,生长激素亦可促进TEC的增殖及受损胸腺功能的恢复[11],该类研究为促进allo-HSCT后T细胞免疫重建提供了新的思路。近期的研究表明,IL-22具有调节上皮细胞稳态作用,可促进肠道和TEC增殖[12]。IL-22识别细胞表面的IL-22受体通过JAK/STAT3通路发挥生物学效应[13]。JAK/STAT通路是调控上皮细胞增殖分化的重要信号通路之一。有研究提示,STAT3是维持小鼠胚胎期和成年TEC稳态的关键要素[14]。此外,IL-22亦可活化MAPK通路进行信号传递[13]。我们的研究发现IL-22具有促进胸腺受损后修复TEC的潜力,在照射诱导的胸腺损伤模型中,给予TBI小鼠腹腔注射IL-22 200 µg·kg−1·d−1×3 d处理,结果显示,输注IL-22可增加胸腺中TEC的数量,提示IL-22可能发挥促进TEC增殖的作用。另一方面,IL-22基因缺失降低了胸腺内Foxn1、Ccl25、Aire及Dll4基因的表达水平,Foxn1基因在小鼠胚胎期和出生后的TEC发育中起主导作用,并影响胸腺细胞的成熟。Ccl25、Aire及Dll4基因受Foxn1调节,其中Ccl25是Ccr9的配体,能够募集胸腺前体细胞至胸腺,Aire基因调节胸腺基质细胞表达多种自身抗原,在自身免疫耐受中发挥重要作用,Dll4基因对T细胞分化有关键作用[15],由此可见,IL-22不仅可以促进TEC数量恢复,亦促进TEC功能的修复。本研究中我们检测了胸腺内上述基因的表达水平,进一步探索TEC内这些基因的表达水平将更加精准地了解IL-22对胸腺功能的影响。除调控T细胞发育之外,TEC在T细胞迁徙出入胸腺的过程中亦发挥重要调节作用,本研究中照射后第7天TBI+IL-22组外周血中T细胞计数高于TBI+PBS组,而此时TBI+IL-22组TEC的数量并未显著增加,该现象可能与IL-22改善胸腺输出功能有关。
本研究中,我们发现胸腺中IL-22水平在照射后短暂升高,提示胸腺具有一定的自我修复能力,但该作用持续时间短,围照射期应用外源性IL-22可增强胸腺修复的能力。此外,IL-22具有免疫调节作用,有研究发现IL-22可减轻肠道急性GVHD,另一些研究则表明IL-22介导皮肤GVHD以及皮肤自身免疫性疾病的发生[4]。因此,仍需进一步阐明allo-HSCT中IL-22产生的时相、组织分布情况以及对靶组织GVHD发生的影响,综合判断在allo-HSCT中应用外源性IL-22的利弊。
Funding Statement
基金项目:国家自然科学基金(81671584、81300377、81500088)
Fund program: National Natural Science Foundation of China (81671584, 81300377, 81500088)
References
- 1.Hamazaki Y. Adult thymic epithelial cell (TEC) progenitors and TEC stem cells: Models and mechanisms for TEC development and maintenance[J] Eur J Immunol. 2015;45(11):2985–2993. doi: 10.1002/eji.201545844. [DOI] [PubMed] [Google Scholar]
- 2.Petrie HT, Zúñiga-Pflücker JC. Zoned out: functional mapping of stromal signaling microenvironments in the thymus[J] Annu Rev Immunol. 2007;25:649–679. doi: 10.1146/annurev.immunol.23.021704.115715. [DOI] [PubMed] [Google Scholar]
- 3.Wils EJ, van der Holt B, Broers AE, et al. Insufficient recovery of thymopoiesis predicts for opportunistic infections in allogeneic hematopoietic stem cell transplant recipients[J] Haematologica. 2011;96(12):1846–1854. doi: 10.3324/haematol.2011.047696. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Dudakov JA, Hanash AM, van den Brink MR. Interleukin-22: immunobiology and pathology[J] Annu Rev Immunol. 2015;33:747–785. doi: 10.1146/annurev-immunol-032414-112123. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Dudakov JA, Hanash AM, Jenq RR, et al. Interleukin-22 drives endogenous thymic regeneration in mice[J] Science. 2012;336(6077):91–95. doi: 10.1126/science.1218004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Rutz S, Eidenschenk C, Ouyang W. IL-22, not simply a Th17 cytokine[J] Immunol Rev. 2013;252(1):116–132. doi: 10.1111/imr.12027. [DOI] [PubMed] [Google Scholar]
- 7.Hernandez P, Gronke K, Diefenbach A. A catch-22: Interleukin-22 and cancer[J] Eur J Immunol. 2018;48(1):15–31. doi: 10.1002/eji.201747183. [DOI] [PubMed] [Google Scholar]
- 8.Krenger W, Blazar BR, Holländer GA. Thymic T-cell development in allogeneic stem cell transplantation[J] Blood. 2011;117(25):6768–6776. doi: 10.1182/blood-2011-02-334623. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Dertschnig S, Hauri-Hohl MM, Vollmer M, et al. Impaired thymic expression of tissue-restricted antigens licenses the de novo generation of autoreactive CD4+ T cells in acute GVHD[J] Blood. 2015;125(17):2720–2723. doi: 10.1182/blood-2014-08-597245. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Chaudhry MS, Velardi E, Malard F, et al. Immune reconstitution after allogeneic hematopoietic stem cell transplantation: time to T up the thymus[J] J Immunol. 2017;198(1):40–46. doi: 10.4049/jimmunol.1601100. [DOI] [PubMed] [Google Scholar]
- 11.Chaudhry MS, Velardi E, Dudakov JA, et al. Thymus: the next (re) generation[J] Immunol Rev. 2016;271(1):56–71. doi: 10.1111/imr.12418. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Yang X, Zheng SG. Interleukin-22: a likely target for treatment of autoimmune diseases[J] Autoimmun Rev. 2014;13(6):615–620. doi: 10.1016/j.autrev.2013.11.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Mitra A, Raychaudhuri SK, Raychaudhuri SP. IL-22 induced cell proliferation is regulated by PI3K/Akt/mTOR signaling cascade[J] Cytokine. 2012;60(1):38–42. doi: 10.1016/j.cyto.2012.06.316. [DOI] [PubMed] [Google Scholar]
- 14.Lomada D, Jain M, Bolner M, et al. Stat3 Signaling Promotes Survival And Maintenance Of Medullary Thymic Epithelial Cells[J] PLoS Genet. 2016;12(1):e1005777. doi: 10.1371/journal.pgen.1005777. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Vaidya HJ, Briones LA, Blackburn CC. FOXN1 in thymus organogenesis and development[J] Eur J Immunol. 2016;46(8):1826–1837. doi: 10.1002/eji.201545814. [DOI] [PMC free article] [PubMed] [Google Scholar]