Abstract
目的
探讨人T淋巴细胞白血病(T-ALL)细胞株Jurkat细胞分泌性卷曲相关蛋白(SFRP)基因甲基化及去甲基化诱导细胞凋亡对Wnt/β-catenin信号通路的影响。
方法
以不同浓度(1.0、2.0、4.0 µmol/L)5-杂氮-2′-脱氧胞苷(5-Aza-CdR)对Jurkat细胞进行去甲基化处理,采用MTT法观察5-Aza-CdR对Jurkat细胞增殖的抑制作用,流式细胞术检测细胞凋亡率,甲基化特异性PCR(MSP)法检测药物处理前后SFRP基因的甲基化状态,实时荧光定量PCR检测SFRP基因以及RT-PCR检测survivin、c-myc和cyclin D1基因mRNA的表达改变,Western blot鉴定处理前后β-catenin的蛋白表达。
结果
1.0、2.0、4.0 µmol/L 5-Aza-CdR对Jurkat细胞的增殖有明显抑制作用,呈时间-剂量依赖性(P<0.05);流式细胞术检测显示5-Aza-CdR作用Jurkat细胞48 h后,不同浓度5-Aza-CdR处理组与对照组比较细胞早期凋亡率明显升高(P<0.05);SFRP1、SFRP2、SFRP4、SFRP5基因甲基化水平随5-Aza-CdR浓度升高而下降,呈剂量依赖性(P<0.05),同时mRNA表达水平较对照组明显上调(P<0.05);Jurkat细胞总蛋白中β-catenin的蛋白表达随5-Aza-CdR浓度的升高而逐渐下降,呈剂量依赖性(P<0.05);凋亡相关基因survivin、c-myc和cyclin D1的mRNA表达随5-Aza-CdR浓度的增高而降低,呈剂量依赖性(P<0.05)。
结论
逆转Jurkat细胞SFRP基因的甲基化,可以恢复SFRP基因转录表达,通过阻断β-catenin蛋白抑制Wnt/β-catenin信号通路的激活而诱导细胞凋亡。
Keywords: SFRP基因, DNA甲基化, Wnt/β-catenin, Jurkat细胞, 细胞凋亡
Abstract
Objective
To study the promoter methylation status of SFRP genes and the effect of 5-aza-2′-deoxycytidine (5-Aza-CdR) induced apoptosis via Wnt/β-catenin pathway by demethylation in Jurkat cells.
Methods
Jurkat cells were treated with different concentrations of 5-Aza-CdR. The cell proliferation level of Jurkat cells was detected by MTT assay. Apoptosis was evaluated by flow cytometry. Methylation-spcific PCR (MSP) was used to determine the methylation status of SFRP genes. The expressions of SFRP genes were detected by real time fluorescence quantitative PCR. The mRNA expression levels of survivin, c-myc and cyclin-D1 were analyzed by RT-PCR. Western blot was used to detect the levels of β-catenin protein.
Results
Compared with control group, the different concentrations of 5-Aza-CdR could significantly inhibit the proliferation of Jurkat cells in a time-dose dependent manner (P<0.05). After being treated by 5-Aza-CdR for 48 hours, the cell early apoptosis rate in experiment group was significantly higher than that in control group (P<0.05). The promoters of SFRP1, SFRP2, SFRP4, SFRP5 genes were hypermethylation state in the control group, after being treated by 5-Aza-CdR for 72 hours, the brightness of SFRP1, SFRP2, SFRP4, SFRP5 genes' methylation strips weakened in a dose-dependent manner. SFRP mRNA expression increased (P<0.05) when 5-Aza-CdR concentration increased, and the level of β-catenin protein was dampened in a dose-dependent manner (P<0.05). As compared to the control group, the mRNA expressions of associated apoptosis genes survivin, c-myc and cyclin-D1, respectively were obviously down-regulated in a dose-dependent manner (P<0.05).
Conclusion
The effect of demethylation could up-regulate SFRP genes expressions by reversing its hypermethylation and induced apoptosis by down-regulation of β-catenin and associated apoptosis genes.
Keywords: SFRP genes, DNA methylstion, Wnt/β-catenin, Jurkat cells, Apoptosis
Wnt/β-catenin信号通路在细胞的生长、发育、凋亡、迁移、信号传递等方面起着重要的调控作用,其异常激活与人类多种肿瘤的发生关系密切[1]。分泌性卷曲相关蛋白(secreted frizzled-related protein,SFRP)基因家族是Wnt/β-catenin信号通路的抑制基因。研究证实SFRP基因启动子CpG岛(CpG island)频繁甲基化导致的基因表达沉默是通路异常激活引发肿瘤的重要机制[2]–[3]。研究表明,Wnt/β-catenin信号通路还能调控造血干细胞自我更新的过程[4],推测其异常活化可能也参与了血液肿瘤的发生和发展。
本研究中,我们采用经典甲基转移酶抑制剂5-杂氮-2′-脱氧胞苷(5-Aza-CdR)去甲基化干预人T淋巴细胞白血病Jurkat细胞株,应用甲基特异性聚合酶链反应(MSP)的方法检测干预前后SFRP基因启动子区的甲基化状态和表达改变,以及去甲基化作用对β-catenin蛋白表达、细胞凋亡的影响。探讨Jurkat细胞中DNA去甲基化作用介导Wnt/β-catenin信号通路中调控因子的变化诱导细胞凋亡的可能机制。
材料与方法
1.细胞及主要试剂:实验用的人T淋巴细胞白血病Jurkat细胞株由福建省血液病研究所传代保存。5-Aza-CdR、蛋白酶K、RNA酶、亚硫氢钠、氢醌(对苯二酚)、PRMI 1640、胎牛血清等均为美国Sigma公司产品;酚-氯仿DNA抽提液、焦碳二乙酯(DEPC)和Trizol试剂均为上海生工生物工程公司产品;Annexin Ⅴ FITC/PI凋亡检测试剂盒购自南京凯基生物公司;亚硫氢盐修饰试剂盒购自美国Promega公司;Platinum SYBR Green Ⅰ qPCR SuperMix-UDG试剂盒购自上海Invitrogen公司;2×Taq PCR MasterMix试剂盒购自北京博迈德生物公司;鼠抗人β-catenin单克隆抗体、鼠抗人β-actin单克隆抗体购自美国Milipore公司;辣根过氧化物酶标记的抗鼠二抗购自中杉金桥生物公司;化学发光法(ECL)发光液购自厦门鹭隆生物公司;引物由上海Invitrogen公司合成。
2.细胞培养:细胞株常规复苏后,用含10%胎牛血清的RPMI 1640培养液(pH 7.2),于37 °C、饱和湿度、5%CO2培养箱中培养,隔天传代1次,实验用细胞为对数生长期细胞。
3.实验分组:实验设不加5-Aza-CdR对照组和1.0、2.0、4.0 µmol/L 5-Aza-CdR处理组。
4.MTT法检测细胞增殖抑制率:取对数生长期的Jurkat细胞,按1.5×105/ml密度接种于96孔培养板。每组设5个平行孔,分别于加药后24、48、72 h加入20 µl MTT(5 mg/ml),继续孵育4 h,离心去上清,每孔加入100 µl二甲基亚枫(DMSO)后在酶标仪上检测492 nm波长下各孔的吸光度(A)值。实验重复3次。按以下公式计算细胞增殖抑制率。
5.流式细胞术检测细胞凋亡率:收集对照组和5-Aza-CdR处理组作用48 h后的Jurkat细胞,离心,去上清后用1×结合缓冲液调整细胞密度为(2~5)×105/ml;每份加入195 µl缓冲液及5 µl FIFC-Annexin Ⅴ,避光孵育10 min,离心,去上清;加入190 µl缓冲液及10 µl PI,避光孵育10 min, 1 h内行流式细胞术检测,计算细胞凋亡率。实验重复3次。
6.MSP检测SFRP基因的甲基化状态:不同浓度5-Aza-CdR作用72 h后,分别收集对照组和各处理组细胞,常规酚-氯仿法提取细胞基因组DNA,参考文献[4]的方法并加以改进,用亚硫氢盐修饰试剂盒修饰纯化DNA。取修饰后的DNA 3 µl为模板进行PCR扩增,反应条件:95 °C预变性4 min, 95 °C变性45 s, 60 °C退火30 s, 72 °C延伸30 s,共35个循环,最后72 °C再延伸10 min. PCR产物行20 g/L琼脂糖凝胶电泳并在凝胶图像分析仪上自动分析成像。实验重复3次。
7.实时荧光定量PCR (RQ-PCR)检测SFRP基因表达水平:收集对照组和4.0 µmol/L 5-Aza-CdR处理组作用72 h后的Jurkat细胞,以Trizol试剂一步法提取细胞总RNA并鉴定RNA的完整性。以2 µg RNA为模板逆转录合成cDNA。采用美国ABI公司7500型实时荧光定量PCR仪和Platinum SYBR Green Ⅰ qPCR SuperMix-UDG试剂盒(Invitrogen公司产品)进行PCR扩增。反应条件:95 °C 1 min,95 °C 5 s,60 °C 1 min,40个循环。结果采用2−ΔΔCt法进行相对定量分析,以管家基因3-磷甘油醛脱氢酶(GAPDH)为内参照。实验重复3次。
8.Western blot法检测β-catenin蛋白的表达:不同浓度5-Aza-CdR作用72 h后,分别收集对照组和各处理组细胞,提取细胞总蛋白质并测定浓度。取30 µg蛋白,行120 g/L SDS-PAGE后4 °C、恒流250 mA下电转膜1.5 h,以50 g/L的脱脂奶粉封闭2 h,与鼠抗人β-catenin单克隆抗体、鼠抗人β-actin单克隆抗体共孵育4 °C过夜,洗膜后分别与辣根过氧化物酶标记的抗鼠二抗孵育1 h,加入ECL发光试剂后在暗室曝光、显影、照相及结果分析。实验重复3次。
9.RT-PCR法检测survivin、c-myc和cyclin D1 mRNA表达水平:取cDNA 1 µl为模板,采用美国ABI公司7700型PCR仪和2×Taq PCR MasterMix试剂盒进行PCR扩增。反应条件:95 °C预变性5 min,95 °C变性30 s,适宜退火温度下30 s, 72 °C延伸30 s,共30个循环,最后72 °C再延伸10 min。以GAPDH为内参照,PCR产物行2%琼脂糖凝胶电泳并在凝胶图像分析仪上自动分析成像。实验重复3次。
10.统计学处理:应用SPSS17.0统计软件进行统计学分析,计量资料以x±s表示,多组比较采用单因素方差分析,不同时间和组间结果比较采用F检验。P<0.05为差异有统计学意义。
结果
1.5-Aza-CdR对Jurkat细胞的增殖抑制作用:1.0、2.0、4.0 µmol/L 5-Aza-CdR作用24、48、72 h,对Jurkat细胞增殖均有明显抑制作用,表现为时间和剂量依赖性(表1)。
表1. 5-杂氮-2′脱氧胞苷(5-Aza-CdR)对Jurkat细胞的增殖抑制作用(x±s,n=3).
| 组别 | 细胞增殖抑制率(%) |
||
| 24 h | 48 h | 72 h | |
| 对照组 | 0 | 0 | 0 |
| 5-Aza-CdR处理组 | |||
| 1.0 µmol/L | 18.23 ± 1.62 | 26.57±2.29 | 36.07±2.58 |
| 2.0 µmol/L | 36.19±0.84 | 52.05±1.59 | 64.57±0.48 |
| 4.0 µmol/L | 47.51 ±0.59 | 71.51±1.26 | 82.38±1.10 |
注:同一浓度组不同时间点及同一时间点不同浓度组的结果比较,P值均<0.001
2.5-Aza-CdR对Jurkat细胞凋亡的影响:1.0、2.0、4.0 µmol/L 5-Aza-CdR作用细胞48 h后,细胞凋亡率随药物浓度的增高逐渐增加,早期凋亡率分别为(22.23±0.76)%、(34.26±1.27)%、(61.83±1.76)%,而不加药对照组为(4.73±0.32)%,差异有统计学意义(P<0.05)。
3.5-Aza-CdR对Jurkat细胞SFRP基因甲基化状态的影响:1.0、2.0、4.0 µmol/L 5-Aza-CdR处理细胞72 h后,MSP分析示随着药物浓度升高,SFRP1、SFRP2、SFRP4和SFRP5基因的甲基化水平逐渐降低,差异有统计学意义(P<0.05)(图1),提示SFRP基因的高甲基化状态被逆转。
图1. 5-杂氮-2′-脱氧胞苷(5-Aza-CdR)对Jurkat细胞SFRP基因甲基化状态的影响.

M:Marker;1:对照组;2、3、4 分别为1.0、2.0、4.0 µmol/L 5-Aza-CdR处理组
4.甲基化的MSP产物序列分析:为证实MSP分析基因甲基化的可靠性,随机挑选了应用SFRP2基因甲基化引物扩增的PCR产物,经T-A克隆后测序,测序结果证明该MSP产物是野生型SFRP2基因启动子区的部分序列(图2),其分析结果完全可靠。甲基化的SFRP2基因,其CpG岛二核苷中的胞嘧啶碱基(C)未被亚硫氢盐硫化改变,仍为C碱基。而在非CpG岛中的C碱基经亚硫氢盐修饰后都转变成胸腺嘧啶碱基(T)。
图2. SFRP2基因甲基化PCR产物片段测序分析图.
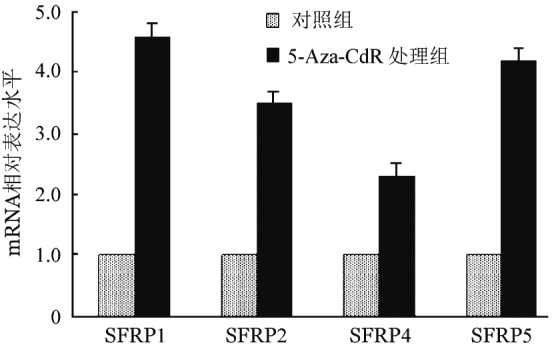
5.5-Aza-CdR对Jurkat细胞SFRP基因mRNA表达的影响:MSP结果显示,4.0 µmol/L 5-Aza-CdR组去甲基化处理72 h,SFRP基因的甲基化逆转程度最大。因此,选取4.0 µmol/L组的Jurkat细胞作为研究对象,实时定量RT-PCR结果显示,终浓度为4.0 µmol/L的5-Aza-CdR组中SFRP1、SFRP2、SFRP4和SFRP5基因表达水平均明显升高,分别是对照组中表达水平的4.6、3.5、2.3、4.2倍(图3),提示SFRP基因的高甲基化状态被逆转,甲基化沉默的SFRP基因被激活转录。
图3. 4.0 µmol/L 5-杂氮-2′-脱氧胞苷(5-Aza-CdR)对Jurkat细胞SFRP基因mRNA表达的影响.
6.5-Aza-CdR对Jurkat细胞β-catenin蛋白表达的影响:1.0、2.0、4.0 µmol/L 5-Aza-CdR处理细胞72 h后,随着5-Aza-CdR浓度的增加,各组Jurkat细胞总蛋白中的β-catenin表达明显降低,其中4.0 µmol/L组的蛋白表达最低,而对照组表达量最高,差异有统计学意义(P<0.05)(图4)。
图4. 不同浓度5-杂氮-2′脱氧胞苷(5-Aza-CdR)对Jurkat细胞β-catenin蛋白表达的影响.

1:对照组;2、3、4分别为1.0、2.0、4.0 µmol/L 5-Aza-CdR处理组
7.5-Aza-CdR对Jurkat细胞survivin、c-myc、和cyclin D1基因mRNA表达的影响:1.0、2.0、4.0 µmol/L 5-Aza-CdR处理细胞72 h后,RT-PCR结果显示,Wnt/β-catenin通路下游的凋亡相关靶基因survivin、c-myc、和cyclin D1 mRNA表达水平随5-Aza-CdR浓度的增加而降低,并具有浓度依赖性(图5)(P<0.05)。
图5. 不同浓度5-杂氮-2′-脱氧胞苷(5-Aza-CdR)对Jurkat细胞凋亡相关基因表达的影响.

M:Marker;1:对照组;2、3、4分别为1.0、2.0、4.0 µmol/L 5-Aza-CdR处理组
讨论
Wnt/β-catenin信号通路抑制基因的表达沉默导致通路异常激活可促进乳腺癌、结肠癌、肺癌、膀胱癌等肿瘤细胞的生长、增殖及凋亡抑制。研究表明,Wnt/β-catenin信号通路中多种抑制基因表达下调或缺失并非基因突变引起,而是由基因启动子区域高甲基化导致的表观遗传修饰所致[5]–[6]。由于Wnt/β-catenin信号通路在造血干细胞自我更新过程中的重要性,Wnt/β-catenin信号通路的失控可能是血液肿瘤潜在的发病基础。最新的研究发现在急性髓系白血病中SFRP基因家族均出现了高频率的甲基化改变[7]。Hou等[8]在166例急性髓系白血病患者中发现61.7%的患者出现至少1种抑制基因的甲基化,其中SFRP1、DKK-1、Wif-1、SFRP2、SFRP5、SFRP4的甲基化比例分别为31.6%、30.1%、26.0%、19.3%、12.6%、1.5%。王焱等[9]的研究证实多种白血病细胞中存在SFRP1基因的异常甲基化和表达缺失。本课题组的前期研究发现,87例急性白血病患者SFRP1、SFRP2、SFRP4、SFRP5基因甲基化总阳性率分别为35.6%、25.3%、12.6%、17.2%,并均存在表达下调[10]–[12]。以上实验结果表明,SFRP基因作为肿瘤抑制基因,其甲基化模式改变是白血病发生过程中的普遍现象,推测SFRP基因的甲基化沉默导致Wnt/β-catenin信号异常活化是白血病发生的机制之一。
正常生理情况下,SFRP基因作为Wnt/β-catenin信号通路的负调控因子,可持续阻断Wnt/β-catenin信号,在SFRP基因发生甲基化沉默后则失去这种作用[13]。β-catenin是Wnt/β-catenin信号通路中有调控转录活性的关键成员,负责激活靶基因的转录,是正向调节因素。Wnt/β-catenin信号通路异常激活时,β-catenin在胞质内蓄积并转移至核内,在核内与T细胞转录因子-4(TCF-4)结合后激活靶基因c-myc、cyclinD1、survivin、BMP-4和MMP等的转录和表达,因而促进肿瘤细胞的增殖[14]–[16]。
既往研究认为Wnt/β-catenin信号通路在淋巴细胞发育的多个阶段中具有重要作用,且该通路上多基因的甲基化沉默被认为是儿童及成人急性淋巴细胞白血病无病生存及总生存的独立不良预后因素[17]。本研究中,我们采用人T淋巴细胞白血病Jurkat细胞株作为实验对象,应用MSP技术发现在Jurkat细胞中SFRP1、SFRP2、SFRP4、SFRP5基因普遍存在高甲基化状态及表达水平下降,同时在细胞总蛋白中β-catenin蛋白水平升高,提示在Jurkat细胞中由于SFRP基因的表观遗传学沉默失去了对Wnt/β-catenin信号的抑制作用,继而使核心蛋白β-catenin表达增加,启动细胞增殖、抗凋亡等恶性生物学效应。本研究应用甲基转移酶抑制剂5-Aza-CdR干预Jurkat细胞,随着药物浓度的增加,SFRP基因的甲基化水平逐渐下降、mRNA表达水平上调,显示SFRP基因的甲基化沉默被逆转并诱导表达。同时细胞学实验显示Jurkat细胞增殖受到抑制,细胞早期凋亡比例升高,总蛋白中β-catenin蛋白水平随之下降。RT-PCR结果也显示抗凋亡基因survivin,调节细胞周期和细胞生存、增殖相关的cyclin D1、细胞分化和凋亡相关的c-myc基因的表达均同时降低,因此可证实当SFRP甲基化状态被逆转后诱导转录表达,Wnt/β-catenin信号则被抑制,直接导致胞质及胞核蛋白中的β-catenin表达下调,失去转录调控作用,并且β-catenin蛋白/TCF-4转录因子复合物与其特异性DNA结合序列的结合活性也随之下降,导致其不能有效启动下游靶基因的表达从而失去维持细胞存活的能力,启动Jurkat细胞凋亡。
Funding Statement
基金项目:福建省自然科学基金(2015J01327)
Fund program: Natural Science Foundation of Fujian Province(2015J01327)
References
- 1.Ochoa-Hernández AB, Juárez-Vázquez CI, Rosales-Reynoso MA, et al. WNT-β-catenin signaling pathway and its relationship with cancer[J] Cir Cir. 2012;80(4):389–398. [PubMed] [Google Scholar]
- 2.Shin H, Kim JH, Lee YS, et al. Change in gene expression profiles of secreted frizzled-related proteins (SFRPs) by sodium butyrate in gastric cancers: induction of promoter demethylation and histone modification causing inhibition of Wnt signaling[J] Int J Oncol. 2012;40(5):1533–1542. doi: 10.3892/ijo.2012.1327. [DOI] [PubMed] [Google Scholar]
- 3.Kaur P, Mani S, Cros MP, et al. Epigenetic silencing of sFRP1 activates the canonical Wnt pathway and contributes to increased cell growth and proliferation in hepatocellular carcinoma[J] Tumour Biol. 2012;33(2):325–336. doi: 10.1007/s13277-012-0331-5. [DOI] [PubMed] [Google Scholar]
- 4.Holland JD, Klaus A, Garratt AN, et al. Wnt signaling in stem and cancer stem cells[J] Curr Opin Cell Biol. 2013;25(2):254–264. doi: 10.1016/j.ceb.2013.01.004. [DOI] [PubMed] [Google Scholar]
- 5.Rawson JB, Manno M, Mrkonjic M, et al. Promoter methylation of Wnt antagonists DKK1 and SFRP1 is associated with opposing tumor subtypes in two large populations of colorectal cancer patients[J] Carcinogenesis. 2011;32(5):741–747. doi: 10.1093/carcin/bgr020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Chen PC, Tsai MH, Yip SK, et al. Distinct DNA methylation epigenotypes in bladder cancer from different Chinese sub-populations and its implication in cancer detection using voided urine[J] BMC Med Genomics. 2011;4:45. doi: 10.1186/1755-8794-4-45. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Ghasemi A, Rostami S, Chahardouli B, et al. Study of SFRP1 and SFRP2 methylation status in patients with de novo Acute Myeloblastic Leukemia[J] Int J Hematol Oncol Stem Cell Res. 2015;9(1):15–21. [PMC free article] [PubMed] [Google Scholar]
- 8.Hou HA, Kuo YY, Liu CY, et al. Distinct association between aberrant methylation of Wnt inhibitors and genetic alterations in acute myeloid leukaemia[J] Br J Cancer. 2011;105(12):1927–1933. doi: 10.1038/bjc.2011.471. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.王 焱, 朱 珣珣, 朱 传升, et al. 白血病细胞SFRP1基因甲基化状态及三氧化二砷对其作用的初步研究[J] 中华血液学杂志. 2013;34(2):157–159. doi: 10.3760/cma.j.issn.0253-2727.2013.02.015. [DOI] [Google Scholar]
- 10.徐 成波, 沈 建箴, 沈 松菲, et al. 分泌型卷曲相关蛋白基因甲基化状态检测在急性白血病中的意义[J] 中华内科杂志. 2010;49(9):769–771. doi: 10.3760/cma.j.issn.0578-1426.2010.09.012. [DOI] [PubMed] [Google Scholar]
- 11.徐 成波, 冯 敏, 廖 斌, et al. 急性白血病细胞系中SFRP基因甲基化及去甲基化诱导表达的研究[J] 中国病理生理杂志. 2013;29(8):1447–1451. doi: 10.3969/j.issn.1000-4718.2013.08.019. [DOI] [Google Scholar]
- 12.Shen JZ, Xu CB, Fu HY, et al. Methylation of secreted frizzled related protein gene in acute leukemia patients in China[J] Asian Pac J Cancer Prev. 2011;12(10):2617–2621. [PubMed] [Google Scholar]
- 13.Saito-Diaz K, Chen TW, Wang X, et al. The way Wnt works: components and mechanism[J] Growth Factors. 2013;31(1):1–31. doi: 10.3109/08977194.2012.752737. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Ring A, Kim YM, Kahn M. Wnt/catenin signaling in adult stem cell physiology and disease[J] Stem Cell Rev. 2014;10(4):512–525. doi: 10.1007/s12015-014-9515-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Ge X, Wang X. Role of Wnt canonical pathway in hematological malignancies[J] J Hematol Oncol. 2010;3:33. doi: 10.1186/1756-8722-3-33. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Voronkov A, Krauss S. Wnt/beta-catenin signaling and small molecule inhibitors[J] Curr Pharm Des. 2013;19(4):634–664. doi: 10.2174/138161213804581837. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Weerkamp F, van Dongen JJ, Staal FJ. Notch and Wnt signaling in T-lymphocyte development and acute lymphoblastic leukemia[J] Leukemia. 2006;20(7):1197–1205. doi: 10.1038/sj.leu.2404255. [DOI] [PubMed] [Google Scholar]



