Abstract
目的
研究地拉罗司对伴有铁过载的再生障碍性贫血(AA)患者的祛铁疗效及安全性。
方法
分析64例伴铁过载的AA患者经地拉罗司治疗12个月后的祛铁疗效,并进行安全性评估。
结果
所有患者地拉罗司的起始剂量为20.0 mg·kg−1·d−1,平均剂量为(18.6±3.60)mg·kg−1·d−1。经12个月治疗后,中位血清铁蛋白(SF)水平由基线的4 924(2 718~6 765)µg/L(64例)降到3 036(1 474~5 551)µg/L(23例),降幅达38%,SF降低量的中位数为651(126~2 125)µg/L;23例完成12个月治疗的患者SF中位水平由基线的5 271(3 420~8 278)µg/L降到3 036(1 474~5 551)µg/L,降幅达到42%,SF降低量的中位数为1 167(580~4 806)µg/L。血肌酐增高(40.98%)、胃肠道不适(40.98%)是地拉罗司治疗期间最主要的不良事件,其次为肝脏转氨酶增高(ALT: 21.31%;AST: 13.11%)、蛋白尿(24.59%)。血肌酐增高呈可逆性、非进行性。对于合并使用环孢素的38例患者,12例(31.8%)连续2次肌酐值>正常值上限(ULN),10例(26.3%)连续2次肌酐值>1.33基线值,仅1例(2.6%)血清肌酐升高超过1.33基线值并超过ULN。对于AST和ALT,整个研究中都没有患者发生两次基线后值>5×ULN或>10×ULN。对于基线PLT水平低于50×109/L的患者,地拉罗司治疗期间中位PLT未降低。
结论
地拉罗司治疗伴有铁过载的AA患者可获得较好祛铁疗效,药物耐受性良好,无临床不可控的严重不良事件。
Keywords: 贫血,再生障碍性, 铁超负荷, 地拉罗司, 祛铁螯合疗法
Abstract
Objective
To explore the efficacy and safety of deferasirox in aplastic anemia (AA)patients with iron overload.
Methods
A single arm, multi-center, prospective, open-label study was conducted to evaluate absolute change in serum ferritin (SF)from baseline to 12 months of deferasirox administration, initially at a dose of 20 mg·kg−1·d−1, and the safety in 64 AA patients with iron overload.
Results
All patients started their deferasirox treatment with a daily dose of 20 mg·kg−1·d−1. The mean actual dose was (18.6±3.60) mg · kg−1·d−1. The median SF decreased from 4 924 (2 718–6 765)µg/L at baseline (n=64) to 3 036 (1 474–5 551)µg/L at 12 months (n=23) with the percentage change from baseline as 38%. A median SF decrease of 651 (126–2 125)µg/L was observed at the end of study in 23 patients who completed 12 months' treatment, the median SF level decreased by 1 167(580–4 806)µg/L [5 271(3 420–8 278)µg/L at baseline; 3 036(1 474–5 551)µg/L after 12 months' treatment; the percentage change from baseline as 42%] after 12 months of deferasirox treatment. The most common adverse events (AEs) were increased serum creatinine levels (40.98%), gastrointestinal discomfort (40.98%), elevated liver transaminase (ALT: 21.31%; AST: 13.11%) and proteinuria (24.59%). The increased serum creatinine levels were reversible and non-progressive. Of 38 patients with concomitant cyclosporine use, 12(31.8%) patients had two consecutive values >ULN, 10(26.3%) patients had two consecutive values >1.33 baseline values, but only 1(2.6%) patient's serum creatinine increased more than 1.33 baseline values and exceeded ULN. For both AST and ALT, no patients experienced two post-baseline values >5×ULN or >10×ULN during the whole study. In AA patients with low baseline PLT count (less than 50×109/L), there was no decrease for median PLT level during 12 months' treatment period.
Conclusion
AA patients with iron overload could achieve satisfactory efficacy of iron chelation by deferasirox treatment. The drug was well tolerated with a clinically manageable safety profile and no major adverse events.
Keywords: Anemia, aplastic; Iron overload; Deferasirox; Iron chelation therapy
再生障碍性贫血(AA)患者常需输注红细胞,但由于骨髓造血功能衰竭铁利用减少,因此高风险发生铁过载[1]。铁过载致活性氧自由基大量产生,不仅加重骨髓造血功能损伤,不利于骨髓造血恢复,更严重影响患者肝脏、心脏、胰岛等重要脏器的功能,导致患者生存质量明显降低[2]。因而,祛铁治疗对改善伴有铁过载AA患者的重要脏器功能、提高生存质量、减轻骨髓造血功能损伤非常重要,相关临床研究也逐渐成为热点[3]–[4]。
地拉罗司是对铁具有高亲和力的口服祛铁药物,能够促进机体通过胃肠道途径将铁排出,已有研究证实其对地中海贫血、镰状细胞贫血、骨髓增生异常综合征(MDS)、AA等输血依赖性疾病铁过载患者有良好的祛铁疗效及安全性[5]–[7]。但是,地拉罗司在中国AA患者中祛铁疗效和安全性的研究尚缺如,因而,我们进行了一项单臂、多中心、前瞻性临床研究,对地拉罗司治疗AA铁过载的祛铁疗效和安全性进行评估。
病例与方法
1.病例:病例来自中国医学科学院血液病医院(血液学研究所)、四川大学华西医院、中国中医科学院西苑医院、上海中医药大学附属岳阳中西医结合医院。2011年11月10日开始访视第1位受试者,2013年11月28日最后1位患者完成末次访视。AA诊断标准均符合文献[8]标准。关键入选标准:①18岁以上的确诊AA患者且进入研究前6个月内血液学指标稳定;②输血相关性铁过载,血清铁蛋白(SF)水平≥1 000 µg/L;③有超过20 U或100 ml/kg红细胞输注史。关键排除标准:①基线水平血清肌酐>正常值上限(ULN)或出现蛋白尿;②肌酐清除率<40 ml/min;③ECOG评分>2分;④超声心动图显示左心室射血分数<56%或有充血性心力衰竭病史;⑤存在妨碍研究治疗的全身性疾病;⑥诊断为Child-Pugh B和C级肝硬化;⑦总胆红素>ULN,ALT或AST>2.5×ULN;⑧既往存在与铁螯合相关的具有临床意义的眼和(或)耳毒性反应。
2.治疗方案:纳入研究的患者均接受地拉罗司祛铁治疗,以20 mg·kg−1·d−1作为固定的起始剂量口服地拉罗司片(每片125 mg)。根据患者SF水平、肾脏安全性评价及其他疗效和安全性参数,按每次5~10 mg·kg−1·d−1调整地拉罗司剂量,最小剂量和最大剂量分别为0和40 mg·kg−1·d−1,共治疗12个月。
3.疗效及安全性评估:每个月检测SF水平并进行安全性评估,结束访视对疗效及安全性进行综合评价。疗效评价主要分析地拉罗司治疗12个月后SF水平的变化。安全性评估将采集所有不良事件,观察其严重程度以及与研究药物的关系,并进行血液学、血生化学以及尿液的定期监测。
4.研究目的及终点:主要研究目的及终点是输血性铁过载AA患者接受地拉罗司治疗后基线至12个月时SF的绝对变化;次要研究目的是评价地拉罗司在接受治疗达12个月患者中的安全性及耐受性特征,尤其是不同基线PLT水平及合并使用环孢素(CsA)患者中的安全性分析。
5.研究方法:本研究是对伴有铁过载的AA患者进行的一项单臂、多中心、前瞻性、开放性临床试验,遵照赫尔辛基宣言伦理原则并获得各参与中心伦理委员会审核通过。患者均自愿参加本临床试验并签署知情同意书。结果主要进行描述性分析,正态分布的数据以均数±标准差表示,不符合正态分布的数据以中位数(四分位数)表示。共招募64例伴有铁过载AA患者,为全分析集(FAS);64例患者中3例在接受治疗前撤回知情同意书而未接受治疗,余61例患者接受了地拉罗司祛铁治疗,为安全性分析集(SAS);23例患者(PPS)完成了12个月治疗并完全符合研究方案,为符合方案集(PPS)。疗效分析均在FAS及PPS中进行。安全性分析在SAS中进行。
结果
一、患者基本资料
全部64例伴有铁过载AA患者中,男44例,女20例,中位红细胞输注量为50(21~300) U,中位年龄40.3(18.2~79.9)岁,其中50岁以下46例(71.9%),50~65岁15例(23.4%),65岁以上3例(4.7%)。17例患者曾接受去铁胺治疗。38例患者不完全符合研究方案,其中1例完成治疗后未进行最后一次疗效及安全性评估,37例提前终止研究。终止的主要原因分别是不良事件18例,撤回知情同意书11例,失访3例,异常实验室值2例,死亡2例,违背方案1例。61例患者均合并应用雄性激素药物,其中26例应用司坦唑醇,24例应用十一酸睾丸酮,11例应用达那唑。合并应用CsA治疗38例。地拉罗司治疗期间,61例患者中38例存在红细胞输注依赖,中位红细胞输注量为19(2~96) U。
二、地拉罗司祛铁治疗疗效评估
1.在FAS人群中,经12个月治疗后,SF水平从基线的4 924(2 718~6 765)µg/L(64例)降到3 036(1 474~5 551)µg/L(23例),降幅达到38%。SF降低量的中位数为651(126~2 125)µg/L。所有患者的地拉罗司起始剂量为20.0 mg·kg−1·d−1,治疗第3、6、9、12个月平均剂量分别为(15.50±5.77)、(16.10±6.00)、(18.00±6.77)、(17.20±7.69)mg·kg−1·d−1。实际平均剂量为(18.60±3.60)mg·kg−1·d−1(图1A)。
图1. 全分析集(A)和符合方案集(B)患者地拉罗司剂量及血清铁蛋白(SF)变化.
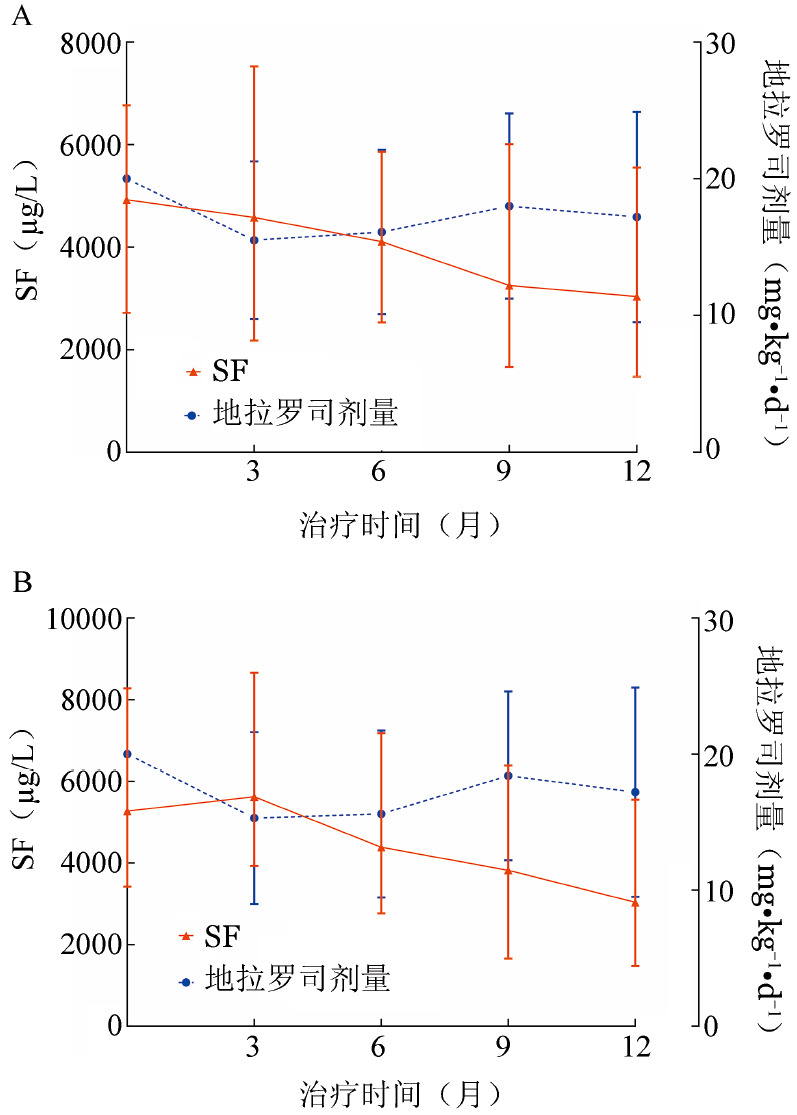
治疗0个月时为基线水平;全分析集中,治疗0、3、6、9、12个月患者例数分别为64、46、37、31及23例;符合方案集中,治疗各时间段患者例数均为23例
2.在PPS人群中,经12个月治疗后,SF从基线的5 271(3 420~8 278)µg/L降到3 036(1 474~5 551)µg/L,降幅达到42%,SF降低量的中位数为1 167(580~4 806)µg/L。在治疗第3、6、9、12个月地拉罗司的平均剂量分别为(15.30±6.31)、(15.60±6.14)、(18.40±6.21)、(17.20±7.69)mg·kg−1·d−1(图1B)。
三、地拉罗司祛铁治疗安全性评估
1.不良事件:58例(95.08%)患者发生了至少1起不良事件。1级(40.98%)和2级(27.87%)不良事件居多。其中,50例(81.97%)患者发生了至少1起研究者评价为与药物有关的不良事件(表1)。血生化异常41例(67.21%),胃肠道不适25例(40.98%),蛋白尿15例(24.59%),皮疹4例(6.56%),头痛4例(6.56%)及食欲减退3例(4.92%)。血生化异常以血肌酐升高(40.98%,25例)最为常见,其次是ALT升高(21.31%,13例)、血尿素升高(14.75%,9例)、尿肌酐升高(13.11%,8例)以及AST升高(13.11%,8例)。7例患者发生了8起严重不良事件(SAE),仅1起SAE(严重皮疹)评估为与试验药物治疗有关;其中2例患者死亡,均死于基础疾病。
表1. 地拉罗司治疗61例再生障碍性贫血患者不良事件发生情况.
| 不良事件 | 例数(%) |
| 血生化异常 | 41(67.21) |
| 血肌酐升高 | 25(40.98) |
| ALT升高 | 13(21.31) |
| 血尿素升高 | 9(14.75) |
| AST升高 | 8(13.11) |
| 尿肌酐升高 | 8(13.11) |
| 直接胆红素升高 | 4(6.56) |
| 血碱性磷酸酶升高 | 4(6.56) |
| 血胆红素升高 | 4(6.56) |
| 尿肌酐降低 | 4(6.56) |
| γ-谷氨酰转移酶升高 | 4(6.56) |
| 尿蛋白/肌酐比升高 | 3(4.92) |
| 血乳酸脱氢酶升高 | 3(4.92) |
| 胃肠道不适 | 25(40.98) |
| 恶心 | 9(14.75) |
| 腹泻 | 6(9.84) |
| 上腹痛 | 5(8.20) |
| 呕吐 | 5(8.20) |
| 胀气 | 3(4.92) |
| 蛋白尿 | 15(24.59) |
| 皮疹 | 4(6.56) |
| 头痛 | 4(6.56) |
| 食欲减退 | 3(4.92) |
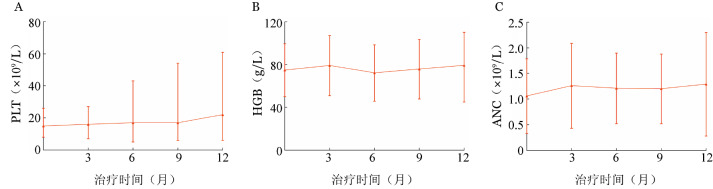
2.血液学参数变化:应用地拉罗司祛铁治疗同时是否会影响血液学参数变化是衡量其安全性的一项重要指标。PLT、HGB及中性粒细胞绝对值(ANC)的基线水平分别为15(8~26)×109/L、(74.73±24.84)g/L和(1.06±0.72)×109/L。SAS中基线及治疗期间PLT、HGB和ANC的时程变化见图2。总体来看,PLT稳中略有升高,治疗第3、6、9及12个月分别为16(7~27)×109/L、17(5~43)×109/L、17(6~54)×109/L、22(6~61)×109/L; HGB及ANC变化不显著,保持稳定。
图2. 61例安全性分析集患者地拉罗司治疗期间PLT(A)、HGB(B)及中性粒细胞绝对值(ANC)(C)水平变化.
治疗0个月时为基线水平
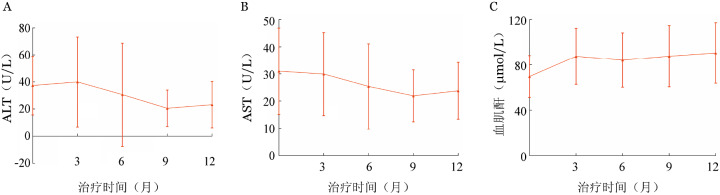
3.肝肾功能参数变化:尽管血肌酐和ALT、AST增高不良反应常见,但从61例SAS患者治疗期间肝肾功能时程变化看,治疗后ALT、AST水平均有改善(图3A、3B)。没有观察到连续两次基线后AST和ALT>5×ULN或>10×ULN患者。患者的总胆红素水平在试验全程保持稳定,均值波动于11.4~13.8 µmol/L。血肌酐增高多开始于地拉罗司治疗第4周,随后血肌酐水平保持较为稳定的水平(图3C),并无进行性增高。
图3. 61例安全性分析集患者地拉罗司治疗期间ALT(A)、AST(B)及血肌酐(C)水平变化.
治疗0个月时为基线水平
4.不同基线PLT水平患者的安全性分析:根据基线PLT不同水平将SAS中的所有患者分为4个亚组,即≥75×109/L组、≥50至<75×109/L组、≥25至<50×109/L组和<25×109/L组,在这些亚组中进行安全性分析。表2中显示从基线到研究结束时PLT水平的变化。总共有44例患者的基线值低于25×109/L,中位数为8×109/L。治疗结束后36例可评价的患者,中位PLT升高至14×109/L; 11例患者的基线值不低于25×109/L但低于50×109/L,中位数为35×109/L。治疗结束后10例可评价的患者,中位PLT升高至59×109/L。这些结果表明,在基线PLT较低的患者中,地拉罗司祛铁治疗后PLT并未降低。在23例完成了所有治疗计划并完成访视的患者中,观察到相似的结果,这些患者基线中位PLT为14×109/L,经过12个月地拉罗司治疗后中位PLT为22×109/L。其中16例患者基线PLT低于25×109/L,中位数为8×109/L,治疗后中位PLT为10×109/L; 5例患者基线PLT介于(25~50)×109/L,中位数为31×109/L,治疗后中位PLT为63×109/L; 2例患者基线PLT≥75×109/L,中位数为114.5×109/L,治疗后中位PLT为121.5×109/L。总的来说,在12个月地拉罗司治疗期间,平均PLT并无降低。
表2. 不同基线PLT分组再生障碍性贫血患者基线及地拉罗司治疗结束PLT水平[×109/L,中位数(中分位数)].
| 线PLT分组 | 基线 |
治疗结束 |
||
| 例数 | 水平 | 例数 | 水平 | |
| SAS人数 | ||||
| <25 | 44 | 8(2~24) | 36 | 14(4~61) |
| 25~<50 | 11 | 35(25~44) | 10 | 59(8~122) |
| 50~<75 | 1 | 54 | 1 | 37 |
| ≥75 | 5 | 107(88〜150) | 5 | 94(70〜197) |
| PPS人数a | ||||
| <25 | 16 | 8(3~24) | 16 | 10(4~61) |
| 25〜<50 | 5 | 31(25~43) | 5 | 63(33〜122) |
| 50〜<75 | 0 | 0 | ||
| ≥75 | 2 | 115(97〜132) | 2 | 122(94~149) |
注:SAS:安全性分析集;PPS:符合方案集;a:PPS人数均来自SAS人群
5.合并应用CsA患者的安全性分析:61例患者中38例合并应用CsA治疗。合并应用CsA的38例患者中,12例(31.8%)连续两次肌酐值>ULN, 10例(26.3%)连续两次肌酐值升高>1.33基线值,仅1例(2.6%)血清肌酐升高>1.33基线值并超过ULN。共发生37起肌酐升高事件,29起(78.4%)评估为与地拉罗司治疗有关,其中调整地拉罗司剂量或暂停使用(17/37, 45.9%),或未干预(14/37,37.8%);73.0%(27/37)的肌酐升高事件可恢复,中位恢复时间为31(5~201) d。
讨论
2010年一项全球多中心、前瞻性、开放、单臂临床研究(Evaluation of Patients' Iron Chelation with Exjade®,EPIC研究)证实了地拉罗司祛铁治疗地中海贫血、MDS、AA、镰状细胞贫血及其他伴有输血性铁过载贫血性疾病患者的疗效及安全性[7],但该研究纳入的AA患者仅有116例,临床医师并未完全解除对于地拉罗司在AA祛铁治疗中的安全性疑虑。AA在我国更为常见,地拉罗司对中国AA患者的祛铁疗效和安全性正是我们这项临床研究关注的重点。
EPIC研究中入选的116例AA患者经20 mg·kg−1·d−1起始剂量的地拉罗司治疗12个月后,中位SF由基线水平的3 254 µg/L降至1 854 µg/L,中位降低了964 µg/L[9]。我们的临床研究数据与之相近,在12个月的治疗期间,SF均呈降低的趋势。FAS人群的SF降低量的中位数为651 µg/L;PPS人群的SF降低量的中位数为1 167 µg/L。本研究与EPIC研究最突出的区别在于入选的AA患者的基线水平差异,我们入选的AA患者铁负荷更高,AA病情更为严重,因此研究难度更大。64例AA患者(FAS人群)和23例完成祛铁治疗的AA患者(PPS人群)中位SF水平分别为4 924 µg/L和5 271 µg/L,祛铁治疗前PLT、HGB的水平分别为15(8~26)×109/L和(74.73±24.84)g/L,而EPIC研究的116例AA患者中位PLT水平在80×109/L左右,HGB水平介于90~100 g/L之间。从这个意义上讲,我们这项研究的安全性评估更有参考价值。
EPIC研究中最常见的与药物相关的不良事件是血肌酐增高(36%)、胃肠道不适(28%)及皮疹(10%),肝脏转氨酶增高比较少见[7],[9]。血肌酐的增高为轻度、可逆性、非进行性增高,大部分在正常范围内,呈剂量依赖性,通过减少剂量可缓解,亦可自发缓解。常见的胃肠道不适有恶心、腹泻、呕吐及上腹痛等。我们研究中对不良事件的观察结果与EPIC研究相近,血肌酐增高(40.98%)及胃肠道不适(40.98%)仍然是最主要的不良事件,其次肝脏转氨酶增高(ALT:21.31%;AST:13.11%)、蛋白尿(24.59%)、皮疹(6.56%)和头痛(6.56%)比较常见。但是血肌酐或肝脏转氨酶的增高大多无临床意义,鲜有超过ULN的血肌酐增高,肝脏转氨酶治疗期间呈下降趋势。即使合并应用CsA的患者调整地拉罗司剂量后大多数血肌酐得以恢复。
EPIC研究中AA患者的基线PLT水平均超过50×109/L,而大多数需要祛铁治疗的AA患者PLT水平往往低于50×109/L,甚至低于20×109/L。我们研究中约70%的患者PLT低于25×109/L, 90%的患者PLT低于50×109/L,在这些基线水平较低的AA患者,并没有观察到新的安全性问题,也没有引起PLT降低的不良事件,反而经12个月治疗后PLT水平略有改善。因此,基线PLT水平较低的AA患者应用地拉罗司安全可靠在我们的这项研究中得到了验证。
虽然,我们的研究中没有观察到地拉罗司祛铁治疗后AA患者获得血液学反应,但是已有多篇个案报道了祛铁治疗后AA患者可获得一定的血液学反应[10]–[15]。较大系列的报道来自EPIC研究事后分析72例血液学参数可评价的AA患者资料[16],其中24例(2例重型AA,22例非重型AA)只接受地拉罗司治疗,并没有伴随免疫抑制剂治疗。这24例患者中11例非重型AA(45.8%)获得了部分血液学反应,所有患者均不再依赖输血;1例患者获得了额外的PLT反应;1例患者获得了额外的PLT和HGB反应。在研究结束时,获得部分血液学反应的患者平均SF水平降幅为45.7%。未获得血液学反应患者SF降幅仅为27.6%。因此,地拉罗司在AA患者亚群中,尤其是非重型AA中,除了能降低铁过载外,还有可能改善血液学反应,当然今后需要进一步的研究来阐明相关机制。
总之,我们的临床研究达到了地拉罗司祛铁疗效评价及安全性评估的主要目的。与国外研究结果一致,地拉罗司治疗伴有铁过载的中国AA患者能够达到较好的祛铁疗效。地拉罗司治疗期间的不良事件可控,安全性特征与目前的国际研究报道相似,没有发现新的安全性问题。尤其对于基线PLT水平低于50×109/L的AA患者没有发现安全性问题,更进一步验证了地拉罗司在这部分患者中的安全性;对于合并应用CsA的AA患者,地拉罗司对肾脏和肝脏没有非预期的安全性问题。
Footnotes
临床试验注册:Clinicaltrial, NCT01546415
Clinical trial reginstration: Clinicaltrial, NCT01546415
References
- 1.金 朋, 施 均, 李 星鑫, et al. 再生障碍性贫血患者铁代谢异常及铁过载状况研究[J] 中华血液学杂志. 2013;34(10):877–882. doi: 10.3760/cma.j.issn.0253-2727.2013.10.011. [DOI] [PubMed] [Google Scholar]
- 2.Fleming RE, Ponka P. Iron overload in human disease[J] N Engl J Med. 2012;366(4):348–359. doi: 10.1056/NEJM-ra1004967. [DOI] [PubMed] [Google Scholar]
- 3.Brittenham GM. Iron-chelation therapy for transfusional iron overload[J] N Engl J Med. 2011;364(2):146–156. doi: 10.1056/NEJMct1004810. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Hoffbrand AV, Taher A, Cappellini MD. How I treat transfusional iron overload[J] Blood. 2012;120(18):3657–3669. doi: 10.1182/blood-2012-05-370098. [DOI] [PubMed] [Google Scholar]
- 5.Cappellini MD, Cohen A, Piga A, et al. A phase 3 study of deferasirox (ICL670), a once-daily oral iron chelator, in patients with beta-thalassemia[J] Blood. 2006;107(9):3455–3462. doi: 10.1182/blood-2005-08-3430. [DOI] [PubMed] [Google Scholar]
- 6.Vichinsky E, Onyekwere O, Porter J, et al. A randomised comparison of deferasirox versus deferoxamine for the treatment of transfusional iron overload in sickle cell disease[J] Br J Haematol. 2007;136(3):501–508. doi: 10.1111/j.1365-2141.2006.06455.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Cappellini MD, Porter J, El-Beshlawy A, et al. Tailoring iron chelation by iron intake and serum ferritin: the prospective EPIC study of deferasirox in 1744 patients with transfusion-dependent anemias[J] Haematologica. 2010;95(4):557–566. doi: 10.3324/haematol.2009.014696. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.张 之南, 沈 悌. 血液病诊断及疗效标准[M] 3版. 北京: 科学出版社; 2007. pp. 19–23. [Google Scholar]
- 9.Lee JW, Yoon SS, Shen ZX, et al. Iron chelation therapy with deferasirox in patients with aplastic anemia: a subgroup analysis of 116 patients from the EPIC trial[J] Blood. 2010;116(14):2448–2454. doi: 10.1182/blood-2010-01-261289. [DOI] [PubMed] [Google Scholar]
- 10.Lee SE, Yahng SA, Cho BS, et al. Improvement in hematopoiesis after iron chelation therapy with deferasirox in patients with aplastic anemia[J] Acta Haematol. 2013;129(2):72–77. doi: 10.1159/000342772. [DOI] [PubMed] [Google Scholar]
- 11.Quarta A, Melpignano A, Quarta G. Oral iron chelator deferasirox in the treatment of secondary hemochromatosis following bone marrow transplantation in a patient with severe aplastic anemia[J] Acta Haematol. 2011;125(4):219–221. doi: 10.1159/000322802. [DOI] [PubMed] [Google Scholar]
- 12.Lee JW, Jang PS, Chung NG, et al. Iron chelation therapy with deferasirox results in recovery of hematopoiesis in a child with aplastic anemia[J] Pediatr Hematol Oncol. 2011;28(8):718–720. doi: 10.3109/08880018.2011.615050. [DOI] [PubMed] [Google Scholar]
- 13.Koh KN, Park M, Kim BE, et al. Restoration of hematopoiesis after iron chelation therapy with deferasirox in 2 children with severe aplastic anemia[J] J Pediatr Hematol Oncol. 2010;32(8):611–614. doi: 10.1097/MPH.0b013e3181e8854d. [DOI] [PubMed] [Google Scholar]
- 14.Oliva EN, Ronco F, Marino A, et al. Iron chelation therapy associated with improvement of hematopoiesis in transfusion-dependent patients[J] Transfusion. 2010;50(7):1568–1570. doi: 10.1111/j.1537-2995.2010.02617.x. [DOI] [PubMed] [Google Scholar]
- 15.Kiguchi T, Ito Y, Kimura Y, et al. Restoration of cardiac function by an iron chelator, deferasirox, in a patient with aplastic anemia and cardiac iron overload[J] Int J Hematol. 2009;89(4):546–548. doi: 10.1007/s12185-009-0310-9. [DOI] [PubMed] [Google Scholar]
- 16.Lee JW, Yoon SS, Shen ZX, et al. Hematologic responses in patients with aplastic anemia treated with deferasirox: a post hoc analysis from the EPIC study[J] Haematologica. 2013;98(7):1045–1048. doi: 10.3324/haematol.2012.077669. [DOI] [PMC free article] [PubMed] [Google Scholar]