Abstract
目的
观察地西他滨联合预激方案再诱导治疗伴DNA甲基转移酶(DNMT3A)基因突变的复发难治正常核型急性髓系白血病(CN-AML)的疗效。
方法
回顾性分析2011年4月至2014年10月接受地西他滨联合预激方案再诱导治疗的53例复发或难治CN-AML患者的临床特征及对地西他滨联合预激方案的治疗反应,其中伴DNMT3A基因突变(DNMT3A+)24例,不伴DNMT3A基因突变(DNMT3A−)29例。
结果
DNMT3A+组患者中位年龄为46(26~68)岁,与DNMT3A−组差异无统计学意义,WBC中位数19.5(0.5~218.5)×109/L,骨髓原始细胞中位数0.635(0.020~0.920),较DNMT3A−组高,但差异亦无统计学意义(P值均>0.05)。DNMT3A+患者对地西他滨联合预激方案治疗的总体反应率(ORR)达62.50%,完全缓解(CR)率为54.17%,DNMT3A−组分别为48.28%和37.93%,两组相比差异无统计学意义(P值分别为0.407、0.277)。两组患者应用地西他滨联合预激方案再诱导治疗的不良反应类似。53例患者中,共有29例患者伴有FLT3-ITD突变,FLT3-ITD+/DNMT3A+组(14例)与FLT3-ITD+/DNMT3A−组(15例)的ORR及CR率差异有统计学意义(P值分别为0.040、0.042)。DNMT3A+组与DNMT3A−组1年总生存(OS)率分别为59.58%和54.09%,差异无统计学意义(P=0.438)。后期25例患者行异基因造血干细胞移植,DNMT3A+ CN-AML患者1年OS率为87.50%,1年无病生存(DFS)率为72.73%;DNMT3A−组1年OS率为61.54%,1年DFS率为58.02%;两组差异无统计学意义(P值分别为0.456、0.217)。
结论
地西他滨联合预激方案是复发难治CN-AML有效且安全的再诱导治疗手段,FLT3-ITD+/DNMT3A+组CN-AML患者对地西他滨联合预激方案的反应率优于FLT3-ITD+/DNMT3A−组。地西他滨桥接allo-HSCT可以提高CN-AML患者的OS率。
Keywords: 地西他滨, 白血病,髓样,急性, 复发, 难治病, DNA修饰甲基酶类
Abstract
Objective
To study clinical characteristics of refractory or relapsed DNMT3A+ cytogenetically normal acute myeloid leukemia (CN-AML) patients, and to explore the overall response rate (ORR) and side effects of these patients followed the therapy including decitabine with CAG or CAG-like regimen.
Methods
In this study we retrospectively analyzed 53 refractory or relapsed CN-AML patients receiving the therapy including decitabine combined with CAG and CAG-like regimen in our center from April 2011 to October 2014. The clinical characteristics and ORR were further analyzed. Based on gene mutations, these patients could be divided into 2 groups: DNMT3A+ AML patients (n=24) and DNMT3A−AML patients (n=29).
Results
The median age of DNMT3A+ AML patients was 46 years old, higher white blood cells and bone marrow blasts were observed in DNMT3A+ AML group. The ORR and complete response (CR) rate of DNMT3A+ group were 62.50% and 54.17%, respectively. No differences were observed in ORR and CR rates (P>0.05) between these two groups. DNMT3A+/FLT3-ITD+ CN-AML patients (n=14) had higher ORR and CR rates than DNMT3A−/FLT3-ITD+CN-AML patients (n=15) (P=0.040 and 0.042, respectively). The one-year overall survival (OS) of DNMT3A+ AML group and DNMT3A−AML group were 59.58%, 54.09%, no differences were observed (P=0.438). 25 patients received further therapy of allo-HSCT, the one-year OS of DNMT3A+ CN-AML was 87.50% and one-year disease free survival (DFS) was 72.73%, while the one-year OS was 61.54% and one-year DFS was 58.02% in DNMT3A−group. No differences were observed between 2 groups (P=0.456, 0.217).
Conclusion
Decitabine combined with CAG or CAG-like regimen was an effective and safe treatment for refractory or relapsed CN-AML patients. Compared to DNMT3A−/FLT3-ITD+ CN-AML patients, DNMT3A+/FLT3-ITD+ CN-AML patients had higher ORR and CR rates. Decitabine bridged hematopoietic stem cells transplant could likely improve the survival of refractory or relapsed CN-AML patients.
Keywords: Decitabine; Leukemia, myeloid, acute; Recurrence; Refractory diseases; DNA modification methylases
复发难治急性髓系白血病(AML)是白血病治疗的热点和难点,治疗方案局限且再诱导缓解率低。DNA甲基转移酶(DNMT3A)基因突变是正常核型AML(CN-AML)常见的突变之一,突变率为20%~40%,主要位于第23号外显子第882位氨基酸,往往与疾病预后不良有关[1]–[3]。去甲基化药物再诱导治疗伴有DNMT3A突变的复发难治AML的临床疗效国内外报道较少。在本研究中,我们回顾性分析地西他滨联合预激方案再诱导治疗53例伴或不伴DNMT3A突变CN-AML患者的临床疗效,报告如下。
病例和方法
1.病例:2011年4月至2014年10月于我院接受地西他滨联合预激方案再诱导治疗的难治或复发CN-AML患者53例,其中24例伴DNMT3A基因突变(DNMT3A+),29例不伴DNMT3A基因突变(DNMT3A−)。所有患者均经骨髓细胞形态学、免疫分型、染色体核型分析及多重PCR检测确诊,诊断符合文献[4]–[5]标准。难治AML诊断标准:标准方案诱导化疗2个疗程未获完全缓解(CR);第1次CR后6个月内复发;第1次CR后6个月后复发经原方案再诱导化疗失败;2次或2次以上复发;髓外白血病持续存在。复发AML诊断标准:CR后外周血重新出现白血病细胞或骨髓原始细胞大于0.050或髓外出现白血病细胞浸润。
2.染色体核型分析和基因突变检测:染色体核型分析采用骨髓细胞直接法和(或)短期培养法,按常规制备染色体标本,采用R显带技术进行核型分析。正常核型者至少分析20个分裂象,异常核型者至少分析10个分裂象,2个以上具有相同核型异常定为异常克隆。采用PCR产物测序法检测DNMT3A基因第23号外显子,FLT3基因第14、15号外显子,NPM1基因第12号外显子,c-kit基因第8、17号外显子及CEBPA全部编码区。
3.再诱导治疗:全部复发难治CN-AML患者均接受地西他滨联合预激方案再诱导化疗。包括①地西他滨+CAG方案:地西他滨20 mg·m−2·d−1,第1~3天;阿克拉霉素20 mg/d,第1~7天;阿糖胞苷40 mg·m−2·d−1(每12 h 1次),第1~14天;G-CSF 300 µg/d,WBC>20×109/L时停用。②地西他滨+HCAG方案:地西他滨20 mg·m−2·d−1,第1~3天;高三尖杉酯碱2 mg·m−2·d−1,第1~7天;阿克拉霉素20 mg/d,第1~7天;阿糖胞苷20 mg·m−2·d−1(每12 h 1次),第1~14天;G-CSF 300 µg/d,WBC>20×109/L时停用。③地西他滨+IAG方案:地西他滨20 mg·m−2·d−1,第1~3天;去甲氧柔红霉素累计8 mg/m2,隔日1次;阿糖胞苷20 mg·m−2·d−1(每12 h 1次),第1~14天;G-CSF 300 µg/d,WBC>20×109/L时停用。
4.造血干细胞移植:后续治疗中,DNMT3A+组和DNMT3A−组中分别有12和13例患者行异基因造血干细胞移植(allo-HSCT)。预处理方案:22例采用改良BU/CY方案:司莫司汀250 mg/m2,−2 d;白消安0.8 mg/kg,每6 h 1次,−7~−5 d;环磷酰胺1.8 g·m−2·d−1,−4、−3 d;阿糖胞苷2 g·m−2·d−1,−9、−8 d。3例采用减低剂量预处理方案:氟达拉滨30 mg·m−2·d−1,−7~−2 d;白消安3.2 mg·m−2·d−1,−4、−3 d;阿糖胞苷0.5 g·m−2·d−1,−5~−3 d。移植物抗宿主病(GVHD)预防:接受无关供者HLA全相合移植患者GVHD预防方案:抗胸腺细胞球蛋白2.5 mg·kg−1·d−1,−4~−2 d;甲氨蝶呤15 mg·m−2·d−1,+1 d,10 mg·m−2·d−1,+3、+6、+11 d;环孢素(CsA)3 mg·kg−1·d−1,−8 d起;霉酚酸酯15 mg·kg−1·d−1,−8 d起。接受亲缘HLA单倍型移植患者GVHD预防方案:抗胸腺细胞球蛋白2.5 mg·kg−1·d−1,−5~−2 d;甲氨蝶呤15 mg/m2,+1 d,10 mg/m2,+3、+6、+11 d;CsA 3 mg·kg−1·d−1,−9 d起;霉酚酸酯1.0 g/d,−9 d起。接受同胞HLA全相合造血干细胞移植的患者GVHD预防方案如下:甲氨蝶呤+1 d 15 mg/m2,+3、+6 d 10 mg/m2;CsA 3 mg·kg−1·d−1,−1 d开始。
5.疗效、不良反应评价标准及随访:疗效评价参照文献[5]标准。不良反应参照WHO急性及亚急性化疗药物不良反应分级标准来判定。总体生存(OS)时间定义为从疾病诊断之日至死亡或末次随访的时间,无病生存(DFS)时间定义为从疾病CR之日至首次复发或死亡。通过住院病历、门诊病历或电话进行随访,随访截止日期为2015年3月1日。
6.统计学处理:采用SPSS 19.0软件进行数据分析。组间均值(符合正态分布)比较采用Student's t检验,率的比较采用卡方检验。采用Kaplan-Meier法绘制生存曲线,通过Log-rank检验比较各组患者生存率的差异。P<0.05为差异有统计学意义。
结果
1.患者一般特征:患者一般特征见表1。24例DNMT3A+患者中复发10例,难治14例;29例DNMT3A−患者中复发13例,难治16例。24例DNMT3A+患者中10例髓系表达,14例为髓单核系表达;23例融合基因阴性,1例MLLT3-MLL阳性;合并其他基因突变情况:合并FLT3-ITD基因突变14例,合并NPM1基因突变1例,合并NPM1、CEBPA突变1例;突变位点分布:R882H位点14例、R882P位点3例、R882C位点4例、N879D位点1例、未知2例。
表1. 53例接受地西他滨联合预激方案治疗的复发难治急性髓系白血病患者的临床特征.
| 特征 | 伴DNMT3A基因突变(24例) | 不伴DNMT3A基因突变(29例) | P值 |
| 年龄[岁,M(范围)] | 46(26~68) | 48(16~72) | 0.983 |
| 性别(例,男/女) | 10/14 | 19/10 | 0.083 |
| ECOG评分[例(%)] | 0.682 | ||
| 0 | 8(33.3) | 7(24.1) | |
| 1 | 11(45.8) | 13(44.8) | |
| 2 | 5(20.9) | 9(31.1) | |
| FAB分型[例(%)] | 0.240 | ||
| M1 | 1(4.2) | 5(17.2) | |
| M2 | 8(33.2) | 9(31.1) | |
| M4 | 7(29.2) | 4(13.8) | |
| M5 | 7(29.2) | 5(17.2) | |
| M6 | 0 | 2(6.9) | |
| 不能分型 | 1(4.2) | 4(13.8) | |
| 骨髓原始细胞比例[M(范围)] | 0.635(0.020~0.920) | 0.520(0.215~0.840) | 0.666 |
| WBC[×109/L,M(范围)] | 19.5(0.5~218.5) | 8.6(0.3~244.0) | 0.394 |
| HGB[g/L,M(范围)] | 75(23~113) | 93(40~139) | 0.051 |
| PLT[×109/L,M(范围)] | 48(11~239) | 45(10~337) | 0.964 |
2.地西他滨联合预激方案治疗效果:地西他滨联合预激方案治疗1个疗程后,24例DNMT3A+患者中CR 13例、部分缓解(PR)2例、未缓解(NR)7例、死亡2例,CR率为54.17%,总有效率(ORR)为62.50%。粒细胞缺乏中位时间为15(5~43)d,血小板回升中位时间为15(4~50)d。29例DNMT3A−患者中CR 11例、PR 3例、NR 10例、死亡5例,CR率为37.93%,ORR为48.28%。两组CR率及ORR差异均无统计学意义(P值分别为0.277、0.407)。基于欧洲白血病协会FLT3-ITD/NPM1/CEBPA基因突变危险度分层,将患者归为2组:合并FLT3-ITD+定义为高危组,其余患者定义为中低危组。24例DNMT3A+患者中伴FLT3-ITD+共14例,29例DNMT3A−患者中伴FLT3-ITD+共15例。对两组患者进行疗效比较,FLT3-ITD+/DNMT3A+组ORR为71.43%,CR率为64.29%,FLT3-ITD+/DNMT3A−组ORR为33.33%,CR率为26.67%,差异均有统计学意义(P值分别为0.040、0.042)。10例FLT3-ITD−/DNMT3A+患者ORR及CR率分别为50.00%及40.00%,14例FLT3-ITD−/DNMT3A−组ORR及CR率分别为64.29%及50.00%,两组ORR及CR率比较差异均无统计学意义(P值分别为0.678、0.697)。
3.不良反应:不良反应发生情况见表2。24例DNMT3A+患者及29例DNMT3A−患者均发生Ⅲ~Ⅳ级血液学不良反应(100.0%);其他不良反应包括感染、出血、肝功能损害、胃肠道反应等,无严重出血以及恶心、呕吐等不良反应。
表2. 地西他滨联合预激方案治疗53例复发难治急性髓系白血病患者的不良反应[例(%)].
| 不良反应 | 伴DNMT3A突变(24例) | 不伴DNMT3A突变(29例) | P值 |
| 胃肠道反应 | 1(4.2) | 4(13.8) | 0.400 |
| Ⅰ~Ⅱ级 | 0 | 3(10.3) | |
| Ⅲ~Ⅳ级 | 1(4.2) | 1(3.5) | |
| Ⅲ~Ⅳ级骨髓抑制 | 24(100.0) | 29(100.0) | 1.000 |
| 感染 | 9(37.5) | 8(27.7) | 0.620 |
| Ⅰ~Ⅱ级 | 4(16.7) | 2(7.0) | |
| Ⅲ~Ⅳ级 | 5(20.8) | 6(20.7) | |
| 肝功能损害 | 1(4.2) | 2(7.0) | 1.000 |
| Ⅰ~Ⅱ级 | 1(4.2) | 1(3.5) | |
| Ⅲ~Ⅳ级 | 0 | 1(3.5) | |
| Ⅲ~Ⅳ级肺部感染 | 11(45.9) | 12(41.4) | 0.745 |
| 出血 | 24(100.0) | 29(100.0) | 0.487 |
| Ⅰ~Ⅱ级 | 21(87.5) | 23(79.3) | |
| Ⅲ~Ⅳ级 | 3(12.5) | 6(20.7) |
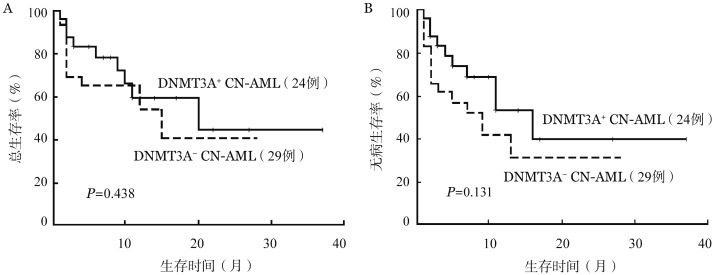
4.生存分析:24例DNMT3A+患者中位OS时间为20(1~37)个月,1年OS率为59.58%,1年DFS率为52.17%;29例DNMT3A−患者中位OS时间为15(0~28)个月,1年OS率为54.09%,1年DFS率为41.89%。两组1年OS及DFS率差异均无统计学意义(P值分别为0.438、0.131)(图1)。
图1. 地西他滨联合预激方案再诱导治疗53例复发难治正常核型急性髓系白血病(CN-AML)患者总生存(A)及无病生存(B)情况.
25例(21例CR,4例PR)患者后期行allo-HSCT,中位随访时间为12(0~37)个月。其中,DNMT3A+组中同胞全相合移植5例,无关全相合移植2例,单倍体移植5例;DNMT3A−组中同胞全相合移植7例,无关全相合移植2例,单倍体移植4例,两组移植方式比较差异无统计学意义(P=0.866)。DNMT3A+组回输单个核细胞(MNC)中位数为9.56(5.91~14.25)×108/L,回输CD34+细胞中位数为4.50(2.57~7.45)×106/L;DNMT3A−组回输MNC中位数为7.86(3.37~16.80)×108/L,回输CD34+细胞中位数为3.32(1.38~5.50)×106/L,两组比较差异均无统计学意义(P值分别为0.429、0.127)。DNMT3A+ CN-AML患者中位OS时间未达到,1年OS率为87.50%,1年DFS率为72.73%;DNMT3A−CN-AML患者中位OS时间未达到,1年OS率为61.54%,1年DFS率为58.02%,两组比较差异均无统计学意义(P值分别为0.456、0.217)(图2)。
图2. 25例复发难治正常核型急性髓系白血病(CN-AML)患者行地西他滨联合预激方案后桥接异基因造血干细胞移植的总生存(A)及无病生存(B)情况.
讨论
近年来,随着标准诱导化疗方案的应用,AML的CR率得到了极大提高,但难治及复发AML的化疗缓解率仍然较低。DNA甲基化在维持正常细胞功能、遗传印记、胚胎发育以及人类肿瘤发生中起重要作用,是目前新的研究热点之一。随着对表观遗传学的深入研究,多项研究发现AML发病机制中有DNA甲基化的参与[6]–[7]。DNMT3A基因突变是AML常见的基因突变,该基因位于染色体2p23,DNA全长109 615 bp,开放读码框(ORF)4 314 bp,蛋白编码区(CDS)2 739 bp,编码912个氨基酸。DNMT3A主要解码甲基转移酶,催化甲基至CpG岛的胞嘧啶残基,引起下游基因的表达减少。Mizuno等[8]发现,DNMT家族在AML中有较高的表达水平,并且认为DNMT表达的上调会引发超甲基化最终导致白血病的发生。在成人AML患者中,存在大约22%的DNMT3A基因突变,并且与疾病的不良预后有独立的关系[2]–[3]。
Thomas[9]认为TET2、IDH1/2和DNMT3A等突变患者对于DNMT抑制剂反应率更高,DNMT对于AML的治疗提供了较好的表观遗传学靶点。地西他滨作为DNMT抑制剂,能够诱导造血干细胞分化和DNA去甲基化,近年来应用于治疗多种血液系统恶性肿瘤。地西他滨的去甲基化作用主要是通过抑制DNMT使基因组中局部高甲基化CpG岛发生去甲基化,从而使抑癌基因重新活化,而这种去甲基化作用对于已处于低甲基化状态的其他基因的影响不大[10]。自从地西他滨用于治疗骨髓增生异常综合征(MDS)取得明确疗效以后,越来越多的研究者开始尝试将其应用于治疗AML,尤其是复发难治AML以及老年AML。
Chowdhury等[11]采用地西他滨联合吉姆单抗治疗12例复发难治AML患者,5例患者获得CR。在一项地西他滨联合雷帕霉素的Ⅰ期临床试验中,Liesveld等[12]通过地西他滨联合雷帕霉素治疗13例复发难治AML患者,1个疗程后4例患者治疗有效,ORR达31%。Ganguly等[13]对8例造血干细胞移植术后复发的患者应用地西他滨治疗,ORR为25%,并且认为造血干细胞移植后明显复发的患者并不适合接受地西他滨治疗,但在早期形态或者遗传学、分子学复发的患者中可能有效。Song等[14]采用地西他滨联合其他方案治疗20例复发难治及老年AML患者,CR率达55%,并且7例患者1个疗程后可达CR。Ritchie等[15]通过地西他滨联合其他方案治疗102例复发难治AML患者,结果显示ORR为15.7%,其中化疗有效的患者中最多者接受28个疗程的化疗。郝杰等[16]采用地西他滨联合其他方案治疗复发难治AML患者,9例难治患者有效率为33.3%,10例复发患者有效率为60%,ORR为47.4%。靖彧等[17]采用地西他滨联合预激方案治疗5例AML1-ETO阳性复发难治AML患者,4例治疗有效。
本研究中53例患者均接受地西他滨联合预激方案再诱导治疗。1个疗程后,24例DNMT3A+ CN-AML患者CR率为54.17%,ORR为62.50%;29例DNMT3A−患者CR率为37.93%,ORR为48.28%,差异无统计学意义。FLT3-ITD+/DNMT3A+组与FLT3-ITD+/DNMT3A−组ORR及CR率差异均有统计学意义(P值分别为0.040、0.042)。生存分析显示,DNMT3A+ CN-AML患者与DNMT3A−CN-AML患者生存情况比较差异均无统计学意义。行allo-HSCT的患者中,DNMT3A+ CN-AML患者1年OS率为87.50%,1年DFS率为72.73%;DNMT3A−CN-AML患者1年OS率为61.54%,1年DFS率为58.02%,两组比较差异无统计学意义。
相关文献报道地西他滨联合化疗治疗复发难治AML患者的ORR均低于50%,本研究中伴DNMT3A+组ORR达62.50%,DNMT3A−组ORR为48.28%。在FLT3-ITD+/DNMT3A+及FLT3-ITD+/DNMT3A−组的疗效对比中,可发现伴高危的FLT3-ITD基因突变的患者中,伴有DNMT3A+者对地西他滨治疗的反应率更高(P<0.05),表明地西他滨在复发难治AML,特别是FLT3-ITD+/DNMT3A+ AML患者疗效较好,后期行allo-HSCT可改善复发难治AML患者的预后。吴倩等[18]报道对19例AML/MDS患者行地西他滨桥接移植治疗,移植后2年OS率为57.89%。本研究中病例数较少,地西他滨的最佳给药模式、与其他药物的联合治疗效果以及桥接allo-HSCT的疗效仍有待于大样本临床研究进一步阐明。
本研究结果表明,地西他滨联合预激方案是复发难治CN-AML有效且安全的再诱导治疗手段,FLT3-ITD+/DNMT3A+ CN-AML组对地西他滨联合预激方案的反应率优于FLT3-ITD+/DNMT3A−CN-AML组。地西他滨桥接allo-HSCT可以提高患者的OS率。
Funding Statement
基金项目:国家自然科学基金(81302046、81270617);国家临床重点专科建设项目;卫生公益性行业科研专项(201202017);高等学校博士点新教师基金(20123201120021);江苏高校优势学科建设工程血液转化医学项目;江苏省科教兴卫工程-临床医学中心(ZX201102);江苏省科技厅生命健康专项(BL2012005)
References
- 1.Marcucci G, Metzeler KH, Schwind S, et al. Age-related prognostic impact of different types of DNMT3A mutations in adults with primary cytogenetically normal acute myeloid leukemia[J] J Clin Oncol. 2012;30(7):742–750. doi: 10.1200/JCO.2011.39.2092. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Ley TJ, Ding L, Walter MJ, et al. DNMT3A mutations in acute myeloid leukemia[J] N Engl J Med. 2010;363(25):2424–2433. doi: 10.1056/NEJMoa1005143. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Thol F, Damm F, Lüdeking A, et al. Incidence and prognostic influence of DNMT3A mutations in acute myeloid leukemia[J] J Clin Oncol. 2011;29(21):2889–2896. doi: 10.1200/JCO.2011.35.4894. [DOI] [PubMed] [Google Scholar]
- 4.中华医学会血液学分会. 急性髓系白血病(复发难治性)中国诊疗指南(2011年版)[J] 中华血液学杂志. 2011;32(12):887–888. [Google Scholar]
- 5.张 之南, 沈 悌. 血液病诊断及疗效标准[M] 3版. 北京: 科学出版社; 2007. pp. 103–121. [Google Scholar]
- 6.Kantarjian HM, Thomas XG, Dmoszynska A, et al. Multicenter, randomized, open-label, phase III trial of decitabine versus patient choice, with physician advice, of either supportive care or low-dose cytarabine for the treatment of older patients with newly diagnosed acute myeloid leukemia[J] J Clin Oncol. 2012;30(21):2670–2677. doi: 10.1200/JCO.2011.38.9429. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Rowe JM. The increasing genomic complexity of acute myeloid leukemia[J] Best Pract Res Clin Haematol. 2014;27(3/4):209–213. doi: 10.1016/j.beha.2014.10.001. [DOI] [PubMed] [Google Scholar]
- 8.Mizuno S, Chijiwa T, Okamura T, et al. Expression of DNA methyltransferases DNMT1, 3A, and 3B in normal hematopoiesis and in acute and chronic myelogenous leukemia[J] Blood. 2001;97(5):1172–1179. doi: 10.1182/blood.v97.5.1172. [DOI] [PubMed] [Google Scholar]
- 9.Thomas X. DNA methyltransferase inhibitors in acute myeloid leukemia: discovery, design and first therapeutic experiences[J] Expert Opin Drug Discov. 2012;7(11):1039–1051. doi: 10.1517/17460441.2012.722618. [DOI] [PubMed] [Google Scholar]
- 10.Si J, Boumber YA, Shu J, et al. Chromatin remodeling is required for gene reactivation after decitabine-mediated DNA hypomethylation[J] Cancer Res. 2010;70(17):6968–6977. doi: 10.1158/0008-5472.CAN-09-4474. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Chowdhury S, Seropian S, Marks PW. Decitabine combined with fractionated gemtuzumab ozogamicin therapy in patients with relapsed or refractory acute myeloid leukemia[J] Am J Hematol. 2009;84(9):599–600. doi: 10.1002/ajh.21478. [DOI] [PubMed] [Google Scholar]
- 12.Liesveld JL, O'Dwyer K, Walker A, et al. A phase I study of decitabine and rapamycin in relapsed/refractory AML[J] Leuk Res. 2013;37(9):1622–1627. doi: 10.1016/j.leukres.2013.09.002. [DOI] [PubMed] [Google Scholar]
- 13.Ganguly S, Amin M, Divine C, et al. Decitabine in patients with relapsed acute myeloid leukemia (AML) after allogeneic stem cell transplantation (allo-SCT)[J] Ann Hematol. 2013;92(4):549–550. doi: 10.1007/s00277-012-1607-y. [DOI] [PubMed] [Google Scholar]
- 14.Song LX, Xu L, Li X, et al. Clinical outcome of treatment with a combined regimen of decitabine and aclacinomycin/cytarabine for patients with refractory acute myeloid leukemia[J] Ann Hematol. 2012;91(12):1879–1886. doi: 10.1007/s00277-012-1550-y. [DOI] [PubMed] [Google Scholar]
- 15.Ritchie EK, Feldman EJ, Christos PJ, et al. Decitabine in patients with newly diagnosed and relapsed acute myeloid leukemia[J] Leuk Lymphoma. 2013;54(9):2003–2007. doi: 10.3109/10428194.2012.762093. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.郝 杰, 王 黎, 王 艳煜, et al. 地西他滨联合DAG方案等三种方案治疗复发、难治急性髓系白血病疗效的比较分析[J] 中华血液学杂志. 2014;35(6):481–485. [Google Scholar]
- 17.靖 彧, 朱 成英, 张 琪, et al. 地西他滨联合改良CAG方案治疗AML1-ETO阳性复发、难治急性髓系白血病的临床研究[J] 中国实验血液学杂志. 2014;22(5):1245–1250. doi: 10.7534/j.issn.1009-2137.2014.05.011. [DOI] [PubMed] [Google Scholar]
- 18.吴 倩, 何 广胜, 吴 德沛, et al. 地西他滨桥接allo-HSCT治疗骨髓增生异常综合征和急性髓细胞白血病[J] 中华血液学杂志. 2012;33(Suppl):257. [Google Scholar]