Abstract
目的
探讨我国GATA2突变相关儿童原发性骨髓增生异常综合征(MDS)的发生情况、临床特点及分子生物学特征。
方法
回顾性分析2007年1月至2018年1月129例儿童原发性MDS患者临床资料,采用二代测序技术检测GATA2及髓系恶性肿瘤相关基因突变情况。分析基因突变谱及其与临床表现型的关系。
结果
在所有129例患者中,11例(8.5%)检出GATA2胚系突变。在50例MDS伴原始细胞增高(MDS-EB)和急性髓系白血病伴MDS相关改变(AML-MRC)患者中,GATA2胚系突变占14.0%。GATA2突变多位于第二个锌指(ZF2)区。多因素分析结果显示,SETBP1体细胞突变(P=0.041,OR=9.003,95%CI 1.098~73.787)和独立的7号染色体单体(P=0.002,OR=24.835,95%CI 3.305~186.620)与GATA2胚系突变显著相关。与GATA2野生型的患者相比,GATA2突变型患者中位发病年龄更大[8(1~16)岁对6岁(1月龄~18岁),P=0.035],更易伴有7号染色体单体(72.7%对5.2%,P<0.001),较之儿童难治性血细胞减少(RCC)更倾向于存在于MDS-EB/AML-MRC亚型中(5.1%对13.7%,P=0.111)。GATA2突变与否不影响儿童原发性MDS患者的3年预期总生存(OS)率[(80.1±4.2)%对(60.6±25.4)%,P=0.437];在44例接受allo-HSCT患者中,GATA2突变与否对移植后3年预期OS率无显著影响[100.0%对(94.0±3.8)%,P=0.562]。
结论
GATA2突变在我国伴有7号染色体单体及年龄较大的儿童原发性MDS患者中占有较高的比例,且GATA2突变患者多进展为MDS-EB和AML-MRC。GATA2突变状态不影响儿童原发性MDS的总体生存。
Keywords: 儿童, 骨髓增生异常综合征, GATA2
Abstract
Objective
To clarify the prevalence, clinical features and molecular characteristics of germline GATA2 mutations in pediatric primary myelodysplastic syndromes (MDS).
Methods
Next-generation sequencing technology was used to detect mutations in GATA2 and other myeloid malignancy genes in 129 children with primary MDS from Jan. 2007 to Jan. 2018. The relationship between genotypes and phenotypes was analyzed.
Results
Germline GATA2 mutations accounted for 8.5% (11/129) of all primary MDS cases, and 14.0% (11/50) of MDS with excess blasts (MDS-EB) and acute myeloid leukaemia with myelodysplasia-related changes (AML-MRC). Compared with GATA2 wild-type patients, GATA2 mutated patients were older at diagnosis[8 (1–16) years old vs 6 years old (range: 1 month old-18 years old), P=0.035]and higher risk of monosomy 7 (72.7%vs 5.2%, P<0.001) and classified into MDS-EB and AML-MRC compared with refractory cytopenia of childhood (RCC) (63.6%vs 36.4%, P=0.111). The multivariate analysis showed SETBP1 mutation (P=0.041, OR=9.003, 95%CI 1.098–73.787) and isolated monosomy 7 (P=0.002, OR=24.835, 95%CI 3.305–186.620) were significantly associated with germline mutated GATA2. Overall survival (OS) and outcomes of hematopoietic stem cell transplantation (HSCT) were not influenced by GATA2 mutational status.
Conclusion
Our data identify germline GATA2 mutations have a high prevalence in older pediatric patients with monosomy 7, and high risk of progression into advanced MDS subtypes. GATA2 mutation status does not affect OS in pediatric primary MDS.
Keywords: Pediatric, Myelodysplastic syndrome, GATA2 mutation, Germline
骨髓增生异常综合征(MDS)是一组具有异质性的克隆性造血性疾病,儿童罕见。在儿童和青少年中,儿童难治性血细胞减少(refractory cytopenia of childhood,RCC)是最常见的亚型,常表现为全血细胞减少和低增生骨髓象[1]–[2]。儿童MDS最常见的染色体核型异常是7号染色体单体(−7/7q−),而在成人中常见的单纯5号染色体缺失(5q−)和复杂核型罕见[3]。儿童和成人MDS体细胞突变谱亦显著不同[4]–[6]。MDS可继发于先天性骨髓衰竭(IBMF),如范可尼贫血、先天性角化不良及家族性MDS/急性髓系白血病(AML)综合征。其中家族性MDS/AML综合征是由造血转录因子CEBPA、RUNX1和GATA2等缺陷导致的[7]。GATA2相关的疾病谱还包括免疫缺陷和血液系统以外的综合征,如MonoMAC综合征和Emberger综合征等[8]。GATA2突变患者在婴儿或儿童期即出现造血、免疫和淋巴系统症状,并伴有反复感染,高风险进展为MDS/AML[9]–[10]。目前我国尚无儿童MDS胚系GATA2突变情况的研究,这给实验室检查选择、预后评估及治疗决策带来一定的困难。本研究探讨GATA2胚系突变在我国儿童原发性MDS中的发生频率,并分析GATA2相关儿童MDS的临床及分子生物学特征。
病例与方法
1.病例:回顾性分析我院2007年1月至2018年1月确诊的129例儿童原发性MDS患者,MDS诊断符合2016年WHO分型诊断标准儿童MDS诊断标准[11]。包括RCC 78例(61%)、MDS伴原始细胞增高(MDS-EB)35例(27%)和急性髓系白血病伴MDS相关改变(AML-MRC)16例(12%)。排除继发性MDS。本研究经我院伦理委员会审核批准,并获得所有研究对象及(或)其监护人的知情同意。患者根据病情及治疗意愿接受免疫抑制治疗、化疗、allo-HSCT或支持治疗[12]。其中,34%(44/129)的患者接受了allo-HSCT。供者来源:同胞全相合3例,父母/同胞不全相合41例。移植方式:16%(7/44)为外周血+骨髓,82%(36/44)为外周血,2%(1/44)为外周血+骨髓+脐带血。11例GATA2突变患者中7例接受了HSCT。
2.标本采集:骨髓及体细胞对照标本取自患者初次诊断时。常规方法留取骨髓单个核细胞,提取DNA。体细胞对照DNA提取自初诊时的口腔上皮细胞。家系验证DNA提取自父母和(或)同胞外周血DNA。
3.检测方法:设计包含与IBMF、家族性MDS/AML、MDS相关的基因等在内的564个基因的全部外显子及剪接区的捕获芯片。取1 µg DNA常规方法制备DNA全基因组文库。采用GenCap液相捕获试剂盒(北京迈基诺基因科技股份有限公司产品)对文库目标区域进行捕获及定量,采用Illumina Nextseq 500测序。平均覆盖度98.1%,平均深度1 000×,95%的目的区域覆盖度在20×以上。测序后原始数据利用CCDS、人基因组数据库(HG19)、dbSNP(v138)、1 000 genomes、COSMIC、PolyPhen、SIFT等数据库进行生物信息学分析,确定致病性基因突变位点[13],并采用Sanger测序验证。新发GATA2变异依据以下标准判断为可能致病性和疾病相关[14]:①其他患有MDS的家庭成员具有同样的突变;②具有其他GATA2缺陷相关的表型(如淋巴水肿);③既往在GATA2缺陷中报道过的突变;④在Exome Aggregation Consortium Browser、dbSNP和Exome Variant Server数据库中未被报道的新发突变;⑤在物种间高度保守及预测致病性高的位点。骨髓细胞经过24 h培养,收集细胞常规制片,G或R显带,根据《人类细胞遗传学国际命名体制(ISCN2013)》描述核型异常。单纯7号染色体单体指经染色体核型分析及FISH检测,除7号染色体单体外不伴有其他异常核型;涉及7号染色体单体指出7号染色体单体外还伴有其他异常核型。
4.随访:所有病例随访至2018年10月。随访资料来源于住院病历、门诊病历。对随访期间死亡的病例,依病历记录或与患者家属电话联系确认。预期总生存(OS)期为确诊至死亡的时间或随访终点。共9例(7%)患者失访。中位随访时间为29(2~131)个月。
5.统计学处理:采用SPSS 22.0软件进行统计学分析。非连续变量资料采用卡方检验或者Fisher精确概率法,连续变量资料采用Mann-Whitney U检验,相关性分析采用Spearman等级相关系数,单因素生存分析采用Kaplan-Meier法,将单因素分析P<0.01的指标纳入Cox模型进行多因素分析。P<0.05为差异有统计学意义。
结果
一、GATA2相关MDS的临床及遗传学特征
1.临床特征:8.5%(11/129)的儿童原发性MDS患者具有GATA2突变。较之RCC,GATA2在MDS-EB/AML-MRC中的比例更高(5.1%对13.7%,P=0.111)。GATA2突变型患者首次诊断年龄晚于GATA2野生型患者[8(1~16)岁对6岁(1月龄~18岁),P=0.035]。GATA2突变患者更易合并7号染色体单体(72.7%对5.2%,P<0.001)。因为RCC诊断标准宽泛,我们对其中同时符合成人MDS伴多系血细胞发育异常(MDS-MLD)诊断标准[11]的患者进行分析,发现所有的GATA2突变患者均属于此组。所有的GATA2突变患者均为自发突变,无血液系统恶性肿瘤家族史。与GATA2野生型患者相比,GATA2突变患者血小板计数更高[100(17~299)×109/L对36.5(2~528)×109/L,z=−2.058,P=0.040]。其他实验室检查指标(外周血血红蛋白浓度、白细胞计数、中性粒细胞计数、单核细胞计数及骨髓髓系原始细胞比例)无显著性差异(表1)。
表1. GATA2突变型与野生型儿童骨髓增生异常综合征(MDS)临床特征比较.
| 临床特征 | GATA2突变型(11例) | GATA2野生型(118例) | P值 |
| 中位年龄[M(范围)] | 8(1~16)岁 | 6岁(1月龄~18岁) | 0.035 |
| 性别(例,男/女) | 7/4 | 70/48 | 1.000 |
| MDS亚型[例(%)] | 0.111 | ||
| RCC | 4(36.4) | 74(62.7) | |
| MDS-EB/AML-MRC | 7(63.6) | 44(37.3) | |
| 染色体核型[例(%)]a | |||
| 7号染色体单体 | 8(72.7) | 6(5.2) | <0.001 |
| +8 | 1(9.1) | 8(6.9) | 0.564 |
| 复杂核型 | 0(0.0) | 8(6.9) | 1.000 |
| 正常核型 | 2(18.2) | 77(66.4) | 0.003 |
| 其他核型 | 0(0.0) | 17(14.6) | 0.357 |
| AML/MDS家族史[例(%)] | 0(0.0) | 2(1.7) | 1.000 |
| HGB[g/L,M(范围)] | 81(66~110) | 83(34~130) | 0.918 |
| WBC[×109/L,M(范围)] | 3.94(1.61~24.43) | 4.00(0.91~140.30) | 0.345 |
| ANC[×109/L,M(范围)] | 0.66(0.35~11.17) | 0.97(0.01~14.74) | 0.324 |
| 单核细胞计数[×109/L,M(范围)] | 0.42(0.02~7.07) | 0.23(0.01~7.79) | 0.323 |
| PLT[×109/L,M(范围)] | 100(17~299) | 36.5(2~528) | 0.040 |
| 骨髓髓系原始细胞比例[%,M(范围)] | 7.7(0~29.0) | 4.5(0~30.0) | 0.708 |
注:RCC:难治性血细胞减少;MDS-EB:MDS伴原始细胞增高;AML-MRC:急性髓系白血病伴MDS相关改变;AML:急性髓系白血病。a 127例患者有染色体核型分析结果
2.细胞遗传学特点:11例伴有GATA2突变的MDS患者中,染色体核型异常包括7号染色体单体8例,其中非平衡易位der(1;7)(q10;p10)(导致7号染色体长臂缺失)2例;8号染色体三体1例;未检测到−5/5q−及复杂核型。在127例具有可分析染色体核型的患者中,7号染色体单体14例(11.0%),而其中8例具有GATA2突变,且诊断时的中位年龄倾向于大于6例GATA2野生型患者[11(3~16)岁对5.5(1~10)岁]。
3.GATA2突变特征:共在11例儿童MDS患者中检测到12个致病性或可疑致病性胚系突变(其中10个为新发突变),及1个意义未明突变。包括7个移码/无义突变导致的截短突变,3个错义突变,1个非移码缺失突变,1个剪接位点突变。等位基因突变频率在0.28~0.62之间。11个突变位于编码区,其中6个突变位于第二个锌指(ZF2)区(氨基酸347~398),2个位于C末端,1个位于N末端。位于非编码区的突变c.1143+2T>G位于第5内含子,邻近剪接位点。其中1例患者(例10)具有3个突变,包括位于第5内含子的c.1143+2T>G,位于ZF2区的c.1086_1087ins63(p.N36delins22)及位于ZF1区的意义未明的突变c.961C>T(p.L321F)(表2)。GATA2突变类型与血液学表型无相关性。所有患者的父母和(或)正常同胞采用Sanger测序进行了相应位点的检测,未检测到健康携带者。具有GATA2突变的患者中,最常见的体细胞突变为SETBP1(4个)、ASXL1(4个)及RUNX1(3个)突变,5例患者未检出合并体细胞突变。另有1例患者合并SAMD9突变。单因素分析提示,体细胞SETBP1(P=0.001,χ2=10.438)、ASXL1(P<0.001,χ2=13.766)、RUNX1(P=0.002,χ2=9.179)突变,单纯7号染色体单体(P<0.001, χ2=46.748),涉及7号染色体单体(P<0.001,χ2=26.229)与GATA2突变显著相关。进一步多因素分析提示,SETBP1突变(P=0.041,OR=9.003,95%CI 1.098~73.787)和单纯7号染色体单体(P=0.002,OR=24.835,95%CI 3.305~186.620)与GATA2突变显著相关。
表2. 11例GATA2突变儿童骨髓增生异常综合征(MDS)患者临床特征、治疗及转归.
| 例号 | 性别 | GATA2基因型 | 诊断年龄(岁) | MDS亚型 | 染色体核型 | 治疗 | 供者 | 造血干细胞来源 | 随访时间(月) | 转归 |
| 1 | 女 | c.1160C>A(p.T387N) | 1 | RCC | +8 | HSCT | 单倍型 | 外周血+骨髓 | 14 | 无病存活 |
| 2 | 女 | c.1038_1039insCGC-CAGAAGAGCCGGC(p.T347Rfs*42) | 3 | RCC a | −7 | 支持治疗 | NA | NA | 63 | 死于高白细胞瘀滞 |
| 3 | 男 | c.1286G>C(p.S429T) | 3 | RCC | 正常 | 支持治疗 | NA | NA | 24 | 存活 |
| 4 | 男 | c.17_18del(p.E6Afs*178) | 5 | MDS-EB a | −7 | AML方案化疗 | NA | NA | 30 | 死于高白细胞瘀滞 |
| 5 | 男 | c.1028dupG(p.R344Kfs*40) | 7 | MDS-EB | 正常 | HSCT | 单倍型 | 外周血+骨髓 | 36 | 存活 |
| 6 | 男 | c.1019delC(p.S340Wfs*47) | 8 | RCC | −7 | HSCT | 单倍型 | 外周血 | 9 | 无病存活 |
| 7 | 男 | c.1055G>T(p.C352F) | 10 | AML-MRC | der(1;7)(q10;p10),+1 | AML方案化疗 | NA | NA | 6 | 死于脑梗死 |
| 8 | 男 | c.1216_1217insGTCCAA-CAAGTCCAAGA(p.K406Sfs*77) | 12 | MDS-EB | −7 | HSCT | 单倍型 | 外周血 | 16 | 无病存活 |
| 9 | 女 | c.1124delT(p.Leu375PrsX12) | 14 | MDS-EB a | −7 | HSCT | 单倍型 | 外周血+骨髓 | 23 | 无病存活 |
| 10 | 男 | c.1086_1087ins63(p.N363delins222T>G、c.961C>T(p.L321F) | 14 | AML-MRC | −7 | HSCT | 单倍型 | 外周血+骨髓 | 28 | 无病存活 |
| 11 | 女 | c.303delC(p.Ala103fsX116) | 16 | MDS-EB a | der(1;7)(q10;p10) | HSCT | 单倍型 | 外周血+骨髓 | 32 | 无病存活 |
注:RCC:儿童难治性血细胞减少;MDS-EB:MDS伴原始细胞增高;AML-MRC:急性髓系白血病急性髓系白血病伴MDS相关改变;AML:急性髓系白血病;a最终进展为AML-MRC;NA:不适用
4.GATA2缺陷有关的非血液系统表型:除1例(例5)具有p.R344Kfs*40突变的患者同时合并先天性淋巴水肿外,1例(例6)具有p.S340Wfs*47突变的患者合并先天性上睑下垂外,其他患者均无非血液系统表型。
二、GATA2相关儿童MDS预后分析
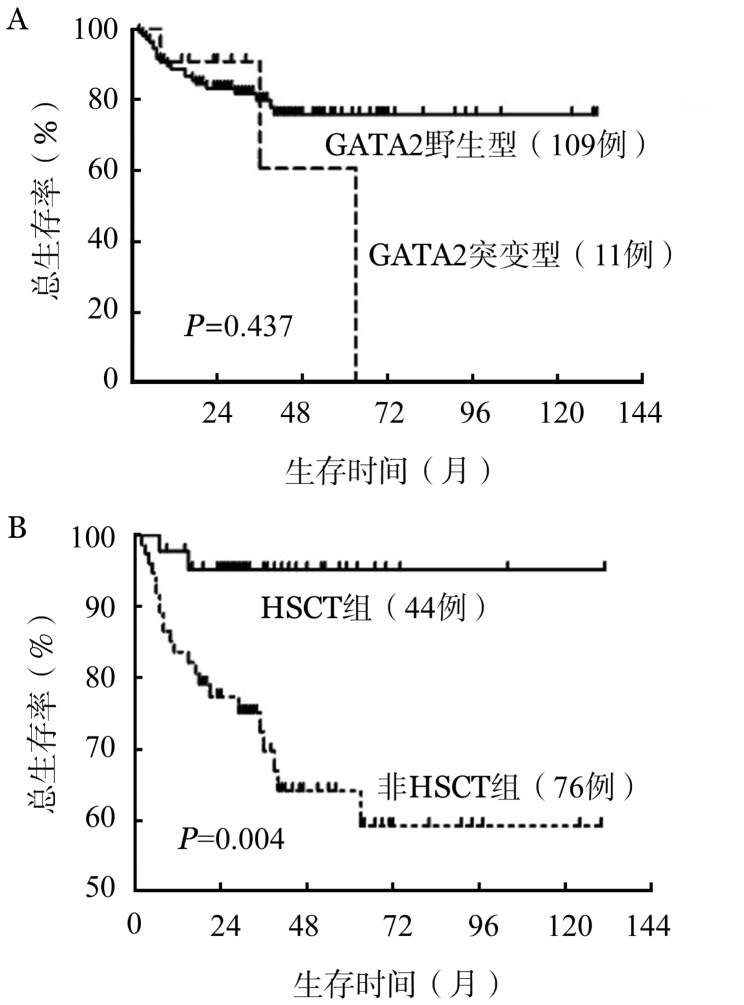
全部患者3年预期OS率为(79.1±4.3)%。RCC患儿的3年OS率显著高于MDS-EB/AML-MRC患者[(91.1±4.0)%对(59.9±8.7)%,P<0.001]。单因素分析示,GATA2突变型与GATA2野生型患者3年OS率差异无统计学意义[(80.1±4.2)%对(60.6±25.4)%,P=0.437](图1A)。44例行allo-HSCT患者的3年OS率显著高于未行移植的患者[(95.2±3.3)%对(77.3±5.0)%,P=0.002](图1B)。在接受移植治疗患者中,GATA2基因突变状态对移植后3年OS率无显著影响[100.0%对(94.0±3.8)%,P=0.562]。
图1. GATA2相关儿童骨髓增生异常综合征患者总生存曲线.
A:GATA2突变型与GATA2野生型;B:造血干细胞移植组(HSCT)组与非HSCT组
讨论
近年来遗传易感性在原发性MDS中的作用受到关注。本研究结果示在我国儿童原发性MDS中,GATA2突变占到8.5%。而在MDS-EB和AML-MRC的患者中,占到13.7%。这与既往文献[14]中报道的比例相似。而成人MDS患者中,GATA2突变的发生率仅为0.5%,GATA2突变相关疾病的中位发病年龄为29岁[9],而针对儿童及青少年的研究中,GATA2相关MDS的中位发病年龄为12岁[14],结合本研究结果及文献报道,推测GATA2相关疾病主要存在于青少年及年轻成人MDS患者中,GATA2不是老年患者的主要致病基因。
既往报道过的与GATA2突变有关的综合征包括Emberger综合征(原发性淋巴水肿、皮肤疣、耳聋)、MonoMAC综合征(严重的单核细胞、NK细胞、树突状细胞和B淋巴细胞减少,鸟结核分枝杆菌复合物感染)[8],非血液系统表型包括性功能减退、外眦赘皮、手指变细、颈蹼、行为障碍/多动症、甲状腺功能减退、泌尿生殖系统畸形、单侧/双侧上睑下垂或胎儿水肿[15]。值得注意的是,本研究中GATA2相关的MDS均为散发,且大部分患者无GATA2缺陷相关的综合征或非血液系统的表型。而接近半数的GATA2相关非MDS疾病伴有综合征相关症状[14],[16]。在儿童MDS中高比例的新发GATA2突变及极少的无症状携带者表明该基因突变较高的外显率和表现度。本研究GATA突变发生率高,且编码区突变具有完全的外显率,但因为病例数量有限,可能存在偏倚。既往研究曾报道在超过200例患者中检测到8例无症状携带者[9]。此外,非编码区突变的无症状携带者,外显率减低既往也有报道[8],[14]。
GATA2基因编码重要的造血转录因子,其通过两个ZF与上千个基因的GATA结合结构域作用[17]。GATA2以剂量依赖的方式,通过与其他转录因子协同作用,调控早期造血[18]。GATA2胚系突变涉及截短突变多导致ZF2缺失[8],[15]。此外,目前认为ZF2内的错义突变和位于GATA2-9.5 kb调控区的非编码区变异导致半倍体剂量不足[7]–[8],[15]。GATA2体细胞突变也存在于成人髓系肿瘤中,不同的是,突变可发生于两个ZF区,既可引起功能获得亦可引起功能缺失效应[15],[19]。
与既往报道GATA2半倍体剂量不足导致血细胞减少及免疫缺陷相似,我们检测到2种单等位基因突变,包括截短突变和位于ZF2区的错义突变。但未检测到位于第4内含子的增强子区域突变。迄今为止,只有一小部分的GATA2错义突变进行了功能验证。丧失功能性突变包括在家族性MDS/AML中位于ZF2区的Thr354Met及Thr355del13,在Emberger综合征中的Arg361Leu及Cys373Arg17,在原发性AML中的Arg350_Asn351ins(体细胞突变状况不明)[20]。本研究我们未检测到上述突变。本研究及既往报道GATA2截短突变均破环了ZF2区,提示这一区域的重要性。Wlodarski等[14]研究显示非编码区突变占10.5%,且部分非编码区突变的患者具有更长的疾病稳定期,但本研究只检测到1个内含子区的突变。本研究及既往研究均未发现GATA2基因型与临床表型具有显著相关性。
高危险度MDS亚型和7号染色体单体在GATA2相关MDS中比例显著增加。相反,在GATA2相关免疫缺陷患者中,8号染色体三体(24%)多于7号染色体单体(16%)[8]。既往报道7号染色体单体在整个年龄组GATA2突变中占29%[9],在儿童及青少年组中占70%[17],这与本儿童队列中结果基本一致(72.7%)。而且,本研究中,2例患者为der(1;7)(q10;p10)非平衡易位,导致1q三体和7q缺失,这一变异在儿童MDS中较少见[4],[6]。既往研究[14]及本研究均证实GATA2胚系突变在伴有7号染色体单体的青少年MDS患者中比例较高,因此对这部分患者在诊断时需注意除外GATA2突变。
GATA2突变相关疾病易向髓系肿瘤转化的驱动突变尚不清楚。既往研究报道示30%GATA2突变患者可检测到同时合并ASXL1基因突变,且附加的获得性突变与疾病进展有关[21]–[22]。因此,获得性ASXL1突变被认为与GATA2突变向髓系肿瘤恶性转化有关[9],[21],[23]。但这一观点目前存在争议,首先,在更大队列的研究中,并未观察到GATA2突变患者具有更高的ASXL1突变比例,其次,之前研究得出的两者之间的联系可能是由于7号染色体单体造成的偏倚[6],[23]。其他GATA2相关MDS常见的突变有SETBP1功能获得性突变。本研究中,多因素及单因素分析均示SETBP1突变与GATA2显著相关,提示这一体细胞突变在GATA2突变的致病机制中具有重要作用。
在考虑了MDS亚型和细胞遗传学因素后,本研究中儿童原发性MDS的OS不受GATA2突变状态的影响,提示MDS亚型是影响预后的主要因素。尽管GATA2突变MDS患者更容易在初次诊断时即为MDS-EB和AML-MRC,但OS与GATA2野生型患者无统计学差异。较大系列(534例MDS患者,其中GATA2相关MDS 57例)的研究[14]亦得出与本研究相似结论:当单因素分析GATA2突变状态时,GATA2突变患者预后较差(5年预期OS率:73%对84%,P<0.05),但当纳入MDS亚型、7号染色体单体共同分析时,GATA2突变状态与OS无显著相关性。因此考虑GATA2缺陷虽具有很强的MDS倾向性,但可能不影响总体生存。这一结论需在更大规模的样本中验证。HSCT是目前唯一可以治愈GATA2相关MDS的治疗。既往NIH研究报道,GATA2突变(包括了家族性MDS/AML,肺泡蛋白沉积或反复感染)患者移植后4年OS率为54%[8]。一项针对儿童GATA2相关MDS的研究报道,HSCT后5年OS率为66%[14]。本研究中GATA2相关MDS患者的预后与上述报道相似。儿童GATA2相关原发性MDS移植后总体生存较好,可能与移植年龄较小及无GATA2相关非血液系统并发症有关。
总之,本研究表明GATA2在我国儿童原发性MDS中发生率约9%,在青少年伴有7号染色体单体的患者中占到72.7%。GATA2突变状态不影响MDS患儿的预后。与所有MDS患儿一样,应根据已知的危险因素,来决定GATA2相关MDS中HSCT的时机和预处理方案。早期诊断GATA2缺陷可以使患者的疾病监测更具有针对性,并减少了非治愈性治疗的应用,尤其是避免免疫抑制治疗。我们建议对所有儿童和年轻成人MDS患者都应进行GATA2基因突变分析,无论其是否具有家族史或者GATA2缺陷相关表型。
Funding Statement
基金项目:国家自然科学基金(81700109);协和青年科研基金&中央高校基本科研业务费专项资金(2017320024);国家重点研发计划(2016YFC0901503);中国医学科学院医学与健康科技创新工程(2016-I2M-1-002、2017-I2M-3-018);爱佑慈善基金
Fund Project: National Natural Science Funds(81700109); Program for Peking Union Scholars and Innovative Research Team; PUMC Youth Fund & Fundamental Research Funds for the Central Universities(2017320024); The National Key Research and Development Program of China(2016YFC0901503); the CAMS Innovation Fund for Medical Sciences(2016-I2M-1-002, 2017-I2M-3-018); Ai You foundation.
References
- 1.中华医学会血液学分会. 骨髓增生异常综合征中国诊断与治疗指南(2019年版)[J] 中华血液学杂志. 2019;40(2):89–97. doi: 10.3760/cma.j.issn.0253-2727.2019.02.001. [DOI] [Google Scholar]
- 2.Hasle H, Niemeyer CM. Advances in the prognostication and management of advanced MDS in children[J] Br J Haematol. 2011;154(2):185–195. doi: 10.1111/j.1365-2141.2011.08724.x. [DOI] [PubMed] [Google Scholar]
- 3.Göhring G, Michalova K, Beverloo HB, et al. Complex karyotype newly defined: the strongest prognostic factor in advanced childhood myelodysplastic syndrome[J] Blood. 2010;116(19):3766–3769. doi: 10.1182/blood-2010-04-280313. [DOI] [PubMed] [Google Scholar]
- 4.Schwartz JR, Ma J, Lamprecht T, et al. The genomic landscape of pediatric myelodysplastic syndromes[J] Nat Commun. 2017;8(1):1557. doi: 10.1038/s41467-017-01590-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Li B, Liu J, Jia Y, et al. Clinical features and biological implications of different U2AF1 mutation types in myelodysplastic syndromes[J] Genes Chromosomes Cancer. 2018;57(2):80–88. doi: 10.1002/gcc.22510. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Pastor V, Hirabayashi S, Karow A, et al. Mutational landscape in children with myelodysplastic syndromes is distinct from adults: specific somatic drivers and novel germline variants[J] Leukemia. 2017;31(3):759–762. doi: 10.1038/leu.2016.342. [DOI] [PubMed] [Google Scholar]
- 7.Bannon SA, DiNardo CD. Hereditary Predispositions to Myelodysplastic Syndrome[J] Int J Mol Sci. 2016;17(6):pii: E838. doi: 10.3390/ijms17060838. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Spinner MA, Sanchez LA, Hsu AP, et al. GATA2 deficiency: a protean disorder of hematopoiesis, lymphatics, and immunity[J] Blood. 2014;123(6):809–821. doi: 10.1182/blood-2013-07-515528. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Micol JB, Abdel-Wahab O. Collaborating constitutive and somatic genetic events in myeloid malignancies: ASXL1 mutations in patients with germline GATA2 mutations[J] Haematologica. 2014;99(2):201–203. doi: 10.3324/haematol.2013.101303. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Hirabayashi SSB, Niemeyer CM, Wlodarski MW. Unexpected high frequency of GATA2 mutations in children with non-familial MDS and monosomy 7[J] Blood (Annual Meeting Abstracts) 2012;120(21):Abstract 1699. [Google Scholar]
- 11.Arber DA, Orazi A, Hasserjian R, et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia[J] Blood. 2016;127(20):2391–2405. doi: 10.1182/blood-2016-03-643544. [DOI] [PubMed] [Google Scholar]
- 12.中华医学会儿科学分会血液学组, 《中华儿科杂志》编辑委员会. 儿童骨髓增生异常综合征诊断与治疗中国专家共识(2015年版)[J] 中华儿科杂志. 2015;53(11):804–809. doi: 10.3760/cma.j.issn.0578-1310.2015.11.002. [DOI] [Google Scholar]
- 13.Papaemmanuil E, Gerstung M, Malcovati L, et al. Clinical and biological implications of driver mutations in myelodysplastic syndromes[J] Blood. 2013;122(22):3616–3627; quiz 3699. doi: 10.1182/blood-2013-08-518886. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Wlodarski MW, Hirabayashi S, Pastor V, et al. Prevalence, clinical characteristics, and prognosis of GATA2-related myelodysplastic syndromes in children and adolescents[J] Blood. 2016;127(11):1387–1397; quiz 1518. doi: 10.1182/blood-2015-09-669937. [DOI] [PubMed] [Google Scholar]
- 15.Wlodarski MW, Collin M, Horwitz MS. GATA2 deficiency and related myeloid neoplasms[J] Semin Hematol. 2017;54(2):81–86. doi: 10.1053/j.seminhematol.2017.05.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Zhang MY, Keel SB, Walsh T, et al. Genomic analysis of bone marrow failure and myelodysplastic syndromes reveals phenotypic and diagnostic complexity[J] Haematologica. 2015;100(1):42–48. doi: 10.3324/haematol.2014.113456. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Doré LC, Chlon TM, Brown CD, et al. Chromatin occupancy analysis reveals genome-wide GATA factor switching during hematopoiesis[J] Blood. 2012;119(16):3724–3733. doi: 10.1182/blood-2011-09-380634. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Bresnick EH, Katsumura KR, Lee HY, et al. Master regulatory GATA transcription factors: mechanistic principles and emerging links to hematologic malignancies[J] Nucleic Acids Res. 2012;40(13):5819–5831. doi: 10.1093/nar/gks281. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Tien FM, Hou HA, Tsai CH, et al. GATA2 zinc finger 1 mutations are associated with distinct clinico-biological features and outcomes different from GATA2 zinc finger 2 mutations in adult acute myeloid leukemia[J] Blood Cancer J. 2018;8(9):87. doi: 10.1038/s41408-018-0123-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Niimi K, Kiyoi H, Ishikawa Y, et al. GATA2 zinc finger 2 mutation found in acute myeloid leukemia impairs myeloid differentiation[J] Leuk Res Rep. 2013;2(1):21–25. doi: 10.1016/j.lrr.2013.02.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Bödör C, Renneville A, Smith M, et al. Germ-line GATA2 p.THR354MET mutation in familial myelodysplastic syndrome with acquired monosomy 7 and ASXL1 mutation demonstrating rapid onset and poor survival[J] Haematologica. 2012;97(6):890–894. doi: 10.3324/haematol.2011.054361. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Stieglitz E, Loh ML. Pediatric MDS: GATA screen the germline[J] Blood. 2016;127(11):1377–1378. doi: 10.1182/blood-2016-01-690016. [DOI] [PubMed] [Google Scholar]
- 23.West RR, Hsu AP, Holland SM, et al. Acquired ASXL1 mutations are common in patients with inherited GATA2 mutations and correlate with myeloid transformation[J] Haematologica. 2014;99(2):276–281. doi: 10.3324/haematol.2013.090217. [DOI] [PMC free article] [PubMed] [Google Scholar]