髓外浆细胞瘤(Extramedullary plasmacytoma, EMP)是原发于骨髓之外的浆细胞实体肿瘤,占浆细胞肿瘤的3%~5%,大多发病于头颈部或上呼吸道,下呼吸道罕见,且以单发病灶为主[1]。原发于肺的浆细胞瘤(Primary pulmonary plasmacytoma,PPP)极为罕见,临床症状及影像学检查结果与支气管肺癌难以鉴别,易误诊,诊断主要依靠局部活检病理[2]。PPP多数表现为单发结节,少数为弥散性多发结节[3]–[5]。近期我院诊断1例以肺部多发浆细胞瘤为首发表现的EMP患者,现报告如下。
病例资料
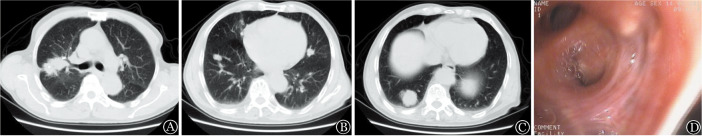
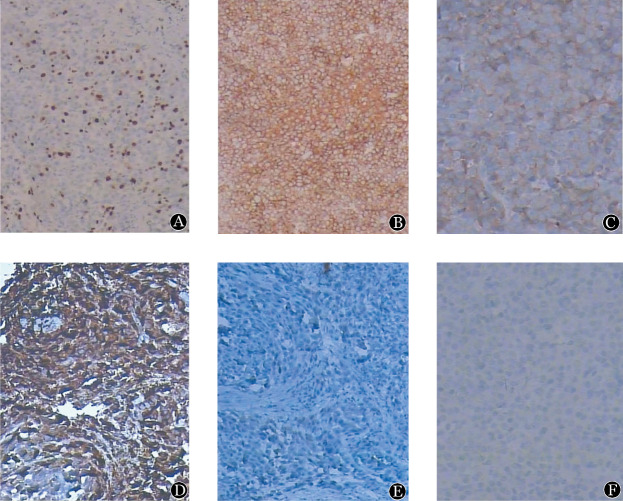
患者,男,83岁。有约50年间断吸烟史。2014年2月10日因“咳嗽、咳痰,伴痰中带血10余天”入住我院。2014年1月底无明显诱因出现发作性咳嗽,伴咳少量黄浓痰,痰中带血丝,为鲜红色,量较少,在外院门诊以“肺部感染”输液治疗3 d,症状无好转,并出现咯血1次,为鲜红色,量约20 ml。病程中无发热、胸痛、夜间盗汗及夜间端坐呼吸等。2014年2月7日外院X线胸片提示右肺中叶占位性病变。2014年2月10日为进一步诊治至我院,门诊以“右肺占位待查”收治入院。查体:体温36.6 °C,无贫血貌,全身浅表淋巴结未及肿大,听诊双肺呼吸音粗,右肺可闻及少许湿性啰音,心脏听诊未见异常。腹平软,无压痛及反跳痛,肝、脾肋缘下未触及肿大,双下肢无水肿。入院查血常规:WBC 3.4×109/L,HGB 139 g/L,PLT 136×109/L;生化:总蛋白62.9 g/L,白蛋白40.2 g/L,球蛋白22.7 g/L,血钙2.16 mmol/L,肝功能和肾功能正常;尿常规:隐血(+),尿蛋白(+/−);男性肿瘤指标:癌胚抗原9.16 µg/L(正常参考值<6.5 µg/L),糖类抗原125 35.63 U/ml(正常参考值<35 U/ml),细胞角质素片段抗原21-1 6.70 µg/L(正常参考值<3.3 µg/L),NSE、SCC、TPS和TSGF均正常。1-3-β-D葡聚糖、降钙素原正常。头颅平扫未见明显骨质破坏。胸部CT:①右肺上叶癌伴两肺多发转移;②纵隔淋巴结增大,两肺炎症;③右侧胸腔积液,两侧胸膜局限性增厚(图1A~C)。纤维支气管镜:左侧各支气管管腔通畅,右上叶尖段支气管黏膜肥厚,管腔完全闭塞,右下叶各支气管管腔通畅,未见新生物及出血(图1D)。脱落细胞学检查结论:考虑恶性肿瘤细胞,倾向腺癌可能。组织病理学检查结论:肺浆细胞瘤可能。免疫组化:CD138(+)、CD38(+)、Ki-67(+,20%)、LCA(−)、CD2(−)、CD3(−)、CD19(−)、CD20(−)、CD79a(−)、Kappa(+)、Lambda(−)、CK7(−),支持EMP(图2A~F)。全身骨骼X线片检测未见明显骨病变。血清免疫球蛋白定量、血清蛋白电泳、血β2微球蛋白、尿β2微球蛋白、血轻链定量、24 h尿轻链定量等均在正常范围内。血清免疫固定电泳阴性、血清游离轻链正常。骨髓细胞形态学:粒系增生活跃,红系增生活跃,淋巴细胞比例及形态正常;粒系、红系及巨核系正常,未见浆细胞。骨髓免疫分型:CD2 86%、CD3 77%、CD5 65%、CD7 55%、CD19 10%、CD38 32%、CD138 1%;HLA-DR 37%;无克隆性浆细胞。骨髓染色体核型分析结果:正常核型。FISH: 13q14/Rb1/P53缺失阴性;1q21扩增阴性;IgH重排阴性。根据以上相关检查结果,诊断为原发性肺浆细胞瘤。患者拒绝进一步诊治而自动出院,院外间断口服抗生素治疗(具体不详),2014年12月死亡。
图1. 患者胸部CT(A~C)和支气管镜(D)检查结果.
A:右肺上叶一较大团状肿块,边缘不清晰;B:两肺多发小结节灶;C:右下肺较大结节灶;D:纤维支气管镜示右上叶支气管管腔完全闭塞
图2. 患者肺活检组织免疫组织化学染色结果(×200).
A:Ki-67(+);B:CD38(+);C:CD138(+);D:Kappa(+);E:Lambda(−);F:CK7(−)
讨论及文献复习
浆细胞病系来源于成熟B淋巴细胞的单克隆浆细胞异常增殖,并伴有合成和分泌过量单克隆免疫球蛋白或其多肽链亚单位(轻链/重链)的一组疾病[6]。M蛋白的量与浆细胞的数量呈正相关,是评价恶性浆细胞肿瘤负荷的指标。最常见的浆细胞病为多发性骨髓瘤(MM),多数浆细胞局限于骨髓腔中,依赖于骨髓微环境,但是浆细胞也可以在外周血中检测到,尤其是在疾病复发时。如果浆细胞突破骨髓腔至血液中或者形成肿块,则表现为浆细胞白血病或者软组织浆细胞瘤,这种生长于骨髓之外的浆细胞软组织肿瘤称为EMP,此时浆细胞则不依赖于微环境而存在[7]。MM发病初期,7%~18%的患者合并有浆细胞瘤,而当疾病进展或者复发时,另外有6%~20%的患者出现浆细胞瘤的表现[8]。
不同于继发或者伴发于MM的EMP,有3%~5%的浆细胞肿瘤为原发于骨髓之外,无MM证据的原发浆细胞软组织肿瘤[9],且80%以上的原发EMP发生在头颈部,以鼻腔、副鼻、鼻咽等上呼吸道最为常见,而下呼吸道为罕见发病部位。其诊断条件包括:①经病理证实的原发于骨髓外的浆细胞瘤。②骨髓象正常。③无MM相关临床表现及相关实验室检查阳性指标。④无M蛋白或者检测到少量的M蛋白[9]。
EMP可以发生于全身各个组织和器官,如肝脏、肾脏、皮肤、中枢神经系统、乳腺、淋巴结。PPP是一种极为罕见的EMP。本例患者经支气管镜活检病理HE染色提示为浆细胞骨髓瘤,进一步的免疫组化CD138(+)、CD38(+)、Kappa(+)明确该诊断。患者骨髓象正常,且无高钙血症、肾功能不全、贫血表现、明显骨病变和组织损伤表现。血清免疫球蛋白定量、血清蛋白电泳、血和尿轻链定量等均在正常范围内、血清免疫固定电泳阴性以及血清游离轻链正常,这些检测结果均可以排除MM诊断,证明为原发于肺的EMP。
国际上第1例PPP由Gordon和Walker于1944年在Arch Pathol上报道(Gordon J, Walker G. Plasmacytoma of the lung. Arch Pathol 1944, 37: 222)。检索PubMed和万方数据库,有比较详细临床资料的PPP病例国外报道43例,国内11例,我们对其中部分数据进行了汇总。结果发现,国内外PPP患者的中位发病年龄和MM基本相似,均为50岁以上,说明PPP和其他浆细胞疾病一样,为老年性疾病。从性别因素上分析,国外的男女发病率无明显差异,而国内报的11例患者中只有1例为女性。对于肺部浆细胞瘤病灶的数量,国外报道单发病灶为66%,多发病灶为34%,而国内报道的11例患者均为肺部单发病灶,所以我们报道的该例患者应该为国内首例多发性肺部浆细胞瘤。
浆细胞瘤的诊断依赖于病理活检,PPP同样如此,而取得组织的难易程度与病灶位置有关。Joseph等[2]报道PPP好发于肺门或肺叶,在胸片、CT和MRI等影像学检查通常表现为孤立性、密度均匀、边界清晰的团块灶,故在初诊时极易误诊为肺癌,主要的诊断顺序依次为痰脱落细胞学、支气管镜检查、经皮细针穿刺学和开胸活检。前两者可发现异常,但确诊困难。细针穿刺学诊断率较活检低,其原因可能与所取到的组织、细胞较少有关,后者因组织较多,且可进行免疫组化等精确度更高的检查以进一步明确。CT和MRI有助于判断肿瘤是否具有侵袭性、有无钙化及坏死[10]。本文统计的病例中,国外和国内的患者确诊手段多数依赖于开胸活检取得病理,分别为46.5%和63.6%。另外,在国外,30.2%的患者依靠支气管镜活检诊断,其次为经皮肺穿刺活检(16.3%),少数通过胸腔镜或纵隔镜明确诊断。到目前为止国内尚无经过支气管镜和纵隔镜活检的报道,我们的报道可能是国内首例通过支气管镜明确诊断的PPP。
免疫组织化学检查结果是诊断浆细胞瘤的重要依据,尤其是κ或λ轻链的表达是判断单克隆浆细胞的重要指标,本例患者浆细胞κ轻链阳性而不表达λ轻链,支持单克隆浆细胞的诊断。国内报道的11例患者,有8例未提供相关资料。而国外报道的患者资料相对完整,43例患者中只有4例未提供相关资料,另外39例患者中κ轻链和λ轻链的阳性率几乎一致,说明在浆细胞瘤中轻链的表达没有倾向性。对于外周血中单克隆球蛋白的检查,国外的资料也明显较国内资料详尽,国内11例患者中只有6例患者检测该项目,且均为阴性。而国外的43例患者中,只有2例未提供资料,其他41例患者中,有24例患者未检测出单克隆球蛋白。以上资料说明,在PPP患者中有50%以上外周血中不能检测到M蛋白。文献报道约25%的EMP患者外周血可检测到单克隆免疫球蛋白或其M片段[11]。当然检测方法也很重要,我们检索到的国内外文献对M蛋白的检测均采用免疫固定电泳,如果联合血清游离轻链可能阳性率会提高,而我们报道的该例患者经免疫固定电泳和血清游离轻链检测M蛋白均为阴性。
对于孤立性EMP的治疗多选择放射治疗或手术切除,治疗有效率为80%~100%,10年无病生存(DFS)率为50%~65%,手术切除对呼吸道病灶较头颈部病灶疗效好,但对于多发或弥散病灶的患者来说,化疗效果则是理想选择[12]–[13]。同样对于孤立性PPP,无论是国内还是国外文献报道绝大多数选择放疗或者手术切除,国内报道的11例患者均为孤立性病灶,其中7例(63.6%)行单纯手术切除,接受放疗、VAD(长春新碱+阿霉素+地塞米松)方案化疗、放疗联合VAD方案化疗各1例,另外1例随诊观察,没有接受治疗。而国外报道的35例孤立性病灶,有17例接受单纯切除治疗,8例接受单纯放疗,6例接受MP(马法兰+泼尼松)、CMP(马法兰+环磷酰胺+泼尼松)或者VAMP(长春新碱、阿霉素、马法兰、泼尼松)方案化疗,3例接受放疗和化疗联合治疗,另1例在VAD方案化疗后接受自体造血干细胞移植[14]。对于多发性PPP患者,治疗方案倾向于MM的治疗方案,我们统计的国外8例多发性PPP患者,均接受MP、VAD+MP或者VAMP方案化疗。
EMP患者的预后优于MM。原发于上呼吸道的局限性病灶预后最好,而发生于头颈部之外的巨大EMP或多发性病灶易扩散。原位复发概率为10%~30%,最终转化为MM的概率为17%~48%,中位生存期为63~102个月[15]。Wise等[16]在2001年统计发现,PPP患者的2年生存率为66%,5年生存率为40%,其中有患者甚至存活超过20年,但所统计的患者均为孤立性PPP,而多发性PPP的预后推测同其他EMP患者,转化为MM的概率明显升高,所以治疗方案也参照MM。国外文献报道随访时间最长为15年,平均随访时间为40.8(6.0~180.0)个月,国内平均随访时间为28.8(3.0~60.0)个月,多数患者未到疾病进展或者死亡,所以对于目前可以检索到的文献,无法确切得到PPP的无进展生存和总生存时间。近来有研究者发现,以硼替佐米为主的化疗方案,如BD(硼替佐米+地塞米松)、BDT(硼替佐米+地塞米松+沙利度胺)方案,对骨、胃、胰腺、硬膜外等EMP患者有较好的治疗效果,甚至可达完全缓解[17]–[21]。所以新药如蛋白酶体抑制剂和免疫调节剂是否可以明显提高多发性PPP患者的无进展生存和总生存率尚需大量的临床资料予以证实。
综上,我们报道的该例多发性PPP,为国内首例通过支气管镜活检明确诊断的PPP。对于多病灶的PPP,建议按照MM方案治疗,尤其是新药物如蛋白酶体抑制剂和(或)免疫调节剂。
Funding Statement
基金项目:国家自然科学基金(81172256);中国博士后科学基金面上项目(2014M550307)
References
- 1.Galieni P, Cavo M, Pulsoni A, et al. Clinical outcome of extramedullary plasmacytoma[J] Haematologica. 2000;85(1):47–51. [PubMed] [Google Scholar]
- 2.Joseph G, Pandit M, Korfhage L. Primary pulmonary plasmacytoma[J] Cancer. 1993;71(3):721–724. doi: 10.1002/1097-0142(19930201)71:3<721::aid-cncr2820710311>3.0.co;2-u. [DOI] [PubMed] [Google Scholar]
- 3.Horiuchi T, Hirokawa M, Oyama Y, et al. Diffuse pulmonary infiltrates as a roentgenographic manifestation of primary pulmonary plasmacytoma[J] Am J Med. 1998;105(1):72–74. doi: 10.1016/s0002-9343(98)00131-4. [DOI] [PubMed] [Google Scholar]
- 4.Lazarevic V, Cemerikic-Martinovic V, Suvajdzic N, et al. Diffuse primary plasmacytoma of the lung[J] Haematologia (Budap) 2001;31(2):161–165. doi: 10.1163/15685590152492972. [DOI] [PubMed] [Google Scholar]
- 5.Kim SH, Kim TH, Sohn JW, et al. Primary pulmonary plasmacytoma presenting as multiple lung nodules[J] Korean J Intern Med. 2012;27(1):111–113. doi: 10.3904/kjim.2012.27.1.111. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.中国医师协会血液科医师分会. 中国多发性骨髓瘤诊治指南(2013年修订)[J] 中华内科杂志. 2013;52(9):791–795. [Google Scholar]
- 7.Blade J, Fernandez de Larrea C, Rosinol L, et al. Soft-tissue plasmacytomas in multiple myeloma: incidence, mechanisms of extramedullary spread, and treatment approach[J] J Clin Oncol. 2011;29(28):3805–3812. doi: 10.1200/JCO.2011.34.9290. [DOI] [PubMed] [Google Scholar]
- 8.Varettoni M, Corso A, Pica G, et al. Incidence, presenting features and outcome of extramedullary disease in multiple myeloma: a longitudinal study on 1003 consecutive patients[J] Ann Oncol. 2010;21(2):325–330. doi: 10.1093/annonc/mdp329. [DOI] [PubMed] [Google Scholar]
- 9.International Myeloma Working Group. Criteria for the classification of monoclonal gammopathies, multiple myeloma and related disorders: a report of the International Myeloma Working Group[J] Br J Haematol. 2003;121(5):749–757. [PubMed] [Google Scholar]
- 10.Egashira K, Hirakata K, Nakata H, et al. CT and MRI manifestations of primary pulmonary plasmacytoma[J] Clin Imaging. 1995;19(1):17–19. doi: 10.1016/0899-7071(94)00033-9. [DOI] [PubMed] [Google Scholar]
- 11.Mohammad Taheri Z, Mohammadi F, Karbasi M, et al. Primary pulmonary plasmacytoma with diffuse alveolar consolidation: a case report[J] Patholog Res Int. 2010;2010:463465. doi: 10.4061/2010/463465. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Tsang RW, Gospodarowicz MK, Pintilie M, et al. Solitary plasmacytoma treated with radiotherapy: impact of tumor size on outcome[J] Int J Radiat Oncol Biol Phys. 2001;50(1):113–120. doi: 10.1016/s0360-3016(00)01572-8. [DOI] [PubMed] [Google Scholar]
- 13.Liebross RH, Ha CS, Cox JD, et al. Clinical course of solitary extramedullary plasmacytoma[J] Radiother Oncol. 1999;52(3):245–249. doi: 10.1016/s0167-8140(99)00114-0. [DOI] [PubMed] [Google Scholar]
- 14.Gozdziuk K, Kedra M, Rybojad P, et al. A rare case of solitary plasmacytoma mimicking a primary lung tumor[J] Ann Thorac Surg. 2009;87(4):e25–26. doi: 10.1016/j.athoracsur.2008.11.066. [DOI] [PubMed] [Google Scholar]
- 15.Wang J, Pandha HS, Treleaven J, et al. Metastatic extramedullary plasmacytoma of the lung[J] Leuk Lymphoma. 1999;35(3-4):423–425. doi: 10.3109/10428199909145749. [DOI] [PubMed] [Google Scholar]
- 16.Wise JN, Schaefer RF, Read RC. Primary pulmonary plasmacytoma: a case report[J] Chest. 2001;120(4):1405–1407. doi: 10.1378/chest.120.4.1405. [DOI] [PubMed] [Google Scholar]
- 17.Katodritou E, Kartsios C, Gastari V, et al. Successful treatment of extramedullary gastric plasmacytoma with the combination of bortezomib and dexamethasone: first reported case[J] Leuk Res. 2008;32(2):339–341. doi: 10.1016/j.leukres.2007.04.016. [DOI] [PubMed] [Google Scholar]
- 18.Espanol I, Martinez A, Lopez MD, et al. First report of a medullar cord compression secondary to osseous plasmacytoma successfully treated with bortezomib and dexamethasone[J] Leuk Res. 2010;34(4):e97–99. doi: 10.1016/j.leukres.2009.09.029. [DOI] [PubMed] [Google Scholar]
- 19.Wei JY, Tong HY, Zhu WF, et al. Bortezomib in treatment of extramedullary plasmacytoma of the pancreas[J] Hepatobiliary Pancreat Dis Int. 2009;8(3):329–331. [PubMed] [Google Scholar]
- 20.Zeng Z, Zheng L, Lin J, et al. Successful bortezomib treatment in combination with dexamethasone and thalidomide for previously untreated epidural plasmacytoma[J] Oncol Lett. 2012;3(3):557–559. doi: 10.3892/ol.2011.539. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Shah BK, Shrestha A. Pulmonary plasmacytoma[J] J Thorac Oncol. 2012;7(5):923. doi: 10.1097/JTO.0b013e31824cbb2f. [DOI] [PubMed] [Google Scholar]