Abstract
目的
探讨白花前胡提取物角型吡喃骈香豆素(+/−)-4′-O-acetyl-3′-O-angeloyl-ciskhellactone(APC)对骨髓瘤细胞株U266细胞增殖和凋亡的影响。
方法
采用石油醚法提取APC,高效液相色谱检测其纯度,磁共振谱法进行结构鉴定。采用不同浓度的APC(0、10、20、30、40 µg/ml)作用于U266细胞不同时间(24、48 h),CCK-8法检测其对细胞增殖的影响;作用于U266细胞24 h后,采用AnnexinⅤ/PI流式细胞术及Hochest33342荧光染色法检测细胞凋亡;Western blot法检测caspase-3、caspase-8、AKT、p-AKT、ERK、p-ERK蛋白活性的变化;RT-PCR法检测人端粒酶逆转录酶(hTERT)亚基表达的变化。
结果
高效液相色谱检测APC纯度为98.8%。APC可抑制U266细胞的增殖,抑制率呈一定的浓度和时间依赖性,与空白对照组比较,抑制率差异均有统计学意义(P值均<0.01);10、20、30、40 µg/ml APC作用24 h后U266细胞凋亡率分别为(5.63±0.21)%、(16.07±2.27)%、(24.83±1.65)%、(43.46±2.91)%,与空白对照组[(2.50±0.13)%]比较,差异均有统计学意义(P值均<0.05);caspase-3、caspase-8蛋白表达随药物浓度增加呈上调趋势,AKT、ERK变化不明显,p-AKT、p-ERK蛋白表达随药物浓度增加而明显下调;随APC药物浓度增加,hTERT mRNA的表达下调。
结论
APC能抑制U266细胞增殖并诱导其凋亡,其凋亡机制可能与caspase-8、caspase-3、p-AKT、p-ERK蛋白表达变化以及hTERT亚基表达下调相关。
Keywords: 角型吡喃骈香豆素, U266细胞, 细胞凋亡, 作用机制
Abstract
Objective
To investigate the effects of angular pyranocoumarin (±)-4′-O-acetyl-3′-O-angeloyl-cis-khellactone (APC) extracted from peucedanum praeruptoruon on the proliferation and apoptosis of U266 cells, and to explore its related mechanism.
Methods
APC was extracted by petroleum ether technique, and its purity was tested by high performance liquid chromatography, and its chemical structure was identified by magnetic resonance spectroscopy. U266 cells were treated with APC in various concentrations (0, 10, 20, 30, 40 µg/ml) for different durations (24 and 48 h). The inhibitive effect of APC on cell growth was detected by CCK-8 method. After U266 cells were incubated with APC (0, 10, 20, 30, 40 µg/ml) for 24 h, the apoptosis of cells were observed by flow cytometry stained with Annexin Ⅴ/PI and Hochest33342; the expression levels of caspase-3, 8, ERK, p-ERK, AKT and p-AKT protein were assayed by Western blot; the expression of hTERT mRNA was measured by RT-PCR.
Results
The purity of APC identified by magnetic resonance imaging was 98.8%. The proliferation of U266 cells was inhibited, and the apoptosis was induced in a time-and/or dose-dependent manner after treatment with APC. APC could upregulate the caspase-8, 3 protein expression and downregulate the p-ERK, p-AKT protein expression along with the increase of APC dose. APC also could downregulate the hTERT mRNA expression.
Conclusion
Angular pyranocoumarin APC could inhibit the proliferation and induce the apoptosis of U266 cells. The probable mechanism might be achieved by upregulating caspase-8, 3 protein expression and downregulating p-ERK, P-AKT protein and the hTERT mRNA expression.
Keywords: Angular pyranocoumarin, U266 cells, Apoptosis, Mechanism
多发性骨髓瘤(MM)是浆细胞恶性肿瘤,尽管有化疗及造血干细胞移植等多种治疗手段,但除极少数接受异基因造血干细胞移植的患者可能获得治愈外,绝大多数患者仍会复发[1]。因而,MM的治疗迫切需要新的药物来提高疗效,以期取得长期缓解,甚至达到治愈。
前胡为伞形科植物白花前胡的干燥根。近年来研究发现前胡有抗心肌缺血、保护心肌、改善心脏功能、扩张血管、降低血压、抗氧化、祛痰、抗菌、解热镇痛抗炎、抑制肝药酶活性及抗肿瘤等多种作用[2]–[9]。最近香港学者报道前胡的提取物角型吡喃骈香豆素(+/−)-4′-O-acetyl-3′-O-angeloyl-ciskhellactone(APC)可以诱导人急性髓系白血病细胞株HL-60细胞分化,促进细胞凋亡[10],而对MM细胞的作用尚不清楚。在本研究中,我们观察APC对MM细胞株U226细胞的作用并探讨其作用机制,从而为其抗MM的临床应用提供理论依据。
材料和方法
1.药品和主要试剂:所用药材白花前胡购自华东医药股份有限公司药材参茸分公司(批号121017)。RPMI 1640培养液、PBS购自杭州吉诺生物医药技术有限公司。胎牛血清为浙江天杭生物科技股份有限公司产品。DMSO为美国Sigma公司产品。CCK-8试剂盒为碧云天生物技术研究所产品。细胞凋亡检测试剂盒为南京凯基生物科技发展有限公司产品。Hochest33342荧光染料为美国Cell Signaling Technology公司产品。caspase-3、caspase-8、AKT、p-AKT、ERK、p-ERK抗体为美国Epitomics公司产品。RT-PCR试剂盒为宝生物工程(大连)有限公司产品。
2.细胞培养:U266细胞由浙江大学第一附属医院血液病研究所惠赠。细胞悬浮培养于含10%胎牛血清的RPMI 1640培养液中,置于37 °C、5%CO2、饱和湿度培养箱中培养。取对数生长期细胞用于实验。
3.APC提取及鉴定:取白花前胡1 kg,参照文献[9]–[11]进行APC的提取及纯化。采用高效液相色谱分析APC的纯度,经峰面积归一化法进行计算。采用核磁共振氢谱(1H-NMR)、核磁共振碳谱(13C-NMR)、红外光谱(IR)、电喷雾质谱法(ESI-MS)对获得的APC进行结构鉴定。
4.CCK-8法检测APC对U266细胞增殖的抑制率:取对数生长期U266细胞,调整细胞密度为0.6× 104/ml,接种于96孔板内(每孔加入细胞悬液200 µl)。实验组设APC药物终浓度为10、20、30、40 µg/ml,并设不加药细胞对照组(空白对照组)及溶剂对照组,培养24、48 h后,每孔加入CCK-8溶液20 µl, 37 °C培养3 h,采用酶标仪于450 nm波长处测定吸光度(A)值。每组实验设5个复孔,实验重复3次。APC对U266细胞的增殖抑制作用以增殖抑制率表示,按以下公式进行计算:
5.Hochest33342荧光染色检测凋亡细胞:取对数生长期U266细胞,调整细胞密度为2×104/ml,接种于12孔板内(每孔加入细胞悬液1 ml)。实验组设APC药物终浓度为10、20、30、40 µg/ml,并设空白对照组,培养24 h后收集各孔细胞于离心管内,1 200 r/min,离心5 min(离心半径为7 cm),去上清液,PBS洗涤,加Hochest33342荧光染料(10 µg/ml)100 µl,避光作用15 min,采用PBS洗涤并重悬细胞,荧光显微镜下观察并照相。每组实验设3个复孔,实验重复3次。
6.流式细胞术检测凋亡细胞:取对数生长期细胞,收集不同浓度(0、10、20、30、40 µg/ml) APC处理24 h的U266细胞,PBS洗涤,调整细胞密度为5× 105 /ml,加入500 µl的结合缓冲液悬浮细胞,先后加入5 µl AnnexinⅤ-FITC,5 µl碘化丙锭(PI),室温下避光反应5~15 min,上流式细胞仪(EPISXL,美国Coulter公司产品)检测,采用CeIIgueSt软件进行资料分析。实验重复3次。
7.Western blot法检测凋亡相关蛋白表达:取对数生长期U266细胞,调整细胞密度为5×104/ml,接种于6孔板内(每孔加入细胞悬液2 ml)。实验组设终浓度为10、20、30、40 µg/ml APC组及空白对照组,培养24 h后收集细胞,按照蛋白抽提试剂盒说明书提取细胞总蛋白,BCA法测定蛋白浓度后,取40 µg变性后蛋白样品上样,行SDS-聚丙烯酰胺凝胶电泳,电泳结束后将蛋白转移至PVDF膜上,用含50 g/L脱脂奶粉溶液的TBST室温封闭2 h,待测蛋白抗体4 °C封闭过夜,TBST洗膜后,加二抗室温孵育2 h, TBST洗膜,DAB显色,以β-actin为内参照,IPP光密度分析软件进行分析,以目的条带与β-actin灰度值的比值表示目的蛋白的表达水平。
8.RT-PCR法检测APC对U266细胞人端粒酶逆转录酶(hTERT)基因表达的影响:收集不同浓度(0、10、20、30、40 µg/ml) APC处理24 h的U266细胞,提取总RNA,按照反转录试剂盒说明书合成cDNA。hTERT及内参β-actin基因扩增引物由生工生物工程(上海)有限公司合成。hTERT基因上游引物:5′-TATGCCGTGGTCCAGAAGG-3′,hTERT基因下游引物:5′-ACAAGAAATCATCCACCAAACG-3′,扩增片段145 bp;内参β-actin基因上游引物:5′-AGAAGGCTGGGGCTCATTTG-3′,内参β-actin基因下游引物:5′-AGGGGCCATCCACAGTCTTC-3′,扩增片段为619 bp. PCR条件:94 °C变性20 s, 55 °C退火20 s, 72延伸15 s,共30个循环。扩增产物行15 g/L的琼脂糖凝胶电泳,采用凝胶成像系统进行结果分析。
9.统计学处理:采用SPSS13.0软件进行统计学分析。数据以x±s表示,采用单因素方差分析进行统计学处理,组间差异的比较采用LSD检验,以P< 0.05为差异有统计学意义。
结果
1.APC的纯度检测:采用高效液相色谱分析,计算峰面积得其纯度为98.8%。
2.APC结构鉴定:获得的化合物为无色针晶状。其结构分析数据与文献[11]–[13]进行比对,确证其结构为APC。
3.APC对U266细胞增殖的抑制作用:U266细胞经APC(10、20、30、40 µg/ml)作用24、48 h后,APC各药物浓度组与与空白对照组比较,差异均有统计学意义(P值均<0.01),并呈一定的量效和时效关系(表1)。
表1. 角型吡喃骈香豆素(APC)对U266细胞增殖的抑制作用(%,x±s).
| 组别 | 24 h处理组 | 48 h处理组 |
| 空白对照组 | 0 | 0 |
| APC处理组 | ||
| 10 µg/ml | 21.23±1.67a | 27.19±2.00a |
| 20 µg/ml | 22.68±2.23a | 28.62±1.91a |
| 30 µg/ml | 42.86±2.03a | 54.51±1.89a |
| 40 µg/ml | 58.08±1.11a | 59.50±1.73a |
注:与空白对照组相比较,aP<0.01;每组实验设5个复孔,实验重复3次
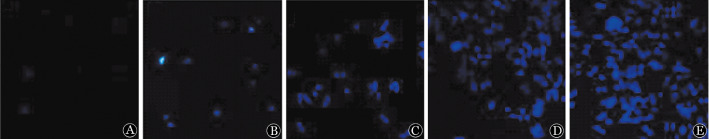
4.Hochest33342荧光染色检测凋亡细胞:不同浓度APC(0、10、20、30、40 µg/ml)作用U266细胞24 h后,Hochest33342荧光染色后于荧光显微镜下观察,发现空白对照组成活细胞极少量被染成淡蓝色,随药物浓度的增加,被紫外光激发出的蓝色荧光增强,且荧光强度随药物浓度的增加而增强,说明APC可诱导U266细胞的凋亡,且呈剂量依赖性(图1)。
图1. Hochest33342荧光染色法检测角型吡喃骈香豆素(APC)对U266细胞凋亡的影响.
A:空白对照组;B~E:分别为10、20、30、40 µg/ml APC处理组
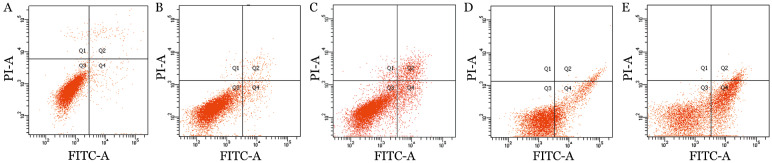
5.流式细胞术检测细胞凋亡:空白对照组的细胞凋亡率为(2.50±0.13)%,10、20、30、40 µg/ml APC处理组细胞凋亡率分别为(5.63±0.21)%、(16.07± 2.27)%、(24.83±1.65)%、(43.46±2.91)%,与空白对照组比较差异均有统计学意义(P值均为0.000)。结果显示APC可诱导U266细胞凋亡,凋亡率随APC药物浓度增高而增加,呈剂量依赖性(图2)。
图2. 流式细胞术检测角型吡喃骈香豆素(APC)对U266细胞凋亡的影响.
A:空白对照组;B~E:分别为10、20、30、40 µg/ml APC处理组
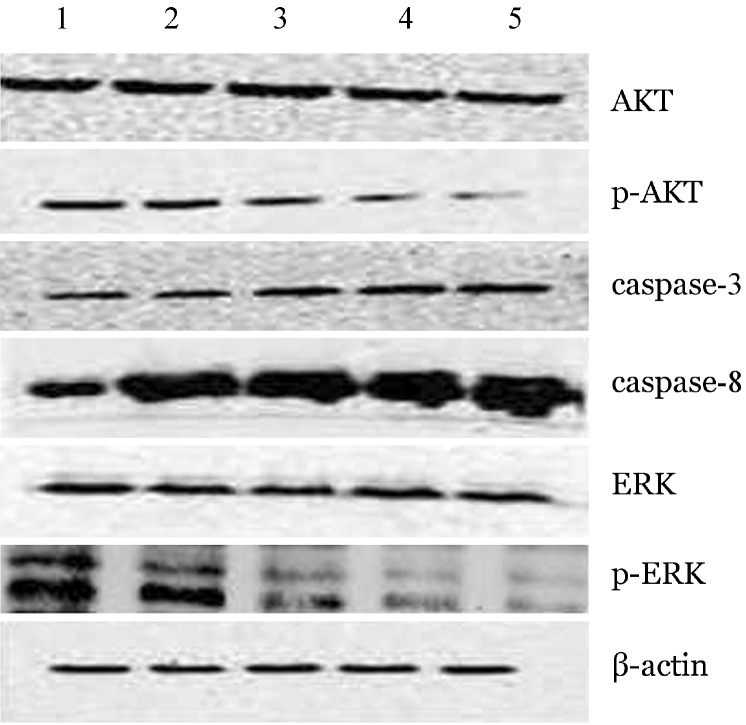
6.Western blot法检测凋亡相关蛋白表达:不同浓度APC(10、20、30、40 µg/ml)处理U266细胞24 h后检测AKT、p-AKT、caspase-3、caspase-8、ERK、p-ERK蛋白的表达,结果显示,与空白对照组相比,AKT、ERK无明显变化,p-AKT、p-ERK蛋白表达随药物浓度增加而下调,caspase-3、caspase-8蛋白表达随药物浓度增加而增加(图3)。
图3. Western blot检测角型吡喃骈香豆素(APC)对U266细胞蛋白表达的影响.
1:空白对照组;2~5:分别为10、20、30、40 µg/ml APC处理组
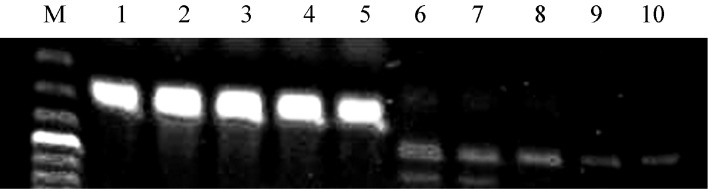
7.RT-PCR法检测端粒酶亚基hTERT基因表达:结果显示不同浓度APC(10、20、30、40 µg/ml)处理24 h后,U266细胞内hTERT基因表达受到不同程度的影响,随药物浓度增高,hTERT基因表达下调越明显(图4)。
图4. RT-PCR法检测角型吡喃骈香豆素(APC)对U266细胞hTERT表达的影响.
M:Marker;1:内参照β-actin;2~5:分别为10、20、30、40 µg/ml APC处理组+内参照β-actin 基因扩增引物;6:空白对照组;7~10:分别为10、20、30、40 µg/ml APC处理组+hTERT 基因扩增引物
讨论
白花前胡是一种传统中药,具有疏散风热、降气化痰的功效。白花前胡主要的化学成分为香豆素类化合物,还含有挥发油类及D-甘露醇等其他成分。白花前胡香豆素类化合物以角型吡喃香豆素类成分为主。白花前胡香豆素类活性成分具有抗肿瘤作用[9]–[10]。
PI3K/Akt/mTOR信号通路参与调节端粒酶活性、血管形成、肿瘤侵袭等过程,与肿瘤细胞生存、凋亡密切相关[14],抑制该信号通路可有效促进肿瘤细胞凋亡。p-AKT蛋白的高水平表达是重要的人体肿瘤发生的特征[15]。在本研究中我们发现U266细胞经APC作用后检测到的总AKT蛋白表达未受明显影响,而p-AKT蛋白表达随药物浓度增加而下调,推测APC抑制U266细胞增殖并诱导凋亡可能与该信号通路相关。
Ras/MeK/ERK通路是所有真核细胞内存在的细胞分裂素活化蛋白激酶(MAPK)众多通路之一,主要参与细胞生长、增殖、分化及凋亡等过程[16]。MAPK信号通路是连接细胞内因子表达和细胞外刺激的桥梁,在肿瘤药物治疗疾病中发挥着重要作用。有文献报道ERK的过度表达与多种肿瘤治疗耐药存在正相关[17]。我们的研究结果显示U266细胞p-ERK蛋白随药物浓度增加而明显下调,提示APC有逆转MM细胞药物耐药的可能。
caspase蛋白家族是诱导细胞凋亡的核心,参与两条凋亡途径。caspase-3是caspase级联反应的最终效应酶,是凋亡信号通路下游的效应半胱氨酸,caspase-3的活化是决定细胞进入凋亡程序的关键,参与降解凋亡过程中的细胞底物[18]。我们的结果显示caspase-8、caspase-3蛋白表达均随APC药物浓度增加而上调,提示当APC作用于U266细胞后,产生死亡效应激活caspase-8蛋白,出现级联反应进而激活下游的caspase-3蛋白,最终导致细胞凋亡。
肿瘤细胞不断增殖分化与端粒酶活性及端粒长度密切相关,hTERT具有维持端粒酶活性及端粒长度的作用[19],因而hTERT与肿瘤细胞寿命密切相关。在本研究中我们发现,随着APC浓度的增加U266细胞中hTERT基因表达下降,提示APC抑制U266细胞增殖与抑制hTERT活性有关。
综上,在本研究中我们证实了前胡提取物APC可以明显抑制U266细胞增殖并诱导其凋亡,其机制可能与下调p-AKT、p-ERK蛋白表达、激活caspase-8、caspase-3及hTERT基因表达下降密切相关。
Funding Statement
基金项目:浙江省中医药科学研究基金(2012ZA038)
References
- 1.黄 晓军. 中国多发性骨髓瘤治疗现状及挑战[J] 中华血液学杂志. 2013;34(4):281–282. doi: 10.3760/cma.j.issn.0253-2727.2013.04.001. [DOI] [PubMed] [Google Scholar]
- 2.涂 乾, 张 雯娟, 涂 欣. 白花前胡提取液抗慢性压力超负荷大鼠心肌细胞凋亡研究[J] 江汉大学学报(自然科学版) 2006;34(2):71–73. [Google Scholar]
- 3.李 刚, 张 乐, 邹 军, et al. 白花前胡提取物对急性心肌缺血的保护作用[C] 中国药理学会第十次全国学术会议专刊. 2009;25(Suppl):295. [Google Scholar]
- 4.Tu X, Miao L, Kang Y, et al. Effects of dl-praeruptorin A on cultured neonatal rat ventricular cardiomyocytes with hypertrophy induced by endothelin-1[J] Methods Find Exp Clin Pharmacol. 2009;31(4):231–236. doi: 10.1358/mf.2009.31.4.1371199. [DOI] [PubMed] [Google Scholar]
- 5.饶 曼人, 刘 宛斌, 张 晓文, et al. 前胡丙素对Ang II致离体血管平滑肌细胞肥厚及胞内钙、NO含量和信号转导的影响[J] 药学学报. 2002;37(1):5–8. [PubMed] [Google Scholar]
- 6.Wei EH, Rao MR, Chen XY, et al. Inhibitory effects of praeruptorin C on cattle aortic smooth muscle cell proliferation[J] Acta Pharmacol Sinica. 2002;23(2):129–132. [PubMed] [Google Scholar]
- 7.饶 曼人, 刘 宛斌, 刘 培庆, et al. 前胡丙素对高血压大鼠血管肥厚、细胞内钙、胶原及NO的影响[J] 药学学报. 2002;11(3):110–114. [Google Scholar]
- 8.王 德才, 马 健, 孔 志峰, et al. 白花前胡总香豆素解热镇痛抗炎作用的实验研究[J] 中国中医药信息杂志. 2004;11(8):688–690. [Google Scholar]
- 9.Zhang JX, Fong WF, Wu JY, et al. Pyranocoumarins isolated from peucedanum praeruptorum as differentiation inducers in human leukemic HL-60 cells[J] Planta Med. 2003;69(3):223–229. doi: 10.1055/s-2003-38490. [DOI] [PubMed] [Google Scholar]
- 10.Fong WF, Zhang JX, Wu JY, et al. Pyranocoumarin(+/−)-4′-O-acetyl-3′-O-angeloyl-cis-khellactone induces mitochondrial-dependent apoptosis in HL-60 cells[J] Planta Med. 2004;70(6):489–495. doi: 10.1055/s-2004-827146. [DOI] [PubMed] [Google Scholar]
- 11.Xiong Y, Wang J, Wu F, et al. Effects of(±)-praeruptorin A on airway inflammation, airway hyperresponsiveness and NF-κB signaling pathway in a mouse model of allergic airway disease[J] Eur J Pharmacol. 2012;683(1-3):316–324. doi: 10.1016/j.ejphar.2012.03.004. [DOI] [PubMed] [Google Scholar]
- 12.陈 政雄, 黄 宝山, 佘 其龙, et al. 中药白花前胡化学成分的研究–四种新香豆素的结构[J] 药学学报. 1979;8:486–496. [PubMed] [Google Scholar]
- 13.Xu Z, Wang X, Dai Y, et al. (+/−)-Praeruptorin A enantiomers exert distinct relaxant effects on isolated rat aorta rings dependent on endothelium and nitric oxide synthesis[J] Chem Biol Interact. 2010;186(2):239–246. doi: 10.1016/j.cbi.2010.04.024. [DOI] [PubMed] [Google Scholar]
- 14.李 月飞. PI3K/Akt/mTOR信号传导通路在恶性肿瘤中的研究进展[J] 中国医药指南. 2013;36:358. [Google Scholar]
- 15.陈 葆国, 朱 敏, 罗 文达, et al. 骨髓增生异常综合征PTEN基因表达和Akt磷酸化水平的相关性研究[J] 中华血液学杂志. 2007;28(7):470–473. [PubMed] [Google Scholar]
- 16.陈 建勇, 王 聪, 王 娟, et al. MAPK信号通路研究进展[J] 中国医药科学. 2011;1(8):32–34. [Google Scholar]
- 17.付 倍蓓, 范 莹, 郝 良纯, et al. 不同浓度硼替佐米对柔红霉素诱导的K562耐药细胞株ERK、JNK、及P-38表达的影响[J] 中国实验血液学杂志. 2011;19(3):671–673. [PubMed] [Google Scholar]
- 18.林 圣云, 沈 楚云, 蒋 剑平, et al. 白花蛇舌草多糖诱导多发性骨髓瘤细胞凋亡及其机制研究[J] 中华血液学杂志. 2013;34(4):337–340. [Google Scholar]
- 19.Calado RT, Yewdell WT, Wilkerson KL, et al. Sex hormones, acting on the TERT gene, increase telomerase activity in human primary hematopoietic cells[J] Blood. 2009;114(11):2236–2243. doi: 10.1182/blood-2008-09-178871. [DOI] [PMC free article] [PubMed] [Google Scholar]