Abstract
目的
观察CD45在初诊多发性骨髓瘤(MM)患者中的表达,探讨其与MM疗效和预后的关系。
方法
回顾性分析2010年1月至2017年1月河南省人民医院收治的130例初诊MM患者骨髓异常浆细胞中CD45的表达情况,对CD45+与CD45−患者的疗效和预后进行比较。
结果
①130例初诊MM患者中CD45+组33例(25.38%),CD45−组97例(74.62%)。②CD45+组和CD45−组的客观缓解率(ORR)分别为33.33%和64.95%,差异有统计学意义(P=0.002);以硼替佐米为基础方案治疗的患者,CD45+组和CD45−组的ORR分别为35.71%和66.25%,差异有统计学意义(P=0.005)。③130例MM患者的中位无进展生存(PFS)时间为33.3(95%CI 6.0~69.0)个月,中位总生存(OS)时间为36.3(95%CI 6.0~78.0)个月,CD45+组与CD45−组的中位PFS时间分别为29.8(95%CI 10.0~59.0)个月和34.5(95%CI 6.0~69.0)个月,差异有统计学意义(χ2=14.59,P<0.001),中位OS时间分别为32.5(95%CI 10.0~68.0)个月和37.6(95%CI 6.0~78.0)个月,差异有统计学意义(χ2=11.42,P=0.001);接受硼替佐米的患者中,CD45+组与CD45−组的中位PFS分别为30.3(95%CI 10.0~59.0)个月和36.3(95%CI 6.0~69.0)个月,差异有统计学意义(χ2=14.75,P=0.001)。中位OS时间分别为34.0(95%CI 10.0~68.0)个月和39.5(95%CI 6.0~78.0)个月,差异有统计学意义(χ2=10.62,P=0.001)。④Cox风险回归模型分析显示血肌酐≥176.8 µmol/L[HR=2.723(95%CI 1.744~6.723),P=0.001]、CD45阳性[HR=1.330(95%CI 1.067~1.804),P=0.008],LDH ≥ 220 IU/L[HR=1.308(95%CI 1.160~2.417),P=0.015]是独立于其他临床指标的预后危险因素。
结论
CD45阳性是MM患者的预后不良因素。硼替佐米不能改善CD45+MM患者的不良预后。
Keywords: 多发性骨髓瘤, 抗原,CD45, 预后
Abstract
Objective
To explore the expression of CD45 in newly diagnosed multiple myeloma (MM) and its relationship with clinical efficacy and prognosis.
Methods
This study retrospectively analyzed expression and distribution of CD45 in 130 cases of newly diagnosed MM, comparing clinical efficacy and prognosis in CD45+/CD45− groups.
Results
①The CD45+ group was 33 cases (25.38%), and CD45− group was 97 cases (74.62%). ②The objective remission rate (ORR) of CD45+ and CD45−group was 33.33% and 64.95%, respectively. The difference was statistically significant (P=0.002). For patients in Bortezomib regimen, the ORR of CD45+ and CD45− group was 35.71% and 66.25%, respectively. The difference was statistically significant (P=0.005). ③The median progress free survival (PFS) of CD45+ group and CD45− group was 29.8 (95%CI 10.0–59.0) months vs 34.5 (95%CI 6.0–69.0) months (χ2=14.59, P<0.001) and the median overall survival (OS) was 32.5 (95%CI 10.0–68.0) months vs 37.6 (95%CI 6.0–78.0) months (χ2=11.42, P=0.001), respectively. Among the patients in bortezomib regimen, The median PFS and median OS of CD45 + group and CD45− group were 30.3 (95%CI 10.0–59.0) months vs 36.3 (95%CI 6.0–69.0) months (χ2=14.75, P=0.001) and 34.0 (95%CI 10.0–68.0) months vs 39.5 (95%CI 6.0–78.0) months (χ2=10.62, P=0.001). ④Cox risk regression model analysis showed that serum creatinine≥176.8 µmol/L (HR=5.078, 95%CI 1.744–14.723, P=0.001), CD45 positive (HR=14.504, 95%CI 0.168–0.42, P=0.001), LDH≥220 IU/L (HR=1.308, 95%CI 1.16–2.417, P=0.015) were independent risk prognostic factors.
Conclusion
CD45 expression is a risk prognostic factor of MM patients. Bortezomib did not improve the poor prognosis of CD45+ MM patients.
Keywords: Multiple myeloma, CD45, Prognosis
多发性骨髓瘤(MM)是血液科常见的恶性肿瘤,其临床表现及预后有高度的异质性。细胞遗传学检查在预后分层中具有重要作用,荧光原位杂交技术(FISH)已作为必查项目在2013年NCCN指南中被推荐,del(17p)、t(14; 16)及t(14; 20)等是国际公认的不良预后因素[1]。但临床工作中仍需要易操作、技术稳定的指标作为补充协助评估预后。近年来的研究显示,免疫表型不同的各MM细胞亚群,其增殖能力和药物敏感性也迥异,临床表现也各不相同,可应用于MM的预后评估[2]。
CD45是单链跨膜糖蛋白,属于蛋白酪氨酸磷酸酶家族成员。研究显示CD45主要存在于浆细胞的早期阶段,随着浆细胞的成熟表达减少。典型MM患者的浆细胞CD45呈阴性,但仍有少部分MM患者浆细胞CD45阳性,这两群细胞存在明显的生物学差异[3],有研究认为CD45阳性是新诊断MM患者预后不良的独立预测因子[4]。不同研究中CD45+ MM患者的比例差异明显(20.0%~68.5%)[4]–[8],且目前尚无研究探讨CD45的表达与中国MM人群预后的相关性。我们总结了单中心130例初诊MM患者的临床资料,对CD45的表达进行分析,评估CD45的表达与MM患者的临床指标、预后间的关系。
病例与方法
1.病例:2010年1月至2017年1月河南省人民医院血液科收治的初诊MM患者130例,其中男性74例,女性56例,中位年龄65(41~85)岁。所有患者均符合2014年国际骨髓瘤工作组(IMWG)的诊断标准。采集资料包括患者的一般特征(性别、年龄)、血常规、血生化、免疫球蛋白水平、β2微球蛋白(β2-MG)水平、游离轻链类型、乳酸脱氢酶(LDH)、有无溶骨性破坏、骨髓中浆细胞比例、浆细胞免疫表型及比例等。
2.流式细胞术(FCM)检测细胞免疫表型:采用EDTA抗凝管采集MM患者的骨髓液3 ml,抗体为鼠抗人单克隆抗体CD45、CD38、CD138、CD19、CD56、CD20、κ、λ。用鼠IgG1抗体作为阴性对照。采用流式细胞仪(美国BD公司FACSCalibur、FACSCanto Ⅱ)进行检测,每例标本采集50 000个细胞。通过CD45/SSC对骨髓细胞进行分群,CD38/CD138圈定浆细胞群,根据CD19、CD56的表达情况圈定正常浆细胞和异常浆细胞,CD19阴性被认为是异常浆细胞,并分析异常浆细胞表面CD45抗原表达情况,Kumar等[3]的研究显示,预后不良的CD45+克隆性浆细胞比值的临界值为20%(AUC为0.63,敏感性53%,特异性80%),因此本研究将CD45表达阳性率≥20%界定为表达阳性。
3.化疗方案及疗效评价:130例MM患者均入院接受治疗,化疗方案主要是以硼替佐米为基础的联合方案,少数患者应用长春新碱+阿霉素+地塞米松(VAD)方案。年龄≤65岁且适合自体造血干细胞移植者予PAD(硼替佐米+阿霉素+地塞米松)或PCD(硼替佐米+环磷酰胺+地塞米松)方案化疗。部分高龄患者根据患者的耐受性予药物减量。因接受自体造血干细胞移植的患者数量少,本研究未纳入造血干细胞移植对疗效的影响。无移植计划的患者化疗4~8个周期,随后进入维持治疗(来那度胺+地塞米松,沙利度胺+地塞米松或硼替佐米单药),4个疗程的化疗结束后参照中国多发性骨髓瘤诊治指南(2017年修订版)[9]进行疗效评估。疗效分为:严格意义上的完全缓解(sCR)、完全缓解(CR)、非常好的部分缓解(VGPR)、部分缓解(PR)、微小缓解(MR)、疾病稳定(SD)、疾病进展(PD)。客观缓解率(ORR)为sCR、CR、VGPR、PR率的总和。
4.随访:随访截止日期为2017年6月30日。中位随访时间33(6~78)个月。10例患者失访,其中CD45+组3例,CD45−组7例。失访病例以末次明确存活时间处理,末次随访仍存活者按截尾数据处理。生存指标:总体生存(OS)时间为自确诊之日至死亡或末次随访时间。无进展生存(PFS)时间为自确诊之日至疾病发生进展或死亡的时间。
5.统计学处理:采用SPSS 19.0软件进行统计学分析,计数资料采用卡方检验。Kaplan-Meier法绘制生存曲线,Log-rank检验用于估计单个危险因素的生存差异,预后因素分析采用Cox风险模型。P<0.05为差异有统计学意义。
结果
1.MM患者一般临床特征:ISS分期Ⅰ或Ⅱ期患者91例(70%),Ⅲ期患者39例(30%);骨髓浆细胞比例≥30%的患者43例(33.1%),<30%的患者87例(66.9%);血肌酐水平<176.8 µmol/L的患者42例(32.3%),≥176.8 µmol/L者88例(67.7%)。IgG型患者62例(47.7%),IgA型24例(18.5%),IgD型8例(6.2%),IgM型2例(1.5%),轻链型32例(24.6%),不分泌型2例(1.5%)。接受硼替佐米为基础方案的患者108例(83.1%),接受VAD为基础方案的患者22例(16.9%)。
2.MM患者CD45免疫表型与临床特征的相关性分析:将患者年龄、性别、ISS分期、血肌酐水平、骨髓浆细胞比例、β2-MG、LDH、血红蛋白、血清钙等指标纳入相关性分析。结果显示,CD45表达情况与骨髓浆细胞比例≥30%(P=0.002)、血肌酐≥ 176.8 µmo/L(P=0.006)、LDH ≥ 220 IU/L(P=0.021)呈正相关(表1)。
表1. CD45表达与多发性骨髓瘤患者临床特征的相关性分析.
| 临床特征 | CD45表达[例(%)] |
P值 | |
| 阳性(33例) | 阴性(97例) | ||
| 性别(例,男/女) | 0.621 | ||
| 男 | 20(60.6) | 54(55.7) | |
| 女 | 13(39.4) | 43(44.3) | |
| 年龄 | 0.474 | ||
| ≥60岁 | 16(48.5) | 54(55.7) | |
| <60岁 | 17(51.5) | 43(44.3) | |
| ISS分期 | 0.173 | ||
| Ⅰ/Ⅱ期 | 20(60.6) | 71(73.2) | |
| Ⅲ期 | 13(39.4) | 26(26.8) | |
| 骨髓浆细胞比例 | 0.002 | ||
| ≥30% | 18(54.5) | 25(25.8) | |
| <30% | 15(45.5) | 72(74.2) | |
| 血红蛋白 | 0.402 | ||
| ≥100 g/L | 11(33.3) | 25(25.8) | |
| <100 g/L | 22(66.7) | 72(74.2) | |
| 血肌酐 | 0.006 | ||
| ≥176.8 µmol/L | 17(51.5) | 25(25.8) | |
| <176.8 µmol/L | 16(48.5) | 72(74.2) | |
| 血清钙 | 0.753 | ||
| ≥2.75 mmol/L | 5(15.2) | 17(17.5) | |
| <2.75 mmol/L | 27(81.8) | 80(82.5) | |
| β2微球蛋白 | 0.191 | ||
| ≥55 mg/L | 13(39.4) | 51(52.6) | |
| <55 mg/L | 20(60.6) | 46(47.4) | |
| LDH | 0.021 | ||
| ≥220 IU/L | 23(69.7) | 45(46.4) | |
| <220 IU/L | 10(30.3) | 52(53.6) | |
| 免疫分型 | 0.318 | ||
| IgG型 | 13(39.4) | 49(50.5) | |
| IgA型 | 6(18.2) | 18(18.6) | |
| IgD型 | 3(9.1) | 5(5.2) | |
| IgM型 | 2(6.1) | 0(0.0) | |
| 轻链型 | 8(24.2) | 24(24.7) | |
| 不分泌型 | 1(3.0) | 1(1.0) | |
| 一线治疗方案 | 0.753 | ||
| 硼替佐米为基础的方案 | 28(84.8) | 80(82.5) | |
| VAD为基础的方案 | 5(15.2) | 17(17.5) | |
注:ISS:多发性骨髓瘤国际分期系统;LDH:乳酸脱氢酶;VAD:长春新碱+阿霉素+地塞米松
3.MM患者CD45免疫表型与疗效的关系:4个疗程化疗结束后评估疗效,采用χ2检验比较指标与疗效的关系。结果显示,CD45+组ORR为33.33%,CD45−组ORR为64.95%,差异有统计学意义(P=0.002)。以硼替佐米为基础治疗方案的108例患者中,CD45+组的ORR(35.71%)仍显著低于CD45−组(66.25%)(P=0.005)。
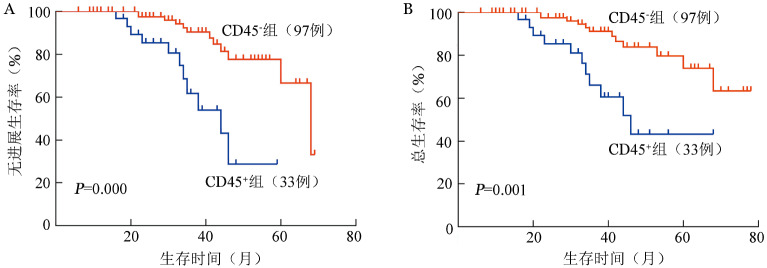
4.生存分析:130例MM患者的中位PFS时间为33.3(95%CI 6.0~69.0)个月,中位OS时间为36.3(95%CI 6.0~78.0)个月。CD45+组与CD45−组的中位PFS时间分别为29.8(95%CI 10.0~59.0)个月和34.5(95%CI 6.0~69.0)个月,差异有统计学意义(χ2=14.59,P<0.001),中位OS时间分别为32.5(95%CI 10.0~68.0)个月和37.6(95%CI 6.0~78.0)个月,差异有统计学意义(χ2=11.42,P=0.001)(图1A、1B)。108例以硼替佐米为基础方案的MM患者中,CD45+组与CD45−组的中位PFS时间分别为30.3(95%CI 10.0~59.0)个月和36.3(95%CI 6.0~69.0)个月,差异有统计学意义(χ2=14.75,P=0.001);中位OS时间分别为34.0(95%CI 10.0~68.0)个月和39.5(95%CI 6.0~78.0)个月,差异有统计学意义(χ2=10.62,P=0.001)(图2A、2B)。
图1. CD45表达对初诊多发性骨髓瘤患者无进展生存率(A)和总生存率(B)的影响.
图2. CD45表达对以硼替佐米为基础方案的初诊多发性骨髓瘤患者无进展生存率(A)和总生存率(B)的影响.
5.预后影响因素分析:单因素Cox回归分析结果显示ISS Ⅲ期(χ2=10.433,P=0.001)、血肌酐≥176.8 µmol/L(χ2=34.040,P<0.001)、CD45阳性(χ2=11.416,P=0.001)、LDH ≥ 220 IU/L(χ2=13.790,P=0.002)与初诊MM患者预后不良显著相关。进一步将上述变量纳入Cox风险回归模型进行多变量分析,结果显示,血肌酐≥176.8 µmol/L、CD45阳性、LDH≥220 IU/L是独立于其他临床指标的预后危险因素(P值分别为0.001、0.008、0.015)。LDH ≥ 220 IU/L者的不良预后风险是低LDH水平者的1.308倍(95%CI 1.160~2.417)(P=0.001);CD45阳性者的不良预后风险是CD45阴性者的1.330倍(95%CI 1.067~1.804)(P=0.008);血肌酐≥176.8 µmol/L者的不良预后风险是血肌酐<176.8 µmol/L者的2.723倍(95%CI 1.744~6.723)(P=0.015)。
讨论
目前临床上用于预测MM患者预后的指标主要包括特异性细胞遗传学异常[如t(4;14),t(11;14),17q−等]、国际分期系统(ISS)、血清游离轻链比(sFLCR)和LDH。新药时代的多项研究显示,传统的预后指标对患者预后的预测价值在减小[10]–[11]。不同的单中心研究结果均得出将免疫表型分析纳入MM患者的常规诊断评估能够协助识别高进展风险的患者[7],[12]。新近发表的PETHEMA/GEM研究分析了参加GEM2000、GEM2005MENOS65、GEM2005MAS65和GEM2010MAS65方案的1 265例初诊MM患者,发现CD19+CD27−CD38low CD45+CD81+CD117−和CD138low表达预示生存较差,肿瘤细胞的免疫表型可提供额外的预后信息,作为预测预后的有益补充[13]。
CD45是一种受体型蛋白酪氨酸磷酸酶,表达在除红细胞和血小板以外的所有造血细胞上。在正常情况下,不成熟的浆细胞表达高水平的CD45,在浆细胞的分化发育中,CD45的表达逐渐下调。研究发现与CD45阴性的骨髓瘤克隆相比,CD45阳性骨髓瘤克隆是主要的增殖部分,且其增殖与CD45的表达平行[14]。
非常有趣的是,2005年前后的临床研究发现CD45阳性MM患者所占比例分别为44%和68.5%,且CD45阳性MM患者的预后更佳[8],[15];而近期的多项临床研究显示CD45阳性MM患者的比例分别为28%、23%和35%,且CD45阳性MM患者的预后更差[4],[7],[12]。对比上述研究发现,近期研究中CD45阳性MM患者的比例较前期研究明显降低,原因可能是前期研究采用3色或4色流式细胞仪,对CD45、CD38和CD138进行检测,缺乏CD19的设门可能导致分析中包含非克隆性浆细胞。而近期的研究多采用4色或8色流式细胞仪,并采用SSC、CD38、CD138、CD19和CD45联合设门,从而对骨髓瘤细胞进行了更加准确的分组。检测手段导致的分组偏差可能是CD45作为预后因素在不同时期研究结论相互矛盾的原因之一。本研究采用4色流式细胞分析仪,通过联合设门,检测分析130例初诊MM患者,检测到CD45阳性MM患者的比例为25.38%,与近期的研究结果类似。
疗效分析显示,CD45阳性组的ORR率明显低于CD45阴性组。以硼替佐米为主要化疗方案的亚组分析显示,CD45阳性组的ORR仍远低于CD45阴性组,提示硼替佐米对CD45阳性MM患者的疗效欠佳。相关的基础研究认为IL-6仅能增强CD45阳性骨髓瘤细胞的增殖,CD45阳性骨髓瘤细胞不依赖于IL-6的src家族激酶活化[16]。CD45阳性骨髓瘤细胞与更高水平的STAT3和(或)STAT5活性相关。CD45阳性骨髓瘤细胞表现出与JAK-STAT途径相关的高水平活性,且CD45阳性可能与对硼替佐米反应不佳相关[17]。这也从一定程度上解释了CD45阳性MM患者对以硼替佐米为主化疗方案的反应率仍远低于CD45阴性MM患者。
目前临床上常用的独立预后指标包括LDH、血肌酐、β2-MG水平和特定遗传学异常。因本研究纳入的部分早期患者行FISH检测时并未进行CD138+细胞筛选,阴性结果比例明显升高,结果并不可靠,可用于分析的病例数较少,因此本研究仅纳入LDH、血肌酐、β2-MG等传统预后因素和CD45的表达进行相关性分析,发现CD45阳性与多项反映肿瘤负荷及预后的指标[骨髓浆细胞比例≥ 30%(P=0.002)、血肌酐≥176.8 µmo/L(P=0.006)、LDH ≥ 220 IU/L(P=0.021)]呈正相关。本中心正在进行遗传学异常与CD45表达相关性的研究。
生存分析的数据表明,骨髓瘤细胞CD45表达阳性是影响PFS和OS的不良预后因素。硼替佐米的应用也不能克服CD45阳性MM患者的不良预后。Cox预后风险模型分析的结果也证实CD45阳性是独立于其他临床指标的不良预后因素。一些研究证据表明,具有IL-6活化的JAK/STAT3途径的CD45阳性骨髓瘤细胞对Hsp-90抑制剂敏感[18],新型的JAK-2抑制剂TG101209对CD45阳性骨髓瘤细胞的细胞毒性和抗增殖活性更强[19]。
本研究的结果提示,对于MM患者需要采用多色流式细胞术联合精确设门圈定出异常的浆细胞群,并常规分析CD45的表达情况。CD45阳性的MM患者预后较差,且对硼替佐米的治疗反应不佳。应用Hsp-90抑制剂或JAK2抑制剂有望提高此类患者的疗效。CD45的表达有望成为预测MM患者预后及硼替佐米敏感性的潜在新途径。
Funding Statement
基金项目:河南省医学科技攻关计划(201403154)
Fund program: The medical science and technology breakthrough projects of Henan(201403154)
References
- 1.Chng WJ, Dispenzieri A, Chim CS, et al. IMWG consensus on risk stratification in multiple myeloma[J] Leukemia. 2014;28(2):269–277. doi: 10.1038/leu.2013.247. [DOI] [PubMed] [Google Scholar]
- 2.Mateo G, Montalbán MA, Vidriales MB, et al. Prognostic value of immunophenotyping in multiple myeloma: a study by the PETHEMA/GEM cooperative study groups on patients uniformly treated with high-dose therapy[J] J Clin Oncol. 2008;26(16):2737–2744. doi: 10.1200/JCO.2007.15.4120. [DOI] [PubMed] [Google Scholar]
- 3.Kumar S, Rajkumar SV, Kimlinger T, et al. CD45 expression by bone marrow plasma cells in multiple myeloma: clinical and biological correlations[J] Leukemia. 2005;19(8):1466–1470. doi: 10.1038/sj.leu.2403823. [DOI] [PubMed] [Google Scholar]
- 4.Gonsalves WI, Timm MM, Rajkumar SV, et al. The prognostic significance of CD45 expression by clonal bone marrow plasma cells in patients with newly diagnosed multiple myeloma[J] Leuk Res. 2016;44:32–39. doi: 10.1016/j.leukres.2016.03.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Shin SY, Lee ST, Kim HJ, et al. Antigen expression patterns of plasma cell myeloma: an association of cytogenetic abnormality and international staging system (ISS) for myeloma[J] J Clin Lab Anal. 2015;29(6):505–510. doi: 10.1002/jcla.21801. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.林 向华, 谢 晓英, 肖 旺贤, et al. 浆细胞骨髓瘤非典型免疫表型特征及其意义[J] 中华检验医学杂志. 2014;(9):687–690. doi: 10.3760/cma.j.issn.1009-9158.2014.09.012. [DOI] [Google Scholar]
- 7.Guo J, Su J, He Q, et al. The prognostic impact of multiparameter flow cytometry immunophenotyping and cytogenetic aberrancies in patients with multiple myeloma[J] Hematology. 2016;21(3):152–161. doi: 10.1179/1607845415Y.0000000010. [DOI] [PubMed] [Google Scholar]
- 8.Moreau P, Robillard N, Avet-Loiseau H, et al. Patients with CD45 negative multiple myeloma receiving high-dose therapy have a shorter survival than those with CD45 positive multiple myeloma[J] Haematologica. 2004;89(5):547–551. [PubMed] [Google Scholar]
- 9.中国医师协会血液科医师分会, 中华医学会血液学分会, 中国医师协会多发性骨髓瘤专业委员会. 中国多发性骨髓瘤诊治指南(2017年修订)[J] 中华内科杂志. 2017;56(11):866–870. doi: 10.3760/cma.j.issn.0578-1426.2017.11.021. [DOI] [Google Scholar]
- 10.Kuroda J, Shimura Y, Ohta K, et al. Limited value of the international staging system for predicting long-term outcome of transplant-ineligible, newly diagnosed, symptomatic multiple myeloma in the era of novel agents[J] Int J Hematol. 2014;99(4):441–449. doi: 10.1007/s12185-014-1539-5. [DOI] [PubMed] [Google Scholar]
- 11.Maltezas D, Dimopoulos MA, Katodritou I, et al. Re-evaluation of prognostic markers including staging, serum free light chains or their ratio and serum lactate dehydrogenase in multiple myeloma patients receiving novel agents[J] Hematol Oncol. 2013;31(2):96–102. doi: 10.1002/hon.2026. [DOI] [PubMed] [Google Scholar]
- 12.Iriyama N, Miura K, Hatta Y, et al. Clinical effect of immunophenotyping on the prognosis of multiple myeloma patients treated with bortezomib[J] Oncol Lett. 2017;13(5):3803–3808. doi: 10.3892/ol.2017.5920. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Arana P, Paiva B, Cedena MT, et al. Prognostic value of antigen expression in multiple myeloma: a PETHEMA/GEM study on 1265 patients enrolled in four consecutive clinical trials[J] Leukemia. 2018;32(4):971–978. doi: 10.1038/leu.2017.320. [DOI] [PubMed] [Google Scholar]
- 14.Pope B, Brown R, Gibson J, et al. The bone marrow plasma cell labeling index by flow cytometry[J] Cytometry. 1999;38(6):286–292. doi: 10.1002/(sici)1097-0320(19991215)38:6<286::aid-cyto5>3.0.co;2-7. [DOI] [PubMed] [Google Scholar]
- 15.Morice WG, Hanson CA, Kumar S, et al. Novel multi-parameter flow cytometry sensitively detects phenotypically distinct plasma cell subsets in plasma cell proliferative disorders[J] Leukemia. 2007;21(9):2043–2046. doi: 10.1038/sj.leu.2404712. [DOI] [PubMed] [Google Scholar]
- 16.Ishikawa H, Tsuyama N, Abroun S, et al. Requirements of src family kinase activity associated with CD45 for myeloma cell proliferation by interleukin-6[J] Blood. 2002;99(6):2172–2178. doi: 10.1182/blood.v99.6.2172. [DOI] [PubMed] [Google Scholar]
- 17.Brown R, Yang S, Weatherburn C, et al. Phospho-flow detection of constitutive and cytokine-induced pSTAT3/5, pAKT and pERK expression highlights novel prognostic biomarkers for patients with multiple myeloma[J] Leukemia. 2015;29(2):483–490. doi: 10.1038/leu.2014.204. [DOI] [PubMed] [Google Scholar]
- 18.Lin H, Kolosenko I, Björklund AC, et al. An activated JAK/STAT3 pathway and CD45 expression are associated with sensitivity to Hsp90 inhibitors in multiple myeloma[J] Exp Cell Res. 2013;319(5):600–611. doi: 10.1016/j.yexcr.2012.12.006. [DOI] [PubMed] [Google Scholar]
- 19.Ramakrishnan V, Kimlinger T, Haug J, et al. TG101209, a novel JAK2 inhibitor, has significant in vitro activity in multiple myeloma and displays preferential cytotoxicity for CD45+ myeloma cells[J] Am J Hematol. 2010;85(9):675–686. doi: 10.1002/ajh.21785. [DOI] [PMC free article] [PubMed] [Google Scholar]