Abstract
目的
采用十色流式细胞术监测多发性骨髓瘤(MM)患者治疗后骨髓微小残留病(MRD),探讨其对MM患者预后的预测价值。
方法
回顾性分析2015年7月至2017年7月苏州大学附属第一医院收治的150例MM患者的临床资料,十色流式细胞术检测MRD水平。
结果
①诱导治疗结束后采用十色流式细胞术监测MRD的87例MM患者中,MRD阴性者34例(39.1%)。自体造血干细胞移植后1年内行十色流式细胞术监测MRD的69例患者中,MRD阴性者34例(49.3%),诱导治疗结束和移植后MRD阴性患者的无进展生存(PFS)期优于MRD阳性患者(未达到对21个月,P=0.022;未达到对18个月,P<0.001)。②根据移植前后MRD的动态改变将MM患者分为MRD持续阴性、阳性转阴性、持续阳性、阴性转阳性四组,四组的2年PFS率分别为83%、82%、44%、0(P=0.002)。③多因素分析显示诱导治疗结束后的MRD水平是影响PFS的独立预后因素[P=0.002,HR=4.808(95%CI 1.818~12.718)]。
结论
治疗后MRD转阴提示更好的临床预后,MRD水平对于MM患者的预后价值优于血清学疗效评估,可以联合R-ISS分期及细胞遗传学异常评估患者预后。
Keywords: 多发性骨髓瘤, 微小残留病, 预后, 流式细胞术
Abstract
Objective
To evaluate the prognostic significance of minimal residual disease (MRD) monitoring by 10-color flow cytometry in multiple myeloma (MM) patients after treatment.
Methods
150 patients with MM who were admitted to the First Affiliated Hospital of Soochow University from July 2015 to July 2017 were retrospectively analyzed. Clinical data, MRD data monitoring by 10-color flow cytometry and prognosis were analyzed.
Results
39.1% (34/87) patients were MRD negative after induction chemotherapy, and 49.3% (34/69) patients were MRD negative within 1 year after autologous hematopoietic stem cell transplantation (ASCT). MRD-negative patients after induction chemotherapy or after transplantation have better progress-free survival (PFS) than MRD-positive patients (P=0.022 and P<0.001). According to the changes of MRD pre-ASCT and after ASCT, the patients were divided into 4 groups: patients with MRD continued negativity,improved from MRD positive to MRD negative, MRD continued positivity, transformed from MRD negative to MRD positive. The two-year PFS of the four groups were 83%, 82%, 44%, 0, respectively, (P=0.002). Multivariate analysis showed that the level of MRD after induction chemotherapy was an independent factor for PFS (P=0.002), HR=4.808 (95%CI 1.818–12.718).
Conclusion
Patients with MRD negative after treatment is a better prognosis marker than complete remission or even the best marker, which can evaluate prognosis by combining R-ISS and cytogenetic changes.
Keywords: Multiple myeloma, Minimal residual disease, Prognosis, Flow cytometry
多发性骨髓瘤(MM)的治疗在过去的几十年取得了重大进展,包括蛋白酶体抑制剂(硼替佐米和伊沙佐米)、免疫调节剂(来那度胺、沙立度胺和泊马度胺)、大剂量化疗联合自体造血干细胞移植技术等传统治疗手段,以及小分子药物、靶向药物和细胞免疫治疗等新型治疗方法的应用。这些治疗方案很大程度上提高了MM患者的缓解率和生存时间,超过50%的MM患者可以在治疗后获得完全缓解(CR)[1]。为满足临床疗效评估的需求,2006年国际骨髓瘤工作组在疗效评估标准中增加了严格意义的完全缓解(sCR),即除满足CR要求外,还需同时满足血清游离轻链比值正常和骨髓中未能检测到单克隆浆细胞[2]。但目前血清学疗效评估依然不能全面反映患者的预后,大部分获得CR甚至是sCR的患者均出现疾病的复发[3],表明获得CR的患者体内可能存在包括血清蛋白电泳和免疫固定电泳在内的传统检测手段无法检测到的残留病灶,要求我们探索更为敏感的监测手段。
多参数流式细胞术监测MRD是血液系统恶性肿瘤患者疗效评估及预后判断的一项有效技术,近年来许多报道关注其在MM患者中的临床意义[3]–[7],而该项技术的敏感性、可重复性以及临床相关性分析的标准化仍在进一步探索中[8]–[9]。我中心自2015年开始对MM患者开展十色流式细胞术监测MRD,积累了大量的病例资料,本研究回顾性分析了这部分患者的病例资料,探讨采用十色流式细胞术监测MRD的临床意义及可行性。
病例与方法
1.病例:回顾性分析了2015年7月至2017年7月在苏州大学附属第一医院就诊的150例初诊MM患者的临床资料,其中102例患者治疗后获得非常好的部分缓解(VGPR)及以上疗效。MM患者的诊断和分期标准参照2014及2015年国际骨髓瘤工作组(IMWG)的标准[10]–[11]。96%的患者接受以硼替佐米或来那度胺为基础的三药方案诱导治疗4~6个疗程,1例患者接受硼替佐米+地塞米松方案,3例患者接受沙利度胺+脂质体阿霉素+地塞米松方案,诱导治疗结束后有69例患者接受自体造血干细胞移植[12]。每个周期诱导治疗结束后行血清学疗效评估,移植后1年内每3个月进行一次疗效评估,1年后每半年进行一次疗效评估,血清学疗效判断标准按照国际骨髓瘤工作组(IMWG)的最新标准[13]。末次诱导治疗结束后1个月行流式细胞术MRD检测,其中87例患者采用十色流式细胞术检测MRD,接受移植的69例患者在移植后3个月、6个月及1年分别行十色流式细胞术监测MRD,此后每半年检测一次。研究旨在探索MRD水平对上述MM患者预后的影响。随访时间自监测MRD至2018年12月31日,中位随访时间18.5(1~35)个月,随访结束时32例(31%)患者出现疾病进展、复发或死亡,其中死亡患者8例(8%)。
2.十色流式细胞术:①抗体的选择:包括CD138-APC、CD38-APC750、CD45-KO、CD19-ECD、CD56-PC7、CD27-PB、CD81-APC700、CD117-PC5在内的8种膜抗体以及Kappa-FITC、Lambda-PE两种胞质抗体(Kappa-FITC和Lambda-PE购自丹麦Dako公司,膜抗体购自美国Beckman Coulter公司);②样本的制备及检测:取200 µl~5 ml患者骨髓[(2~20)×106个细胞],加入氯化铵溶血剂混匀后离心洗涤去上清,洗涤后的细胞(50~100 µl)加入上述8种膜抗体并混匀,室温孵育30 min,加入PBS离心洗涤弃上清,振荡混匀加入破膜剂A避光孵育30 min,加入PBS离心洗涤弃上清。加入破膜剂B,轻轻混匀后加入上述两种胞质抗体,混匀,室温避光孵育30 min;加入PBS混匀离心弃上清,细胞沉淀加入PBS混匀,上流式细胞仪(Navios)检测。每次获取100万个有核细胞,检测到≥20个异常浆细胞为阳性,检测的敏感度为10−4。
3.细胞遗传学:所有患者在治疗前采用FISH检测细胞遗传学(骨髓标本未进行CD138磁珠分选),检测的主要异常包括1q21扩增、13q14扩增、Rb1缺失、IgH重排、p53缺失。其中IgH重排阳性者加做t(4;14)、t(11;14)、t(14;16)[14]。出现17p−、t(4;14)、t(14;16)、1q21扩增定义为遗传学高危,未出现以上遗传学异常定义为遗传学标危。
4.统计学处理:使用SPSS 22.0软件进行统计学分析。均数的比较采用独立样本t检验和方差分析的双侧检验,率的比较采用χ2检验;无进展生存(PFS)时间定义为自监测MRD至疾病进展、复发或患者死亡的时间,总生存(OS)时间定义为自监测MRD至患者死亡的时间。生存分析采用Kaplan-Meier法,显著性检验采用Log-rank检验,多因素分析采用Cox生存回归分析,P<0.05为差异有统计学意义。
结果
1.患者的一般资料分析:纳入的102例患者临床资料及一般生物学特点见表1。诱导治疗结束后87例患者采用十色流式细胞术检测MRD,MRD阴性组34例(39.1%)。MRD阴性患者和阳性患者临床及生物学特点比较见表2。两组患者在年龄、分期、细胞遗传学特点、肿瘤负荷、治疗方案上均无明显差异;MRD阴性组较阳性组包含更多血清学疗效为CR的患者(61.8%比22.6%,P=0.001)。
表1. 102例多发性骨髓瘤患者基本临床资料及生物学特点.
| 特征 | 数值 |
| 性别(例,男/女) | 60/42 |
| 年龄[岁,M(范围)] | 58.5(31~75) |
| 分型[例(%)] | |
| IgG型 | 45(44.1) |
| IgA型 | 23(22.5) |
| 轻链型 | 15(14.7) |
| 其他类型 | 19(18.6) |
| DS分期[例(%)] | |
| Ⅰ、Ⅱ期 | 9(8.8) |
| Ⅲ期 | 93(91.2) |
| R-ISS分期[例(%)] | |
| Ⅰ期 | 29(29.6) |
| Ⅱ期 | 38(38.8) |
| Ⅲ期 | 31(31.6) |
| HGB(g/L, x±s) | 97±27 |
| 白蛋白(g/L, x±s) | 36±7 |
| 乳酸脱氢酶[U/L,M(范围)] | 177(63~514) |
| 血肌酐[µmol/L,M(范围)] | 77(38~1 563) |
| 血清钙[mmol/L,M(范围)] | 2.3(1.4~3.6) |
| β2微球蛋白[mg/L,M(范围)] | 3.5(0.2~35.7) |
| 细胞遗传学[例(%)] | |
| t(4;14) | 16(15.7) |
| t(11;14) | 7(6.9) |
| t(14;16) | 1(1.0) |
| 17p– | 8(7.8) |
| 1q21+ | 42(44.2) |
| 诱导治疗方案[例(%)] | |
| PAD | 40(39.2) |
| PDD | 36(35.3) |
| PTD | 12(11.8) |
| PCD | 6(5.9) |
| VRD | 4(3.9) |
| TDD | 3(2.9) |
| PD | 1(1.0) |
| 是否移植[例(%)] | |
| 是 | 69(67.2) |
| 否 | 33(32.4) |
| 诱导治疗后疗效[例(%)] | |
| CR | 39(38.2) |
| VGPR | 46(45.1) |
| PR | 17(16.7) |
注:PAD:硼替佐米、阿霉素、地塞米松;PDD:硼替佐米、脂质体阿霉素、地塞米松;PTD:硼替佐米、沙利度胺、地塞米松;PCD:硼替佐米、地塞米松、环磷酰胺;VRD:硼替佐米、来那度胺、地塞米松;TDD:沙利度胺、脂质体阿霉素、地塞米松;PD:硼替佐米、地塞米松;CR:完全缓解;VGPR:非常好的部分缓解;PR:部分缓解
表2. 诱导治疗结束后MRD阳性与MRD阴性多发性骨髓瘤患者的临床特点.
| 特征 | MRD阳性组(53例) | MRD阴性组(34例) | 统计量 | P值 |
| 年龄[岁,M(范围)] | 59(38~75) | 58(31~71) | −0.064(t值) | 0.949 |
| ISS分期[例(%)] | 0.859(χ2值) | 0.651 | ||
| Ⅰ期 | 17(32.7) | 9(27.3) | ||
| Ⅱ期 | 21(40.4) | 12(36.4) | ||
| Ⅲ期 | 14(26.9) | 12(36.4) | ||
| R-ISS分期[例(%)] | 0.653(χ2值) | 0.721 | ||
| ISS Ⅰ期 | 14(30.4) | 8(24.2) | ||
| ISS Ⅱ期 | 25(54.3) | 18(54.5) | ||
| ISS Ⅲ期 | 7(15.2) | 7(21.2) | ||
| HGB(g/L) | 96±28 | 98±26 | −0.331(t值) | 0.742 |
| 白蛋白(g/L) | 35±6 | 36±8 | −0.622(t值) | 0.536 |
| 乳酸脱氢酶[U/L,M(范围)] | 169(99~530) | 182(63~347) | −0.527(t值) | 0.598 |
| β2微球蛋白[mg/L,M(范围)] | 3.0(0.1~35.7) | 4.2(0.9~20.0) | −1.117(t值) | 0.264 |
| 游离轻链比值[例(%)] | 0.308(χ2值) | 0.579 | ||
| >100 | 16(34.0) | 9(28.1) | ||
| ≤100 | 7(6.9) | 23(71.9) | ||
| 细胞遗传学[例(%)] | 0.990(χ2值) | 0.320 | ||
| 高危 | 26(55.3) | 15(44.1) | ||
| 标危 | 21(44.7) | 19(55.9) | ||
| 诱导治疗方案[例(%)] | 6.531(χ2值) | 0.366 | ||
| PAD | 23(43.4) | 11(32.4) | ||
| PDD | 18(34.0) | 14(41.2) | ||
| PTD | 5(9.4) | 5(14.7) | ||
| PCD | 2(3.8) | 2(5.9) | ||
| VRD | 3(5.7) | 0(0.0) | ||
| TDD | 1(1.9) | 2(5.9) | ||
| PD | 1(1.9) | 0(0.0) | ||
| 是否移植[例(%)] | 0.464(χ2值) | 0.496 | ||
| 是 | 35(66.0) | 20(58.8) | ||
| 否 | 18(34.0) | 14(41.2) | 0.001 | |
| 诱导治疗后疗效[例(%)] | 13.563(χ2值) | |||
| CR | 12(22.6) | 21(61.8) | ||
| VGPR | 31(58.5) | 10(29.4) | ||
| PR | 10(18.9) | 3(8.8) |
注:PAD:硼替佐米、阿霉素、地塞米松;PDD:硼替佐米、脂质体阿霉素、地塞米松;PTD:硼替佐米、沙利度胺、地塞米松;PCD:硼替佐米、地塞米松、环磷酰胺;VRD:硼替佐米、来那度胺、地塞米松;TDD:沙利度胺、脂质体阿霉素、地塞米松;PD:硼替佐米、地塞米松;CR:完全缓解;VGPR:非常好的部分缓解;PR:部分缓解
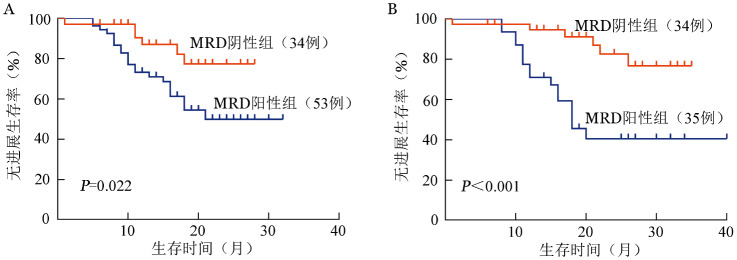
2.MRD对于患者预后的影响:诱导治疗结束后采用十色流式细胞术监测MRD的87例患者中,MRD阴性组(39.1%,34/87)和MRD阳性组(61.0%,53/87)的中位PFS时间分别为未达到和21个月(P=0.022)(图1A)。69例患者接受自体造血干细胞移植,移植后1年内采用十色流式细胞术检测MRD,MRD阴性组(49.3%,34/69)和MRD阳性组(50.7%,35/69)的患者中位PFS时间分别为未达到和18个月,两组的2年PFS率分别为83%和41%(P<0.001)(图1B)。
图1. 诱导治疗结束(A)及移植后(B)微小残留病(MRD)对多发性骨髓瘤患者无进展生存的影响.
接受自体造血干细胞移植的患者中,移植后疗效未达CR但MRD阴性者的PFS优于MRD阳性者,与疗效达CR且MRD阴性者相比,PFS的差异无统计学意义(P=0.136);疗效达CR但MRD阳性的患者预后也较差,与疗效未达CR且MRD阳性者相比,PFS的差异无统计学意义(P=0.779)(图2)。R-ISS Ⅱ期和Ⅲ期MRD阴性患者的PFS优于MRD阳性患者(P=0.012),与R-ISS Ⅰ期MRD阴性患者相比,PFS的差异无统计学意义(P=0.925)。R-ISS Ⅰ期的MRD阳性患者转归也较差,与R-ISS Ⅱ期和Ⅲ期MRD阳性患者相比,PFS的差异无统计学意义(P=0.395)(图3)。根据细胞遗传学异常将患者分为遗传学高危组和标危组,伴遗传学高危因素的MRD阴性患者的PFS优于MRD阳性患者(P=0.059),与遗传学标危的MRD阴性患者相比,PFS的差异无统计学意义(P=0.474)。遗传学标危的MRD阳性患者预后也很差,仅优于遗传学高危的MRD阳性患者(P=0.063)(图4)。
图2. 基于血清学疗效分组的微小残留病(MRD)对多发性骨髓瘤患者无进展生存的影响.
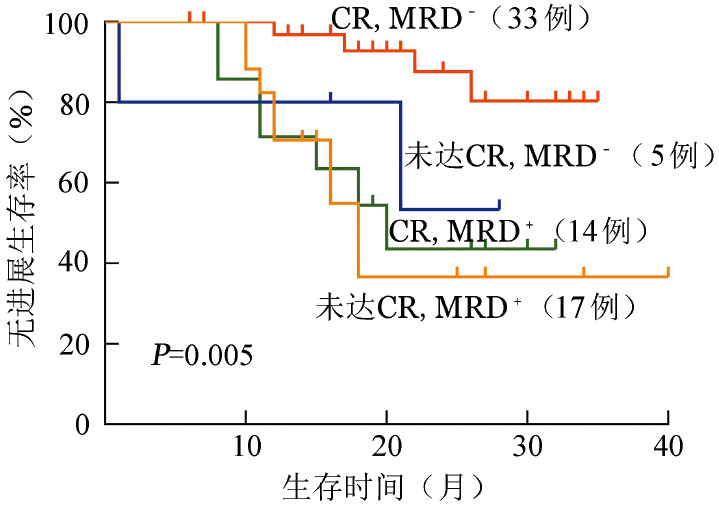
CR:完全缓解
图3. 基于R-ISS分期分组的微小残留病(MRD)对多发性骨髓瘤患者无进展生存的影响.
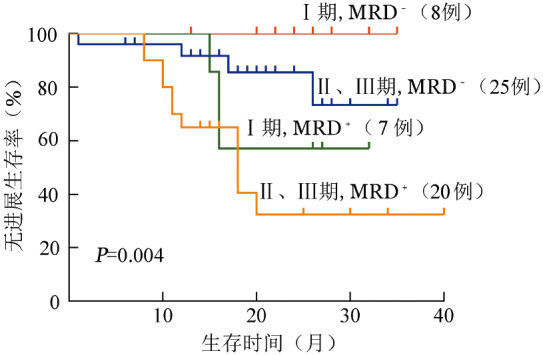
图4. 基于细胞遗传学分组的微小残留病(MRD)对多发性骨髓瘤患者无进展生存的影响.

根据患者诱导治疗后和移植后MRD水平,将接受造血干细胞移植的69例患者分为4组,MRD持续阴性(诱导治疗后和移植后MRD均阴性)者20例,3例(15.0%)出现进展或死亡;MRD阳性转阴性(诱导治疗后MRD阳性,移植后MRD阴性)者18例,3例(16.7%)出现进展或死亡;MRD持续阳性(诱导治疗后和移植后MRD均阳性)者29例,14例(48.3%)出现进展或死亡;MRD阴性转阳性(诱导治疗后MRD阴性,移植后MRD阳性)患者2例,均进展或死亡(100%)。四组患者的中位PFS时间分别为未达到、未达到、18个月、11个月,2年PFS率分别为83%、82%、44%、0(P=0.002)(图5)。持续阴性组转归最好,阴性转阳性组转归最差。
图5. 移植前后多发性骨髓瘤患者的微小残留病(MRD)状态对无进展生存的影响.

3.影响PFS的单因素和多因素分析:单因素分析结果显示,ISS分期≥Ⅱ期(P=0.017)、血清白蛋白浓度<30 g/L(P=0.011)、诱导治疗后血清学疗效未达CR(P=0.010)以及流式细胞术MRD阳性(P<0.001)影响患者PFS。多因素分析显示,仅流式细胞术MRD阳性是影响PFS的独立危险因素[P=0.002,HR=4.8(95%CI 1.8~12.7)](表3)。
表3. 影响102例多发性骨髓瘤患者无进展生存危险因素分析.
| 因素 | 单因素分析 |
多因素分析 |
||
| HR(95%CI) | P值 | HR(95%CI) | P值 | |
| 年龄(≥65岁比<65岁) | 0.971(0.374~2.525) | 0.952 | 1.528(0.482~4.852) | 0.472 |
| ISS分期(Ⅱ、Ⅲ期比Ⅰ期) | 3.591(1.252~10.301) | 0.017 | − | 0.932 |
| R-ISS分期(Ⅱ、Ⅲ期比Ⅰ期) | 2.872(0.991~8.320) | 0.052 | − | 0.939 |
| ALB(<30 g/L比≥30 g/L) | 0.939(0.895~0.985) | 0.011 | 0.956(0.895~1.020) | 0.176 |
| 诱导治疗结束后疗效(未达CR比达CR) | 3.002(1.195~6.959) | 0.010 | 1.274(0.434~3.737) | 0.659 |
| MRD阳性/阴性 | 4.462(1.996~9.977) | <0.001 | 4.808(1.818~12.718) | 0.002 |
注:ALB:血清白蛋白浓度;MRD:微小残留病;−:未进行统计学分析
讨论
随着新药时代的到来,MM患者治疗后可获得更高的血清学缓解率,文献报道超过50%的患者在治疗后获得CR[1]。然而无论获得何种程度的血清学缓解,MM患者大多死于疾病的复发,传统的血清学评估手段已远远不能满足临床疗效的评估。近几年的大量文献报道,对于移植后患者,MRD监测在评估预后方面的意义明显优于传统血清学[4]–[5],[15]–[18]。有研究报道,在非移植老年患者中,MRD阴性的患者也具有更好的预后[19]。国内的相关报道尚缺乏,采用敏感度和特异度更高的多色流式细胞术监测MRD的研究更少。
我们的研究纳入102例治疗结束后获得VGPR及以上疗效的MM患者,采用十色流式细胞术监测其骨髓MRD水平,MRD阴性患者的PFS较MRD阳性者显著延长。无论在诱导治疗后还是移植后,MRD转阴都预示更好的临床预后。对于疗效未达CR的患者,R-ISS分期Ⅱ、Ⅲ期的患者及伴有遗传学高危因素的患者,治疗后MRD转阴者的PFS明显优于MRD阳性者,同国外的相关报道一致。此外,巩固治疗前后MRD持续阴性以及阳性转阴性的患者PFS较长,而MRD持续阳性,尤其是阴性转阳性的患者预后较差。多因素分析也显示MRD水平在预测临床预后方面具有重要意义。本研究纳入的患者是治疗后获得VGPR及以上的人群,这部分患者较患者总体可能有更长的PFS和OS时间。由于随访时间较短(中位随访时间为18.5个月)以及患者复发后我们采取的一些干预措施(化疗、靶向治疗及免疫治疗)明显延长了患者的总生存期,至随访结束仅有8例患者死亡,因此MRD水平对于OS的影响目前尚不能明确得出。后期我们将对这些患者继续随访,探讨MRD水平对于患者总生存的影响。
目前为止还没有临床试验根据MRD水平将患者分组,进行个体化治疗,研究MRD在个体化治疗中的作用。然而多个临床研究表明,即使在CR患者中,MRD持续阳性也提示预后较差,加之MRD阴性结果存在不确定性,临床治疗中基于MRD阳性而不是阴性做出决策可能更加安全。要想将MRD的监测作为制定临床治疗策略的标准,还需要我们引入标准化、敏感度高、成本低和广泛可用的MRD监测技术。
References
- 1.Attal M, Lauwers-Cances V, Marit G, et al. Lenalidomide maintenance after stem-cell transplantation for multiple myeloma[J] N Engl J Med. 2012;366(19):1782. doi: 10.1056/NEJMoa1114138. [DOI] [PubMed] [Google Scholar]
- 2.Durie BG, Harousseau JL, Miguel JS, et al. International uniform response criteria for multiple myeloma[J] Leukemia. 2006;20(9):1467–1473. doi: 10.1038/sj.leu.2404284. [DOI] [PubMed] [Google Scholar]
- 3.Munshi NC, Anderson KC. Minimal residual disease in multiplemyeloma[J] J Clin Oncol. 2013;31(20):2523–2526. doi: 10.1200/jco.2013.49.2124. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Paiva B, Vidriales MB, Cerveró J, et al. Multiparameter flow cytometric remission is the most relevant prognostic factor for multiple myeloma patients who undergo autologous stem cell transplantation[J] Blood. 2008;112(10):4017–4023. doi: 10.1182/blood-2008-05-159624. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Rawstron AC, Child JA, de Tute RM, et al. Minimal residual disease assessed by multiparameter flow cytometry in multiple myeloma: impact on outcome in the Medical Research Council Myeloma IX Study[J] J Clin Oncol. 2013;31(20):2540–2547. doi: 10.1200/JCO.2012.46.2119. [DOI] [PubMed] [Google Scholar]
- 6.Landgren O, Gormley N, Turley D, et al. Flow cytometry detection of minimal residual disease in multiple myeloma: Lessons learned at FDA-NCI roundtable symposium[J] Am J Hematol. 2014;89(12):1159–1160. doi: 10.1002/ajh.23831. [DOI] [PubMed] [Google Scholar]
- 7.Lahuerta JJ, Paiva B, Vidriales MB, et al. Depth of Response in Multiple Myeloma: A Pooled Analysis of Three PETHEMA/GEM Clinical Trials[J] J Clin Oncol. 2017;35(25):2900–2910. doi: 10.1200/JCO.2016.69.2517. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Arroz M, Came N, Lin P, et al. Consensus guidelines on plasma cell myeloma minimal residual disease analysis and reporting[J] Cytometry B Clin Cytom. 2016;90(1):31–39. doi: 10.1002/cyto.b.21228. [DOI] [PubMed] [Google Scholar]
- 9.Rawstron AC, Paiva B, Stetler-Stevenson M. Assessment of minimal residual disease in myeloma and the need for a consensus approach[J] Cytometry B Clin Cytom. 2016;90(1):21–25. doi: 10.1002/cyto.b.21272. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Rajkumar SV, Dimopoulos MA, Palumbo A, et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma[J] Lancet Oncol. 2014;15(12):e538–e548. doi: 10.1016/S1470-2045(14)70442-5. [DOI] [PubMed] [Google Scholar]
- 11.Palumbo A, Avet-Loiseau H, Oliva S, et al. Revised International Staging System for Multiple Myeloma: A Report From International Myeloma Working Group[J] J Clin Oncol. 2015;33(26):2863–2869. doi: 10.1200/JCO.2015.61.2267. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Palumbo A, Rajkumar SV, San Miguel JF, et al. International Myeloma Working Group consensus statement for the management, treatment, and supportive care of patients with myeloma not eligible for standard autologous stem-cell transplantation[J] J Clin Oncol. 2014;32(6):587–600. doi: 10.1200/JCO.2013.48.7934. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Kumar S, Paiva B, Anderson KC, et al. International Myeloma Working Group consensus criteria for response and minimal residual disease assessment in multiple myeloma[J] Lancet Oncol. 2016;17(8):e328–e346. doi: 10.1016/S1470-2045(16)30206-6. [DOI] [PubMed] [Google Scholar]
- 14.He H, Fu W, Jiang H, et al. The clinical characteristics and prognosis of IGH deletion in multiple myeloma[J] Leuk Res. 2015;39(5):515–519. doi: 10.1016/j.leukres.2015.02.010. [DOI] [PubMed] [Google Scholar]
- 15.Puig N, Sarasquete ME, Balanzategui A, et al. Critical evaluation of ASO RQ-PCR for minimal residual disease evaluation in multiple myeloma. A comparative analysis with flow cytometry[J] Leukemia. 2014;28(2):391–397. doi: 10.1038/leu.2013.217. [DOI] [PubMed] [Google Scholar]
- 16.Martinez-Lopez J, Lahuerta JJ, Pepin F, et al. Prognostic value of deep sequencing method for minimal residual disease detection in multiple myeloma[J] Blood. 2014;123(20):3073–3079. doi: 10.1182/blood-2014-01-550020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Roussel M, Lauwers-Cances V, Robillard N, et al. Front-line transplantation program with lenalidomide, bortezomib, and dexamethasone combination as induction and consolidation followed by lenalidomide maintenance in patients with multiple myeloma: a phase II study by the Intergroupe Francophone du Myélome[J] J Clin Oncol. 2014;32(25):2712–2717. doi: 10.1200/JCO.2013.54.8164. [DOI] [PubMed] [Google Scholar]
- 18.Paiva B, Gutiérrez NC, Rosiñol L, et al. High-risk cytogenetics and persistent minimal residual disease by multiparameter flow cytometry predict unsustained complete response after autologous stem cell transplantation in multiple myeloma[J] Blood. 2012;119(3):687–691. doi: 10.1182/blood-2011-07-370460. [DOI] [PubMed] [Google Scholar]
- 19.Paiva B, Cedena MT, Puig N, et al. Minimal residual disease monitoring and immune profiling in multiple myeloma in elderly patients[J] Blood. 2016;127(25):3165–3174. doi: 10.1182/blood-2016-03-705319. [DOI] [PubMed] [Google Scholar]