Abstract
目的
探讨青蒿琥酯联合硼替佐米对急性髓系白血病(AML)细胞株MV4-11细胞增殖、凋亡及自噬的影响及其作用机制。
方法
MTT法检测青蒿琥酯、硼替佐米单用及两药联合对MV4-11细胞的增殖抑制作用,流式细胞术检测细胞凋亡情况,Western blot法检测细胞内Bcl-2家族蛋白(Bcl-2、Mcl-1、Bim、Bax)、cleaved-Caspase-3及自噬相关蛋白LC3B的表达。
结果
青蒿琥酯呈浓度和时间依赖性抑制MV4-11细胞增殖,作用48 h的IC50为1.44 µg/ml。硼替佐米呈浓度依赖性抑制MV4-11细胞增殖,作用48 h的IC50为8.97 nmol/L。青蒿琥酯(0.75、1.0 µg/ml)与硼替佐米(6、8 nmol/L)联合作用48 h,对MV4-11细胞的增殖抑制率均高于单药组(P值均<0.05),两药相互作用的协同指数(CI)均<1。1.5 µg/ml青蒿琥酯作用MV4-11细胞48 h的凋亡率为(15.27±2.18)%,8 nmol/L硼替佐米作用MV4-11细胞48 h的凋亡率为(19.85±3.23)%,两药联合作用后凋亡率增高至(81.67±5.96)%,显著高于单药组(P值均<0.05)。两药联合作用MV4-11细胞24 h后细胞内cleaved-Caspase-3、促凋亡蛋白Bim及自噬相关蛋白LC3B表达上调,抗凋亡蛋白Bcl-2表达下调。
结论
青蒿琥酯联合硼替佐米具有协同抑制MV4-11细胞增殖和诱导凋亡及促进自噬的效应,作用机制可能与Bcl-2家族蛋白表达的改变有关。
Keywords: 白血病,髓样,急性, 青蒿琥酯, 硼替佐米, MV4-11细胞, Bcl-2家族蛋白
Abstract
Objective
To investigate the effects of artesunate combined with bortezomib on the proliferation, apoptosis and autophagy of human acute myeloid leukemia cell lines MV4-11, and its mechanisms.
Methods
MTT method was used to determine the anti-proliferation effect of different concentrations of artesunate, bortezomib and their combination on MV4-11 cells. The cell apoptosis were analyzed by flow cytometry. The expression of cleaved-Caspase-3, Bcl-2 family protein (Bcl-2, Mcl-1, Bim, Bax) and autophagy-related protein LC3B were assayed by Western blot.
Results
Artesunate displayed a proliferation inhibition effect on MV4-11 with dose- and time-dependent manner, the IC50 of artesunate on MV4-11 after 48 hours was 1.44 µg/ml. Bortezomib displayed a proliferation inhibition effect on MV4-11 with dose-dependent manner, the IC50 of bortezomib on MV4-11 after 48 hours was 8.97 nmol/L. The combination of artesunate (0.75, 1.0 µg/ml) and Bortezomib (6, 8 nmol/L) showed higher inhibition on MV4-11 than artesunate or bortezomib alone in the same concentration gradient after 48 hours (P<0.05). The cooperation index of the two drugs were all less than 1. The 48 h apoptotic rate of artesunate (1.5 µg/ml) on MV4-11 was (15.27±2.18) %, (19.85±3.23) % of bortezomib (8 nmol/L), (81.67±5.96) % of combination of the two drugs, significantly higher than the single group (P<0.05). When combination of the two drugs on MV4-11 after 24 hours, the levels of pro-apoptotic protein Bim and the cleaved activation of Caspase-3 and autophagy-related protein LC3B were up-regulated and the anti-apoptotic protein Bcl-2 expressions was down-regulated.
Conclusion
Combination of artesunate with bortezomib shows a significant synergistic effects on proliferation, apoptosis and autophagy of MV4-11 cell lines, which may be associated with Bcl-2 family proteins expression.
Keywords: Leukemia, myeloid, acute; Artesunate; Bortezomib; MV4-11 cell lines; Bcl-2 family proteins
急性髓系白血病(AML)是一种严重危害人类健康的血液系统恶性克隆性疾病。近年来,AML的治疗已取得很大进展,但仍有相当部分患者出现复发或耐药,只有40%~45%的年轻AML患者和不足10%的老年AML患者生存期超过5年[1]。因此,探索新药或新的治疗方案是目前AML的研究重点之一。有研究显示青蒿琥酯(Artesunate,ART)对多种急性白血病细胞株包括耐药细胞株均具有抑制增殖和促进凋亡的作用[2]。硼替佐米(Bortezomib,BTZ)是一种蛋白酶体抑制剂,主要应用于多发性骨髓瘤、套细胞淋巴瘤等血液系统恶性肿瘤的治疗。国内外研究证实BTZ也具有抗白血病效应[3]–[6]。目前国内有报道证实ART联合BTZ能协同抑制T细胞淋巴瘤细胞株Jurkat细胞的增殖[7]。本研究探讨ART联合BTZ对AML细胞株增殖、凋亡及自噬的影响及其可能的作用机制,为两药联合治疗AML提供实验依据。
材料与方法
1.试剂与仪器:ART购自中国食品药品检定研究院,BTZ购自西安杨森制药有限公司,RPMI 1640培养基、胎牛血清均购自美国Hyclone公司,噻唑蓝(MTT)购自美国Sigma公司,Annexin Ⅴ-FITC/碘化丙锭(PI)双染细胞凋亡检测试剂盒购自四正柏公司,BCA蛋白定量试剂盒购自康为试剂公司,半胱氨酸蛋白水解酶(Caspase-3)、cleaved-Caspase-3、Bim、Mcl-1、GAPDH单克隆抗体均购自美国Cell Signaling公司,Bcl-2、Bax单克隆抗体均购自美国Proteintech公司,LC3B单克隆抗体购自美国Sigma公司。流式细胞仪为美国Beckman Coulter公司产品;CO2恒温孵箱为美国Thermo Scientific公司产品。
2.细胞培养:人AML细胞株MV4-11细胞(带有FLT3-ITD突变)由四川大学华西医院血液病研究室提供。MV4-11细胞悬浮培养在含10%胎牛血清、100 U/ml青霉素、100 µg/ml链霉素的RPMI 1640培养液中,在37 °C、5%CO2、饱和湿度的恒温培养箱中培养,每2~3 d换液传代,取对数生长期的细胞进行实验,所有实验均重复3次。
3.细胞增殖抑制实验:MTT法检测ART、BTZ单药及联用对MV4-11细胞增殖的影响。取MV4-11细胞,调整细胞密度为1.5×105/ml,每孔90 µl接种于96孔板,加入不同浓度ART 10 µl,使其终浓度分别为0.75、1.0、1.5、2.0、2.5、3.0、3.5、4.0 µg/ml,每个浓度设3个复孔,并设不加药培养的细胞为对照组,另设不含细胞的培养液为空白组,置37 °C、5% CO2、饱和湿度培养箱中培养至24、48、72 h,每孔加入20 µl的MTT溶液,在培养箱孵育4 h后每孔加MTT溶解液100 µl,次日用酶标仪测定570 nm处的吸光度(A)值,采用graphpad prism6软件计算细胞增殖抑制率及IC50。同样方法检测BTZ对细胞的增殖抑制作用,BTZ终浓度为5、6、7、8、9、10、11、12 nmol/L,培养时间为48 h。两药联合作用时,ART浓度选择0.75和1 µg/ml,BTZ浓度选择6和8 nmol/L,培养时间为48 h,同样设对照组和空白组,采用CalcuSyn软件计算协同指数(CI)。
4.Annexin Ⅴ-FITC/PI双染法检测细胞凋亡率:收集药物处理48 h后的细胞悬液,1 200 r/min离心5 min(离心机半径15 cm),PBS洗涤细胞2次;加入200 µl的结合缓冲液(binding buffer)重悬细胞,先后避光加入2 µl的Annexin-Ⅴ-FITC和1.5 µl PI,避光孵育15 min,1 h内上流式细胞仪检测。
5.Western blot法检测蛋白表达水平:收集药物处理24 h后的各组细胞,加入细胞裂解液混匀后冰上裂解40 min,离心收集上清,BCA法检测蛋白浓度。以40 µg总蛋白进行SDS-PAGE后转膜至PVDF膜,50 g/L脱脂牛奶室温封闭1 h,一抗4 °C孵育过夜,次日洗涤后加入相应二抗共孵育1 h,洗涤后进行X光胶片显影。
6.统计学处理:采用SPSS17.0统计软件进行数据分析,本实验数据采用x±s进行描述,两组间均数比较采用t检验,多组间比较采用单因素方差分析,组间两两比较采用SNK法分析;P<0.05为差异具有统计学意义,各种统计图则采用Graphpad Prism6.0软件进行绘制。
结果
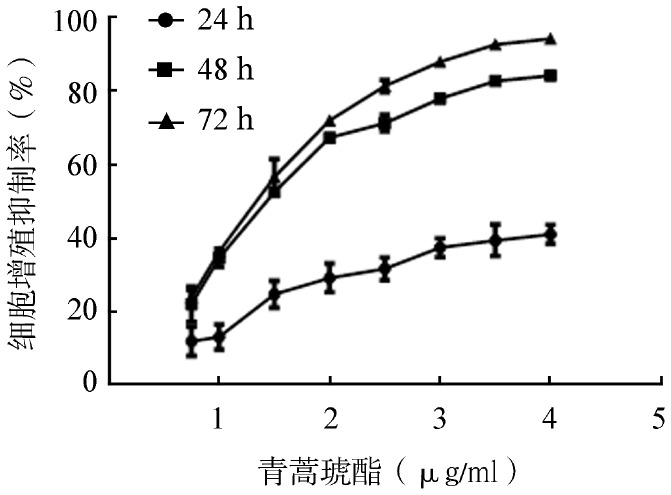
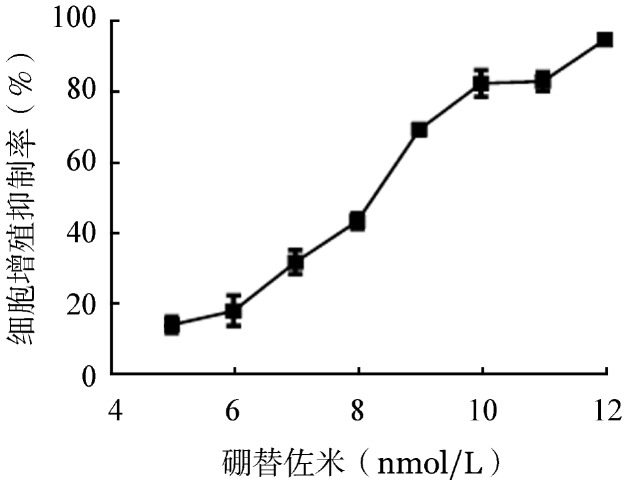
1.ART联合BTZ对MV4-11细胞增殖的影响:ART能抑制MV4-11细胞增殖,且作用呈时间和浓度依赖性(图1)。ART作用48 h对MV4-11细胞的IC50为1.44(95%CI 1.37~1.51)µg/ml。BTZ能抑制MV4-11细胞增殖,且作用呈浓度依赖性(图2)。BTZ作用48 h对MV4-11细胞的IC50为8.97(95% CI 8.60~9.35)nmol/L。
图1. 青蒿琥酯对MV4-11细胞增殖的影响(实验重复3次).
图2. 硼替佐米作用48 h对MV-11细胞增殖的影响(实验重复3次).
根据药物作用细胞株的IC50,选择低浓度的ART与BTZ分别或联合作用MV4-11细胞48 h,结果显示两药联合对MV4-11细胞的增殖抑制率均高于BTZ单药组(P<0.05)。两药相互作用的CI均<1(表1)。
表1. 青蒿琥酯(ART)联合硼替佐米对MV4-11细胞增殖的影响及两药协同指数(CI).
| 硼替佐米浓度 | 0 µg/ml ART |
0.75 µg/ml ART |
1.0 µg/ml ART |
||
| IR(%) | IR(%) | CI | IR(%) | CI | |
| 6 nmol/L | 16.83±1.93 | 72.40±0.91a | 0.80 | 83.29±0.75a | 0.70 |
| 8 nmol/L | 37.54±0.64 | 93.38±0.86a | 0.55 | 97.01±0.79a | 0.44 |
注:和硼替佐米单药组相比,aP<0.05;IR:细胞增殖抑制率。实验重复3次
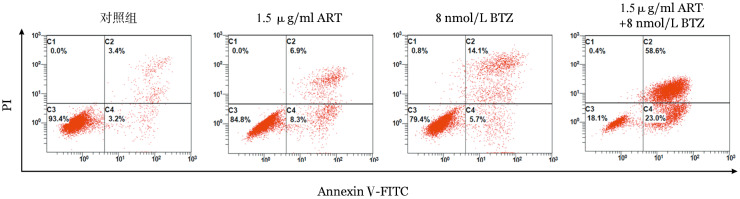
2.ART联合BTZ对MV4-11细胞凋亡的影响:1.5 µg/ml ART、8 nmol/L BTZ作用MV4-11细胞48 h的凋亡率分别为(15.27±2.18)%、(9.85±3.23)%,两用联合作用MV-11细胞的凋亡率为(81.67±5.96)%,显著高于单药组(t=18.12、18.35,P值均<0.05)(图3)。
图3. 青蒿琥酯(ART)联合硼替佐米(BTZ)对MV4-11细胞凋亡的影响.
3.ART联合BTZ对MV4-11细胞LC3B蛋白表达的影响:1.5 µg/ml ART联合6或8 nmol/L BTZ处理24 h后,MV4-11细胞株中LC3B-II表达上调(图4)。
图4. 青蒿琥酯联合硼替佐米对MV4-11细胞LC3B蛋白表达的影响.
1:对照组;2:1.5 µg/ml青蒿琥酯作用组;3:6 nmol/L硼替佐米作用组;4:8 nmol/L硼替佐米作用组;5:1.5 µg/ml青蒿琥酯联合6 nmol/L的硼替佐米作用组;6:1.5 µg/ml青蒿琥酯联合8 nmol/L硼替佐米作用组
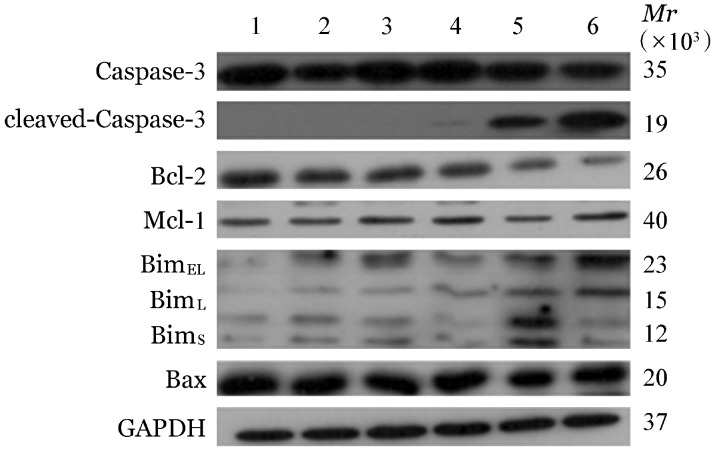
4.ART联合BTZ对MV4-11细胞内cleaved-Caspase-3及Bcl-2家族蛋白表达的影响:ART联合BTZ处理24 h后,MV4-11细胞中cleaved-Caspase-3表达上调,Bcl-2家族蛋白中抗凋亡蛋白Bcl-2表达下调,而促凋亡蛋白Bim蛋白表达上调(图5)。
图5. 青蒿琥酯联合硼替佐米对MV4-11细胞cleaved-Caspase3、Bcl-2、Mcl-1、Bim、Bax蛋白表达的影响.
1:对照组;2:1.5 µg/ml青蒿琥酯作用组;3:6 nmol/L硼替佐米作用组;4:8 nmol/L硼替佐米作用组;5:1.5 µg/ml青蒿琥酯联合6 nmol/L的硼替佐米作用组;6:1.5 µg/ml青蒿琥酯联合8 nmol/L硼替佐米作用组
讨论
青蒿素是从中国传统中草药黄花蒿中提取的有效抗疟疾成分。ART是青蒿素类似物,近年来其显著的抗肿瘤活性逐渐引起了人们的关注[8]。大量研究表明ART对多种AML细胞株均具有抑制增殖和诱导凋亡的作用,尤其对含MLL重排和FLT3-ITD突变的AML细胞更敏感[2],[9]。ART对正常造血细胞毒性低,与传统化疗药物不产生交叉耐药,与多种传统抗白血病药物如阿糖胞苷、阿霉素等联合使用具有协同效应,这使其成为一种有前景的抗白血病药物[2]。本研究结果显示,ART呈浓度和时间依赖性抑制MV4-11细胞增殖,与国内文献报道相似[10]。
BTZ是首个被美国FDA批准用于临床的蛋白酶体抑制剂,已成功应用于多发性骨髓瘤、套细胞淋巴瘤等血液系统恶性肿瘤的治疗。近年来,BTZ对AML细胞的作用引起学者们重视。研究表明,较低浓度的BTZ即可诱导AML细胞株及白血病干细胞凋亡,而对正常造血细胞毒性低[3],[11]–[12]。我们的研究结果显示BTZ可以抑制MV4-11细胞增殖,作用呈浓度依赖性,这与Yu等[13]的研究结果相似。ART和BTZ都显示出抗白血病效应,两药联合是否具有协同效应?我们的研究证实,ART联合BTZ对MV4-11细胞有协同抑制增殖和促进凋亡的作用,Western blot法检测结果显示两药联合后水解活化的Caspase-3的表达也明显增强,也符合我们的预期。
自噬(Autophagy)是细胞内受损、变性或衰老的蛋白质和细胞器被运输到溶酶体,溶酶体对其消化降解,以胞质内自噬体的出现为标志的自我消化过程,是除凋亡途径外细胞死亡的另一种重要方式[14]。有文献报道,ART可诱导乳腺癌细胞发生自噬[15]。也有研究表明,BTZ可诱导部分AML细胞和骨髓增生异常综合征细胞发生自噬[4],[16]。我们的研究结果表明ART联合BTZ可使MV4-11细胞中自噬相关蛋白LC3B的表达上调,这说明ART联合BTZ协同促进MV4-11细胞凋亡的同时也促进MV4-11细胞发生自噬。
研究表明,ART主要是通过线粒体凋亡途径诱导多种肿瘤细胞株包括白血病细胞株凋亡[17]–[19]。而BTZ也主要通过线粒体途径诱导细胞凋亡[13],[20]。细胞凋亡的线粒体途径主要受Bcl-2家族蛋白的调控,Bcl-2家族蛋白是细胞凋亡中最重要的调控因子,包括两类作用相反的凋亡调节蛋白,一类是抗凋亡蛋白,主要包括Bcl-2、Mcl-1、Bcl-xl;另一类是促凋亡蛋白,主要包括Bax、Bak、Bim、Bad等,两类凋亡调节蛋白的失衡促进或抑制了肿瘤细胞的凋亡。多个研究表明,ART诱导肿瘤细胞死亡的同时伴随Bcl-2家族蛋白的改变,如Bcl-2蛋白下调和Bax蛋白的上调[21]–[22]。也有研究表明,BTZ主要通过影响Bcl-2家族蛋白等的表达促进肿瘤细胞凋亡[23]。我们的研究结果显示,ART联合BTZ促进MV4-11细胞凋亡和自噬的同时伴随Bim蛋白的表达上调和Bcl-2蛋白的表达下调。
总之,ART联合BTZ具有协同抑制AML细胞株MV4-11细胞增殖和诱导凋亡及促进自噬的效应,作用机制可能与抗凋亡蛋白Bcl-2的下调和促凋亡蛋白Bim的上调有关。肿瘤的传统治疗如放疗、化疗不良反应大,本研究选用传统中药及靶向药物相结合,在减轻不良反应、增强疗效方面可能具有优势,这是本研究的创新之处。本研究首次证实了ART联合BTZ对AML细胞株具有协同抑制增殖和促进凋亡及自噬的作用,为两药联合治疗AML提供一定的实验依据,但其相互作用的具体机制还有待深入研究。
References
- 1.Siveen KS, Uddin S, Mohammad RM. Targeting acute myeloid leukemia stem cell signaling by natural products[J] Mol Cancer. 2017;16(1):13. doi: 10.1186/s12943-016-0571-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Fox JM, Moynihan JR, Mott BT, et al. Artemisinin-derived dimer ART-838 potently inhibited human acute leukemias, persisted in vivo, and synergized with antileukemic drugs[J] Oncotarget. 2016;7(6):7268–7279. doi: 10.18632/oncotarget.6896. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Colado E, Alvarez-Fernández S, Maiso P, et al. The effect of the proteasome inhibitor bortezomib on acute myeloid leukemia cells and drug resistance associated with the CD34+ immature phenotype[J] Haematologica. 2008;93(1):57–66. doi: 10.3324/haematol.11666. [DOI] [PubMed] [Google Scholar]
- 4.Larrue C, Saland E, Boutzen H, et al. Proteasome inhibitors induce FLT3-ITD degradation through autophagy in AML cells[J] Blood. 2016;127(7):882–892. doi: 10.1182/blood-2015-05-646497. [DOI] [PubMed] [Google Scholar]
- 5.尚 晋, 陈 志忠, 吴 文滨, et al. 硼替佐米对多药耐药HL-60细胞增殖的影响及耐药逆转作用[J] 中华血液学杂志. 2012;33(11):911–916. doi: 10.3760/cma.j.issn.0253-2727.2012.11.005. [DOI] [PubMed] [Google Scholar]
- 6.邵 明, 孙 玲, 崔 雪艳, et al. 硼替佐米对K562细胞增殖、凋亡及其对XIAP表达的影响[J] 中华血液学杂志. 2011;32(3):182–186. doi: 10.3760/cma.j.issn.0253-2727.2011.03.009. [DOI] [Google Scholar]
- 7.陈 均法, 金 洁, 郑 智茵, et al. 青蒿琥酯联合硼替佐米对T细胞淋巴瘤细胞的抑制作用观察[J] 浙江中医药大学学报. 2012;36(9):974–976. doi: 10.3969/j.issn.1005-5509.2012.09.006. [DOI] [Google Scholar]
- 8.Crespo-Ortiz MP, Wei MQ. Antitumor activity of artemisinin and its derivatives: from a well-known antimalarial agent to a potential anticancer drug[J] J Biomed Biotechnol. 2012;2012:247597. doi: 10.1155/2012/247597. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Drenberg CD, Buaboonnam J, Orwick SJ, et al. Evaluation of artemisinins for the treatment of acute myeloid leukemia[J] Cancer Chemother Pharmacol. 2016;77(6):1231–1243. doi: 10.1007/s00280-016-3038-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.王 建峰, 陈 燕, 虞 荣喜. 青蒿琥酯诱导白血病细胞凋亡及机理的实验研究[J] 浙江中医学院学报. 2005;29(6):55–58. doi: 10.3969/j.issn.1005-5509.2005.06.032. [DOI] [Google Scholar]
- 11.Guzman ML, Neering SJ, Upchurch D, et al. Nuclear factor-kappaB is constitutively activated in primitive human acute myelogenous leukemia cells[J] Blood. 2001;98(8):2301–2307. doi: 10.1182/blood.v98.8.2301. [DOI] [PubMed] [Google Scholar]
- 12.Guzman ML, Swiderski CF, Howard DS, et al. Preferential induction of apoptosis for primary human leukemic stem cells[J] Proc Natl Acad Sci U S A. 2002;99(25):16220–16225. doi: 10.1073/pnas.252462599. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Yu C, Rahmani M, Dent P, et al. The hierarchical relationship between MAPK signaling and ROS generation in human leukemia cells undergoing apoptosis in response to the proteasome inhibitor Bortezomib[J] Exp Cell Res. 2004;295(2):555–566. doi: 10.1016/j.yexcr.2004.02.001. [DOI] [PubMed] [Google Scholar]
- 14.Mizushima N. Autophagy: process and function[J] Genes Dev. 2007;21(22):2861–2873. doi: 10.1101/gad.1599207. [DOI] [PubMed] [Google Scholar]
- 15.Chen K, Shou LM, Lin F, et al. Artesunate induces G2/M cell cycle arrest through autophagy induction in breast cancer cells[J] Anticancer Drugs. 2014;25(6):652–662. doi: 10.1097/CAD.0000000000000089. [DOI] [PubMed] [Google Scholar]
- 16.Fang J, Rhyasen G, Bolanos L, et al. Cytotoxic effects of bortezomib in myelodysplastic syndrome/acute myeloid leukemia depend on autophagy-mediated lysosomal degradation of TRAF6 and repression of PSMA1[J] Blood. 2012;120(4):858–867. doi: 10.1182/blood-2012-02-407999. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Hamacher-Brady A, Stein HA, Turschner S, et al. Artesunate activates mitochondrial apoptosis in breast cancer cells via iron-catalyzed lysosomal reactive oxygen species production[J] J Biol Chem. 2011;286(8):6587–6601. doi: 10.1074/jbc.M110.210047. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Jiang Z, Chai J, Chuang HH, et al. Artesunate induces G0/G1 cell cycle arrest and iron-mediated mitochondrial apoptosis in A431 human epidermoid carcinoma cells[J] Anticancer Drugs. 2012;23(6):606–613. doi: 10.1097/CAD.0b013e328350e8ac. [DOI] [PubMed] [Google Scholar]
- 19.曾 彦, 倪 勋, 孟 文彤, et al. 青蒿琥酯对人淋巴细胞白血病/淋巴瘤细胞抑制作用及机理的研究[J] 四川大学学报(医学版) 2009;40(6):1038–1043. doi: 10.3969/j.issn.1672-173X.2009.06.016. [DOI] [PubMed] [Google Scholar]
- 20.扶 云碧, 孙 启鑫, 孟 凡义, et al. 蛋白酶体抑制剂硼替佐米诱导髓系白血病细胞株HL60凋亡的机制研究[J] 中华医学杂志. 2006;86(34):2413–2416. doi: 10.3760/j:issn:0376-2491.2006.34.010. [DOI] [PubMed] [Google Scholar]
- 21.乔 淑凯, 王 颖, 牛 志云, et al. 青蒿琥酯对SKM-1细胞增殖、细胞周期和细胞凋亡的作用及其相关机制[J] 中国实验血液学杂志. 2016;24(1):131–137. doi: 10.7534/j.issn.1009-2137.2016.01.026. [DOI] [PubMed] [Google Scholar]
- 22.Holien T, Olsen OE, Misund K, et al. Lymphoma and myeloma cells are highly sensitive to growth arrest and apoptosis induced by artesunate[J] Eur J Haematol. 2013;91(4):339–346. doi: 10.1111/ejh.12176. [DOI] [PubMed] [Google Scholar]
- 23.Fennell DA, Chacko A, Mutti L. BCL-2 family regulation by the 20S proteasome inhibitor bortezomib[J] Oncogene. 2008;27(9):1189–1197. doi: 10.1038/sj.onc.1210744. [DOI] [PubMed] [Google Scholar]