Abstract
目的
探讨针对CD4膜蛋白的CAR-T细胞对CD4+T细胞淋巴瘤细胞的靶向特异性杀伤作用。
方法
采用重组DNA技术构建含4-1BB共刺激分子的第二代针对CD4的CAR慢病毒载体,应用293T细胞包装慢病毒,采用流式细胞术检测T细胞的转染效率及T细胞亚群动态变化,采用流式细胞术微球法检测培养上清中IFN-γ浓度。
结果
①构建的慢病毒载体转染激活的T细胞后CAR膜蛋白阳性率达到50.0%~70.0%。T细胞激活后部分CD8+T细胞弱表达(dim)CD4膜蛋白。T细胞转染针对CD4的CAR慢病毒后CD4+ T细胞、CD8+ CD4dim T细胞逐渐被清除。②CAR-T细胞、对照组T细胞(空载体转染的T细胞)以8∶1效靶比分别与CD4+人T细胞淋巴瘤细胞株KARPAS 299细胞共培养24 h,杀伤效率分别为(96.9±2.1)%和(11.2±3.1)%,前者明显高于后者(t=7.137,P=0.028)。③CAR-T细胞单独培养,与转染慢病毒载体表达人CD4的K562细胞(K562-CD4细胞)、K562细胞共培养后上清中IFN-γ浓度分别为(1 785±268)、(15 648±2 168)、(1 978±354)pg/ml,CAR-T细胞与K562-CD4细胞共培养上清IFN-γ浓度明显高于其他两组,差异有统计学意义(P<0.01)。
结论
CD4特异性CAR-T细胞效应细胞免疫表型为CD8+ CD4+ T细胞,在体外具有杀伤正常CD4+ T细胞和CD4+ T细胞淋巴瘤细胞的活性,对于CD4dim T细胞也有较好的清除活性。
Keywords: 抗原,CD4, 淋巴瘤,T细胞, 嵌合抗原受体修饰的T细胞
Abstract
Objective
To study the specific killing effect of CD4 membrane protein targeted chimeric antigen receptor modified T (CAR-T) cell.
Methods
The second generation CD4 targeted chimeric antigen receptor containing 4-1BB costimulation domain was insert into lentiviral vector through recombinant DNA technology. Lentivirus was prepared and packaged by 293T cells with four plasmids. Beads activated T cells were transduced with lentivirus and the transduction efficiency was checked with Protein L and flow cytometry. T cell subsets and IFN-γ concentrations were detected with probe-tagged antibody and cytometric bead assay.
Results
①The transduction efficiency of activated T cells with prepared lentivirus were 50.0%–70.0%. A subset of CD8+ T cell acquired dim expression of CD4 membrane protein after activation. CD4+T cell and CD8+CD4dim T cell were gradually killed by CD4 targeted CAR-T post lentivirus transduction. ②The kill efficacy of CD4 targeted CAR-T cell and control T cell toward KARPAS 299 T cell at an E∶T ratio of 8∶1 for 24 h was (96.9±2.1)% and (11.2±3.1)%, CAR-T cell has a higher killing efficacy than control T cell (t=7.137, P=0.028). The IFN-γ concentrations in culture supernatant of CAR-T cell with K562-CD4 cell, CAR-T cell with K562 cell and CAR-T cell alone were (15 648±2 168), (1 978±354) and (1 785±268) pg/ml, CAR-T cell cocultured with K562-CD4 cell produced more IFN-γ than the other two controls (P<0.01).
Conclusion
CD4 targeted CAR-T has an immunophenotype of CD8+CD4−T cell. CD4 targeted CAR-T cell has killing efficacy toward normal CD4+T cell and CD4+T lymphoma cell. CD4 targeted CAR-T cell also has a killing efficacy toward CD4dim target cell.
Keywords: Antigen, CD4; Lymphoma, T cell; Chimeric antigen receptor modified T cell
T细胞淋巴瘤常以结外病变居多,按照临床病理学特征主要分为成人T细胞性白血病/淋巴瘤、外周T细胞淋巴瘤未定型、血管免疫母T细胞淋巴瘤、皮下脂膜炎样T细胞淋巴瘤、皮肤γδT细胞淋巴瘤、肝脾T细胞淋巴瘤、肠病型肠道T细胞淋巴瘤等[1]。T细胞淋巴瘤的疗效和预后较B细胞淋巴瘤差,而其疗效的提高有赖于针对T细胞淋巴瘤发生的原癌基因的靶向治疗新型药物、针对其免疫表型的抗体治疗等[2]–[4]。大部分外周T细胞淋巴瘤、间变大细胞淋巴瘤和血管免疫母T细胞淋巴瘤表达膜CD4抗原,针对CD4的治疗性单抗应用于T细胞淋巴瘤治疗,患者耐受性良好无严重不良反应[5]–[6]。
针对CD19的CAR-T细胞应用于B细胞急性淋巴细胞白血病(ALL)治疗,完全缓解率可达90%[7]–[9]。鉴于CAR构建元件包括单抗的单链可变区(scFv)、铰链区、跨膜区和共刺激信号区、CD3zeta胞内信号区[10]–[11],我们构建了针对CD4单抗scFv片段构成的CAR,通过慢病毒载体转染T细胞并观察其对CD4+T细胞的杀伤活性。
材料和方法
1. 主要试剂与仪器:RPMI 1640培养基、高糖DMEM培养液、TRIzol、Lipofectamine 2000、αCD3/CD28磁珠及PCR仪均为美国Gibco公司产品,X-Vivo 15无血清培养基为美国Lonza公司产品,重组人IL-2(rhIL-2)、rhIL-7和rhIL-15购自美国Peprotech公司。无内毒素质粒大提试剂盒购自德国QIAGEN公司,Polybrene购自美国Sigma公司,细胞因子CBA微球试剂盒购自美国BD公司。ONE-Glo Luciferase活性检测试剂盒购自美国Promega公司。FC500流式细胞仪为美国Coulter公司产品。Varioskan Flash多功能读数仪为美国Thermo公司产品。
2. 细胞株培养:人CD4+T细胞淋巴瘤细胞株KARPAS 299细胞购自美国菌种保藏中心(american type culture collection,ATCC),在实验室自行转染含萤火虫荧光素酶的慢病毒,并筛选稳定表达萤火虫荧光素酶的单克隆细胞。转染慢病毒载体表达人CD4的K562细胞(K562-CD4细胞)由本实验室制备。KARPAS 299、K562-CD4、K562细胞用RPMI 1640培养基+10%胎牛血清培养。
3. 慢病毒载体构建及浓缩制备:构建Lenti-CD4-CAR慢病毒载体。应用Lipo3000脂质体转染法分别将Lenti-CD4-CAR慢病毒载体质粒、Gag-pol质粒、VSV-G质粒共同转入293T包装细胞系,培养24~72 h时收集病毒上清。慢病毒上清经离心沉淀后采用定量PCR法滴定慢病毒滴度。
4. 流式细胞术检测Lenti-CD4-CAR在T细胞中的表达:调整健康志愿者外周血单个核细胞密度为2.0×106/ml,按2∶1比例加入CD3/CD28磁珠体外活化3 d,第4天加入150 U/ml rhIL-2,于37 °C、5% CO2、饱和湿度孵箱中扩增2 d。经流式细胞术验证CD3阳性率均>98%。感染复数(MOI)=5时,加入慢病毒悬液至激活的T细胞悬液,添加Polybrene 6 µg/ml,1 200×g室温条件离心2 h促进转染。收集慢病毒转染4 d后T细胞,用含5 g/L牛血清白蛋白、0.9 g/L叠氮钠的PBS液洗涤3次。按照说明书加入生物素标记的Protein L,洗涤去除多余游离Protein L,随后加入链亲和霉素-PE避光孵育30 min后洗涤、重悬,加入7-AAD孵育10 min后上流式细胞仪检测,分析活细胞群体CAR表达。
5. 萤火虫萤光素酶化学发光法检测CAR-T细胞的体外杀伤活性:采用V形底96孔板进行效应细胞(CAR-T细胞、空载体转染的T细胞)与靶细胞(KARPAS 299细胞)混合培养。每孔接种1×105个KARPAS 299细胞,转移至1.6 ml EP管离心收集细胞,按效靶比0.5∶1、1∶1、2∶1、4∶1、8∶1进行分组,采用无血清培养基补足终体积至200 µl,37 °C培养24 h。培养结束后转移100 µl细胞悬液至96孔平底板,加入100 µl ONE-Glo Luciferase活性检测试剂,室温孵育10 min后用Varioskan Flash多功能读数仪[购自赛默飞世尔科技(中国)有限公司]检测。杀伤活性计算公式为:
6. 流式细胞术微球法检测培养上清IFN-γ蛋白水平:无血清培养基调整效应细胞(CAR-T细胞、空载体转染的T细胞)密度为1×106/ml,靶细胞为K562-CD4细胞、K562细胞,效靶比为1∶1。CAR-T细胞实验分组:①CAR-T细胞单独培养组;②K562-CD4细胞+CAR-T细胞共培养组;③K562细胞+CAR-T细胞共培养组。空载体转染的T细胞实验分组同CAR-T细胞。培养24 h后收集培养上清,按照试剂盒说明书进行操作,上流式细胞仪检测IFN-γ表达水平,应用FCAP Array软件分析数据。
7. 统计学处理:采用SPSS18.0软件进行统计学分析。每组设3个复孔,实验重复3次。数据以均值±标准误表示,进行t检验。以P<0.05为差异有统计学意义。
结果
1.Lenti-CD4-CAR-4-1BB慢病毒表达质粒构建:成功构建针对人CD4的CARLenti-CD4-CAR-4-1BB(由抗人CD4的单链抗体、CD8α的铰链区和跨膜区及4-1BB胞内区、CD3zeta的胞内信号结构域构成),慢病毒表达转移质粒经限制性内切酶EcoRI-BamHI双酶切后所得长片段为8 500 bp左右,短片段为1 500 bp左右,且采用针对EF-1α的引物正向测序确认DNA序列无误,由此可以证明Lenti-CD4-CAR-4-1BB的编码基因插入位点正确(图1)。DNA测序结果显示Lenti-CD4-CAR-4-1BB的编码序列与设计序列完全一致。收集293T细胞制备的慢病毒上清液,超速冷冻离心机浓缩,应用定量PCR法测定活病毒滴度(浓缩后慢病毒滴度为1.0×108 TU/ml)。
图1. 针对CD4的CAR结构示意图(A)及慢病毒载体酶切后电泳图(B).
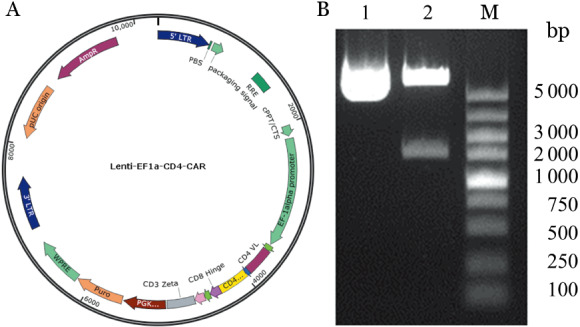
M:Marker;1:无酶切;2:酶切后
2.T细胞CAR的表达:CAR在T细胞中稳定表达对于CAR-T细胞发挥杀伤靶细胞作用是非常重要的。结果显示空载体慢病毒转染的T细胞中Protein L-PE阳性率低于4.5%,Lenti-CD4-CAR-4-1BB载体慢病毒转染的T细胞中Protein L-PE阳性率50.0%~70.0%(图2)。
图2. 流式细胞术检测针对CD4的CAR慢病毒载体转染T细胞效率.
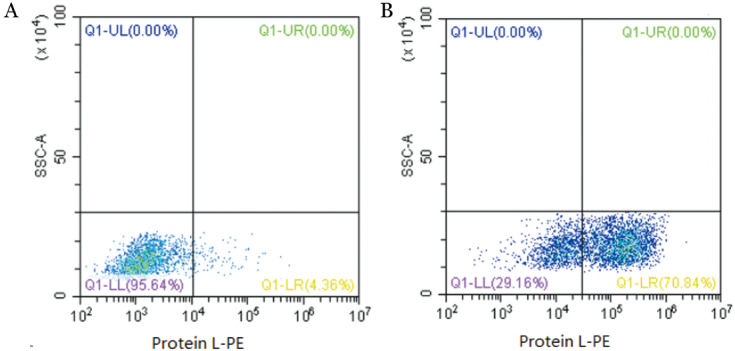
A:空载体慢病毒转染T细胞后;B:针对CD4的CAR慢病毒载体转染T细胞后
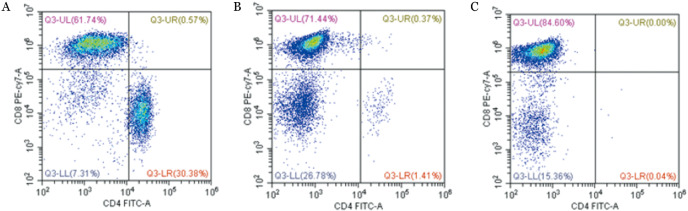
3.CAR对T细胞亚群的影响:慢病毒转染T细胞4 d后CD4+ T细胞为1.4%~2.0%,可见少量CD8+CD4low T细胞,提示T细胞表达CAR能够识别CD4分子并激活T细胞杀伤功能。慢病毒转染T细胞7 d后CD4+ T细胞和CD8+CD4low T细胞消失,主要为CD8+ T细胞,少量为CD4− CD8− T细胞(图3)。提示构建的CAR能够介导激活T细胞清除CD4+ T细胞和CD8+ CD4low T细胞。
图3. 流式细胞术检测针对CD4的慢病毒转染后CAR-T细胞中CD4+T细胞亚群变化.
A:转染前;B:转染后第4天;C:转染后第7天
4.CAR-T细胞对靶细胞的杀伤活性:结果显示CAR-T细胞与KARPAS 299细胞共培养24 h后,CAR-T细胞对KARPAS 299细胞的杀伤作用明显强于对照组(空载体转染的T细胞组),不同效靶比组间差异均有统计学意义(P值均<0.05)(表1)。
表1. 针对CD4的CAR-T细胞对KARPAS 299细胞的特异性杀伤活性(%,x±SE).
| 组别 | 不同效靶比 |
||||
| 0.5∶1 | 1∶1 | 2∶1 | 4∶1 | 8∶1 | |
| CAR-T细胞组 | 25.8±4.5 | 56.0±5.4 | 92.3±6.2 | 94.1±4.3 | 96.9±2.1 |
| 对照组 | 1.3±0.5 | 2.4±1.0 | 6.7±1.8 | 9.6±2.1 | 11.2±3.1 |
| t值 | 6.723 | 6.980 | 7.340 | 7.523 | 7.137 |
| P值 | 0.035 | 0.031 | 0.020 | 0.017 | 0.028 |
注:对照组:空载体转染的T细胞组。每组设3个复孔,实验重复3次
5.CAR-T细胞对靶细胞IFN-γ表达水平的影响:结果显示,CAR-T细胞与K562-CD4细胞共培养上清中IFN-γ表达水平高于其他两组,差异有统计学意义(P<0.01)(表2)。空载体转染的T细胞共培养组各组间差异无统计学意义(P>0.05)。
表2. 针对CD4的CAR-T细胞对K562细胞IFN-γ表达水平的影响(pg/ml,x±SE).
| 组别 | 对照组 | CAR-T细胞组 |
| T细胞单独培养组 | 583±50 | 1 785±268 |
| T细胞+K562细胞共培养组 | 679±66 | 1 978±354 |
| T细胞+K562-CD4细胞共培养组 | 679±65 | 15 648±2 168a |
注:对照组:空载体转染的T细胞组;K562-CD4细胞:表达人CD4的K562细胞;a与其他两组比较,P<0.01。每组设3个复孔,实验重复3次
讨论
T细胞淋巴瘤是起源于胸腺后或成熟T细胞的一组异质性淋巴瘤,在我国所有淋巴瘤中所占比例高达30%以上[1]。可供选择的一线治疗方案包括CHOP、HyperCVAD/MTX-AraC、EPOCH方案,对于年轻患者可考虑在疾病早期行造血干细胞移植。与传统化疗相比,自体造血干细胞移植可提高低危T细胞淋巴瘤患者的长期生存率,但对复发和难治的T细胞淋巴瘤患者的疗效较差,异基因造血干细胞移植后具有移植物抗淋巴瘤效应,但移植相关死亡率较高[12]。
大多数T细胞淋巴瘤呈CD4+,部分为CD8+、CD4+CD8+[13]。d'Amore等[6]研究发现,针对CD4的单抗联合化疗药物用于间变大细胞淋巴瘤、血管免疫母细胞T细胞淋巴瘤治疗后,患者外周血CD4+T细胞数减少,但是无抗体治疗相关严重感染发生。膜蛋白CD4高表达于辅助性T细胞表面、弱表达于单核细胞表面,造血干细胞不表达。鉴于针对CD19的CAR-T细胞治疗在B细胞ALL患者临床试验中取得良好的疗效[7],且目前T细胞淋巴瘤患者化疗、造血干细胞移植疗效差,我们设计了针对CD4胞外区的CAR慢病毒载体,其中的单抗针对的CD4具体表位不明,不同表位可能影响CAR-T细胞识别靶细胞及免疫突触的形成[14]。采用Protein L染色法,我们构建的慢病毒载体转染正常人T细胞后可获得高达50.0%~70.0%的阳性T细胞。有研究者报道CD8+ T细胞被激活后弱表达CD4[15]。我们在研究中也发现体外αCD3/CD28磁珠激活部分CD8+ T细胞弱表达CD4,针对CD4的CAR-T细胞培养7 d后其中的CD4+T细胞被清除,而且CD8+CD4low+ T细胞也被清除。提示我们构建的CAR能够介导激活T细胞,在体外与表达CD4的靶细胞形成免疫突触并杀伤靶细胞,且具有较高的亲和力,可以杀伤弱表达CD4的靶细胞。
人体CD4+ T细胞具有重要的抗感染、抗肿瘤作用。针对CD19的CAR-T细胞治疗ALL后患者出现低球蛋白血症,患者需要定期输注免疫球蛋白。在针对CD4的CAR中加入单纯疱疹病毒胸苷激酶、诱导性caspase 9、截短的表皮生长因子受体(EGFRt)等自杀基因元件有利于清除CAR-T细胞,促进患者正常CD4+ T细胞免疫重建。B细胞淋巴瘤患者CAR-T细胞治疗的有效率及CAR-T细胞体内扩增倍数低于B细胞ALL患者,可能与淋巴瘤患者前期多次应用利妥昔单抗免疫清除外周血B细胞而出现低B细胞血症有一定关系。鉴于CD4+ T细胞淋巴瘤患者的外周淋巴细胞主要为T细胞,其中的正常CD4+ T细胞及循环CD4+ T细胞淋巴瘤细胞均可以作为针对CD4的CAR-T细胞的靶细胞,理论上针对CD4的CAR-T细胞可以激活并大量增殖,并以较高的效靶比清除CD4+淋巴瘤细胞,提高CAR-T细胞治疗的安全性。
综上,在本研究中我们成功构建了含4-1BB共刺激分子、靶向CD4抗原的第二代CAR慢病毒载体,具有较高的转染激活T细胞效率,体外具有杀伤CD4+ T细胞及弱表达CD4的靶细胞活性。
Funding Statement
基金项目:江苏省科教强卫工程-临床医学中心(ZX201102);国家临床重点专科建设项目(201202017);国家高技术研究发展计划(863计划)(2012AA02A505);国家自然科学基金(81300444);江苏省自然科学基金(BK20130273)
Fund program: Jiangsu Provincial Key Medical Center and the Priority Academic Program Development of Jiangsu Higher Education Institutions (ZX201102); National Clinical Key Specialty Development Project and National Public Health Grand Research Foundation (201202017); National High Technology Research and Development Program of China 863 Program (2012AA02A505); National Natural Science Foundation of China (81300444); Natural Science Foundation of Jiangsu Province (BK20130273)
References
- 1.尹 光丽, 李 建勇, 缪 扣荣. 异基因造血干细胞移植治疗外周T细胞淋巴瘤研究进展[J] 中华血液学杂志. 2016;37(4):343–347. doi: 10.3760/cma.j.issn.0253-2727.2016.04.020. [DOI] [Google Scholar]
- 2.Gkotzamanidou M, Papadimitriou CA. Peripheral T-cell lymphoma: the role of hematopoietic stem cell transplantation[J] Crit Rev Oncol Hematol. 2014;89(2):248–261. doi: 10.1016/j.critrevonc.2013.08.016. [DOI] [PubMed] [Google Scholar]
- 3.陈 荣华, 郭 树霞, 张 晓娟. HyperCVAD方案和CHOP/CHOP样方案治疗初发的外周T细胞淋巴瘤的疗效[J] 中国实验血液学杂志. 2016;24(1):80–83. doi: 10.7534/j.issn.1009-2137.2016.01.015. [DOI] [PubMed] [Google Scholar]
- 4.邹 德慧, 黄 文阳, 刘 宏, et al. 自体造血干细胞移植治疗25例侵袭性外周T细胞淋巴瘤患者临床分析[J] 中华血液学杂志. 2015;36(6):455–459. doi: 10.3760/cma.j.issn.0253-2727.2015.06.002. [DOI] [Google Scholar]
- 5.Knox S, Hoppe RT, Maloney D, et al. Treatment of cutaneous T-cell lymphoma with chimeric anti-CD4 monoclonal antibody[J] Blood. 1996;87(3):893–899. [PubMed] [Google Scholar]
- 6.D'Amore F, Radford J, Relander T, et al. Phase II trial of zanolimumab (HuMax-CD4) in relapsed or refractory non-cutaneous peripheral T cell lymphoma[J] Br J Haematol. 2010;150(5):565–573. doi: 10.1111/j.1365-2141.2010.08298.x. [DOI] [PubMed] [Google Scholar]
- 7.Turtle CJ, Hanafi LA, Berger C, et al. CD19 CAR-T cells of defined CD4+:CD8+ composition in adult B cell ALL patients[J] J Clin Invest. 2016;126(6):2123–2138. doi: 10.1172/JCI85309. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Lee DW, Kochenderfer JN, Stetler-Stevenson M, et al. T cells expressing CD19 chimeric antigen receptors for acute lymphoblastic leukaemia in children and young adults: a phase 1 dose-escalation trial[J] Lancet. 2015;385(9967):517–528. doi: 10.1016/S0140-6736(14)61403-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Grupp SA, Kalos M, Barrett D, et al. Chimeric antigen receptor-modified T cells for acute lymphoid leukemia[J] N Engl J Med. 2013;368(16):1509–1518. doi: 10.1056/NEJMoa1215134. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Porter DL, Levine BL, Kalos M, et al. Chimeric antigen receptor-modified T cells in chronic lymphoid leukemia[J] N Engl J Med. 2011;365(8):725–733. doi: 10.1056/NEJMoa1103849. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Milone MC, Fish JD, Carpenito C, et al. Chimeric receptors containing CD137 signal transduction domains mediate enhanced survival of T cells and increased antileukemic efficacy in vivo[J] Mol Ther. 2009;17(8):1453–1464. doi: 10.1038/mt.2009.83. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Corradini P, Dodero A, Zallio F, et al. Graft-versus-lymphoma effect in relapsed peripheral T-cell non-Hodgkin's lymphomas after reduced-intensity conditioning followed by allogeneic transplantation of hematopoietic cells[J] J Clin Oncol. 2004;22(11):2172–2176. doi: 10.1200/JCO.2004.12.050. [DOI] [PubMed] [Google Scholar]
- 13.Pinz K, Liu H, Golightly M, et al. Preclinical targeting of human T-cell malignancies using CD4-specific chimeric antigen receptor (CAR)-engineered T cells[J] Leukemia. 2016;30(3):701–707. doi: 10.1038/leu.2015.311. [DOI] [PubMed] [Google Scholar]
- 14.Haso W, Lee DW, Shah NN, et al. Anti-CD22-chimeric antigen receptors targeting B-cell precursor acute lymphoblastic leukemia[J] Blood. 2013;121(7):1165–1174. doi: 10.1182/blood-2012-06-438002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Kitchen SG, Korin YD, Roth MD, et al. Costimulation of naive CD8(+) lymphocytes induces CD4 expression and allows human immunodeficiency virus type 1 infection[J] J Virol. 1998;72(11):9054–9060. doi: 10.1128/jvi.72.11.9054-9060.1998. [DOI] [PMC free article] [PubMed] [Google Scholar]