Abstract
目的
探讨JAK/STAT3介导的信号途径在苦参碱对K562细胞增殖抑制作用中的分子机制。
方法
以不同浓度苦参碱处理K562细胞,Western blot法分析JAK/STAT3通路分子JAK2、STAT3及其磷酸化蛋白表达的改变;荧光实时定量RT-PCR及Western blot法分析STAT3下游调控基因Bcl-xL、Cyclin D1、c-Myc的表达;荧光实时定量RT-PCR及ELISA法检测K562细胞IL-6表达的改变。以IL-6预处理K562细胞,Western blot法分析苦参碱对细胞内JAK2、STAT3及其磷酸化蛋白表达的作用。
结果
0.5 mg/ml苦参碱处理48 h, K562细胞内STAT3及JAK2总蛋白表达无明显变化,磷酸化STAT3(p-Tyr705 STAT3、p-Ser727 STAT3)和磷酸化JAK2 (p-JAK2)表达水平分别由处理前的0.690± 0.119、1.150±0.263和0.670±0.137下降至0.370±0.024、0.700±0.172和0.049±0.057。苦参碱对STAT3下游调控基因Bcl-xL、Cyclin D1及c-Myc的转录及蛋白表达均有抑制作用,并可显著抑制IL-6的表达和分泌,0.5和0.8 mg/ml苦参碱处理后细胞培养上清中IL-6浓度分别为(10.74±1.83) pg/ml和(8.66± 1.24) pg/ml,较处理前[(35.1±1.93) pg/ml]显著降低(P<0.05)。IL-6预处理K562细胞后,STAT3、JAK2、p-STAT3及p-JAK2表达均有增加,苦参碱可抑制IL-6对上述分子表达的上调。
结论
苦参碱抑制K562细胞增殖与JAK/STAT3介导的信号通路抑制有关,IL-6表达抑制可能是苦参碱调控JAK/STAT3通路活性的始动机制。
Keywords: 苦参碱, K562细胞, 白细胞介素6, JAK/STAT3信号通路
Abstract
Objective
To investigate the molecular mechanism of the growth inhibitory effect of matrine on K562 cells in JAK/STAT3 mediated signal pathway.
Methods
Western blot analyses were performed to investigate the differential expression of JAK2, STAT3, phospho-STAT3 (Tyr705 & Ser727) and phospho-JAK2 proteins after matrine treatment in K562 cells with or without human recombinant interleukin 6 (IL-6) pretreatment. The expressions of STAT3 response gene products such as Bcl-xL, Cyclin D1 and c-Myc, were investigated by Western blot and quantitative real time RT-PCR (qRT-PCR). Expression of IL-6, a potent upstream activating factor of JAK/STAT3 pathway, was analyzed by both real time qRT-PCR and ELISA.
Results
Western blot revealed that matrine treatment resulted in a strong down-regulation of phospho-STAT3 both in Tyr705 and Ser727 sites or phospho-JAK2 proteins expression without significant effects on the total STAT3 and JAK2 proteins. The expression of phospho-Tyr705 STAT3 and phospho-Ser727 STAT3 was decreased to 0.370±0.024 and 0.700±0.172 in K562 cells treated with 0.5 mg/ml matrine for 48 h, respectively, from 0.690 ± 0.119 and 1.150 ± 0.263 in control cells, accompanied with a dramatical down-regulation of phospho-JAK2 from 0.670±0.137 to 0.049±0.057 (P< 0.05). In addition, it was found that the expression of Bcl-xL, Cyclin D1, c-Myc was decreased both at the transcriptional and protein level in K562 cells after matrine treatment. Matrine treatment resulted in a significant decrease in the expression level of IL-6 in K562 cells from (35.1±1.93) to (10.74±1.83) and (8.66±1.24) pg/ml at the dose of 0.5 and 0.8 mg/ml, respectively (P<0.05). Matrine treatment could diminish the up-regulation of STAT3, JAK2, phospho-STAT3 and phospho-JAK2 protein following pretreatment with IL-6 in K562 cells.
Conclusion
Matrine exerts its anti-leukemia effect by interfering with the JAK2/STAT3 signaling pathway. The inhibition of IL-6 expression may play a pivotal role in the disruption of JAK/STAT pathway by matrine.
Keywords: Matrine, K562 cell, Interleukin-6, JAK/STAT3 signal pathway
慢性髓性白血病(CML)是一种常见的造血系统恶性肿瘤,具有独特的生物学特性。信号转导与转录激活因子家族3(STAT3)是一种广泛表达于多种组织和细胞中的转录激活因子,主要受细胞因子介导激活,其在造血细胞的发育分化中发挥着不可或缺的重要作用[1]–[2]。JAK/STAT3途径是STAT3激活的经典途径,在介导STAT3活化的胞外细胞因子信号中IL-6与JAK/STAT3的激活关系最为密切。作为重要的白血病细胞生长存活因子,白血病细胞自身或免疫细胞分泌的IL-6均可直接激活胞内的JAK/STAT3信号通路,对白血病的发生、发展发挥重要作用[3]–[4]。我们此前的研究表明,苦参碱可显著抑制包括人白血病细胞在内的多种肿瘤细胞体外增殖[5]–[6]。本研究中我们进一步观察苦参碱对人CML细胞株K562细胞增殖抑制的分子机制。
材料和方法
一、细胞及主要试剂
K562细胞购自中国科学院上海生命科学院生物化学与细胞生物学研究所,以含10% FBS的RPMI 1640培养基,于37 °C、5%CO2条件下常规培养。苦参碱购自陕西省西安植物园植物化学开发研究所,纯度为99.5%,以ddH2O配为10 mg/ml储存浓度备用。FBS、细胞培养基(RPMI 1640、α-MEM)为美国Gibco公司产品。IL-6、STAT3、Bcl-xL、Cyclin D1及c-Myc上下游引物由上海生工生物工程技术服务有限公司合成。逆转录试剂盒(RevertAid™ First Strand cDNA Synthesis Kit,K1622)为美国Fermentas (MBI)公司产品。Marker DL2000 (3427Q)、PCR体系为日本TaKaRa公司产品。TRIzol总RNA提取试剂(15596-026)为美国Invitrogen公司产品。RIPA细胞裂解液(PP1901)购自北京百泰克生物科技有限公司。蛋白酶抑制剂(Protease Inhibitor Cocktail,ab65621)为英国Abcam公司产品。STAT3 (Ser727) (9136)、STAT3 (Tyr705)(9132)、磷酸化STAT3、JAK2(3230L)、磷酸化JAK2 (4406S)、Bcl-xL (2762)、Cyclin D1 (2922)、c-Myc (9402)单克隆抗体为美国Cell Signaling Technology公司产品。化学发光Amersham ECL Plus™ Kit为美国GE Healthcare公司产品。人重组IL-6冻干粉(200-06)购自美国PeproTech公司。人IL-6 ELISA检测试剂盒(D6050)为美国R&D公司产品。
二、方法
1.细胞处理:收集对数生长期K562细胞,调整细胞密度为(0.5~1.0)×105/ml,置于37 °C、饱和湿度、5% CO2培养箱中培养。苦参碱处理组细胞加入10 mg/ml苦参碱溶液,使其终浓度为0.5和0.8 mg/ml,处理24或48 h,对照组加入等体积PBS缓冲液。IL-6预处理组则将人IL-6冻干粉用无菌水重悬至1.0 mg/ml,加入实验细胞中,使其终浓度达50 ng/ml,预处理6 h,再加入苦参碱溶液,使其终浓度为0.5和0.8 mg/ml,处理24或48 h。收集各处理组细胞,提取细胞内总RNA及蛋白进行RT-PCR及Western blot分析;收集细胞培养上清液冻存于−20 °C,进行ELISA分析。
2.实时荧光定量RT-PCR分析IL-6、Bcl-xL、Cyclin D1及c-Myc mRNA表达:苦参碱(0.5、0.8 mg/ml)处理K562细胞24或48 h后,收集细胞,按TRIzol Reagent说明步骤,抽提各组细胞总RNA,逆转录生成cDNA,两步法行荧光实时定量RT-PCR,相对定量法(mRNA相对表达水平= 2−ΔΔCt)计算目标片段的扩增比例。GAPDH为内参,以目的条带灰度值与GAPDH条带灰度值的比值进行归一标准化,不同处理组目的基因的表达水平以其标准化值与对照组标准化值的比值表示。PCR扩增条件:95 °C预变性3 min后,95 °C 25 s、57 °C 25 s(Bcl-xL为60 °C 45 s)、72 °C 50 s, 72 °C延伸5 min,共40个循环。各目的片段扩增引物序列及大小见表1。
表1. 扩增目的片段的引物序列及大小.
| 基因 | 引物序列(5′→3′) | 扩增片段长度(bp) |
| IL-6 | 上游:AAATTCGGTACATCCTCGACGG | 112 |
| 下游:GGAAGGTTCAGGTTGTTTTCTGC | ||
| Bcl-xL | 上游:CCCAGAAAGGATACAGCTGG | 448 |
| 下游:GCGATCCGACTCACCAATAC | ||
| Cyclin D1 | 上游:CTGGCCATGAACTACCTGGA | 483 |
| 下游:GTCACACTTGATCACTCTGG | ||
| c-Myc | 上游:CTCTCAACGACAGCAGCCCG | 250 |
| 下游:CCAGTCTCAGACCTAGTGGA | ||
| GAPDH | 上游:ACCACAGTCCATGCCATCAC | 450 |
| 下游:TCCACCACCCTGTTGCTGTA |
3.Western blot法分析JAK/STAT3信号通路分子表达改变:收集各实验组细胞,以RIPA裂解液充分裂解细胞,抽提细胞内总蛋白,BCA法进行蛋白定量后,分别取20和50 µg总蛋白行胞内总蛋白或磷酸化蛋白的125 g/L SDS-PAGE, 30 mA恒流条件下,半干法转至PVDF膜,4 °C过夜;50 g/L脱脂奶粉溶液封闭,分别与各目标蛋白单克隆抗体(1∶500或1∶2 000稀释)4 °C孵育过夜,β-actin为内参;TBST洗膜3次后,与HRP标记的二抗(1∶5 000稀释)作用,37 °C孵育4 h,ECL显色、X线胶片曝光后,凝胶成像分析系统进行图像采集。采用Quantity One(美国BIO-RAD公司产品)对目的条带灰度值定量,以目的蛋白磷酸化条带灰度值与其总蛋白条带灰度值的比值表示细胞内JAK、STAT3蛋白磷酸化水平。
4.IL-6的ELISA分析:IL-6的分析采用双抗夹心ELISA法,操作按试剂说明书进行。
三、统计学处理
采用SPSS13.0软件进行统计学分析。实验数据用均数±标准差表示,多组间差异性比较采用方差分析,两两比较采用q检验(Newman-Kueuls法),P<0.05为差异具有统计学意义。
结果
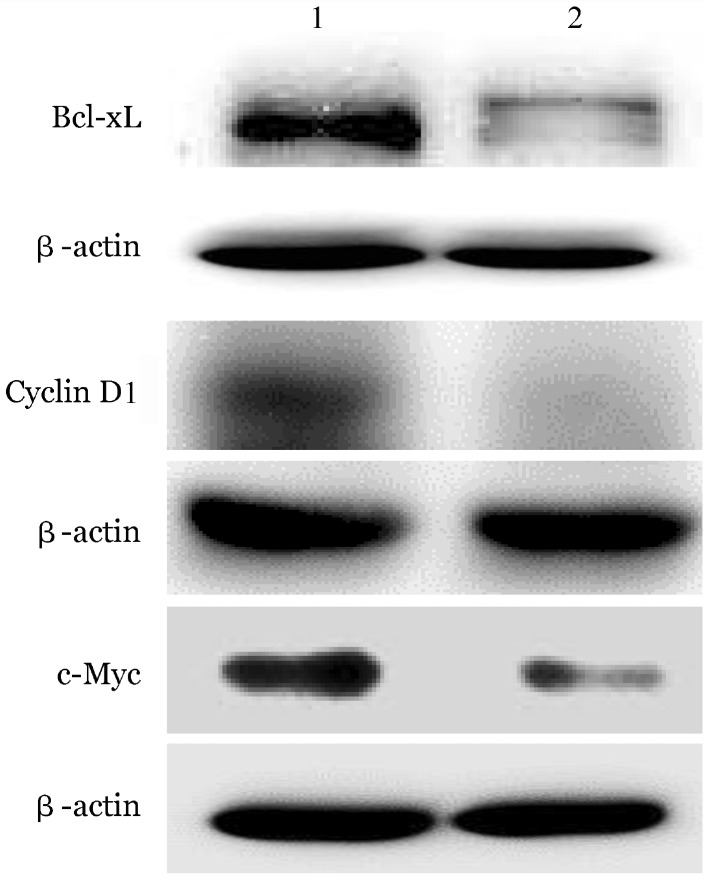
1.苦参碱对STAT3调控基因Bcl-xL、Cyclin D1、c-Myc表达的影响:Western blot结果显示,0.5 mg/ml苦参碱作用48 h,K562细胞Bcl-xL、Cyclin D1及c-Myc的蛋白表达水平下降(图1);RT-PCR分析结果显示,0.5、0.8 mg/ml苦参碱作用后细胞中Bcl-xL、Cyclin D1及c-Myc的mRNA表达不同程度降低(表2)。
图1. Western blot法分析苦参碱作用48 h后对K562细胞STAT3靶基因表达的影响.
1:对照组;2:0.5 mg/ml苦参碱处理组
表2. 苦参碱(MAT)作用48 h后对K562细胞Bcl-xL、Cyclin D1及c-Myc mRNA表达的影响(n=3,x±s).
| 组别 | Bcl-xL | Cyclin D1 | c-Myc |
| 对照组 | 1 | 1 | 1 |
| MAT作用组 | |||
| 0.5 mg/ml | 0.640±0.020a | 0.704±0.026 | 0.840±0.042 |
| 0.8 mg/ml | 0.573±0.028b | 0.580±0.001b | 0.721±0.031a |
注:与对照组比较,aP <0.05,bP <0.01
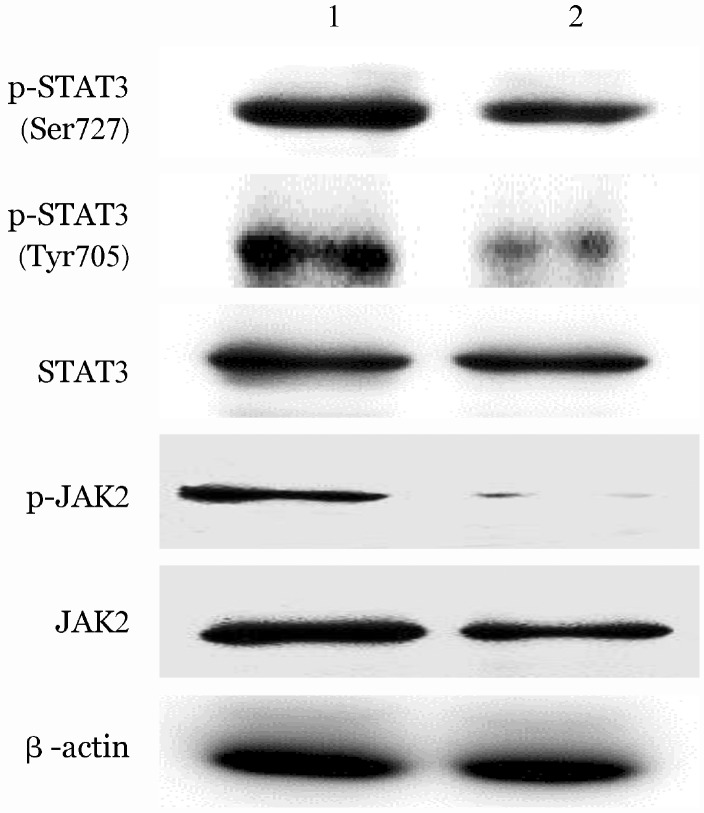
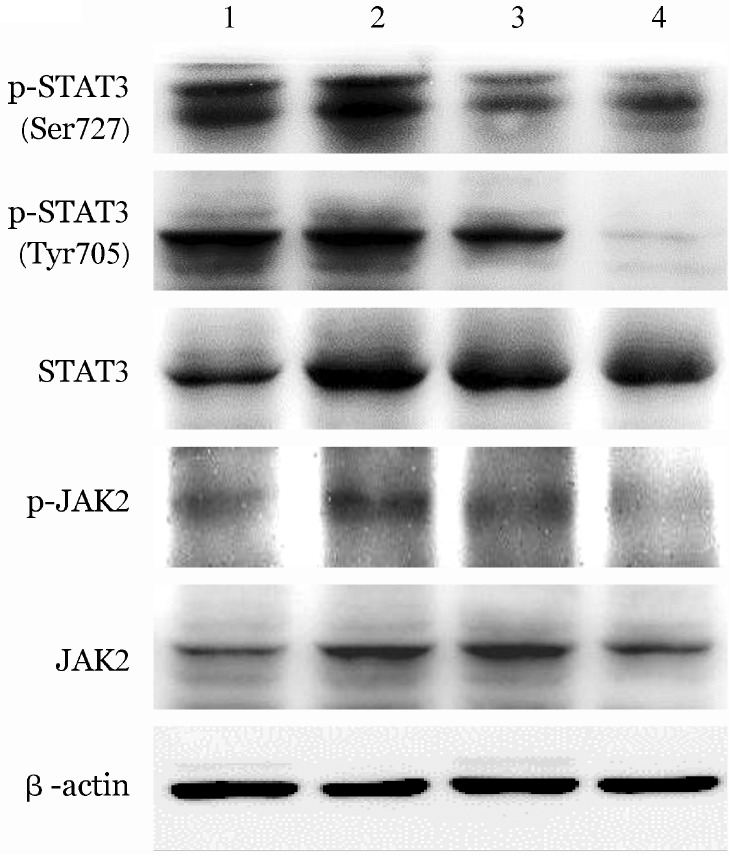
2.苦参碱对JAK/STAT3通路分子磷酸化水平的影响:Western blot结果显示,0.5 mg/ml苦参碱处理48 h, K562细胞内JAK2和STAT3总蛋白的表达无明显改变,磷酸化STAT3(p-Tyr705和p-Ser727)及磷酸化JAK2 (p-Tyr1007)表达均较对照组明显降低,磷酸化STAT3(p-Tyr705)的降低更为显著(图2,表3)。以IL-6预处理后,细胞内STAT3、JAK2、磷酸化STAT3 (p-Tyr705和p-Ser727)和磷酸化JAK2 (p-Tyr1007)蛋白表达水平均明显增高,加入0.5 mg/ml苦参碱处理后,上述分子的表达一定程度抑制,增加苦参碱处理浓度(0.8 mg/ml),上述分子的抑制效应更为明显(图3,表4)。
图2. Western blot法分析苦参碱作用48 h后对K562细胞JAK2、STAT3表达的影响.
1:对照组;2:0.5 mg/ml苦参碱处理组
表3. Western blot法检测0.5 mg/ml苦参碱作用48 h后对K562细胞JAK2、STAT3蛋白表达的影响(n=3,x±s).
| 组别 | JAK2 | p-JAK2 | p-JAK2/JAK2 | STAT3 | p-STAT3(Tyr705) | p-STAT3(Tyr705)/STAT3 | p-STAT3(Ser727) | p-STAT3(Ser727)/STAT3 |
| 对照组 | 11 805±522 | 7 874±293 | 0.670±0.137 | 11 658±1 044 | 8 063±831 | 0.690±0.119 | 13 403±731 | 1.150±0.263 |
| 苦参碱组 | 8 147±682 | 392±90 | 0.049±0.057a | 9 835±846 | 7 016±965 | 0.370±0.024b | 6 878±337 | 0.700±0.172b |
注:p:磷酸化;与对照组比较,aP <0.05,bP <0.01
图3. Western blot法分析苦参碱(MAT)作用48 h后对经50 ng/ml IL-6预处理的K562细胞JAK2、STAT3蛋白表达的影响.
1:对照组;2:IL-6预处理组;3:IL-6 +0.5 mg/ml MAT作用组;4:IL-6 +0.8 mg/ml MAT作用组
表4. Western blot法检测MAT作用48 h后对经50 ng/ml IL-6预处理的K562细胞JAK2、STAT3蛋白表达的影响(n=3,x±s).
| 组别 | JAK2 | p-JAK2 | p-JAK2/JAK2 | STAT3 | p-STAT3(Tyr705) | p-STAT3(Tyr705)/STAT3 | p-STAT3(Ser727) | p-STAT3(Ser727)/STAT3 |
| 对照组 | 22 205±1 873 | 16 112±1 242 | 0.799±0.120 | 25 425±2 473 | 22 343±2 089 | 0.879±0.254 | 21 514±1 723 | 0.814±0.243 |
| IL-6 | 26 718±2 143 | 22 354±1 483 | 0.841±0.240 | 36 189±3 186a | 24 181±2 703 | 0.670±0.213a | 33 134±2 318a | 0.920±0.306 |
| IL-6+0.5 mg/ml MAT | 32 308±216b | 20 791±1 049a | 0.647±0.153a | 28 573±2 224 | 16 333±1 519a | 0.572±0.136a | 18 538±2 862 | 0.649±0.171b |
| IL-6+0.8 mg/ml MAT | 18 416±573 | 7 348±607b | 0.401±0.019b | 19 139±1 348b | 912±128b | 0.052±0.146b | 20 756±2 014a | 1.024±0.223b |
注:MAT:苦参碱;p:磷酸化;与对照组比较,aP<0.05,bP<0.01
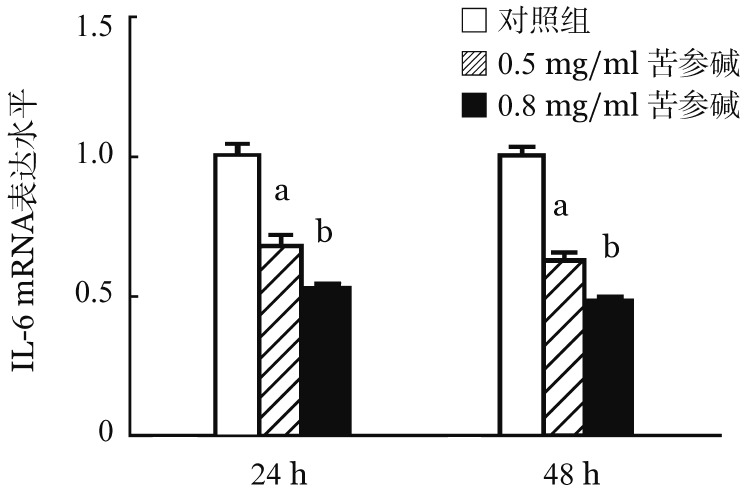
3.苦参碱对IL-6表达的影响:ELISA结果显示,0.5和0.8 mg/ml苦参碱处理48 h后,K562细胞培养上清中IL-6浓度分别由处理前的(35.1±1.93)pg/ml降低至(10.74±1.83)pg/ml和(8.66±1.24)pg/ml(P<0.05)。RT-PCR分析结果显示,0.5和0.8 mg/ml苦参碱分别处理24和48 h,细胞内IL-6的转录均显著降低(P<0.05),并具有时间和浓度依赖性效应(图4)。
图4. RT-PCR分析苦参碱对K562细胞IL-6 mRNA表达的影响(n=3).
与对照组比较,aP<0.05,bP<0.01
讨论
苦参碱是从苦参类植物的根中提取出的一种生物碱成分,具有抗病毒、抗心律失常、消炎去肿等多种药理学活性。近年来,苦参碱的抗肿瘤作用被广为关注。研究发现,苦参碱可诱导人CML细胞株K562细胞向红系方向分化、抑制细胞内DNA的合成、诱导细胞早期凋亡;与临床常用化疗药物联用可逆转细胞耐药等[7]–[8],显示苦参碱在白血病治疗中具有一定的应用前景。
JAK/STAT通路的持续激活被证实与白血病细胞的增殖异常、凋亡受阻及分化障碍密切相关[9]。我们在以往研究中曾发现,苦参碱抑制K562细胞增殖、诱导细胞向红系分化的过程中伴有广泛的蛋白酪氨酸激酶活性短暂下降和酪氨酸磷酸酶的活性改变,表明苦参碱可能通过影响细胞内酪氨酸蛋白激酶的磷酸化水平,影响细胞的增殖、分化,促进其凋亡[10]。本研究结果显示,苦参碱处理对K562细胞JAK/STAT3通路JAK2、STAT3分子的总蛋白表达没有明显作用,但可显著抑制JAK2及STAT3蛋白的磷酸化,提示苦参碱可能通过抑制上述分子或激酶的磷酸化影响JAK/STAT3通路活性。
白血病细胞中普遍存在STAT3的组成性活化。持续激活的STAT3信号能够将酪氨酸激酶信号进行整合,通过与细胞核DNA作用元件的结合,启动下游多个与细胞生长和增殖相关基因的转录,促进白血病的发生[9]。在STAT3作为转录因子参与调控的下游相关基因中,Cyclin D1、c-Myc、Bcl-xL与细胞周期的转换、分化和凋亡关系密切。Cyclin D1是一种主要在G1期发挥调控作用的细胞周期调控因子,可增强细胞通过G→S期检查点,促进细胞的增殖[11]。c-Myc对细胞周期进程发挥关键性调节作用,此外,c-Myc还通过多种途径参与细胞增殖与凋亡调控[12]。对上述分子的表达分析发现,苦参碱处理后细胞内Cyclin D1、c-Myc与Bcl-xL的转录和蛋白表达均出现不同程度下调。我们此前的研究已证实苦参碱对体外培养的K562细胞增殖具有明显的剂量和时间依赖性抑制效应,诱导细胞早期凋亡是苦参碱抑制K562细胞增殖的重要分子机制。此外,苦参碱处理的K562细胞G0/G1期细胞显著增多,S期细胞明显减少,出现明显的G0→S期阻滞。结合本研究结果,我们认为,Bcl-xL、c-Myc和Cyclin D1表达下调是苦参碱导致K562细胞周期阻滞和凋亡的分子机制,这一作用与JAK/STAT3通路抑制有关。
IL-6及其受体介导的胞外信号是JAK/STAT3通路激活的最主要的激活因子,白血病细胞可通过自分泌或旁分泌IL-6引起STAT3的组成性活化,进而参与白血病细胞的恶性转化[3]。有研究报道,阻断IL-6诱导的STAT3通路活化可抑制人骨髓瘤细胞Bcl-xL蛋白表达,从而诱导细胞凋亡[13]。我们的研究结果显示,苦参碱处理可使K562细胞IL-6mRNA及蛋白的表达明显降低,提示苦参碱介导的JAK/STAT3通路抑制可能与IL-6的表达有关。
综上所述,苦参碱对K562细胞的增殖抑制与JAK/STAT3通路的活性抑制有关,IL-6的表达下调与苦参碱介导的JAK/STAT3通路抑制有关。但IL-6是否为苦参碱介导的JAK/STAT3抑制的主要原因?是否还有其他机制参与?这些问题的进一步阐明对揭示苦参碱的抗肿瘤作用机制,进一步应用于白血病临床治疗具有重要意义。
Funding Statement
基金项目:国家自然科学基金(81101647);常州市医学卫生创新人才项目;南京医科大学博士后课题
References
- 1.Yu H, Jove R. The STATs of cancer—new molecular targets come of age[J] Nat Rev Cancer. 2004;4(2):97–105. doi: 10.1038/nrc1275. [DOI] [PubMed] [Google Scholar]
- 2.Bowman T, Garcia R, Turkson J. STATs in oncogenesis[J] Oncogene. 2000;19(21):2474–2488. doi: 10.1038/sj.onc.1203527. [DOI] [PubMed] [Google Scholar]
- 3.Burger R. Impact of interleukin-6 in hematological malignancies[J] Transfus Med Hemother. 2013;40(5):336–343. doi: 10.1159/000354194. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Reynaud D, Pietras E, Barry-Holson K, et al. IL-6 controls leukemic multipotent progenitor cell fate and contributes to chronic myelogenous leukemia development[J] Cancer Cell. 2011;20(5):661–673. doi: 10.1016/j.ccr.2011.10.012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Sun M, Han J, Duan J, et al. Novel antitumor activities of Kushen flavonoids in vitro and in vivo[J] Phytother Res. 2007;21(3):269–277. doi: 10.1002/ptr.2066. [DOI] [PubMed] [Google Scholar]
- 6.Zhang S, Zhang Y, Zhuang Y, et al. Matrine induces apoptosis in human acute myeloid leukemia cells via the mitochondrial pathway and Akt inactivation[J] PLoS One. 2012;7(10):e46853. doi: 10.1371/journal.pone.0046853. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.张 莉萍, 蒋 纪恺, 张 彦, et al. 苦参碱对K562细胞增殖与分化作用的机制研究[J] 中华血液学杂志. 1999;20(6):793–800. [Google Scholar]
- 8.Liu XS, Jiang J. Molecular mechanism of matrine-induced apoptosis in leukemia K562 cells[J] Am J Chin Med. 2006;34(6):1095–1103. doi: 10.1142/S0192415X06004557. [DOI] [PubMed] [Google Scholar]
- 9.Benekli M, Baumann H, Wetzler M. Targeting signal transducer and activator of transcription signaling pathway in leukemias[J] J Clin Oncol. 2009;27(26):4422–4432. doi: 10.1200/JCO.2008.21.3264. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.刘 北忠, 蒋 纪恺, 何 於娟, et al. 苦参碱对K562细胞蛋白酪氨酸激酶及磷酸酶活性的影响[J] 癌症. 2002;21(12):1292–1295. [Google Scholar]
- 11.Pestell RG. New roles of cyclin D1[J] Am J Pathol. 2013;183(1):3–9. doi: 10.1016/j.ajpath.2013.03.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Bretones G, Delgado MD, Leon J. Myc and cell cycle control[J] Biochim Biophys Acta. 2015;1849(5):506–516. doi: 10.1016/j.bbagrm.2014.03.013. [DOI] [PubMed] [Google Scholar]
- 13.Bharti AC, Donato N, Aggarwal BB. Curcumin (diferuloylmethane) inhibits constitutive and IL-6-inducible STAT3 phosphorylation in human multiple myeloma cells[J] J Immunol. 2003;171(7):3863–3871. doi: 10.4049/jimmunol.171.7.3863. [DOI] [PubMed] [Google Scholar]