Abstract
目的
优化二代CD19嵌合抗原受体(CD19-CAR)逆转录病毒载体对人原代T细胞的转染效率。
方法
应用重组DNA技术将CD19-CAR构建入逆转录病毒载体,转入plat-A包装细胞收集病毒上清并转染人原代T细胞及K562细胞系,采用流式细胞术检测不同条件下的转染效率,用RT-PCR方法检测目的基因的表达情况,用ELISA法检测IFN-γ、TNF-α表达水平。
结果
①MigR1-CD19-CAR逆转录病毒载体成功构建后包装高滴度逆转率病毒;②相同条件下,MigR1-CD19-CAR逆转录病毒对K562细胞系转染效率显著高于T细胞;③对T细胞,离心120 min组的转染率为(54.5±14.6)%,明显高于未离心组、离心30 min组及离心60 min组(P值均<0.05);④CD3/CD28磁珠与rhIL-2联合对人T细胞活化扩增效率个体差异显著,根据扩增倍数优化个体转染时机可提高转染效率(最高达69.3%),且RT-PCR检测证实CD19-CAR目的基因在转染后72 h T细胞中高效特异性转录;⑤CD19-CAR-T细胞与CD19-K562细胞共培养组IFN-γ、TNF-α表达水平均增加,分别为(13 230±1 543)pg/ml、(4 217±211)pg/ml,与阴性对照组比较差异均有统计学意义(P值均<0.01)。
结论
通过MigR1-CD19-CAR逆转录病毒载体转染人原代T细胞,并通过延长离心转染时间、根据扩增倍数确定个体转染时机而成功优化转染效率,RT-PCR检测CD19-CAR目的基因在转染后人T细胞中高效特异性转录,CD19-CAR-T细胞特异性识别靶细胞引发IFN-γ、TNF-α表达水平增加。
Keywords: 受体,抗原, 质粒,MigR1, 转染, T淋巴细胞, 细胞因子类
Abstract
Objective
To improve the MigR1-CD19-CAR (chimeric antigen receptor) that contains a single chain variable region (scFv) which targeted to CD19 through a retroviral vector transduction efficiency of T-lymphocytes.
Methods
Insert the CD19-CAR fragment into the retroviral vector (MigR1) through recombinant DNA technology, after transfecting plat-A packaging cell lines, viral supernatant was collected to transduce K562 cell line and activated human T-lymphocytes. We used flow cytometry to determine the transduction efficiency and RT-PCR to confirm the transcription of CD19-CAR gene. The ability of the transduced T cells to produce IFN-γ and TNF-α in a CD19-specific manner was measured in an enzyme-linked immunosorbent (ELISA) assay.
Results
①Using MigR1-CD19-CAR retroviral vector to produce the high titer retrovirus. ②MigR1-CD19-CAR transduction efficiency of K562 cell line was significantly higher than human T-lymphocytes (P<0.01). ③120 min centrifugation could significantly improve transduction efficiency of T-lymphocytes to (54.5±14.6)%. ④Transduction efficiency could be improved by deciding transduce time according to T-lymphocytes proliferation fold in vitro individually, and the highest transduction efficiency in the study was 69.3%. The CD19-CAR gene sequence was transcripted specificly with high efficiency. ⑤IFN-γ and TNF-α released by CD19-CAR transduced T-lymphocytes significantly increased to (13 230±1 543) pg/ml and (4 217±211) pg/ml when coculture with CD19-K562 cells.
Conclusion
We have successfully constructed a second generation CAR which targeted to CD19 through a retroviral vector called MigR1 (MigR1-CD19-CAR). Deciding transduce time according to T-lymphocytes proliferation fold in vitro individually and 120 min centrifugation could improve the CAR transduction efficiency of T-lymphocytes. RT-PCR confirmed that the CD19-CAR gene was specificly transcripted with high efficiency. IFN-γ and TNF-α released by CD19-CAR transduced T-lymphocytes significantly increased when activated by target cells.
Keywords: Receptors, antigen; Plasmids, MigR1; Transfection; T-Lymphocyte; Cytokine
嵌合抗原受体(CAR)由单克隆抗体(单抗)的单链可变区片段(scFv)通过铰链区与T细胞抗原受体(TCR)复合体中的ζ链或Fc受体(FcR)复合体中的γ信号肽融合而成。CAR的抗原识别完全由单抗的性质决定,不受主要组织相容性复合物(MHC)的限制,抗原结合信号经ζ链或γ信号肽激活T细胞,即成为肿瘤特异性杀伤细胞用于肿瘤患者的治疗[1]–[5]。国外多项研究已应用不同载体系统成功构建不同结构的CD19-CAR表达载体并成功转染T细胞,部分在体内外证实这种转基因T细胞(CAR-T)可特异性有效杀灭表达CD19的恶性血液肿瘤细胞[6]–[9]。然而,T细胞是原代悬浮生长细胞,转染难度较高,目前国外报道最高转染效率仅70%~80%[6]–[8]。本研究我们利用MigR1质粒构建CD19-CAR逆转录病毒载体,从不同转染条件及T细胞体外活化扩增效率个体差异等方面对T细胞转染效率进行优化。
对象和方法
1.主要试剂和仪器:MigR1表达质粒由美国Temple大学张怡博士惠赠,FBS、RPMI 1640、DMEM培养液、TRIzol、Lipofectamine 3000、PCR及RT-PCR试剂盒均为美国Invitrogen公司产品,X-Vivo 15淋巴细胞培养液为瑞士Lonza公司产品,CD3/CD28磁珠购自德国Miltenyi公司,重组人IL-2(rhIL-2)购自美国PeproTech公司,无内毒素质粒大抽试剂盒购自天根生化科技(北京)有限公司,多聚季铵盐购自上海翊圣生物科技有限公司,SYBRGreen RT-PCR试剂购自宝生物工程(大连)有限公司,ELISA试剂盒购自美国eBioscience公司。FACS Cabilum流式细胞仪购自美国Beckton Dickson公司,荧光倒置显微镜购自日本Olympus公司。Varioskan Flash多功能读数仪为美国Thermo Scientific公司产品。
2.细胞来源及培养:采集5名均签署知情同意书健康成人志愿者外周血标本,采用Ficoll-Hapaque密度梯度离心法分离外周血单个核细胞(PBMC),培养于含5% FBS的X-Vivo 15培养基中;K562、Raji及CD19-K562(由本实验室构建,经验证CD19阳性率达99.8%)细胞系由本实验室保存,均培养于含10%FBS的RPMI 1640培养液中;Plat-A包装细胞系由同济大学生命科学院康九红教授惠赠,培养于含10% FBS的DMEM培养液中。所有细胞均在37 °C、5% CO2孵育箱中培养,取对数生长期细胞进行实验。
3.淋巴细胞活化扩增:调整PBMC细胞密度为2.5×105/ml,按磁珠细胞比为1∶2加入CD3/CD28磁珠体外活化3 d,第4天加入150 U/ml rhIL-2,于37 °C、5% CO2孵育箱中扩增2 d。经流式细胞术验证CD3阳性率均>98%。
4.逆转录病毒载体构建及病毒上清制备:参照文献[9]构建MigR1-CD19-CAR、CD19-MigR1逆转录病毒载体。应用脂质体转染法(Lipo3000)分别将MigR1-CD19-CAR逆转录病毒载体转入Plat-A包装细胞系,培养72 h时收集病毒上清。
5.不同离心条件转染细胞:取对数生长期K562细胞系,调整细胞密度为1×105/ml,加入感染复数(MOI)=200的新鲜病毒液及多聚季铵盐5 µg/ml,32 °C、1 800 r/min(离心半径18.76 cm)离心30 min。取例3、例5活化后T细胞,调整细胞密度为1×105/ml,加入新鲜病毒液(MOI=200)及多聚季铵盐5 µg/ml,随机分为4组,分别以32 °C、1 800 r/min条件离心0、30、60、120 min。每组设3个复孔,实验重复3次。转染后细胞均置37 °C、CO2孵箱培养。
6.流式细胞术检测MigR1-CD19-CAR在K562细胞系及T细胞中的转染效率:收集经病毒转染72 h后K562细胞系及各离心组T细胞,PBS洗涤2次后弃上清,参照抗体说明书分别加入APC-anti-CD3及anti-mouse IgG(H+L), F(ab′)2单抗避光30 min后PBS洗涤、重悬,过膜后上流式细胞仪检测。各组均设3个复管,实验重复3次。
7.RT-PCR检测CD19-CAR在转染后T细胞中表达:设计分别针对scFv片段、跨scFv末端酶切位点至CD28片段、跨CD28末端酶切位点至TCR片段的上下游引物。PCR体系共15 µl,含SYBRGreen荧光染料7.5 µl、上下游引物各0.5 mmol、cDNA样本0.8 µl、H2O 5.7 µl。PCR条件:95°C 15 s,60 °C 1 min,共40个循环。β-actin为内参。各组基因相对表达水平以2–ΔΔCt表示。
8.ELISA法检测IFN-γ、TNF-α表达水平:取例3转染后CD19-CAR的T细胞,调整细胞密度为1×105,按效靶比为1∶1分别与CD19-K562细胞系、MigR1-K562细胞系、K562细胞系组共培养,并设同一供者相同细胞密度但仅含CAR-T细胞组、仅含活化增殖后T细胞组,培养24 h后收集上清,根据ELISA试剂盒中说明书检测IFN-γ、TNF-α表达水平,于Varioskan Flash多功能读数仪读取实验数据。每组设3个复孔,实验重复3次。
9.统计学处理:应用SPSS 19.0软件进行统计分析。数据均符合正态分布,满足方差齐性,以x±s表示。K562细胞系与人原代T细胞转染效率比较采用独立样本t检验,不同离心时间T细胞转染效率比较及IFN-γ、TNF-α表达水平比较采用单因素方差分析。P<0.05为差异有统计学意义。
结果
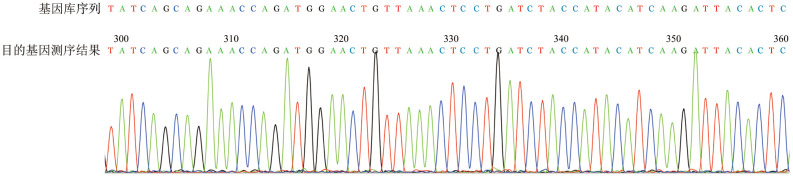
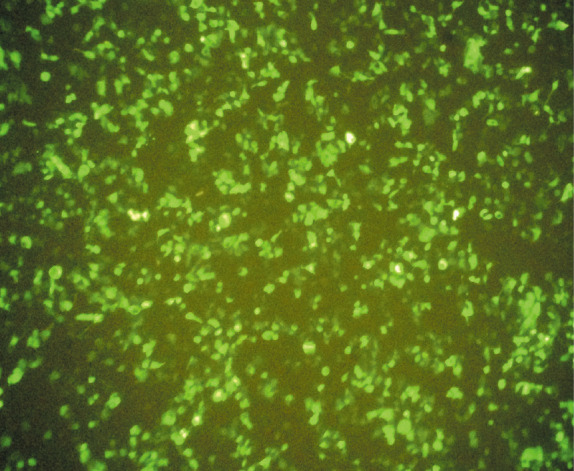
1.MigR1-CD19-CAR逆转录病毒载体构建:本实验所用二代CAR表达载体MigR1-CD19-CAR逆转录病毒载体结构示意图见图1,构建后挑选阳性克隆进行测序(部分结果如图2),经验证目的基因序列与基因库序列完全一致。荧光倒置显微镜下观察到Plat-A包装细胞的增强绿色荧光蛋白(eGFP)荧光亮度比例大于95%(图3),应用有限稀释法测定病毒滴度,经MigR1-CD19-CAR逆转录病毒转染NIH-3T3细胞,由anti-mouse IgG(H+ L),F(ab′)2抗体标记,测得病毒滴度为(5.43~7.34)×107CFU/ml。
图1. MigR1-CD19-CAR逆转录病毒载体结构示意图.
LTR:长末端重复序列;ψ:包装信号;SD:剪接供体;SA:剪接受体;VL:免疫球蛋白轻链可变区;VH:免疫球蛋白重链可变区;scFv:单链可变区片段;ζ-Chain:T细胞抗原受体-ζ链;IRES:内部核糖体进入位点;eGFP:绿色荧光蛋白
图2. MigR1-CD19-CAR逆转录病毒载体的阳性克隆部分测序结果.
图3. MigR1-CD19-CAR逆转录病毒载体转染后48 h的Plat-A包装细胞(×100).
2.K562细胞系及T细胞转染效率与eGFP表达率:相同滴度病毒转染72 h后,K562细胞系目的基因转染效率为(80.0±4.4) %,而T细胞转染效率为(25.1±5.8)%,差异有统计学意义(P<0.01)。K562细胞系中eGFP高表达,表达率为(74.2±3.2)%;而T细胞中eGFP不能有效表达,表达率仅为(0.9±0.5)%,无法提示目的基因的表达。
3.离心不同时间T细胞转染效率:CD19-CAR阳性率:未离心组CD19-CAR-T细胞阳性率为(26.6±6.2)%,离心30、60及120 min组CD19-CART细胞阳性率分别为(25.1±5.8)%、(30.8±5.5)%及(54.5±14.6)%。离心120 min组与其他各组比较差异均有统计学意义(P值均<0.05),而其他各组组间比较差异均无统计学意义(P值均>0.05)。提示离心120 min可有效提高T细胞转染效率。
4.CD3/CD28磁珠联合rhIL-2对T细胞活化扩增效率的个体差异及优化个体转染时机:纳入的5名健康志愿者(表1),以体外培养第6、9、12天的淋巴细胞扩增倍数评价活化扩增效率,第6天时扩增效率大于6倍的样本3、4、5实现MigR1-CD19-CAR逆转录病毒对T细胞的高效转染,转染效率最高的复孔结果达69.3%,而第6天时扩增效率小于2.5倍的样本1、2则分别转染效率较低。于第9天(扩增效率大于6倍时)对样本1、2再次进行MigR1-CD19-CAR逆转录病毒转染(未曾转染样本),转染效率最高的复孔结果分别提升至32.8%和64.7%。实验证实T细胞体外经CD3/CD28磁珠联合rhIL-2扩增后,扩增倍数存在明显个体差异,根据T细胞扩增倍数优化个体转染时机可实现MigR1-CD19-CAR逆转率病毒对T细胞的高效转染。经针对scFv片段、跨scFv末端酶切位点至CD28片段、跨CD28末端酶切位点至TCR片段的3组上下游引物进行RT-PCR鉴定,MigR1-CD19-CAR转染T细胞(表1中样本3、5,每组引物各设3个复孔)72 h后证实CD19-CAR目的基因在转染的人T细胞中特异性转录。
表1. 5名健康志愿者特征及T细胞扩增/转染效率.
| 序号 | 性别 | 年龄(岁) | 体表面积(m2) | 淋巴细胞比例(%) | ALC(×109/L) | T细胞扩增效率(%) |
CD 19-CAR-T转染率(%) |
||
| 第6天 | 第9天 | 第12天 | 第6天 | ||||||
| 1 | 男 | 27 | 1.92 | 31.95 | 2.01 | 2.3 | 15.2 | 165.2 | 17.6a |
| 2 | 女 | 26 | 1.59 | 42.52 | 2.33 | 1.4 | 6.8 | 39.1 | 3.8a |
| 3 | 男 | 28 | 1.71 | 26.97 | 1.68 | 8.1 | 24.1 | 187.5 | 69.3 |
| 4 | 男 | 29 | 1.62 | 32.41 | 1.98 | 7.2 | 17.5 | 134.2 | 58.6 |
| 5 | 女 | 27 | 1.67 | 32.98 | 3.13 | 6.3 | 14.3 | 107.1 | 44.7 |
注:a:扩增效率较低,继续体外培养至第9天进行转染,转染率分别提升至64.7%、32.8%;ALC:淋巴细胞绝对值
5.CD19-CAR-T与CD19-K562效靶细胞共培养后IFN-γ、TNF-α表达水平:CAR-T与CD19-K562共培养组IFN-γ表达水平为(13 230±1 543)pg/ml,较后四组显著增加,差异有统计学意义(P<0.01),CAR-T与MigR1-K562组[(2 486±69)pg/ml]、CAR-T与K562组[(2 615±241)pg/ml]、CAR-T组[(2777±430)pg/ml]、T细胞组[(1 861±799) pg/ml]两两之间差异均无统计学意义(P值均>0.05)。CAR-T与CD19-K562共培养组TNF-α表达水平为(4 217±211)pg/ml,较后四组显著增加,差异有统计学意义(P<0.01),CAR-T与MigR1-K562组[(942±70)pg/ml]、CAR-T与K562组[(986±136)pg/ml]、CAR-T组[(871±118)pg/ml]、T细胞组[(780±74) pg/ml]两两之间差异均无统计学意义(P值均>0.05)。
讨论
近年来随着基因重组及细胞转染技术的进展,作为细胞免疫治疗之一的CAR技术发展迅速。宾夕法尼亚大学[6]、斯隆-凯特琳癌症纪念中心(MSKCC)[7]–[8]、美国国立卫生研究院(NIH)[9]分别应用3种结构不同的CD19-CAR载体转染T细胞,证实CAR-T细胞可特异、有效杀灭表达CD19的复发难治急性淋巴细胞白血病、慢性淋巴细胞白血病及滤泡淋巴瘤等血液系统恶性肿瘤细胞,使患者达到形态学完全缓解[10]–[12]。
本研究中,我们首次选用MigR1逆转录病毒表达质粒构建含T细胞活化所需共刺激分子CD28的二代CD19-CAR载体,MigR1质粒由MSCV(mouse stem cell virus based splice-gag vector)、eGFP、内部核糖体进入位点(Internal ribosome entry site,IRES)三者构成,多用于鼠类特定基因表达载体的构建[13]。IRES常构建于真核生物双顺反子中间,可使第一个蛋白靠5′帽子结构起始翻译,而第二个蛋白则依靠IRES起始翻译,于同一载体中协同表达两个目的基因[14]。NIH报道中应用即为MSCV逆转录病毒表达质粒[9],而本实验验证MigR1可成功转染病毒包装细胞、NIH-3T3工具细胞并同时稳定表达eGFP,因而相较MSCV存在下列应用优势:①便于荧光倒置显微镜下观察包装细胞的绿色荧光而及时评价产毒效力,利于收集高滴度病毒原液;②病毒原液按比例稀释后转染NIH-3T3细胞48 h后即可表达较强荧光,阳性细胞可直接通过流式细胞术检测从而计算病毒滴度;③避免为加入eGFP而进行共转染,省去共转染过程及其中可能产生的各种问题。然而MigR1表达质粒基因序列中并不含有药物筛选基因,故为转染目的细胞后筛选高表达目的基因的稳转株带来一定困难,但同时也避免了同一逆转录病毒载体中药物筛选基因和目的基因所携带启动子间一定程度上的相互干扰。
离心转染法是一种通过增加病毒和靶细胞接触从而提高转染率的常用方法,国内外各项报道所用离心条件不尽相同。Bahnson等[16]应用悬浮的人造血细胞(富集后CD34+细胞)讨论离心力和离心温度对转染率影响。研究显示离心温度为室温时较佳,而静息状态及离心力小于1 000×g时,靶细胞表面病毒受体与病毒的结合力小于离解力,当离心力大于12 000×g时,病毒出现成团倾向不利于转染,唯有离心力为(1 500~10 000)×g时转染率随离心力增加而增加。Bunnell等[17]报道离心转染人外周血淋巴细胞时离心力为1 000×g,离心温度32°C,转染率可达15%~33%。本实验通过探讨离心力(1 800 r/min)、离心温度(32°C)、病毒滴度[(5.43~7.34)×107 CFU/ml]一定时,离心时间对T细胞转染效率影响,明确未离心、离心30 min与离心60 min三种转染方式转染效率并差异无统计学意义,而离心120 min显著提高转染效率。
T细胞属原代血液系统细胞,无法于体外增殖,无外界细胞因子作用下仅能短期(3~4 d)体外培养。本实验应用CD3/CD28磁珠与rhIL-2联合体外活化扩增人T细胞[4]–[5],[17]–[18],共纳入5名健康供者,证实此体外活化扩增法在体外扩增效率、使T细胞进入快速增殖期所需时间方面存在明显个体差异,5名供者体外培养第12天时,扩增效率分别为165.2%、39.1%、187.5%、134.2%、107.1%。逆转录病毒载体介导的基因转染有赖于靶细胞处于细胞增殖状态,因而明确此体外活化扩增法使T细胞进入快速增殖期所需时间的个体差异,对于提高个体淋巴细胞转染效率存在重要意义。而以往国外文献中进行转染的统一时间,如NIH[9]报道中体外活化扩增第2天时转染(并于第3天重复转染),并非针对个体的最佳转染时机,必然导致部分个体T细胞转染效率有所降低,以致影响后续临床应用。鉴于本研究目前纳入研究例数较少,尚需进一步扩大研究例数并结合统计学方法分析得出此体外活化扩增法个体差异与体重、身高、性别、外周血白细胞计数、T细胞比例等影响因素间关系,以便更好指导今后CAR-T技术的临床应用。
MSKCC、NIH、宾夕法尼亚大学等机构在应用CAR-T技术过程中均采用RetroNectin提高病毒对T细胞的转染效率[6]–[9]。RetroNectin (Recombinant Human Fibronectin Fragment)即重组人纤维连接素片断,其包括细胞结合域,肝磷脂结合域和CS1位点三个功能区域,而细胞表面VLA-4及VLA-5可分别与RetroNectin上的CS-1位点、细胞结合域结合,逆转录病毒载体可以与肝磷脂结合域结合。在经RetroNectin包被的培养容器表面,细胞与病毒载体以高浓度共存,从而提高基因转染效率。且后续研究证实经细胞因子刺激后的靶细胞表面VLA-4、VLA-5表达增加,可进一步提高转染效率[15]。本实验通过独立包装新鲜未冻存的高病毒滴度病毒原液转染T细胞,并未应用RetroNectin,转染效率最高可达到69.3%,与NIH应用RetroNectin进行转染所报道最高转染效率76.77%[9]较接近,从而起到优化转染效率、节省实验成本目的。
如前所述,本实验中MigR1表达载体结构中IRES位于目的基因与eGFP基因之间,即目的基因靠mRNA 5′帽子结构起始翻译,而eGFP则依靠IRES起始翻译,IRES前后的两个蛋白的表达通常是成比例的,但IRES活性与所应用细胞系有关,存在eGFP基因、目的基因表达一强一弱或者一者不表达可能。本实验中构建的MigR1-CD19-CAR载体,使病毒包装细胞系、K562细胞系均强烈表达eGFP且不影响目的基因的表达,而在淋巴细胞中eGFP表达均不超过2%,而CD19-CAR目的基因则可高效表达,上述结果显示了IRES活性在人原代淋巴细胞中受抑制,需在今后的研究中继续改进。
CD19-CAR-T与CD19-K562效靶细胞共培养后,IFN-γ、TNF-α释放显著增加,证实CD19-CAR转染后T细胞可特异性识别CD19靶抗原进而引起细胞因子大量释放,为今后的临床应用奠定基础。我们将于后续详细报道CD19-CAR-T的体内外杀伤作用。
综上所述,本实验成功优化含CD28共刺激分子、靶向CD19抗原的二代MigR1-CD19-CAR逆转录病毒载体对人原代T细胞的转染效率,最高至69.3%,RT-PCR检测验证CD19-CAR目的基因在转染后人T细胞中特异性表达,并证实CD19-CAR转染后T细胞可特异性识别CD19靶抗原进而引起细胞因子IFN-γ、TNF-α大量释放。
Funding Statement
基金项目:国家自然科学基金(81470322、81172249)
References
- 1.Brentjens RJ, Santos E, Nikhamin Y, et al. Genetically targeted T cells eradicate systemic acute lymphoblastic leukemia xenografts[J] Clin Cancer Res. 2007;13(18 Pt 1):5426–5435. doi: 10.1158/1078-0432.CCR-07-0674. [DOI] [PubMed] [Google Scholar]
- 2.Sadelain M, Brentjens R, Rivière I. The promise and potential pitfalls of chimeric antigen receptors[J] Curr Opin Immunol. 2009;21(2):215–223. doi: 10.1016/j.coi.2009.02.009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Jena B, Dotti G, Cooper LJ. Redirecting T-cell specificity by introducing a tumor-specific chimeric antigen receptor[J] Blood. 2010;116(7):1035–1044. doi: 10.1182/blood-2010-01-043737. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Li S, Yang J, Urban FA, et al. Genetically engineered T cells expressing a HER2-specific chimeric receptor mediate antigenspecific tumor regression[J] Cancer Gene Ther. 2008;15(6):382–392. doi: 10.1038/cgt.2008.5. [DOI] [PubMed] [Google Scholar]
- 5.Yang J, Friedman MS, Huben MT, et al. In vivo anti-tumor activity of murine hematopoietic stem cells expressing a P185HER2-specific chimeric T-cell receptor gene[J] J Microbiol Immunol. 2006;4(2):117–124. [Google Scholar]
- 6.Grupp SA, Kalos M, Barrett D, et al. Chimeric antigen receptormodified T cells for acute lymphoid leukemia[J] N Engl J Med. 2013;368(16):1509–1518. doi: 10.1056/NEJMoa1215134. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Brentjens RJ, Rivière I, Park JH, et al. Safety and persistence of adoptively transferred autologous CD19-targeted T cells in patients with relapsed or chemotherapy refractory B-cell leukemias[J] Blood. 2011;118(18):4817–4828. doi: 10.1182/blood-2011-04-348540. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Brentjens RJ, Davila ML, Riviere I, et al. CD19-targeted T cells rapidly induce molecular remissions in adults with chemotherapy-refractory acute lymphoblastic leukemia[J] Sci Transl Med. 2013;5(177):177ra38. doi: 10.1126/scitranslmed.3005930. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Kochenderfer JN, Feldman SA, Zhao Y, et al. Construction and preclinical evaluation of an anti-CD19 chimeric antigen receptor[J] J Immunother. 2009;32(7):689–702. doi: 10.1097/CJI.0b013e3181ac6138. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Brentjens RJ, Rivière I, Park JH, et al. Safety and persistence of adoptively transferred autologous CD19-targeted T cells in patients with relapsed or chemotherapy refractory B-cell leukemias[J] Blood. 2011;118(18):4817–4828. doi: 10.1182/blood-2011-04-348540. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Topp MS, Kufer P, Gökbuget N, et al. Targeted therapy with the T-cell-engaging antibody blinatumomab of chemotherapy-refractory minimal residual disease in B-lineage acute lymphoblastic leukemia patients results in high response rate and prolonged leukemia-free survival[J] J Clin Oncol. 2011;29(18):2493–2498. doi: 10.1200/JCO.2010.32.7270. [DOI] [PubMed] [Google Scholar]
- 12.Kalos M, Levine BL, Porter DL, et al. T cells with chimeric antigen receptors have potent antitumor effects and can establish memory in patients with advanced leukemia[J] Sci Transl Med. 2011;3(95):95ra73. doi: 10.1126/scitranslmed.3002842. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Pear WS, Miller JP, Xu L, et al. Efficient and rapid induction of a chronic myelogenous leukemia-like myeloproliferative disease in mice receiving P210 bcr/abl-transduced bone marrow[J] Blood. 1998;92(10):3780–3792. [PubMed] [Google Scholar]
- 14.Sugimoto Y, Aksentijevich I, Gottesman MM, et al. Efficient expression of drug-selectable genes in retroviral vectors under control of an internal ribosome entry site[J] Biotechnology (N Y) 1994;12(7):694–698. doi: 10.1038/nbt0794-694. [DOI] [PubMed] [Google Scholar]
- 15.Bunnell BA, Muul LM, Donahue RE, et al. High-efficiency retroviral-mediated gene transfer into human and nonhuman primate peripheral blood lymphocytes[J] Proc Natl Acad Sci U S A. 1995;92(17):7739–7743. doi: 10.1073/pnas.92.17.7739. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Bahnson AB, Dunigan JT, Baysal BE, et al. Centrifugal enhancement of retroviral mediated gene transfer[J] J Virol Methods. 1995;54(2-3):131–143. doi: 10.1016/0166-0934(95)00035-s. [DOI] [PubMed] [Google Scholar]
- 17.Yang J, Friedman MS, Reynolds CM, et al. Tumor antigen specific activation of primary human T-cells expressing a virally encoded chimeric T-cell receptor specific for p185HER2[J] J Microbiol Immunol. 2004;2(4):272–277. [Google Scholar]
- 18.Yang J, Friedman MS, Bian H, et al. Highly efficient genetic transduction of primary human synoviocytes with concentrated retroviral supernatant[J] Arthritis Res. 2002;4(3):215–219. doi: 10.1186/ar409. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Hanenberg H, Hashino K, Konishi H, et al. Optimization of fibronectin-assisted retroviral gene transfer into human CD34+ hematopoietic cells[J] Hum Gene Ther. 1997;8(18):2193–2206. doi: 10.1089/hum.1997.8.18-2193. [DOI] [PubMed] [Google Scholar]