人参是我国传统中药,其主要药理成分人参皂苷具有抗白血病作用[1]–[4]。人参皂苷Rh4是一类仅结合1个糖基的人参三醇型皂苷,属于低极性人参皂苷,具有适中的肠吸收极性,更易进入体内发挥作用,具备较其他多糖基皂苷更高的生物利用度[5]。Rh4具有抗黑色素瘤、抑制黑色素合成的作用[6],对白血病细胞系P388细胞和L1210细胞具有细胞毒活性[7]。本研究中我们观察人参皂苷Rh4对白血病细胞系株K562细胞增殖及分化的作用,现报道如下。
材料和方法
1.药物及主要试剂:人参皂苷Rh4(批号111109)由上海融禾医药科技有限公司分离制备,纯度>98%。分子式:C36H60O8,相对分子质量620.87. IMDM培养基购自美国Gibco公司,小牛血清购自杭州四季青公司,四氮唑蓝(MTT)购自美国Amresco公司,PE标记的小鼠抗人CD11b、CD14和CD42b抗体购自美国BD公司。
2.细胞来源及培养:K562细胞购自中国科学院上海细胞所,接种至含10%小牛血清的IMDM完全培养基,置于37 °C、5% CO2饱和湿度培养箱中培养,每2 d换液传代1次,取对数生长期细胞用于后续实验。
3.MTT法检测细胞增殖抑制率:K562细胞以1×105/ml密度接种于96孔板内,每孔100 µl,随机分为8组,分别加入终浓度为0、10、25、50、75、100、150、200 mg/L的Rh4溶液100 µl,每组设3个复孔,同时以不含细胞的培养液为空白对照。置于37°C、5% CO2饱和湿度条件下培养,于培养48和72 h加入MTT(5 mg/ml)20 µl,孵育4 h,吸去上清,每孔再加入200 µl DMSO,摇床上振摇10 min,在酶标仪490 nm波长测定各孔吸光度(A)值,根据公式计算细胞增殖抑制率。实验重复6次。
4.半固体集落生成实验:调整K562细胞密度为1×104/ml,随机分为6组,分别加入终浓度为0、10、25、50、75、100 mg/L的Rh4溶液,在2 ml含30%小牛血清、1% L-谷氨酰胺、100 U青/链霉素、3 g/L琼脂的IMDM培养体系中培养,接种于24孔板内,每孔0.5 ml,置于37 °C、5%CO2饱和湿度培养箱中培养7 d。于倒置显微镜下计数集落数(≥40个细胞定义为1个集落)。每组设3个复孔,实验重复6次。
5.流式细胞术检测细胞周期:取Rh4 25、50、100 mg/L处理的2×105细胞,冷PBS洗涤1次,离心去上清,加入0.5 ml含PI和RNase A的DNA染液,室温避光孵育30 min,上流式细胞仪检测。实验重复3次。应用Multicycle软件分析细胞周期,并计算亚二倍体峰的百分率,同时计算细胞增殖指数。
6.流式细胞术检测白血病细胞分化相关表型:取经终浓度为25、50 mg/L的Rh4处理7 d的K562细胞,每管含1×105细胞,分别与细胞分化相关抗体包括鼠抗人CD11b-PE、CD14-PE和CD42b-PE, 4 °C避光孵育30 min,每种抗体设置同型对照。PBS洗涤1次,100 µl PBS重悬细胞,上流式细胞仪检测相关抗原阳性细胞率。实验重复3次。
7.统计学处理:采用SPSS 17.0软件进行统计学分析。计量数据以x±s表示,各组比较采用方差分析,P<0.05为差异有统计学意义。
结果
1.Rh4对K562细胞增殖的作用:不同浓度Rh4处理48和72 h后K562细胞增殖抑制率见表1。MTT分析结果显示,Rh4能明显抑制细胞增殖,50~200 mg/L时,抑制率分别为(19.4±3.8)%~(58.8±4.7)%和(18.0±1.9)%~(73.4±1.6)%(P<0.05)。增殖抑制作用呈时间和剂量依赖性。48 h、72 h的IC50值分别为149.47 mg/L和123.86 mg/L。
表1. 不同剂量人参皂苷Rh4抑制K562细胞增殖的作用(x±s,n=6).
| Rh4 (mg/L) | 48 h |
72 h |
||
| 吸光度值 | 增殖抑制率(%) | 吸光度值 | 增殖抑制率(%) | |
| 0 | 0.36±0.06 | 0 | 0.56±0.11 | 0 |
| 10 | 0.34±0.05 | 7.4±1.6 | 0.52±0.10 | 7.8±1.2 |
| 25 | 0.31±0.05 | 15.0±2.9 | 0.47±0.09 | 16.2±1.1 |
| 50 | 0.30±0.06a | 19.4±3.8 | 0.46±0.08a | 18.0±1.9 |
| 75 | 0.26±0.05b | 29.1±4.8 | 0.38±0.08b | 31.8±3.8 |
| 100 | 0.23±0.06b | 36.5±6.3 | 0.33±0.09b | 42.8±6.5 |
| 150 | 0.16±0.03b | 56.6±3.7 | 0.18±0.03b | 68.7±2.5 |
| 200 | 0.15±0.03b | 58.8±4.7 | 0.15±0.03b | 73.4±1.6 |
注:与未加药对照组(0 mg/L)比较,aP<0.05,bP<0.01
2.Rh4抑制K562白血病集落生成的作用:半固体培养体系加入25~100 mg/L的Rh4,处理K562白血病细胞7 d,集落数均明显低于对照组(P<0.01),抑制率(27.3±5.1)%~(80.2±8.2)%。随着剂量的增加,Rh4抑制作用明显增加,呈剂量依赖性(表2)。
表2. 不同剂量人参皂苷Rh4抑制K562细胞集落生成的作用(x±s,n=6).
| Rh4 (mg/L) | 集落数 | 集落抑制率(%) |
| 0 | 117.5±22.2 | 0 |
| 10 | 111.2±20.2 | 5.2±1.5 |
| 25 | 85.6±17.9a | 27.3±5.1 |
| 50 | 62.4±14.4a | 47.0±7.0 |
| 75 | 36.4±13.0a | 69.4±8.7 |
| 100 | 23.2±9.9a | 80.2±8.2 |
注:与未加药对照组(0 mg/L)比较,aP<0.01
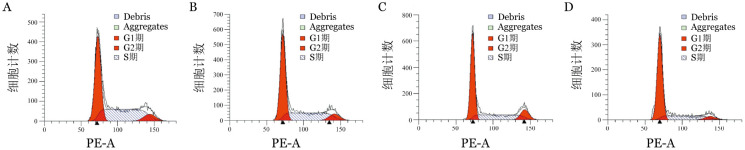
3.Rh4阻滞K562白血病细胞进入增殖周期的作用:流式细胞术显示Rh4能够有效地阻滞K562白血病细胞进入增殖周期,随着Rh4浓度增加,S期细胞比例逐渐降低,而G0/G1期细胞比例则逐渐升高,增殖指数明显下降,从未加药对照组(66.4±0.3)%降至100 mg/L的(37.2±2.8)%(P<0.01),提示Rh4通过阻滞细胞进入增殖周期而抑制白血病细胞增殖(图1)。
图1. 人参皂苷Rh4阻滞K562白血病细胞进入增殖周期的分布.
A:Rh4 0 mg/L;B:Rh425 mg/L;C:Rh450 mg/L;D:Rh4100 mg/L
4.Rh4诱导K562细胞分化的作用:采用25、50 mg/LRh4分别诱导白血病K562细胞7 d,流式细胞术分析粒系分化抗原CD11b、单核系分化抗原CD14和巨核系分化抗原CD42b表达的阳性细胞率。结果显示,50 mg/L明显提高CD11b和CD42b表达阳性的细胞率,分别为(4.4±1.0)%和(24.3± 5.3)%,明显高于对照的(2.6±0.7)%和(3.7±0.6)%(P值均<0.05),提示Rh4能够诱导白血病细胞向多系分化(表3)。
表3. 人参皂苷Rh4诱导K562白血病细胞分化相关表型(x±s,n=3).
| Rh4 (mg/L) | 阳性细胞率(%) |
||
| CD11b | CD14 | CD42b | |
| 0 | 2.6±0.7 | 5.7±1.3 | 3.7±0.6 |
| 25 | 3.2±0.6 | 6.2±1.1 | 12.7±3.3a |
| 50 | 4.4±1.0a | 8.2±2.2 | 24.3±5.3a |
注:与未加药对照组(0 mg/L)比较,aP<0.05
讨论
白血病的生物学特点是细胞增殖失控、分化成熟受阻、正常的凋亡程序失调、异常分化的细胞大量增殖,因此,抑制细胞增殖、诱导异常分化的细胞向成熟或者较成熟细胞方向分化,是白血病的有效治疗方法。目前临床上常用的维甲酸及其衍生物、砷剂、三尖杉酯碱等化疗药物,因不良反应大,应用范围局限,其使用备受争议。人参由于其攻补兼施、毒副作用小或无的特点得到了广泛认可,因此研究中药有效成分抗白血病的作用很有意义。
本研究以K562白血病细胞作为靶细胞,结果显示低极性人参皂苷Rh4能显著抑制K562白血病细胞增殖,半固体培养在25~100 mg/L时,集落抑制率27.3%~80.2%,抑制作用呈剂量依赖关系;用50~200 mg/L的Rh4与K562细胞共孵育48和72 h,用MTT法测定,细胞增殖抑制率分别为19.4%~58.8%和18.0%~73.4%,抑制作用呈时间、剂量依赖关系。提示人参皂苷Rh4能够有效地抑制K562白血病细胞增殖。
细胞周期失控是癌变的重要原因之一,细胞周期有两个重要的时相转换,即G1-S和G2-M,分别为控制进入S期的调控点和控制进入M期的调控点[8]。经Rh4 50、100 mg/L孵育细胞48 h,流式细胞技术分析细胞周期,结果显示S期细胞明显低于未加药对照组,而G0/G1期K562细胞则显著高于对照组,且随着Rh4浓度增加,K562细胞增殖指数由对照组的(66.4±0.3)%分别下降为(49.3±2.2)%和(37.2±2.8)%,提示Rh4能够有效地阻滞K562细胞进入增殖周期,可能是Rh4抑制K562细胞增殖的重要环节。
由于细胞周期阻滞和细胞增殖能力丧失是细胞分化过程中的必要事件及共同特征,Rh4的细胞周期阻滞作用也可能是诱导K562细胞分化的早期必要事件,细胞周期的调控可能参与了细胞的分化进程。细胞表面分化抗原的表达变化是白血病细胞分化为成熟细胞的标志之一。CD11b在原始粒细胞上基本不表达,CD14是一种存在于单核细胞、粒细胞和巨噬细胞等细胞表面的分化抗原,在白血病原始细胞中表达较低,CD42b是巨核系细胞分化相关抗原,当细胞向成熟阶段分化时,以上三者表达均会逐渐升高[9]。本研究中50 mg/L Rh4诱导白血病K562细胞7 d后,CD11b和CD42b表达分别为(4.4±1.0)%和(24.3±5.3)%,明显高于对照组的(2.6±0.7)%和(3.7±0.6)%,CD14表达虽不显著,但较对照组有一定提高。提示Rh4具有诱导K562细胞向粒系和巨核系分化的趋向,同时可能对K562细胞向单核系分化有一定的促进趋向。
当前低极性人参皂苷的研究报道较少,Rh4属于低极性人参皂苷单体。低极性人参皂苷包括二醇型人参皂苷Compund K、Rg3、Rg5、Rk1、Rh2;三醇型人参皂苷Rg2、Rg6、F4、Rh1、Rh4、Rk3等,存在于野山参、红参、人参果等,但含量较低。现代药理学研究证明低极性人参皂苷具有较强的活性,包括抗肿瘤、益智、免疫调节、抗病毒及抗脑缺血等重要功能[10]–[13]。本研究结果表明,低极性人参皂苷Rh4能够有效地抑制白血病K562细胞增殖、阻滞细胞进入增殖周期,具有诱导其向粒系和巨核系分化的趋向,为Rh4抗白血病的研究提供了实验依据,其诱导分化的作用机制尚待进一步深入研究。
Funding Statement
基金项目:国家自然科学基金(81373876);浙江省自然科学基金(LY14H290003、LY14H290004);浙江省中医药科技计划(2013ZA037);浙江省教育厅科研项目(Y201326871)
References
- 1.You ZM, Zhao L, Xia J, et al. Down-regulation of phosphoglucose isomerase/autocrine motility factor enhances gensenoside Rh2 pharmacological action on leukemia KG1α cells[J] Asian Pac J Cancer Prev. 2014;15(3):1099–1104. doi: 10.7314/apjcp.2014.15.3.1099. [DOI] [PubMed] [Google Scholar]
- 2.Zeng D, Wang J, Kong P, et al. Ginsenoside Rg3 inhibits HIF-1α and VEGF expression in patient with acute leukemia via inhibiting the activation of PI3K/Akt and ERK1/2 pathways[J] Int J Clin Exp Pathol. 2014;7(5):2172–2178. [PMC free article] [PubMed] [Google Scholar]
- 3.Li J, Wei Q, Zuo GW, et al. Ginsenoside Rg1 induces apoptosis through inhibition of the EpoR-mediated JAK2/STAT5 signalling pathway in the TF-1/Epo human leukemia cell line[J] Asian Pac J Cancer Prev. 2014;15(6):2453–2459. doi: 10.7314/apjcp.2014.15.6.2453. [DOI] [PubMed] [Google Scholar]
- 4.Chen Y, Xu Y, Zhu Y, et al. Anti-cancer effects of ginsenoside compound k on pediatric acute myeloid leukemia cells[J] Cancer Cell Int. 2013;13(1):24. doi: 10.1186/1475-2867-13-24. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.杨 鑫宝, 杨 秀伟, 刘 建勋. 人参中皂苷类化学成分的研究[J] 中国现代中药. 2013;15(5):350–357. [Google Scholar]
- 6.Jeong YM, Oh WK, Tran TL, et al. Aglycone of Rh4 inhibits melanin synthesis in B16 melanoma cells: possible involvement of the protein kinase A pathway[J] Biosci Biotechnol Biochem. 2013;77(1):119–125. doi: 10.1271/bbb.120602. [DOI] [PubMed] [Google Scholar]
- 7.Baek NI, Kim DS, Lee YH, et al. Ginsenoside Rh4, a genuine dammarane glycoside from Korean red ginseng[J] Planta Med. 1996;62(1):86–87. doi: 10.1055/s-2006-957816. [DOI] [PubMed] [Google Scholar]
- 8.郭 秀伟, 张 培彤, 杨 栋, et al. 苏木含药血清对人肺癌PG细胞增殖周期影响的对比研究[J] 中国中西医结合杂志. 2014;34(6):745–750. [PubMed] [Google Scholar]
- 9.谢 朝阳, 吴 斌华, 杨 志刚, et al. 原花青素诱导HL-60细胞分化及其机制的研究[J] 中国实验血液学杂志. 2013;21(4):920–925. doi: 10.7534/j.issn.1009-2137.2013.04.021. [DOI] [PubMed] [Google Scholar]
- 10.Kim MJ, Yun H, Kim DH, et al. AMP-activated protein kinase determines apoptotic sensitivity of cancer cells to ginsenoside-Rh2[J] J Ginseng Res. 2014;38(1):16–21. doi: 10.1016/j.jgr.2013.11.010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Kim SS, Jang HJ, Oh MY, et al. Ginsenoside Rg3 enhances islet cell function and attenuates apoptosis in mouse islets[J] Transplant Proc. 2014;46(4):1150–1155. doi: 10.1016/j.transproceed.2013.12.028. [DOI] [PubMed] [Google Scholar]
- 12.Nah SY. Ginseng ginsenoside pharmacology in the nervous system: involvement in the regulation of ion channels and receptors[J] Front Physiol. 2014;5:98. doi: 10.3389/fphys.2014.00098. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Lee B, Sur B, Park J, et al. Ginsenoside rg3 alleviates lipopolysaccharide-induced learning and memory impairments by anti-inflammatory activity in rats[J] Biomol Ther (Seoul) 2013;21(5):381–390. doi: 10.4062/biomolther.2013.053. [DOI] [PMC free article] [PubMed] [Google Scholar]