Abstract
目的
评价阿那格雷治疗原发性血小板增多症(ET)的有效性和安全性。
方法
将符合WHO 2008诊断标准的ET患者随机分配到阿那格雷组和羟基脲组。阿那格雷由2 mg/d始逐渐增加,最大剂量为10 mg/d,维持PLT(100~400)×109/L 1个月后,逐渐减量维持。羟基脲由1 000 mg/d逐渐增加,维持PLT(100~400)×109/L 1个月后,减量至10 mg·kg−1·d−1维持。共观察12周。
结果
17个中心共入组222例ET患者(阿那格雷组、羟基脲组分别为113、109例),198例可评价疗效(阿那格雷组、羟基脲组分别为97、101例)。治疗12周,阿那格雷组血液学缓解率为87.63%(85/97),羟基脲组为88.12%(89/101),差异无统计学意义(P=0.174)。阿那格雷组治疗前中位PLT为827(562~1 657)×109/L,治疗12周为400(127~1 130)×109/L,差异有统计学意义(P<0.001)。阿那格雷组治疗后PLT降低值中位数为393(−362~1 339)×109/L,羟基脲组为398(−579~1 846)×109/L,差异无统计学意义(P=0.982)。阿那格雷组、羟基脲组中位起效时间分别为7(3~14)、21(14~28) d,差异有统计学意义(P=0.003)。阿那格雷组不良事件发生率为65.49%(74/113),包括心悸(36.28%)、头痛(21.24%)、乏力(14.16%)和头晕(11.50%)等,均为Ⅰ~Ⅱ级。
结论
盐酸阿那格雷胶囊治疗ET的血液学缓解率与羟基脲相近,不良事件发生率相似,起效时间较短,无明显血液学毒性,安全性较好。
Keywords: 血小板增多,原发性, 阿那格雷, 羟基脲, 治疗,临床研究性, 药物毒性
Abstract
Objective
To evaluate the efficacy and safety of anagrelide in essential thrombocythemia (ET).
Methods
Patients who diagnosed as ET according to the World Health Organization classification were enrolled. Each patient was assigned to take anagrelide hydrochloride capsule or hydroxyurea tablet by random 1∶1 ratio. Dose of anagrelide started at 2 mg/d, then increased gradually and the maximum dose was 10 mg/d until the platelet counts dropped to (100–400)×109/L, one month later gradually reduced to maintain dose. The dose of hydroxyurea was 1000 mg/d at beginning, then increased gradually, when platelet counts dropped to (100–400)×109/L and kept for one month, reduced to maintain dose as 10 mg·kg−1·d−1. The observation period was 12 weeks.
Results
A total of 222 patients were enrolled in seventeen centers (including 113 patients treated with anagrelide and 109 with hydroxyurea). Therapy efficacy can be evaluated in 198 patients (including 97 patients administered with anagrelide and 101 with hydroxyurea). At 12th weeks of therapy, the hematologic remission rate was 87.63% (85/97) in anagrelide group and 88.12% (89/107) in hydroxyurea group, the differences between the two groups were not significant (P=0.173). Treatment with anagrelide lowered the platelet counts by a median of 393 (362–1 339)× 109/L from a median of 827 (562–1657)×109/L at the beginning of the observation to 400(127–1130)×109/L after 12 weeks (P<0.001), which were similar to the treatment result of hydroxyurea by a median drop of 398 (597–1846)×109/L (P=0.982). The median time to achieving response of anagrelide group was 7 (3-14) days, superior to that of hydroxyurea for 21 (14–28) significantly (P=0.003). Frequency of anagrelide related adverse events was 65.49 % (74/113), including cardiopalmus (36.28%), headache (21.24%), fatigue (14.16%) and dizzy (11.50%).
Conclusion
Anagrelide was effective in patients with ET which had similar hematologic remission rate to hydroxyurea and could take effect more quickly than hydroxyurea. Incidence of adverse events was undifferentiated between anagrelide and hydroxyurea, but anagrelide treatment had tolerable adverse effects and no hematologic toxicity.
Keywords: Thrombocythemia, essential; Anagrelide; Hydroxyurea; Therapies, investigational; Drug toxicity
原发性血小板增多症(ET)是费城染色体阴性骨髓增殖性肿瘤(MPN)的一种类型,并发症包括血栓和出血,晚期进展为骨髓纤维化或急性髓系白血病(AML)。其典型实验室特征为:外周血血小板计数持续增高,骨髓增生明显至极度活跃,巨核细胞增多,以成熟的分叶巨核细胞数量增多为主,血小板生成增多。约50%的ET患者存在JAK2 V617F基因突变[1]。
阿那格雷是一种环磷腺苷磷酸二酯酶抑制剂,于1997年以优先审查方式获美国FDA批准用于治疗血小板增多症,随后在加拿大和欧盟上市。经国家食品药物监督管理局批准(2005L04495),国内17家医院协同开展国产盐酸阿那格雷胶囊治疗ET的多中心、随机、开放临床试验,报告如下。
病例和方法
一、受试者选择
入选标准:①自愿签署知情同意书且能够遵从研究方案;②18~75岁,性别不限;③符合WHO 2008诊断标准[2];④PLT≥600×109/L或PLT<600×109/L但JAK2 V617F基因突变阳性。
排除标准:①诊断为其他类型MPN ;②任何可预知的继发性血小板增多者;③除ET外,最近3年内确诊任何恶性肿瘤者;④1周内曾使用或正在使用降低血小板药物治疗者;⑤已知或怀疑对研究药物不耐受者;⑥严重心功能不全者;⑦已知或怀疑充血性心力衰竭者;⑧严重肾功能损伤(肌酐清除率<30 ml/min)、严重肝功能损伤(ALT或AST高于正常值2.5倍)、糖尿病控制不佳者、有心绞痛或心肌梗死病史者;⑨乙型、丙型肝炎病毒或HIV感染者;⑩在2年内有药物或酒精滥用史者;⑪入组前1个月内曾参加其他试验研究者;⑫未采取有效避孕措施的育龄、妊娠及哺乳期女性;⑬有血栓或活动性出血者。
入组前干扰素治疗超过2个月的患者应至少停药1个月,未超过2个月者应至少停药7 d;入组前羟基脲治疗的患者应停药至少7 d。入组时间:2011年11月至2013年11月。
二、试验设计
本研究采用多中心、随机、开放、阳性平行对照试验方法,非劣效性检验,由国内17家中心协同完成。
对照药选用羟基脲片,符合公认有效、安全、可比原则。计划阿那格雷组、羟基脲组各入组120例。病例数分配采用区组随机方法,各个中心所分配的受试者药物随机编号,由SAS9.1.3统计软件产生。各中心药物编号连续,在分配药物时按编号依次发放。本研究获得山西医科大学第二医院及各参与单位医学伦理委员会批准。受试者均知情同意。
三、治疗方案
盐酸阿那格雷胶囊为黑龙江天宏药业股份有限公司产品(批号20110801、20121101,每粒胶囊含阿那格雷0.5 mg)。起始剂量为2 mg/d(分2次口服),每周调整1次,每次增加0.5 mg/d,最大剂量为10 mg/d(分4次口服),直至达到PLT≤400×109/L。维持PLT(100~400)×109/L 1个月后逐渐减量(临床医师依据具体情况决定),PLT上升至500×109/L时可酌情增加剂量0.5 mg/d。
对照药羟基脲片为齐鲁制药有限公司产品(批号109026LC)。初始剂量为1 000 mg/d(分2次口服),每周调整剂量1次,每次增加量为500 mg/d,维持PLT(100~400)× 109/L 1个月后,逐渐减量至10 mg·kg−1·d−1维持。当WBC<4.0×109/L时每日减量500 mg,WBC<2.5×109/L和(或)中性粒细胞绝对值<1.5×109/L时停药。
伴随治疗:服用盐酸阿那格雷胶囊患者禁止使用阿司匹林肠溶片,服用羟基脲片的患者由研究者根据情况决定是否使用阿司匹林肠溶片。除方案规定的药物外,试验期间禁止使用降低血小板数量的药物及其他治疗方法。试验期间,因其他疾病需要治疗者,必须记录药物名称、剂量、用法及用药时间。
阿那格雷组、羟基脲组患者均采用门诊治疗和观察,疗程均为12周,门诊随访每周1次。
四、观察指标
观察体温、静息心率、呼吸、休息10 min后的血压等生命体征,血常规、尿常规、肝功能、肾功能等实验室检查及心电图。
五、疗效标准
1.主要疗效指标:参照文献[3]将疗效分为完全缓解(CR)、部分缓解(PR)和无效。以血液学缓解率(CR率+PR率)为主要疗效指标。
2.次要疗效指标:包括①血小板计数降低水平。②血小板计数反应:完全反应:PLT≤400 × 109/L;部分反应:不符合完全反应的标准但PLT≤ 600×109/L或者比基线降低超过50%;无效:不满足任何部分反应的标准。③血小板计数反应的时间:患者首次服药至血小板完全反应或部分反应时所需时间。④血小板增多症相关症状:出血、血栓、头痛、眩晕、疲乏、视觉模糊、脾大。
六、统计学处理
本研究数据分析由哈尔滨医科大学医学统计教研室采用SAS 9.1.3软件完成。对可评价疗效的198例受试者进行疗效分析,对所有入组的222例受试者进行安全性评价。
规定非劣效界值Δ=0.10为控制假设检验的一类错误发生率,主要终点指标检验P值<0.025时,则认为阿那格雷组非劣于阳性羟基脲组。同时采用CMH方法计算两组有效率比值的双侧95%置信区间,应保证RR值在0.8~1.2。
各组血小板计数以中位数表示,两组间缓解率、血小板计数反应率比较采用Wilcoxon秩和检验,血小板计数降低水平比较采用t检验,血小板计数反应时间比较采用Log-rank检验,临床症状比较采用确切概率法。P<0.05为差异有统计学意义。
结果
一、一般资料
2011年11月1日至2013年11月31日17个中心共入组222例受试者,阿那格雷组113例,羟基脲组109例。最终可评价疗效的受试者为198例,阿那格雷组97例,羟基脲组101例。有临床症状者占51.01%(101/198),脾大者占53.54%(106/198),JAK2 V617F基因突变阳性者占41.41%(82/198)。两组间性别、年龄、病程、发病时血小板计数和白细胞计数、JAK2 V617F基因突变阳性率、既往病史和用药史等临床基本特征比较,差异均无统计学意义(P>0.05)(表1)。
表1. 不同治疗组可评价疗效原发性血小板增多症患者的临床特征.
| 项目 | 阿那格雷组(97例) | 羟基脲组(101例) | 检验统计量 | P值 |
| 性别(例,男/女) | 30/67 | 35/66 | 0.311(χ2) | 0.577 |
| 中位年龄(岁) | 49(20~74) | 52(18~75) | 1.429(t) | 0.186 |
| 年龄段[例(%)] | 5.271(χ2) | 0.072 | ||
| <45岁 | 38(39.18) | 33(32.67) | ||
| 45~60岁 | 37(38.14) | 30(29.70) | ||
| >60岁 | 22(22.68) | 38(37.62) | ||
| 中位病程(月) | 8.0(0.1~276.0) | 7.0(0.5~120.0) | -0.828(t) | 0.340 |
| 中位PLT(×109/L) | 827(562~1 657) | 819(481~2 111) | 0.780(t) | 0.436 |
| 中位WBC(×109/L) | 7.95(2.51~23.19) | 8.00(3.40~24.11) | -0.005(t) | 0.996 |
| JAK2 V617F突变阳性[例(%)] | 45(46.39) | 37(36.63) | 2.125(χ2) | 0.145 |
| 脾大[例(%)] | 58(59.79) | 48(47.52) | 2.329(χ2) | 0.030 |
| 用药史[例(%)] | ||||
| 羟基脲 | 10(10.31) | 18(17.82) | 2.300(χ2) | 0.129 |
| 干扰素 | 1(1.03) | 2(1.98) | 0.299(χ2) | 0.585 |
二、主要疗效指标
阿那格雷组血液学缓解率为87.63%(85/97),其中CR 27例、PR 58例;羟基脲组血液学缓解率为88.12%(89/101),其中CR 38例、PR 51例。两组间血液学缓解率比较差异无统计学意义(P=0.174)。两组血液学缓解率差值的双侧95%可信区间的下限为-8.61%,根据预先设定的非劣效界值Δ=0.10,判定盐酸阿那格雷胶囊的临床血液学缓解率非劣于羟基脲。
三、次要疗效指标分析
1.血小板计数降低水平的分析:阿那格雷组治疗前中位血小板计数为827(562~1 657)×109/L,治疗12周为400(127~1 130)×109/L,差异有统计学意义(P<0.001);羟基脲组治疗前中位血小板计数为819(481~2 111)× 109/L,治疗12周为402(103~1 604)×109/L,差异有统计学意义(P<0.001)。治疗12周血小板计数降低值:阿那格雷组为393(−362~1 339)×109/L,羟基脲组为398(−597~1 846)×109/L,两组间比较差异无统计学意义(P=0.982)。
2.血小板计数反应分析:治疗12周,阿那格雷组52例获血小板计数完全反应,部分反应为33例;羟基脲组49例获血小板计数完全反应,部分反应为39例。阿那格雷组、羟基脲组血小板计数反应率差异无统计学意义[87.6%(85/97)对87.1%(88/101),P=0.610]。
3.血小板计数反应时间分析:阿那格雷组中位血小板计数反应时间为7(3~14) d,羟基脲组为21(14~28)d,差异有统计学意义(P=0.003)。
4.血小板增多症相关症状的分析:治疗28、56 d和结束后,两组患者血小板增多症相关症状(出血、头痛、眩晕、疲乏和视觉模糊等)均明显缓解,两组比较差异均无统计学意义(P>0.05)。
四、药物不良事件
222例受试者中132例(59.46%)发生不良事件,其中3例(1.35%)为严重不良事件。阿那格雷组113例受试者中74例(65.49%)发生不良事件,羟基脲组109例受试者中61例(55.96%)发生不良事件,差异无统计学意义(P=0.146)。
阿那格雷组不良事件发生率:心悸36.28%(41/113),头痛21.24%(24/113),乏力14.16%(16/113),头晕11.50%(13/113),腹泻7.08%(8/113),上呼吸道感染7.08%(8/113),水肿5.31%(6/113),瘙痒4.42%(5/113),粒细胞增多3.54%(4/113)。上述不良事件均为Ⅰ~Ⅱ级。未见白细胞减少、红细胞减少等血液学不良反应。
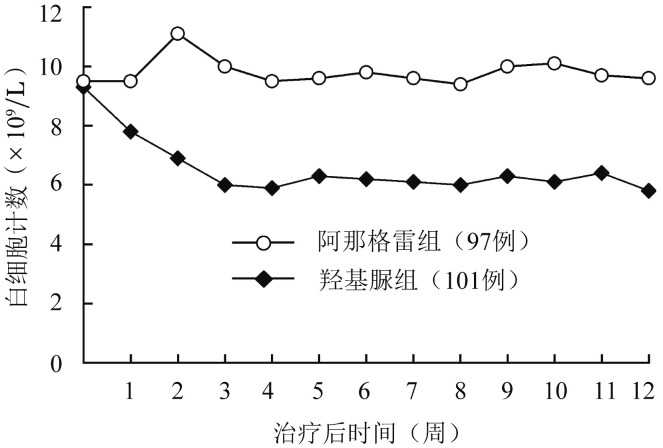
羟基脲组不良事件发生率:白细胞减少24.77%(27/109),乏力8.26%(9/109),头痛7.34%(8/109),红细胞减少6.42%(7/109),头晕6.42%(7/109),心悸5.5%(6/109),视觉异常5.5%(8/109),药物性肝损害3.67%(4/109),恶心3.67%(4/109)。其中白细胞减少更为明显(图1),为Ⅰ~Ⅲ级,其他不良反应为Ⅰ~Ⅱ级。因白细胞减少影响治疗26例(停药9例,药物减量17例);因红细胞减少影响治疗6例(停药1例,减量5例)。
图1. 阿那格雷组和羟基脲组原发性血小板增多症患者的中位白细胞计数动态变化.
本研究未发生死亡事件。3例患者发生严重不良事件,均为阿那格雷组患者。其中1例表现为心悸、鼻出血、发热、呼吸困难和转氨酶升高,经对症治疗和停用试验药物后症状改善,判断与试验药物可疑相关。其余2例分别为不稳定性心绞痛和急性胰腺炎,判定与试验药物可能无关。
讨论
ET是一种以巨核细胞增生为主的克隆性多能干细胞增殖性疾病。其特征是血小板计数持续性增多,常见的并发症包括血栓形成和出血。出血症状一般较轻,血栓是本病患者的主要致死原因。血栓的主要危险因素有血小板计数、年龄和心血管危险因素等[1]。通过降低血小板治疗,可以有效预防和减少血栓事件,从而改善ET患者的预后和生存质量[4]。
羟基脲是目前我国治疗ET的一线药物,具有较好的降血小板疗效,但该药属于烷化剂,长期使用可能增加AML和骨髓增生异常综合征(MDS)的发生率[5]。不良反应主要是骨髓抑制(白细胞和红细胞减少),停药1~2周后可恢复。部分患者不能耐受不良反应,从而影响治疗。此外,少数患者羟基脲治疗无效[6]–[7]。
阿那格雷具有抗环腺苷酸磷酸二酯酶活性,可以抑制血小板聚集。在低于抑制血小板聚集剂量时,具有特异性的血小板减低作用[8]。研究证实,ET患者应用阿那格雷治疗后骨髓巨核细胞减少、细胞体积缩小、染色体倍数下降[9]–[10]。提示阿那格雷降低血小板的作用机制可能是通过同时抑制巨核细胞的增殖和分化成熟,减少骨髓中巨核细胞数量,使血小板生成减少,从而降低血小板计数和周转率,并不影响骨髓中白细胞和红细胞生成。阿那格雷长期用药未发现潜在致癌性[10]–[11]。因此该药在1997年以优先审查方式获美国FDA批准用于治疗克隆性血小板增多患者。目前阿那格雷在我国尚未上市。
可评价疗效的198例受试者中,阿那格雷组的血液学缓解率为87.63%,治疗前中位血小板计数为827(562~1 657)× 109/L,治疗12周为400(127~1130)×109/L;羟基脲组的血液学缓解率为88.12%,治疗前中位血小板计数为819(481~2 111)×109/L,治疗12周为402(103~1 604)×109/L。两组间血液学缓解率和血小板计数降低值比较差异均无统计学意义,提示阿那格雷降低血小板的疗效与羟基脲相似,与文献[12]–[14]的结果一致。本研究中,阿那格雷组血小板计数中位反应时间为7(3~14) d,羟基脲组为21(14~28) d,差异有统计学意义(P=0.003),表明阿那格雷起效更快。
阿那格雷的不良反应与药物的直接血管舒张和正性肌力作用相关,常见的有头痛、体液潴留、心动过速和心律失常等。本研究中阿那格雷组113例受试者中,74例发生不良事件,发生率65.49%。常见的有心悸(36.28%)、头痛(21.24%)、乏力(14.16%)和头晕(11.50%),与文献[12],[14]报道一致。在一项为期2年的研究中,26.6%的患者因阿那格雷不良反应停药[13];在另一项阿那格雷治疗7年的研究中,仅10%的患者因不良反应停药[14],提示阿那格雷不良反应的发生率和严重程度可能随着治疗时间延长而下降。本研究中除1例因严重不良事件停药外,其他患者均未因不良事件终止试验,可能与治疗时间较短有关。少数长期服用阿那格雷的患者可出现轻度贫血[15],本研究中阿那格雷组未观察到明显血液学毒性,可能与治疗时间较短(仅12周)有关。
研究发现,对羟基脲等细胞毒药物耐药或不能耐受的患者,应用阿那格雷作为二线或三线治疗均有较好的疗效和耐受性,反应率达到70%[5]–[6],[14]。对细胞毒药物或阿那格雷单药或多药耐药或不能耐受的ET患者,治疗选择是一项临床挑战。对于这类患者,长期应用小剂量羟基脲和阿那格雷联合治疗总有效率为90%,不良反应轻微,无动脉和静脉血栓以及出血事件发生[16]。因此,小剂量羟基脲和阿那格雷联合治疗是一个治疗ET的新的有效方法。
本研究结果显示,盐酸阿那格雷胶囊治疗ET的血液学缓解率与羟基脲相近,但起效更快,治疗有效的受试者在12周治疗中持续存在血小板降低疗效。阿那格雷组与羟基脲组不良事件发生率相近,羟基脲组的主要不良事件为血液学毒性,而阿那格雷组常见的不良事件是头痛、心悸、腹泻以及体液潴留,未观察到血液学不良事件。1例严重不良事件判断与试验药物可疑相关,无死亡病例。
本研究结果提示,国产阿那格雷胶囊治疗ET的有效性和安全性与文献报道相似,是治疗ET的一个安全有效的选择。本研究的治疗和观察时间仅12周,阿那格雷长期治疗ET的疗效和安全性还有待于进一步观察和研究。
References
- 1.蓝 海峰, 方 志鸿, 张 悦, et al. 438例原发性血小板增多症的临床分析[J] 中华血液学杂志. 2008;29(9):587–591. [PubMed] [Google Scholar]
- 2.Vardiman JW, Thiele J, Arber DA, et al. The 2008 revision of the World Health Organization (WHO) classification of myeloid neoplasms and acute leukemia: rationale and important changes[J] Blood. 2009;114(5):937–951. doi: 10.1182/blood-2009-03-209262. [DOI] [PubMed] [Google Scholar]
- 3.Barosi G, Mesa R, Finazzi G, et al. Revised response criteria for polycythemia vera and essential thrombocythemia: an ELN and IWG-MRT consensus project[J] Blood. 2013;121(23):4778–4781. doi: 10.1182/blood-2013-01-478891. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.付 荣凤, 宣 旻, 张 丽艳, et al. 604例低危原发性血小板增多症患者的临床特征和血栓危险因素分析[J] 中华血液学杂志. 2014;35(9):785–790. [Google Scholar]
- 5.Nielsen I, Hasselbalch HC. Acute leukemia and myelodysplasia in patients with a Philadelphia chromosome negative chronic myeloproliferative disorder treated with hydroxyurea alone or with hydroxyurea after busulphan[J] Am J Hematol. 2003;74(1):26–31. doi: 10.1002/ajh.10375. [DOI] [PubMed] [Google Scholar]
- 6.Rey J, Viallard JF, Keddad K, et al. Characterization of different regimens for initiating anagrelide in patients with essential thrombocythemia who are intolerant or refractory to their current cytoreductive therapy: results from the multicenter FOX study of 177 patients in France[J] Eur J Haematol. 2014;92(2):127–136. doi: 10.1111/ejh.12210. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Kanakura Y, Miyakawa Y, Wilde P, et al. Phase III, single-arm study investigating the efficacy, safety, and tolerability of anagrelide as a second-line treatment in high-risk Japanese patients with essential thrombocythemia[J] Int J Hematol. 2014;100(4):353–360. doi: 10.1007/s12185-014-1631-x. [DOI] [PubMed] [Google Scholar]
- 8.Tefferi A, Silverstein MN, Petitt RM, et al. Anagrelide as a new platelet-lowering agent in essential thrombocythemia: mechanism of actin, efficacy, toxicity, current indications[J] Semin Thromb Hemost. 1997;23(4):379–383. doi: 10.1055/s-2007-996112. [DOI] [PubMed] [Google Scholar]
- 9.Thiele J, Kvasnicka HM, Schmitt-Graeff A. Effects of anagrelide on megakaryopoiesis and platelet production[J] Semin Thromb Hemost. 2006;32(4 Pt 2):352–361. doi: 10.1055/s-2006-942756. [DOI] [PubMed] [Google Scholar]
- 10.Fruchtman SM, Petitt RM, Gilbert HS, et al. Anagrelide: analysis of long-term efficacy, safety and leukemogenic potential in myeloproliferative disorders[J] Leuk Res. 2005;29(5):481–491. doi: 10.1016/j.leukres.2004.10.002. [DOI] [PubMed] [Google Scholar]
- 11.Hong Y, Wang G, Del Arroyo AG, et al. Comparison between anagrelide and hydroxycarbamide in their activities against haematopoietic progenitor cell growth and differentiation: selectivity of anagrelide for the megakaryocytic lineage[J] Leukemia. 2006;20(6):1117–1122. doi: 10.1038/sj.leu.2404180. [DOI] [PubMed] [Google Scholar]
- 12.Gisslinger H, Gotic M, Holowiecki J, et al. Anagrelide compared with hydroxyurea in WHO-classified essential thrombocythemia: the ANAHYDRET Study, a randomized controlled trial[J] Blood. 2013;121(10):1720–1728. doi: 10.1182/blood-2012-07-443770. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Birgegård G, Björkholm M, Kutti J, et al. Adverse effects and benefits of two years of anagrelide treatment for thrombocythemia in chronic myeloproliferative disorders[J] Haematologica. 2004;89(5):520–527. [PubMed] [Google Scholar]
- 14.Petrides PE, Beykirch MK, Trapp OM. Anagrelide, a novel platelet lowering option in essential thrombocythaemia: treatment experience in 48 patients in Germany[J] Eur J Haematol. 1998;61(2):71–76. doi: 10.1111/j.1600-0609.1998.tb01064.x. [DOI] [PubMed] [Google Scholar]
- 15.Storen EC, Tefferi A. Long-term use of anagrelide in young patients with essential thrombocythemia[J] Blood. 2001;97(4):863–866. doi: 10.1182/blood.v97.4.863. [DOI] [PubMed] [Google Scholar]
- 16.Gugliotta L, Besses C, Griesshammer M, et al. Combination therapy of hydroxycarbamide with anagrelide in patients with essential thrombocythemia in the evaluation of Xagrid (R) efficacy and long-term safety study[J] Haematologica. 2014;99(4):679–687. doi: 10.3324/haematol.2012.083097. [DOI] [PMC free article] [PubMed] [Google Scholar]