Abstract
目的
探讨4型含Bromo结构域蛋白(BRD4)拮抗剂对普通型急性B淋巴细胞白血病(B-ALL)患者原代白血病细胞的作用及可能机制。
方法
采用流式细胞术分选14例普通型B-ALL患者(Ph+ B-ALL 4例,Ph−B-ALL 10例)白血病细胞,在模拟骨髓微环境条件下进行短期培养;给予BRD4拮抗剂GSK525762A处理后,采用CCK-8法检测细胞增殖抑制率,用AnnexinⅤ/7-AAD法检测细胞凋亡率,荧光定量PCR法检测c-MYC、CDK6、Bcl-2 mRNA表达水平,Western blot法检测c-MYC、CDK6、Bcl-2蛋白的表达。
结果
GSK525762A对14例普通型B-ALL患者原代白血病细胞均有抑制增殖作用,且呈剂量依赖性,其中位IC50值为256.25(90.64~1 378.39)nmol/L。500、1 000、2 500 nmol/L GSK525762A作用后中位细胞凋亡率分别为45.17%(9.38%~70.91%)、66.02%(24.36%~96.34%)、89.29%(39.29%~99.37%)。GSK525762A对Ph+与Ph−B-ALL细胞具有类似的作用,但对Ph+ B-ALL细胞抑制增殖和诱导凋亡作用均弱于Ph−B-ALL细胞。1 000 nmol/L GSK525762A处理白血病细胞24、48 h后,c-MYC、CDK6和Bcl-2 mRNA表达水平下降,其中对Ph+和Ph−B-ALL细胞c-MYC、CDK6 mRNA的下调作用差异无统计学意义,而对Ph+ B-ALL细胞Bcl-2 mRNA表达水平的下调弱于对Ph−B-ALL细胞;GSK525762A处理后白血病细胞c-MYC、CDK6、Bcl-2蛋白表达水平均下调。
结论
GSK525762A可抑制普通型B-ALL原代细胞的增殖,并促进其凋亡,且对Ph+ ALL细胞在体外具有一定作用。该作用可能通过下调c-MYC、CDK6和Bcl-2而实现。
Keywords: 4型含Bromo 结构域蛋白质, BRD4拮抗剂, 白血病,B细胞, 细胞凋亡, 原代细胞培养
Abstract
Objective
To investigate the effects of bromodomain-containing protein 4 (BRD4) inhibitor GSK525762A on the proliferation and apoptosis of primary common B-cell acute lymphoblastic leukemia (common B-ALL) cells from adult patients, then to further explore the possible mechanisms.
Methods
Purified leukemia cells from 14 common B-ALL adult patients (4 Ph+ and 10 Ph−cases) were obtained by flow cytometry sorting, and maintained in a mimic bone marrow microenvironment culture system for short-term culture. Leukemia cells were treated with various concentrations of GSK525762A. The inhibitory effects of BRD4 inhibitor on common B-ALL leukemia cells were measured by CCK-8 assay and the apoptosis of those cells was determined by AnnexinⅤ/7-AAD staining using flow cytometry. The transcripts of c-MYC, CDK6 and Bcl-2 were detected by quantitative RT-PCR, and the expression of c-MYC, CDK6 and Bcl-2 proteins were detected via Western blot.
Results
GSK525762A could inhibit the proliferation of leukemia cells from all 14 common B-ALL patients in a dose-dependent manner, the median value of IC50 was 256.25 (90.64–1 378.39)nmol/L. GSK525762A could promote cells apoptosis of B-ALL leukemia cells in a dose-dependent manner, the median apoptosis rates respectively were 45.17%(9.38%–70.91%), 66.02% (24.36%–96.34%) and 89.29% (39.29%–99.37%) after treated by 500, 1 000 and 2 500 nmol/L GSK525762A. GSK525762A has a similar effect on Ph+ ALL and Ph−B-ALL, but the effect of proliferation inhibition and apoptosis enhancement on Ph+ B-ALL is weaker than that on Ph−B-ALL. Compared with vehicle control group, the levels of c-MYC, Bcl-2 and CDK6 transcripts in leukemic cells were reduced after treatment for 24 h and 48 h by 1 000 nmol/L GSK525762A, and there are no significant differences in the downregulation of c-MYC and CDK6 mRNA between Ph+ and Ph−B-ALL; however, the inhibitory effect on Bcl-2 transcription was weaker in Ph+ B-ALL cells than that in Ph−B-ALL cells. Moreover, c-MYC, Bcl-2 and CDK6 protein levels decreased in GSK525762A treated group.
Conclusion
GSK525762A could strongly inhibit the proliferation of common B-ALL and trigger apoptosis; meanwhile it has certain effects against Ph+ ALL in vitro. The effect may be achieved by down-regulation of c-MYC, CDK6 and Bcl-2 expression.
Keywords: Bromodomain-containing protein 4; BRD4 antagonists; Leukemia, B-cell; Apoptosis; Primary cell culture
急性B淋巴细胞白血病(B-ALL)是起源于前体B细胞的恶性克隆性疾病。尽管随着联合化疗、造血干细胞移植和靶向治疗的应用,成人B-ALL的预后已有改善,但疗效仍远不能令人满意[1]。多数成人B-ALL免疫表型为普通型,其中Ph+ ALL等预后不良亚型比例高,易早期复发,对供者淋巴细胞输注反应差,长期生存率甚低[2],迫切需要寻找新的治疗靶点和策略。
2011年Zuber等[3]发现4型含Bromo结构域蛋白(Bromodomain-containing protein 4,BRD4)对维持MLL重排阳性AML细胞的存活和干细胞特性起重要作用,沉默BRD4表达对绝大多数AML细胞具有增殖抑制作用。BRD4拮抗剂I-BET151或JQ1对多种AML细胞株和原代细胞具有强大的杀灭作用[4]。本实验室王缦等[5]报道新型BRD4拮抗剂GSK525762A对MLL重排阳性的B-ALL细胞株RS4;11具有与AML细胞类似的作用。在此基础上,我们检测了14例普通型B-ALL患者原代白血病细胞在体外短期培养条件下对GSK525762A的敏感性,为BRD4拮抗剂靶向B-ALL提供临床前研究资料。
病例和方法
1.病例资料:选择2008年1月至2013年10月在徐州医学院附属医院血液科住院治疗的普通型B-ALL患者13例及蚌埠医学院附属医院血液科住院治疗的普通型B-ALL患者1例,诊断和分型均符合文献[6]标准。其中初诊患者8例(男4例、女4例),复发患者6例(男4例、女2例),中位年龄46(13~81)岁,Ph+ B-ALL患者4例,Ph−B-ALL患者10例,具体资料见表1。标本为抽取的患者新鲜骨髓或外周血,患者标本均于化疗前采集,4名正常对照均为健康志愿者。本研究获徐州医学院、蚌埠医学院附属医院伦理委员会批准,患者及志愿者均知情同意并签署知情同意书。
表1. 14例普通型急性B淋巴细胞白血病患者资料.
| 例号 | 年龄(岁) | 性别 | 疾病状态 | 染色体核型 | 融合基因 |
| 1 | 54 | 男 | 复发 | 46,XY[15] | − |
| 2 | 51 | 男 | 初诊 | 46,XY[16] | − |
| 3 | 43 | 男 | 初诊 | 46,XY,t(9;22)(q34;q11)[12] | BCR-ABL |
| 4 | 13 | 女 | 初诊 | 46,XX,?7q−[5] | − |
| 5 | 39 | 男 | 初诊 | 46,XY[20] | − |
| 6 | 39 | 女 | 复发 | 46,XX,t(9;22)(q34;q11)idic(9) (q11)[20] | BCR-ABL |
| 7 | 51 | 女 | 初诊 | 未见分裂象 | TEL-AML1 |
| 8 | 46 | 男 | 复发 | 46,XY,t(9;22)(q34;q11)[2] | BCR-ABL |
| 9 | 27 | 男 | 复发 | 46,XY[4] | − |
| 10 | 34 | 女 | 复发 | 未见分裂象 | − |
| 11 | 81 | 男 | 初诊 | 46,XY[10] | − |
| 12 | 74 | 女 | 初诊 | 46,XX,add(19)(p13)[3]/46,XX[1] | − |
| 13 | 64 | 女 | 初诊 | 46,XX,t(9;22)(q34;q11)[8] | BCR-ABL |
| 14 | 46 | 男 | 复发 | 未见分裂象 | MLL-AF4 |
注:−:阴性
2.主要试剂和仪器:GSK525762A购自德国Merck公司;IMDM培养基、胎牛血清(FBS)购自美国Gibco公司;细胞因子购自美国R&D公司;CCK-8试剂盒购自日本同仁化学研究所;Annexin Ⅴ-APC/7-AAD试剂盒为美国eBioscience公司产品。M-MLV和TRIzol试剂购自美国Invitrogen公司;荧光定量PCR仪(LightCycler480)和试剂购自德国罗氏诊断公司。Influx和Calibur流式细胞仪均为美国BD公司产品。β-actin、BRD4、c-MYC、Bcl-2、CDK6抗体为美国Cell Signaling Technology公司产品。
3.原代B-ALL细胞的纯化及短期培养:采集普通型B-ALL患者治疗前骨髓或外周血5 ml,用淋巴细胞分离液密度梯度离心(800×g,20 min)分离单个核细胞,Influx流式细胞仪分离出CD19+ CD10+ CD34+原始淋巴细胞。将原始细胞常规培养于含20% FBS、5 ng/ml基质细胞衍生因子(SDF-1)、10 ng/ml IL-7的IMDM培养基,接种于使用VCAM-1包被的96孔板中,置于培养箱内常规培养。
4.CCK-8法检测GSK525762A对B-ALL原代细胞增殖的影响:取纯化的B-ALL原代细胞按每孔3×104细胞接种于VCAM-1包被的96孔板,实验组分别加入终浓度为12.5、25、50、100、250、500、1 000和2 500 nmol/L GSK525762A,溶剂对照组加入和实验组等量的DMSO溶液,每组设3个复孔。接种后细胞置于培养箱培养96 h后每孔加入CCK-8试剂,继续孵育4 h后用酶标仪检测波长450 nm处吸光度(A)值。按下列公式计算增殖抑制率。
5.流式细胞术检测GSK525762A对B-ALL原代细胞凋亡的影响:取对数生长期B-ALL原代细胞,以4×105/ml密度接种于6孔板,每孔2 ml。实验组加入终浓度500、1 000和2 500 nmol/L GSK525762A,溶剂对照组加入等量DMSO溶液处理;每组设3个复孔,置于培养箱内培养72 h,收集细胞用Annexin Ⅴ-APC/7-AAD试剂盒,按说明标记细胞后上流式细胞仪检测细胞凋亡率。
6.实时荧光定量RT-PCR检测c-MYC、Bcl-2、CDK6、BAD、BAK、BAX mRNA表达:取对数生长期B-ALL原代细胞,以5×105/ml密度接种于6孔板。实验组加入1 000 nmol/L GSK525762A,溶剂对照组加入等量DMSO溶液;每组设3个复孔,置于37 °C、5% CO2、饱和湿度培养箱培养24或48 h后收集细胞,TRIzol提取总RNA后用M-MLV逆转录酶合成cDNA。采用LightCycle480 SYBR Green Ⅰ Master试剂检测细胞c-MYC、Bcl-2、CDK6、BAD、BAK、BAX基因的表达。PCR引物见表2。用2−ΔΔCt法计算基因相对表达量, ΔCt=目的基因Ct值−GAPDH的Ct值。实验独立重复3次。
表2. 本研究中PCR引物序列.
| 基因 | 上游引物(5′→3′) | 下游引物(5′→3′) | 扩增片段长度(bp) |
| c-MYC | TACAACACCCGAGCAAGGAC | AGGCTGCTGGTTTTCCACTAC | 161 |
| Bcl-2 | ACGACTTCTCCCGCCGCTA | ACCCCACCGAACTCAAAGAAG | 163 |
| CDK6 | GTGACCAGCAGCGGACAAAT | GTACCACAGCGTGACGACCA | 99 |
| BAD | GGAGGATGAGTGACGAGTTTGTG | CCAAGTTCCGATCCCACCAG | 135 |
| BAK | ACTGCACCAAGATTGCCACCAG | GCCATGCTGGTAGACGTGTAGG | 110 |
| BAX | TTCTGACGGCAACTTCAACTG | CCCGGAGGAAGTCCAATGTC | 137 |
| GAPDH | CATCAAGAAGGTGGTGAAGCAG | CAAAGGTGGAGGAGTGGGTG | 116 |
7.Western blot法检测B-ALL原代细胞BRD4、c-MYC、Bcl-2、CDK6蛋白表达:分别收集未处理B-ALL原代细胞及正常人骨髓细胞检测BRD4表达,收集DMSO处理组及1 000 nmol/L GSK525762A作用24、48和72 h后白血病细胞,提取总蛋白并测定蛋白含量,经变性、电泳、湿转NC膜、封闭后,加入一抗、二抗孵育,X线底片曝光显影。以β-actin蛋白为内参照以保持蛋白上样量的一致性。
8.统计学处理:正态分布的计量资料以x±s表示,两组间比较采用t检验,多组间比较采用单因素方差分析和HSD post-hoc检验;非正态分布计量资料采用Mann-Whitney非参数检验;相关性分析采用Pearson线性相关分析法;IC50计算使用直线回归法;P<0.05表示差异有统计学意义。
结果
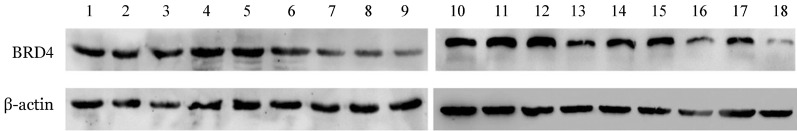
1.BRD4在B-ALL原代细胞的表达:收集14例患者的白血病细胞及4名正常人骨髓细胞,Western blot法检测BRD4的表达。结果显示14例患者白血病细胞中均存在BRD4表达,与4名正常人BRD4表达无明显差异,没有发现表达缺失现象(图1)。
图1. Western blot法检测14例普通型急性B淋巴细胞白血病(B-ALL)患者白血病细胞及正常人骨髓细胞中BRD4表达水平.
1~14:B-ALL患者;15~18:4名正常对照者
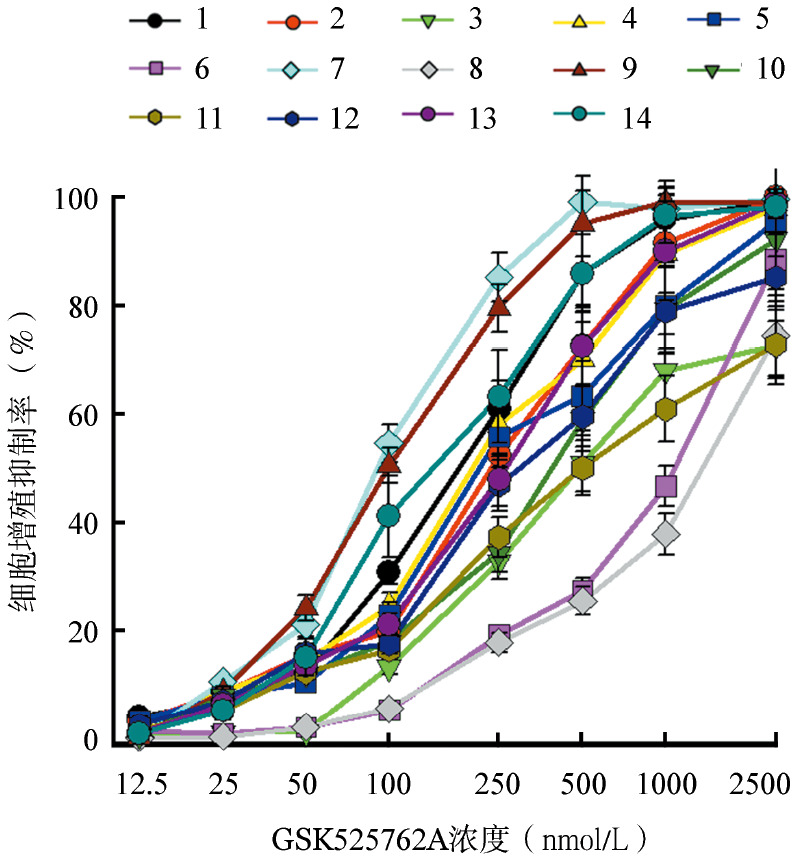
2.BRD4拮抗剂GSK525762A对B-ALL原代细胞增殖的影响:14例患者原代白血病细胞用不同浓度的GSK525762A处理96 h,结果显示GSK525762A对其均具有不同程度的抑制作用,并在一定范围内呈现剂量依赖性(图2)。其中位IC50值为256.25(90.64~1 378.39)nmol/L。未发现GSK525762A对原代B-ALL细胞的IC50值与患者年龄存在明显的相关性(r=0.030,P=0.920),且中位IC50值在初诊和复发患者间的差异无统计学意义(分别为263.81和299.13 nmol/L,P=0.216)。
图2. 采用CCK-8法检测GSK525762A对14例普通型急性B淋巴细胞白血病患者白血病细胞的体外增殖抑制作用.
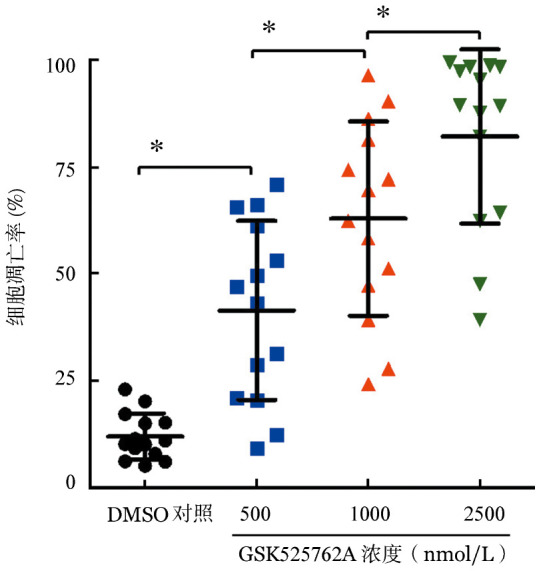
3.GSK525762A对B-ALL原代细胞凋亡的影响:不同浓度GSK525762A作用于原代白血病细胞72 h后,采用Annexin Ⅴ/7-AAD法检测凋亡。结果显示,GSK525762A对B-ALL原代细胞均具有明显的诱导凋亡作用,其中2 500 nmol/L组最强,500 nmol/L组最弱,组间差异均有统计学意义(图3,单因素方差分析和HSD post-hoc分析)。
图3. 采用Annexin Ⅴ/7-AAD法检测不同浓度GSK525762A对14例普通型急性B淋巴细胞白血病患者白血病细胞凋亡的影响(*P<0.05).
4.GSK525762A对Ph+ ALL原代细胞的杀伤作用:本组14例患者中Ph+ ALL 4例。鉴于Ph+ ALL独特的临床意义,我们比较了GSK525762A对Ph+ B-ALL和Ph−B-ALL原代细胞增殖和凋亡的影响,结果显示GSK525762A对Ph+ ALL细胞增殖有抑制作用,但敏感性有所下降,其中位IC50值为790.23 (271.50~1 378.39)nmol/L,而对Ph−ALL细胞的中位IC50值为223.28(90.64~498.45)nmol/L。GSK525762A能有效地诱导Ph+和Ph−B-ALL细胞凋亡,但GSK525762A诱导Ph+ ALL细胞凋亡能力弱于对Ph−B-ALL细胞的作用(表3)。
表3. 不同浓度GSK525762A对Ph+和Ph−B-ALL患者白血病细胞的诱导凋亡作用比较.
| GSK525762A浓度(nmol/L) | 细胞凋亡率[%, M(范围)] |
|
| Ph+ B-ALL(4例) | Ph− B-ALL(10例) | |
| 500 | 16.86(9.38~47.13) | 51.47(20.61~70.91)a |
| 1 000 | 37.64(24.36~74.31) | 70.86(39.34~96.34)a |
| 2 500 | 55.04(39.29~95.31) | 93.32(64.33~99.37)a |
注:B-ALL:急性B淋巴细胞白血病。与Ph+ B-ALL组比较,aP<0.05
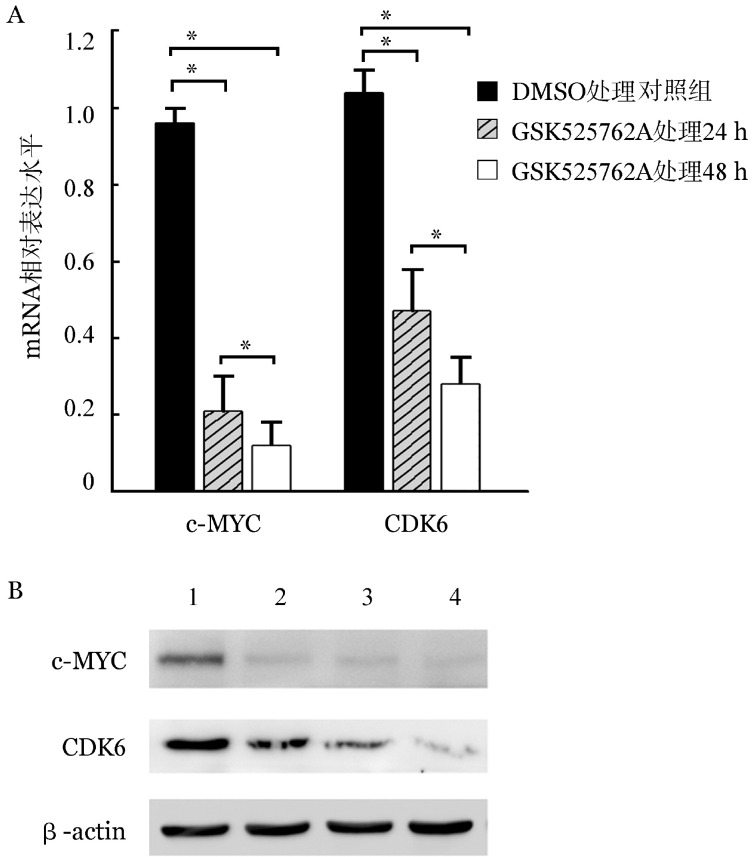
5.GSK525762A对CDK6和c-MYC表达的影响:经GSK525762A处理24 h后,原代白血病细胞中促增殖基因CDK6和c-MYC mRNA水平较对照组明显下降;而处理后48 h CDK6和c-MYC mRNA水平较24 h时进一步下降(图4A)。Western blot检测结果显示原代白血病细胞用1 000 nmol/L GSK525762A处理24、48、72 h后,与对照组相比,c-MYC、CDK6蛋白表达水平下调(图4B)。我们进一步分析了GSK525762A处理对Ph+和Ph− B-ALL原代细胞CDK6和c-MYC mRNA表达水平的影响,结果显示处理24和48 h后,Ph+和Ph− B-ALL组CDK6和c-MYC mRNA表达水平差异无统计学意义(P>0.05)(表4)。
图4. GSK525762A对14例普通型急性B淋巴细胞白血病患者白血病细胞c-MYC和CDK6 mRNA(A)及蛋白(B)表达的影响(*P<0.05).
1:DMSO处理对照组;2~4分别为GSK525762A处理24、48、72 h组
表4. GSK525762A对Ph+和Ph−急性B淋巴细胞白血病(B-ALL)患者白血病细胞c-MYC、CDK6和Bcl-2 mRNA表达的影响(x±s).
| 组别 | 例数 | c-MYC |
CDK6 |
Bcl-2 |
|||
| 24 h | 48 h | 24 h | 48 h | 24 h | 48 h | ||
| Ph+ B-ALL | 4 | 0.216±0.012 | 0.172±0.011 | 0.422±0.032 | 0.265±0.018 | 0.546±0.142 | 0.288±0.098 |
| Ph−B-ALL | 10 | 0.205±0.008 | 0.165±0.017 | 0.478±0.024 | 0.236±0.022 | 0.312±0.117a | 0.112±0.071a |
注:与Ph+ B-ALL组比较,aP<0.05
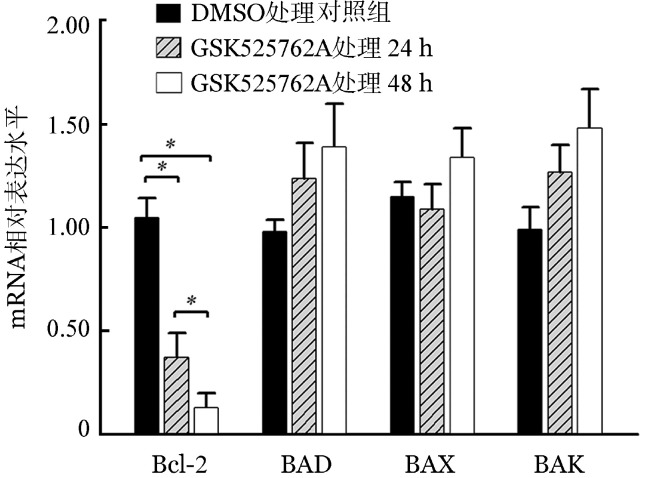
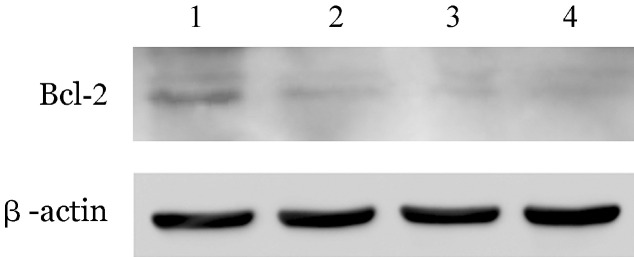
6.GSK525762A对Bcl-2表达的影响:经GSK525762A处理24或48 h后,PCR结果显示Bcl-2 mRNA水平在原代白血病细胞中较对照组显著下调,且48 h时下调较24 h更显著;而其他Bcl-2家族基因如BAX、BAD和BAK mRNA水平变化不明显(图5)。Western blot检测结果显示原代白血病细胞用1 000 nmol/L GSK525762A处理24、48、72 h后,与对照组相比,Bcl-2蛋白表达水平下调(图6);进一步分析显示,在GSK525762A处理后Ph+ B-ALL组下调程度不及Ph−组(P<0.05,表4)。
图5. GSK525762A对14例普通型急性B淋巴细胞白血病患者原代细胞Bcl-2家族基因的调控作用(*P<0.05).
图6. GSK525762A对普通型急性B淋巴细胞白血病原代细胞Bcl-2蛋白的调控作用.
1:DMSO处理对照组;2~4分别为GSK525762A作用24、48、72 h组
讨论
尽管多数成人ALL经联合化疗可获血液学缓解,但多数患者很快复发,长期生存率甚低。因此探索成人ALL治疗的新策略和新靶点是目前亟待探索的课题。BRD4在多种类型的组织和细胞中存在广泛的表达[7],可通过Bromo结构域识别乙酰化的赖氨酸残基,从而参与将包括MLL在内的多种蛋白复合体招募至乙酰化的H3和H4组蛋白。沉默或抑制BRD4可有效抑制AML细胞增殖并促进其凋亡[8],其主要机制是下调c-MYC、CDK6和Bcl-2表达。GSK525762A与Bromo结构域有高度亲和力,在较低浓度下即可抑制BRD4的生物学效应。我们在以往研究的基础上进一步探索了GSK525762A对普通型B-ALL原代细胞的作用。结果显示GSK525762A对14例普通型B-ALL患者的原代白血病细胞均有抑制作用,并能促进其凋亡,其作用机制与在AML中类似。既往资料表明Bromo结构域拮抗剂在常规剂量下没有明显的骨髓抑制作用和主要脏器毒性[9],结合我们的研究结果,提示Bromo结构域拮抗剂有望成为高效低毒的B-ALL治疗新药。
白血病干细胞在很大程度上是白血病难以治愈的根本原因[10]。目前,常规的化疗手段对白血病干细胞作用不佳。c-MYC是干细胞生物学行为的重要调控因子,敲除c-MYC基因可致多种干细胞功能受损[11]。本研究证实BRD4拮抗剂GSK525762A能下调B-ALL细胞c-MYC表达,提示GSK525762A可能在一定程度上通过削弱白血病干细胞功能发挥抗白血病作用,但需要进一步研究证实。
Ph+ ALL是预后最差的白血病类型之一,虽然酪氨酸激酶抑制剂(TKI)联合小剂量化疗显著提高了Ph+ ALL的缓解率,但是否从根本上改善Ph+ ALL的预后仍有争议[12]。T315I等高度耐TKI突变的存在也严重影响TKI治疗Ph+ ALL的长期疗效。本研究中,我们首次报道GSK525762A对Ph+ ALL细胞具有较强的体外杀伤作用,可为开发Ph+ ALL新疗法提供参考。考虑到GSK525762A与TKI的抗白血病机制不同,我们推测GSK525762A对T315I突变Ph+ ALL细胞可能也具有较强的作用。本课题组目前正进行相关研究。但是,我们的研究结果也提示Ph+ ALL细胞对GSK525762A相对不敏感,这可能与该类细胞Bcl-2不易被下调有关。联合使用Bcl-2抑制剂可能提高该类细胞的敏感性。
与B-ALL细胞株不同,B-ALL原代细胞的存活依赖恰当的骨髓微环境。通常,体外培养的B-ALL原代细胞会在数日内凋亡殆尽,极大地增加了B-ALL原代细胞培养的难度。维持原代B-ALL存活的骨髓微环境包括VCAM-1等黏附分子和SDF-1、IL-7等细胞因子。在本研究中,我们使用VCAM-1包被培养板并添加SDF-1和IL-7模拟骨髓微环境,可成功实现B-ALL原代细胞的体外短期培养。该方法可为研究B-ALL提供有力工具。
综上,BRD4拮抗剂GSK525762A能有效杀伤普通型B-ALL白血病细胞,抑制肿瘤细胞增殖。同时,它能够通过调节凋亡因子的表达而诱导白血病细胞凋亡。本研究为BRD4作为B-ALL治疗新靶点和以GSK525762A为母核开发新型抗B-ALL药物提供初步的临床前研究支持。
Funding Statement
基金项目:国家自然科学基金(81000210、81471580、81300399、81270637);江苏省自然科学基金(BK20141138);江苏省临床医学科技专项(BL2013010)
References
- 1.Lech-Maranda E, Mlynarski W. Novel and emerging drugs for acute lymphoblastic leukemia[J] Curr Cancer Drug Targets. 2012;12(5):505–521. doi: 10.2174/156800912800673275. [DOI] [PubMed] [Google Scholar]
- 2.Ribera JM. Optimal approach to treatment of patients with Phila-delphia chromosome-positive acute lymphoblastic leukemia: how to best use all the available tools[J] Leuk Lymphoma. 2013;54(1):21–27. doi: 10.3109/10428194.2012.708753. [DOI] [PubMed] [Google Scholar]
- 3.Zuber J, Shi J, Wang E, et al. RNAi screen identifies Brd4 as a therapeutic target in acute myeloid leukaemia[J] Nature. 2011;478(7370):524–528. doi: 10.1038/nature10334. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Herrmann H, Blatt K, Shi J, et al. Small-molecule inhibition of BRD4 as a new potent approach to eliminate leukemic stem-and progenitor cells in acute myeloid leukemia AML[J] Oncotarget. 2012;3(12):1588–1599. doi: 10.18632/oncotarget.733. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.王 缦, 陈 翀, 徐 杰, et al. 溴结构域蛋白4抑制剂GSK525762A对急性B淋巴细胞白血病细胞增殖和凋亡的影响及可能机制[J] 中华血液学杂志. 2014;35(6):528–532. doi: 10.3760/cma.j.issn.0253-2727.2014.06.012. [DOI] [PubMed] [Google Scholar]
- 6.张 之南, 沈 悌. 血液病诊断及疗效标准[M] 3版. 北京: 科学出版社; 2007. pp. 116–121. [Google Scholar]
- 7.Paillisson A, Levasseur A, Gouret P, et al. Bromodomain testis-specific protein is expressed in mouse oocyte and evolves faster than its ubiquitously expressed paralogs BRD2, -3, and -4[J] Genomics. 2007;89(2):215–223. doi: 10.1016/j.ygeno.2006.09.002. [DOI] [PubMed] [Google Scholar]
- 8.Zhang Y, Chen A, Yan XM, et al. Disordered epigenetic regulation in MLL-related leukemia[J] Int J Hematol. 2012;96(4):428–437. doi: 10.1007/s12185-012-1180-0. [DOI] [PubMed] [Google Scholar]
- 9.Dawson MA, Prinjha RK, Dittmann A, et al. Inhibition of BET recruitment to chromatin as an effective treatment for MLL-fusion leukaemia[J] Nature. 2011;478(7370):529–533. doi: 10.1038/nature10509. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Gluzman DF, Nadgornaya VA, Sklyarenko LM, et al. Study of morphocytochemical and immunophenotypic features of acute leukemia stem cells[J] Exp Oncol. 2008;30(2):102–105. [PubMed] [Google Scholar]
- 11.Li L, Osdal T, Ho Y, et al. SIRT1 activation by a c-MYC oncogenic network promotes the maintenance and drug resistance of human FLT3-ITD acute myeloid leukemia stem cells[J] Cell Stem Cell. 2014;15(4):431–446. doi: 10.1016/j.stem.2014.08.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Bernt KM, Hunger SP. Current concepts in pediatric Philadelphia chromosome-positive acute lymphoblastic leukemia[J] Front Oncol. 2014;4:54. doi: 10.3389/fonc.2014.00054. [DOI] [PMC free article] [PubMed] [Google Scholar]