Abstract
目的
比较尼洛替尼与伊马替尼一线治疗初发慢性髓性白血病(CML)慢性期(CP)患者的细胞遗传学和分子学反应获得率、预后及血液学不良反应的差异。
方法
回顾性分析2006年1月至2018年12月诊治的初诊且尼洛替尼或伊马替尼作为一线治疗的CML-CP患者的连续病例资料。
结果
共524例患者纳入研究,其中伊马替尼治疗组439例(83.8%),尼洛替尼治疗组85例(16.2%)。与伊马替尼组相比,尼洛替尼组患者更为年轻(P=0.019),Sokal积分中/高危患者(P<0.001)、WBC≥100×109/L(P<0.001)、HGB<120 g/L(P<0.001)、骨髓原始细胞(P=0.026)、脾脏可触及肿大(P<0.001)比例显著增高,诊断距服用TKI时间显著延长(P=0.003)。中位治疗57(3~153)个月,与伊马替尼组相比,尼洛替尼组患者更快、更高比例获得完全细胞遗传学反应(CCyR)(P=0.011)、主要分子学反应(MMR)(P=0.001)和分子学反应4.5(MR4.5)(P=0.046)。两组间6年无治疗失败生存(FFS)、无疾病进展生存(PFS)和总生存(OS)率差异均无统计学意义(P>0.05)。多因素分析显示,服用伊马替尼是获得CCyR(OR=0.6,95% CI 0.5~0.8,P=0.001)、MMR(OR=0.6,95%CI 0.5~0.8,P=0.001)和MR4.5(OR=0.6,95%CI 0.5~0.9,P=0.032)的不利因素,并与较差的FFS(OR=1.9,95%CI 1.0~3.4,P=0.041)显著相关。Sokal中/高危与较低的细胞遗传学和分子学反应获得率和较差的FFS、PFS、OS相关。此外,男性、诊断时WBC ≥100×109/L或HGB<120 g/L也与较低的细胞遗传学和分子学反应获得率和(或)较差的FFS显著相关。严重的白细胞减少和血小板减少与药物种类无关。
结论
对于初诊CML-CP患者,与伊马替尼相比,尼洛替尼一线治疗能够更快、更早地获得细胞遗传学反应和深层分子学反应,并显著改善FFS。
Keywords: 白血病,髓系,慢性,BCR-ABL阳性, 尼洛替尼, 伊马替尼
Abstract
Objective
To compare the cytogenetic and molecular responses, outcomes and severe hematologic toxicity of nilotinib and imatinib as frontline therapy in newly diagnosed patients with chronic myeloid leukemia in chronic phase(CML-CP).
Methods
Newly diagnosed CML-CP patients were consecutively recruited from January 2006 to December 2018 who received nilotinib and imatinib as first-line treatment. Clinical data were retrospectively analyzed.
Results
A total of 524 patients were classified into 439(83.8%)receiving imatinib and 85(16.2%)receiving nilotinib. Comparing with imatinib group, patients in nilotinib group were much younger(P=0.019)and more with intermediate and high Sokal risks(P<0.001), WBC ≥100×109/L(P<0.001), HGB<120 g/L(P<0.001), blast cells in bone marrow(P=0.026), splenomegaly(P<0.001)by physical examination at diagnosis, and longer interval from diagnosis to TKI treatment(P=0.003). With a median TKI duration of 57(range 3-153)months, the probabilities of complete cytogenetic response(CCyR)(P=0.011), major molecular response(MMR)(P=0.001)and MR4.5(P=0.046)were much higher in nilotinib group than those in imatnib according to each risk group. There is no statistical significance on probabilities of failure free survival(FFS), progression free survival(PFS)and overall survival(OS)at 6 years between the two groups. Multivariate analyses showed that imatinib was an adverse factor associated with achieving CCyR(OR=0.6, 95% CI 0.5-0.8, P=0.001), MMR(OR=0.6, 95% CI 0.5-0.9, P=0.032)and MR4.5(OR=0.6, 95%CI 0.5-0.9, P=0.032)and poor FFS(OR=1.9, 95% CI 1.0-3.4, P=0.041). In addition, Sokal score was an independent factor affecting cytogenetic and molecular responses, treatment failure, disease progression and survival. Male, WBC ≥100×109/L or HGB<120 g/L at diagnosis were significantly associated with lower cytogenetic and molecular response rates and/or poor FFS. The severe hematologic adverse events were not associated with different TKIs.
Conclusion
Nilotinib reaches to the faster and deeper cytogenetic and molecular responses and significantly improves FFS than imatinib in newly diagnosed patients with CML-CP.
Keywords: Leukemia,myeloid,chronic,BCR-ABL positive, Nilotinib, Imatinib
伊马替尼作为慢性髓性白血病慢性期(CML-CP)患者的一线治疗选择显著改善了治疗结果[1]–[3],二代酪氨酸激酶抑制剂(TKI)尼洛替尼、达沙替尼使初发CML-CP患者获得了更快、更深的分子学反应。尽管二代TKI作为一线治疗与伊马替尼相比患者生存期无明显延长,但显著降低了中高危患者的疾病进展比例,也为部分患者较早达到停药“门槛”提供了可能[4]–[7]。纳入中国初发CML-CP患者的ENESTChina试验证实了国际研究的结果[8],但尼洛替尼在中国上市后,来自真实世界比较伊马替尼和尼洛替尼的临床研究较少[9]–[10]。为此我们回顾性分析了本所2006年以后使用上述两种TKI作为一线治疗的CML-CP患者治疗结果及相关影响因素。
病例与方法
一、病例
2006年1月至2018年12月诊断CML-CP、具有b2a2和(或)b3a2转录本、具有可评估Sokal积分、并于6个月内服用伊马替尼(商品名格列卫®,瑞士诺华公司产品)或尼洛替尼(商品名达希纳®,瑞士诺华公司产品)作为一线治疗、TKI服用时间≥3个月、在北京大学人民医院江倩医师门诊规律诊疗的连续成人病例纳入本项研究。收集患者初诊时的人口学特征、血细胞计数、外周血和骨髓中原始细胞和嗜碱性粒细胞比例、脾脏大小、Sokal积分、TKI种类、剂量调整和转换、治疗中血细胞计数变化、细胞遗传学及分子学检测的结果。CML疾病分期采用MDACC标准。患者的治疗及检测依据欧洲白血病网(ELN)推荐及中国CML诊断与治疗指南进行[11]–[14]。
二、治疗
伊马替尼400 mg每日1次或尼洛替尼300 mg每日2次。根据患者合并症、合并用药、经济负担及治疗目标等进行用药选择。治疗中根据治疗反应和(或)不良反应调整药物剂量或种类。
三、监测
参照《中国慢性髓性白血病诊疗监测规范(2014年版)》[13]对患者进行监测。
1.血液学:治疗的前3个月,每1~2周检测血细胞计数及血涂片分类1次。获得完全血液学反应(CHR)后,每3个月检测1次。
2.细胞遗传学:采用骨髓标本,染色体G显带法,至少计数20个分裂象,每3个月检测1次,直至达到完全细胞遗传学反应(CCyR)。
3.分子学:通过实时定量聚合酶链反应(RQ-PCR)法检测BCR-ABL转录本(b2a2/b3a2)水平,采用外周血标本,以ABL为内参基因,ABL拷贝数至少32 000。BCR-ABL转录本水平=BCR-ABL拷贝数/ABL拷贝数×100%,以国际标准化(IS)数值表达。每3个月监测1次,获得主要分子学反应(MMR)后,每3~6个月监测1次。
四、评估指标及定义
1.治疗反应:根据《中国慢性髓性白血病诊断与治疗指南(2016年版)》[14]定义如下:①CHR:PLT<450×109/L,WBC<10×109/L,外周血中人工分类无不成熟粒细胞,嗜碱性粒细胞<0.05,无CML症状和体征,脾脏不能触及;②CCyR:Ph+细胞=0;③MMR:BCR-ABLIS≤0.1%;④分子学反应4.5(MR4.5):BCR-ABLIS≤0.0032%(ABL转录本≥32 000)。
2.治疗失败、疾病进展和生存:根据ELN2013推荐评估是否达到治疗失败[11]。无治疗失败生存(FFS)期定义为从开始TKI治疗直至ELN定义的治疗失败或末次随访的时间。无疾病进展生存(PFS)期定义为从开始TKI治疗直至进展到加速期(AP)/急变期(BP)、任何原因所致的死亡或末次随访的时间。总生存(OS)期定义为开始TKI治疗直至因任何原因死亡或末次随访的时间。
3.血液学不良反应:根据美国国立卫生研究院/美国国家癌症研究所公布的常见毒性标准CTCAE 4.03版本,白细胞和血小板减少≥3级分别定义为WBC<2.0×109/L和PLT<50×109/L,4级分别为WBC<1.0×109/L和PLT<25×109/L。
五、随访
采用电话或查阅病历的方式进行随访。随访截止时间为2019年7月。
六、统计学处理
患者人口学及疾病特征采用描述性统计分析,连续性变量采用Mann-Whitney检验,二分类变量采用Pearson卡方检验或Fisher确切概率法。单因素分析P<0.2的变量代入二元Logistic回归模型进行严重血液学不良反应相关因素的多因素分析。CCyR、MMR和MR4.5的获得可能性以及FFS、PFS和OS,采用Kaplan-Meier生存曲线进行分析、Log-rank检验进行比较,单因素分析P<0.2的变量代入Cox回归模型进行多因素分析。P<0.05为差异有统计学意义。所有统计学分析均采用SPSS 22.0软件进行。
结果
一、患者特征
共524例患者资料可供分析,其中439例(83.8%)服用伊马替尼,85例(16.2%)服用尼洛替尼作为一线治疗,中位治疗时间49(3~153)个月。与伊马替尼组相比,尼洛替尼组中位年龄显著降低[40(18~83)岁对37(18~73)岁,P=0.019],Sokal积分中、高危患者比例显著升高(P<0.001),WBC≥100×109/L(P<0.001)、HGB<120 g/L(P<0.001)、骨髓原始细胞(P=0.021)、脾脏可触及肿大(P<0.001)比例显著增高,诊断距服用TKI时间显著延长(P=0.003),其他疾病特征和追踪时间两组间差异无统计学意义(表1)。
表1. 524例伊马替尼、尼洛替尼作为一线治疗的慢性髓性白血病慢性期患者特征.
| 特征 | 伊马替尼(439例) | 尼洛替尼(85例) | χ2值/Z值 | P值 |
| 性别[例(%)] | 0.254 | 0.614 | ||
| 男 | 271(61.7) | 50(58.8) | ||
| 女 | 168(38.3) | 35(41.2) | ||
| 年龄[岁,M(范围)] | 40(18~83) | 37(18~73) | 5.028 | 0.089 |
| 18~<40岁[例(%)] | 217(49.4) | 52(61.2) | ||
| 40~<60岁[例(%)] | 182(41.5) | 29(34.1) | ||
| ≥60岁[例(%)] | 40(9.1) | 4(4.7) | ||
| 合并症[例(%)] | 3.000 | 0.083 | ||
| 有 | 110(25.1) | 29(34.1) | ||
| 无 | 329(74.9) | 56(65.9) | ||
| Sokal积分[例(%)] | 21.050 | <0.001 | ||
| 低危 | 242(55.1) | 26(30.6) | ||
| 中危 | 128(29.2) | 31(36.5) | ||
| 高危 | 69(15.7) | 28(32.9) | ||
| 诊断至服用TKI时间[月,M(范围)] | 0.5(0~6) | 1(0~6) | -2.566 | 0.003 |
| WBC[×109/L,M(范围)] | 94.9(3.9~723.7) | 162.7(7.3~754.7) | -3.754 | <0.001 |
| HGB[g/L,M(范围)] | 120(61~177) | 107(68~162) | -3.855 | <0.001 |
| PLT[×109/L,M(范围)] | 396(52~2360) | 413(69~2887) | -1.421 | 0.119 |
| 外周血原始细胞[M(范围)] | 0(0~0.14) | 0.01(0~0.13) | -2.174 | 0.026 |
| 外周血嗜碱性粒细胞[M(范围)] | 0.04(0~0.19) | 0.04(0~0.16) | -0.970 | 0.268 |
| 骨髓原始细胞[M(范围)] | 0.020(0~0.120) | 0.020(0~0.130) | -2.473 | 0.021 |
| 骨髓Ph+附加异常[例(%)] | 15(2.5) | 2(2.4) | 0.003 | 0.960 |
| 脾脏可触及肿大[例(%)] | 188(42.8) | 58(68.2) | 19.599 | <0.001 |
| TKI治疗时间[月,M(范围)] | 66(4~153) | 51(9~128) | -2.480 | 0.075 |
注:TKI:酪氨酸激酶抑制剂
随访期内,伊马替尼组中因疗效不佳50例(11.4%)转换为二代TKI,2例(0.5%)进入临床试验或接受化疗,10例(2.3%)进行了造血干细胞移植;尼洛替尼组中19例(22.4%)由于经济因素或不耐受转换为伊马替尼治疗,1例(1.2%)进入临床试验或化疗,13例(15.3%)由于疗效不佳或不耐受转换为达沙替尼治疗,2例(2.4%)进行了造血干细胞移植。截至末次随访,495例患者仍在服用TKI,其中,355例服用伊马替尼(300 mg/d 74例,400 mg/d 274例,600 mg/d 6例, 800 mg/d 1例),76例服用尼洛替尼(450 mg/d 32例,600 mg/d 41例,800 mg/d 3例),33例服用达沙替尼(70 mg/d 5例,100 mg/d 26例,140 mg/d 2例)。
二、治疗反应和生存
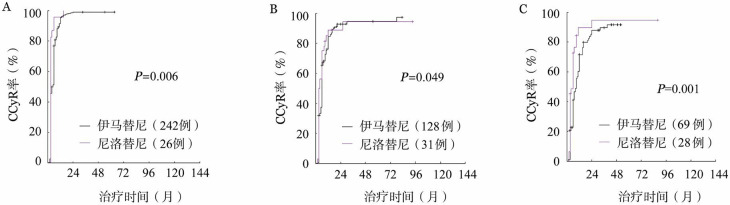
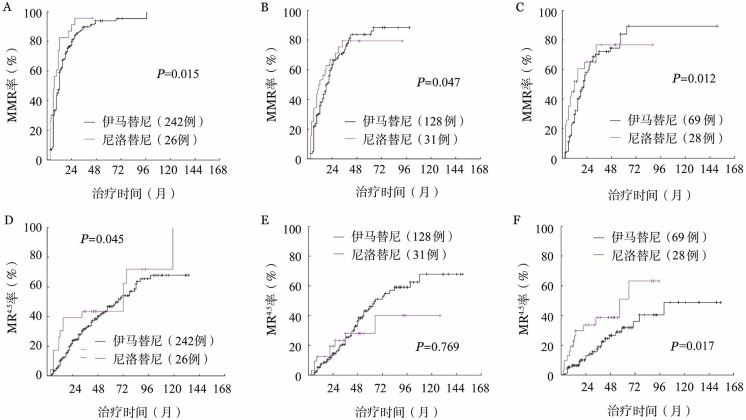
1.血液学、细胞遗传学和分子学反应:伊马替尼组和尼洛替尼组患者中,3个月时可评估获得CHR的患者分别为432例(98.4%)和84例(98.8%)(P=0.351)。两组患者中位随访时间分别为66(3~153)个月和50(9~128)个月,伊马替尼组1、3、6年累积CCyR获得率分别为88.3%、95.6%、97.3%,MMR获得率分别为48.0%、85.7%、95.8%,MR4.5获得率分别为11.0%、30.5%、54.3%;尼洛替尼组1、3、6年累积CCyR获得率分别为91.1%、96.1%、96.1%,MMR获得率分别为60.6%、84.7%、84.7%,MR4.5获得率分别为21.0%、36.0%、54.8%,尼洛替尼组患者更快、更高比例获得CCyR(P=0.011)、MMR(P=0.001)和MR4.5(P=0.046)。根据Sokal积分分层,无论是低、中、高危患者,与伊马替尼组相比,尼洛替尼组几乎均显示更快获得了细胞遗传学及分子学反应(除中危组MR4.5差异无统计学意义外)(图1、2)。
图1. 不同Sokal危险度组服用尼洛替尼与伊马替尼患者的完全细胞遗传学反应(CCyR)获得率比较.
A:低危组;B:中危组;C:高危组
图2. 不同Sokal危险度组服用尼洛替尼与伊马替尼患者的主要分子学反应(MMR)、分子学反应4.5(MR4.5)获得率比较.
A、B、C分别为低、中、高危组MMR获得率比较;D、E、F分别为低、中、高危组MR4.5获得率比较
在524例患者中分析获得细胞遗传学和分子学反应的影响因素,包括TKI种类、性别、年龄、疾病危险度Sokal积分、有无合并症、诊断时WBC和HGB。单因素分析结果见表2。多因素分析结果显示,服用伊马替尼而非尼洛替尼、诊断时WBC≥100×109/L与较低的CCyR、MMR和MR4.5获得率显著相关。此外,男性、Sokal中/高危、HGB<120 g/L也是与较低CCyR、MMR和(或)MR4.5获得率相关的因素(表3)。
表2. 影响慢性髓性白血病慢性期患者治疗反应和生存的单因素分析结果(P值).
| 因素 | CCyR | MMR | MR4.5 | FFS | PFS | OS |
| 男性 | 0.089 | 0.007 | 0.002 | 0.014 | 0.465 | 0.921 |
| 年龄 | 0.226 | 0.615 | 0.024 | 0.914 | 0.309 | 0.078 |
| 18~<40岁 | ||||||
| 40~<60岁 | ||||||
| ≥60岁 | ||||||
| Sokal积分 | 0.001 | <0.001 | 0.184 | <0.001 | 0.001 | 0.009 |
| 低危 | ||||||
| 中危 | ||||||
| 高危 | ||||||
| 诊断时WBC≥100×109/L | <0.001 | <0.001 | <0.001 | 0.003 | 0.058 | 0.245 |
| 诊断时HGB<120g/L | <0.001 | <0.001 | 0.002 | 0.005 | 0.059 | 0.391 |
| 服用伊马替尼(尼洛替尼为参考组) | 0.011 | 0.001 | 0.046 | 0.137 | 0.783 | 0.727 |
| 有合并症 | 0.670 | 0.783 | 0.588 | 0.503 | 0.535 | 0.234 |
注:CCyR:完全细胞遗传学反应;MMR:主要分子学反应;MR4.5:分子学反应4.5;FFS:无治疗失败生存;PFS:无疾病进展生存;OS:总生存
表3. 影响慢性髓性白血病慢性期患者治疗反应的多因素分析结果.
| 因素 | CCyR |
MMR |
MR4.5 |
||||||
| OR | 95% CI | P值 | OR | 95% CI | P值 | OR | 95% CI | P值 | |
| 男性 | 0.7 | 0.6~0.9 | 0.001 | 0.6 | 0.4~0.9 | 0.003 | |||
| 年龄 | 0.023 | ||||||||
| 18~<40岁(参考组) | |||||||||
| 40~<60岁 | 1.4 | 1.0~1.8 | 0.030 | ||||||
| ≥60岁 | 0.7 | 0.4~1.3 | 0.305 | ||||||
| Sokal积分 | <0.001 | 0.005 | |||||||
| 低危(参考组) | |||||||||
| 中危 | 0.7 | 0.6~0.9 | 0.008 | 0.7 | 0.6~0.9 | 0.005 | |||
| 高危 | 0.6 | 0.5~0.8 | <0.001 | 0.7 | 0.5~0.9 | 0.013 | |||
| 诊断时WBC≥100×109/L | 0.7 | 0.6~0.9 | 0.002 | 0.6 | 0.4~0.7 | <0.001 | 0.4 | 0.3~0.5 | <0.001 |
| 诊断时HGB<120g/L | 0.7 | 0.6~1.0 | 0.090 | ||||||
| 服用伊马替尼(尼洛替尼为参考组) | 0.6 | 0.5~0.8 | 0.001 | 0.6 | 0.5~0.8 | 0.001 | 0.6 | 0.5~0.9 | 0.032 |
注:CCyR:完全细胞遗传学反应;MMR:主要分子学反应;MR4.5:分子学反应4.5
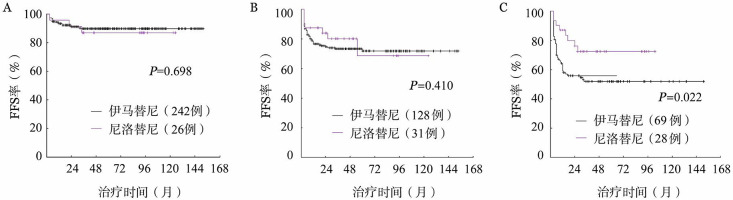
2.治疗失败、疾病进展和生存:随访期间,伊马替尼组和尼洛替尼组分别有132例和17例患者在中位治疗6(3~60)个月和12(3~55)个月时发生治疗失败,24例和6例在中位13(3~84)个月和29(9~47)个月进展为AP或BP。伊马替尼组中,14例患者死亡,其中3例死于非CML的原因(脑出血2例,乳腺癌1例),11例死于疾病进展;尼洛替尼组中,3例死亡,均死于疾病进展。伊马替尼组和尼洛替尼组的6年FFS率分别为78.8%和82.4%(P=0.137),6年PFS率分别为94.0%和91.1%(P=0.783),6年OS率分别为96.3%和91.7%(P=0.727),差异均无统计学意义。根据Sokal积分分层后,高危组中,服用尼洛替尼患者的6年FFS率显著高于服用伊马替尼患者(图3)。
图3. 不同Sokal危险度组服用尼洛替尼与伊马替尼患者的无治疗失败生存(FFS)比较.
A:低危组;B:中危组;C:高危组
在全部患者中分析与获得FFS、PFS和OS相关的影响因素,包括因素同前文所述,单因素分析结果见表2。多因素分析结果显示,服用伊马替尼而非尼洛替尼、男性、Sokal中/高危与较差的FFS显著相关;此外,Sokal积分也是PFS和OS的独立影响因素(表4)。
表4. 影响慢性髓性白血病慢性期患者治疗失败(FFS)、疾病进展(PFS)和生存(OS)的多因素分析结果.
| 因素 | FFS |
PFS |
OS |
||||||
| OR | 95% CI | P值 | OR | 95% CI | P值 | OR | 95% CI | P值 | |
| 男性 | 2.0 | 1.2~3.3 | 0.002 | ||||||
| Sokal积分 | <0.001 | 0.004 | 0.029 | ||||||
| 低危(参考组) | |||||||||
| 中危 | 2.4 | 1.4~4.0 | 0.001 | 3.4 | 1.3~9.2 | 0.013 | 2.6 | 0.7~9.0 | 0.147 |
| 高危 | 4.4 | 2.6~7.4 | <0.001 | 5.4 | 2.0~14.5 | 0.001 | 5.3 | 1.5~18.0 | 0.008 |
| 服用伊马替尼(尼洛替尼为参考组) | 2.0 | 1.1~3.3 | 0.041 | ||||||
三、严重白细胞、血小板减少的发生情况
在患者服用伊马替尼或尼洛替尼、未转换另一种治疗期间,伊马替尼组中59例(13.4%)发生≥3级白细胞和(或)血小板减少,中位发生时间为治疗1(0.1~7)个月时,持续0.5(0.1~6.5)个月,除7例患者外均恢复正常。尼洛替尼组中,18例(20.9%)发生≥3级白细胞和(或)血小板减少,中位发生时间为治疗1(0.2~3)个月时,持续0.9(0.4~2.8)个月,除2例患者外均恢复正常。单因素分析显示,尼洛替尼组患者血液学不良反应发生率高于伊马替尼组患者(P=0.053)。
分析影响≥3级白细胞和(或)血小板减少发生率的相关因素,包括因素同前文所述。多因素分析结果显示,仅诊断时Sokal高危(OR=2.4,95%CI 1.2~4.5,P=0.009)是发生严重血液学不良反应的独立影响因素,而与TKI种类无关。
讨论
本研究比较了初发CML-CP患者服用伊马替尼或尼洛替尼的治疗结果。无论在Sokal低危还是中、高危患者中,与伊马替尼组相比,尼洛替尼组患者的CCyR、MMR、MR4.5获得率均显著升高,严重血液学不良反应发生率与用药种类无关。此外,男性、Sokal中/高危、诊断时WBC≥100×109/L或HGB<120 g/L与较低的细胞遗传学和分子学反应获得率和(或)较差的FFS显著相关。
本研究为真实世界的数据,用药选择是考虑到患者的个体状况、合并症和经济承受能力等因素情况下由患者和医师共同决定的。经过多因素分析,本研究得到了与ENESTnd和ENESTChina随机对照研究一致的结果,尼洛替尼较伊马替尼在初发CML-CP患者CCyR、MMR、MR4.5获得率上有明显优势,而且在Sokal低、中、高危各组中均有体现[5]–[6],[8]。此外,与尼洛替尼相比,伊马替尼是影响患者FFS的独立不良因素,即证实了尼洛替尼较伊马替尼显著减少了治疗失败的发生率。
本研究与既往研究发现相似,Sokal中、高危患者具有较低的细胞遗传学、分子学反应获得率和较差的FFS、PFS和OS,而尼洛替尼可以显著改善各期患者的治疗反应,而且是改善FFS的有利因素,支持NCCN指南等推荐:Sokal中、高危患者宜首选尼洛替尼等二代TKI(而非伊马替尼)为一线治疗,以期改善这些患者的不良预后。此外,本研究与既往研究具有相似的发现:男性、诊断时WBC≥ 100×109/L、HGB<120 g/L与较低的CCyR、MMR、MR4.5获得率或较差的FFS显著相关[15]–[17],提示,此类患者可能也会获益于二代TKI作为一线治疗。
本研究中,尼洛替尼组患者发生≥3级白血病和(或)血小板减少的比例(20.9%)高于伊马替尼组(13.4%),但多因素分析显示,TKI种类并不影响严重血液学不良反应的发生率,分析这种现象与尼洛替尼组中有更高比例的Sokal中、高危患者以及诊断时WBC ≥100×109/L的患者相关。在我们既往的研究中发现,上述因素与严重血液学不良反应高发相关[18]。
本研究尚存在以下缺陷:①本研究为回顾性研究。②由于二代TKI在国内上市较晚,而且曾经价格较高、未纳入国家医保目录,因而限制了使用,因此本研究中以尼洛替尼作为一线治疗的患者数量相对较少。③临床实践中,既往由于患者经济条件等因素,尼洛替尼多用于Sokal中、高危患者,导致伊马替尼和尼洛替尼两组在疾病危险度上有偏倚,但我们试图用多因素分析进行调整。
总之,对于初诊CML-CP患者,与伊马替尼相比,使用尼洛替尼能够更快地获得细胞遗传学反应和深层分子学反应,为Sokal中、高危患者降低治疗失败和改善总体治疗结局提供了更多保障,为将来追求停药的患者提供了更多机会。
Funding Statement
基金项目:国家自然科学基金(81770161)
Fund program: National Natural Science Foundation of China(81770161)
References
- 1.Hochhaus A, Larson RA, Guilhot F, et al. Long-term outcomes of imatinib treatment for chronic myeloid leukemia[J] N Engl J Med. 2017;376(10):917–927. doi: 10.1056/NEJMoa1609324. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Kalmanti L, Saussele S, Lauseker M, et al. Safety and efficacy of imatinib in CML over a period of 10 years: data from the randomized CML-study IV[J] Leukemia. 2015;29(5):1123–1132. doi: 10.1038/leu.2015.36. [DOI] [PubMed] [Google Scholar]
- 3.Bower H, Björkholm M, Dickman PW, et al. Life expectancy of patients with chronic myeloid leukemia approaches the life expectancy of the general population[J] J Clin Oncol. 2016;34(24):2851–2857. doi: 10.1200/JCO.2015.66.2866. [DOI] [PubMed] [Google Scholar]
- 4.Kantarjian H, Flinn IW, Goldberg S, et al. Nilotinib versus imatinib in patients (pts) with newly diagnosed chronic myeloid leukemia in chronic phase (CML-CP): ENESTnd 3-year (yr) follow-up (f/u)[J] Plos One. 2012;9(9):e107367–e107367. doi: 10.1038/leu.2012.134. [DOI] [Google Scholar]
- 5.Larson RA, Kim DW, Jootar S, et al. ENESTnd 5-year (y) update: Long-term outcomes of patients (pts) with chronic myeloid leukemia in chronic phase (CML-CP) treated with frontline nilotinib (NIL) versus imatinib (IM)[J] 2014. http://ascopubs.org.
- 6.Hochhaus A, Saglio G, Hughes TP, et al. Long-term benefits and risks of frontline nilotinib vs imatinib for chronic myeloid leukemia in chronic phase: 5-year update of the randomized ENESTnd trial[J] Leukemia. 2016;30(5):1044–1054. doi: 10.1038/leu.2016.5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Cortes JE, Saglio G, Kantarjian HM, et al. Final 5-Year Study Results of DASISION: The Dasatinib Versus Imatinib Study in Treatment-Naïve Chronic Myeloid Leukemia Patients Trial[J] J Clin Oncol. 2016;34(20):2333–2340. doi: 10.1200/JCO.2015.64.8899. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Wang J, Shen ZX, Saglio G, et al. Phase 3 study of nilotinib vs imatinib in Chinese patients with newly diagnosed chronic myeloid leukemia in chronic phase: ENESTchina[J] Blood. 2015;125(18):2771–2778. doi: 10.1182/blood-2014-09-601674. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.殷 华, 陈 丽凤, 崔 杰克, et al. 尼洛替尼和伊马替尼一线治疗初诊慢性髓性白血病慢性期的比较[J] 中华内科杂志. 2017;56(11):810–815. doi: 10.3760/cma.j.issn.0578-1426.2017.11.007. [DOI] [Google Scholar]
- 10.陈 锋文, 何 宏梅. 伊马替尼、尼洛替尼和达沙替尼对慢性粒细胞白血病慢性期的临床分析[J] 中外医学研究. 2019;17(10):15–17. doi: 10.14033/j.cnki.cfmr.2019.10.007. [DOI] [Google Scholar]
- 11.Baccarani M, Deininger MW, Rosti G, et al. European LeukemiaNet recommendations for the management of chronic myeloid leukemia: 2013[J] Blood. 2013;122(6):872–884. doi: 10.1182/blood-2013-05-501569. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.中华医学会血液学分会. 中国慢性髓系白血病诊断与治疗指南(2011年版)[J] 中华血液学杂志. 2011;32(6):426–432. doi: 10.3760/cma.j.issn.0253-2727.2011.06.020. [DOI] [Google Scholar]
- 13.中华医学会血液学分会实验诊断学组, 中国慢性髓性白血病联盟专家组. 中国慢性髓性白血病诊疗监测规范(2014年版)[J] 中华血液学杂志. 2014;35(8):781–784. doi: 10.3760/cma.j.issn.0253-2727.2014.08.030. [DOI] [Google Scholar]
- 14.中华医学会血液学分会. 中国慢性髓性白血病诊断与治疗指南(2016年版)[J] 中华血液学杂志. 2016;37(8):633–639. doi: 10.3760/cma.j.issn.0253-2727.2016.08.001. [DOI] [Google Scholar]
- 15.Jiang Q, Wang HB, Yu L, et al. Variables associated with patient-reported outcomes in persons with chronic myeloid leukemia receiving tyrosine kinase-inhibitor therapy[J] J Cancer Res Clin Oncol. 2017;143(6):1013–1022. doi: 10.1007/s00432-017-2353-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Jiang Q, Xu LP, Liu DH, et al. Imatinib mesylate versus allogeneic hematopoietic stem cell transplantation for patients with chronic myelogenous leukemia in the accelerated phase[J] Blood. 2011;117(11):3032–3040. doi: 10.1182/blood-2010-09-308510. [DOI] [PubMed] [Google Scholar]
- 17.Larson RA, Druker BJ, Guilhot F, et al. Imatinib pharmacokinetics and its correlation with response and safety in chronic-phase chronic myeloid leukemia: a subanalysis of the IRIS study[J] Blood. 2008;111(8):4022–4028. doi: 10.1182/blood-2007-10-116475. [DOI] [PubMed] [Google Scholar]
- 18.于 露, 秦 亚溱, 赖 悦云, et al. 慢性髓性白血病患者服用酪氨酸激酶抑制剂期间发生的严重血液学不良反应及其对治疗反应的影响[J] 中华血液学杂志. 2019;40(4):281–287. doi: 10.3760/cma.j.issn.0253-2727.2019.04.004. [DOI] [Google Scholar]