急性髓系白血病(AML)患者的长期疗效在近20年得到了明显改善[1]–[3],柔红霉素(DNR)或去甲氧柔红霉素联合阿糖胞苷(Ara-C)(DA或IDA)方案(又称“3+7方案”)目前已经是公认的AML的标准诱导化疗方案。然而诱导后的最佳巩固治疗,目前尚无定论。一项随机对照研究证实4个疗程大剂量(HD)Ara-C(3 g/m2,每日2次,共3 d)作为巩固治疗,患者的总体生存(OS)和无病生存(DFS)均优于400 mg/m2 Ara-C和100 mg/m2 Ara-C的巩固治疗组[4]。因此,HD-Ara-C已经成为国际上AML较为标准的一线巩固治疗方案。国内关于HD-Ara-C巩固治疗的研究较少。因此,我们回顾性分析我院使用HD-Ara-C方案作为巩固治疗的初治AML患者的安全性和长期疗效。
病例与方法
1.患者资料:回顾性分析108例2012年7月至2016年7月在我院接受过至少1个疗程HD-Ara-C(3 g/m2,每日2次,共3 d)作为巩固方案治疗的初治非急性早幼粒细胞白血病的AML患者的临床资料。所有患者根据细胞形态学、免疫表型分析、细胞遗传学和分子生物学检测结果,分别按照WHO 2008诊断标准[5]以及FAB形态学诊断标准[6]进行确诊和分型。
2.细胞遗传学、分子生物学检测以及预后分层:采集患者骨髓,用R显带方法进行染色体核型分析,用实时定量PCR检测AML1-ETO、CBFB-MYH11和BCR-ABL融合基因,用测序法检测FLT3-ITD、c-Kit和NPM1突变,用荧光原位杂交(FISH)技术检测inv(16)、t(8;21)、t(9;22)。按照NCCN标准[7]对患者进行危险分组:①预后良好组:有t(8;21)或inv(16),或正常核型伴有NPM1突变阳性同时FLT3-ITD突变阴性;②预后不良组:复杂核型(≥3种克隆性核型异常),−5,5q−,−7,7q−,inv(3),t(3;3),t(6;9),t(9;22),非t(9;11)的11q23异常以及正常核型伴有FLT3-ITD突变型;③预后中等组:正常核型,+8,t(9;11),其他非上述两组染色体核型异常以及有t(8;21)、inv(16)或t(16;16)伴有c-Kit突变。
3.治疗方案:诱导治疗:对于高白细胞患者(WBC≥100×109/L),诱导化疗前采用羟基脲降低白血病细胞负荷,在WBC<50×109/L时进行诱导化疗。诱导化疗方案包括DA、MA、IDA或CAG方案。DA方案:DNR 30~60 mg·m−2·d−1,静脉滴注,第1~3天;Ara-C 100 mg/m2,皮下注射,每12 h 1次,第1~7天。MA方案:米托蒽醌10 mg·m−2·d−1,静脉滴注,第1~3天;Ara-C 100 mg/m2,皮下注射,每12 h 1次,第1~7天。IDA方案:去甲氧柔红霉素8~10 mg·m−2·d−1,静脉滴注,第1~3天;Ara-C 100 mg/m2,皮下注射,每12 h 1次,第1~7天。CAG方案:G-CSF 300 µg/d,皮下注射,第1~14天;Ara-C 10 mg/m2,皮下注射,每12 h 1次,第1~14天;阿克拉霉素10 mg/d,静脉滴注,第1~10天。骨髓抑制期HGB<60 g/L或出现明显贫血症状时输注悬浮红细胞,PLT<10×109/L或出现出血倾向时输注血小板。
巩固治疗:对于诱导化疗后达到CR者,给予HD-Ara-C(3.0 g/m2,每12 h 1次,第1~3天)巩固治疗,共1~5个疗程。对具备HLA全相合造血干细胞供者的预后中等组或预后不良组患者建议行异基因造血干细胞移植(allo-HSCT)。
4.主要观察指标:记录患者OS时间及DFS时间。观察患者巩固治疗中中性粒细胞(ANC)减少持续时间(从化疗第1日至ANC> 0.5×109/L时间)、PLT减少持续时间(从化疗第1日至PLT >20×109/L)。观察患者巩固治疗中红细胞输注量和PLT输注量,以及巩固治疗中不良事件。OS时间为确诊至患者死亡或末次随访时间(失访时间)。DFS时间为从获CR起至患者复发、死亡或末次随访时间。通过门诊、住院病历查阅及电话进行随访。随访截止日期为2016年8月31日。
5.统计学处理:应用SPSS 21.0软件进行统计学分析。用Kaplan-Meier方法描述生存状态分布,采用Log-rank检验进行单因素预后生存分析,用Cox回归模型进行多因素生存分析。P≤0.05为差异有统计学意义。
结果
1.一般情况:108例患者中,男56例,女52例,中位年龄45(16~70)岁,其中≥60岁患者12例。FAB分型:M0 2例(1.9%)、M1 1例(0.9%)、M2 73例(67.6%)、M4 12例(11.1%)、M5 14例(13.0%)、M6 6例(5.6%)。
2.预后分层:患者染色体核型分布如下:正常核型49例,复杂核型7例,无分裂象或骨髓干抽无染色体结果10例,存在t(8;21)19例(其中2例伴有-Y,2例伴有-X),inv(16)9例,4例患者存在+8[其中1例伴有t(7;11)(p15;p15)、1例伴有t(9;11)(p22;q23)],2例-7[其中1例伴有t(3;5)],−9、−X、t(9;22)、inv(9)(p12;q13)、+19、+4、+2、+11各1例。
本组患者中FLT3-ITD突变阳性11例(11/102,10.8%),NPM1突变阳性12例(12/101,11.9%),c-Kit突变阳性6例(6/102,4.4%)。总的NCCN危险分层包括预后良好组31例,预后中等组59例,预后不良组18例。
3.诱导化疗的方案:108例患者中89例采用DNR 60 mg·m−2·d−1的DA方案诱导治疗,10例采用DNR 45~60 mg·m−2·d−1的DA方案,2例采用DNR 30~45 mg·m−2·d−1的DA方案,2例采用MA方案,2例采用CAG方案,3例患者采用IDA方案。
4.巩固治疗及治疗安全性:108例患者共进行HD-Ara-C巩固治疗304个疗程,中位3(1~5)个疗程。其中仅进行1个疗程22例,2个疗程22例,3个疗程20例,4个疗程42例,5个疗程2例。在12例≥60岁患者中,总共进行了44个疗程HD-Ara-C巩固治疗,中位4(1~5)个疗程。移植方面,总共有15例(12.0%)患者接受了allo-HSCT,3例(2.8%)患者接受了自体造血干细胞移植。
巩固化疗期间共发生各类感染180例次(59.2%),其中≥60岁患者中发生了17例次。感染包括16例(14.8%)临床诊断真菌感染,2例卡氏肺孢子菌肺炎,1例乙肝病毒再活化以及3例细菌感染所致的感染性休克。特殊感染部位包括3例肛周脓肿,1例胆囊炎,1例皮肤软组织感染。2例患者出现过敏,分别表现为皮疹和药物热。8例(2.6%)患者发生出血事件,包括皮肤黏膜出血6例,阴道出血和咯血各1例。共2例(1.9%)患者在巩固治疗期间出现治疗相关死亡,均为感染性休克,其中1例为60岁以上患者。无一例患者发生神经系统并发症。
患者的中位ANC减少持续时间为15(9~21)d,中位PLT减少持续时间为15(9~23)d。中位输注RBC和PLT量分别为0个单位和1个治疗量。
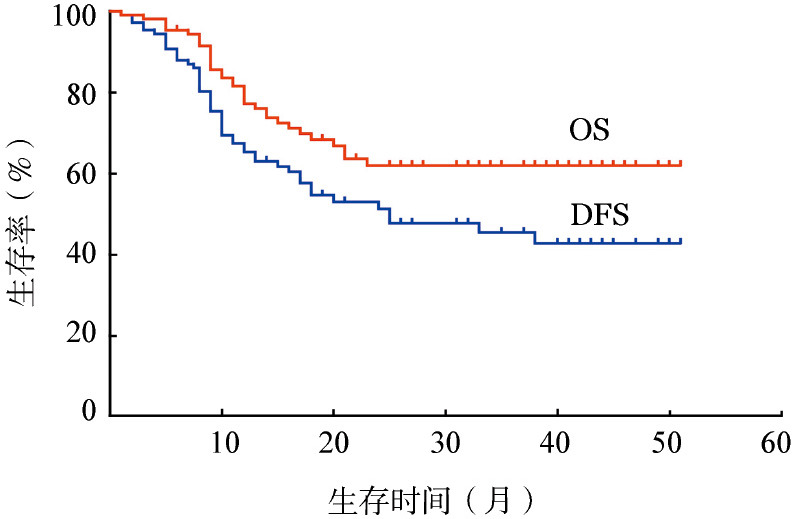
5.长期疗效与生存:截至末次随访时,中位随访了31(6~51)个月。有1例(0.9%)患者失访。42例患者(38.9%)出现疾病复发。34例(31.5%)患者死亡,其中2例死于巩固化疗中的感染性休克,3例死于allo-HSCT相关并发症,1例因其他肿瘤死亡,其他患者均死于白血病进展。73例(67.6%)患者存活。中位DFS时间为25个月,中位OS时间尚未达到(图1)。预计3年DFS和OS率分别为45%和62%。
图1. 108例使用大剂量阿糖胞苷方案巩固治疗的初治急性髓系白血病患者的总体生存(OS)与无病生存(DFS)曲线.
对108例患者进行影响DFS的单因素分析发现:预后不良组中位DFS时间明显低于预后中等组与预后良好组(分别为8个月、33个月、未达到,P<0.001),而预后良好组与预后中等组之间差异无统计学意义;巩固治疗接受>1个疗程HD-Ara-C治疗患者中位DFS时间明显长于仅接受1个疗程HD-Ara-C治疗患者(25个月对11个月,P=0.042);而FLT3-ITD突变阳性患者的中位DFS时间短于野生型患者(9个月对38个月,P=0.003)。Cox多因素分析发现,患者危险分层是否为预后不良组是影响DFS的独立预后因素(HR=3.731,95% CI 1.912~7.246,P<0.001)。而是否接受>1个疗程HD-Ara-C巩固治疗患者的DFS未达到统计学差异(HR=1.845,95% CI 0.972~3.503,P=0.061)。
而影响OS的单因素分析中,预后不良组中位OS时间显著低于预后中等组与预后良好组(分别为12个月、未达到、未达到,P<0.001),而预后中等组与预后良好组间差异无统计学意义;巩固治疗接受>1个疗程HD-Ara-C治疗患者中位OS时间明显长于仅接受1个疗程HD-Ara-C治疗患者(未达到对18个月,P=0.004);FLT3-ITD突变阳性患者中位OS时间短于野生型患者(16个月对未达到,P=0.019)。Cox多因素分析中患者危险分层是否为预后不良组(HR=4.329,95% CI 2.016~9.259,P<0.001)以及是否接受>1个疗程HD-Ara-C巩固治疗(HR=2.547,95% CI 1.224~5. 299,P=0.012)是影响OS的独立预后因素。
讨论
AML获得缓解后如何进行巩固治疗,从而提高AML患者OS一直是研究的重点。Ara-C被认为是AML治疗中的重要药物之一。早年间一般使用100~200 mg/m2共用7~10 d,被称为传统剂量[8]。而随后在具有划时代意义的CALGB-8525研究中,证实4个疗程HD-Ara-C作为巩固治疗,患者的OS和DFS均优于400 mg/m2 Ara-C和100 mg/m2 Ara-C的巩固治疗组[4]。HD-Ara-C因此成为国际上AML较为标准的一线巩固治疗方案。但此后澳大利亚以及SWOG两项随机对照研究比较HD-Ara-C与传统剂量Ara-C联合蒽环类药物诱导治疗年轻初治AML,结果显示HD-Ara-C组DFS显著好于对照组,但两组OS差异无统计学意义[9]–[10]。HD-Ara-C明显增加不良反应,包括血液学、神经系统以及器官不良反应。同样,德国研究组比较了HD-Ara-C与中剂量Ara-C(1 g/m2,每日2次)作为巩固治疗的疗效,结果两组间OS、DFS差异均无统计学意义[11]。因此,HD-Ara-C的治疗地位受到了挑战,有学者提出中剂量Ara-C可以取得与HD-Ara-C同样疗效,并减少治疗相关不良反应。但近期韩国大学医学院比较了HD-Ara-C与中剂量Ara-C联合蒽环类药物作为巩固治疗的疗效,结果显示HD-Ara-C组的OS以及DFS均显著优于中剂量Ara-C组[12]。目前NCCN指南对于年轻初治预后良好组以及预后中等组AML患者仍推荐HD-Ara-C作为巩固治疗方案。我国学者发现含HD-Ara-C的方案巩固治疗伴有t(8;21)的AML-M2患者预后较正常核型患者好[13]。但对于单纯使用HD-Ara-C作为AML巩固治疗方案的大宗研究数据较少。
本研究回顾性分析了单中心108例接受HD-Ara-C作为巩固治疗的患者的疗效以及安全性。入组患者的最大年龄为70岁,超过60岁者12例。结果表明在总共304个疗程的巩固治疗中,主要治疗相关不良反应为感染,但仅3例(2.8%)出现严重感染性休克,其中2例出现治疗相关死亡。巩固治疗期间的感染、出血等并发症发生率、中位ANC减少持续时间和中位PLT减少持续时间均与我院历史数据相当。而本研究中无一例患者出现神经系统不良反应,同时无3级以上脏器不良反应发生。因此HD-Ara-C作为巩固治疗的安全性较好,甚至在一些体能状态良好的老年患者中也可安全使用。
遗传学和分子学异常是AML主要的预后分层依据[14],如FLT3-ITD突变是染色体核型正常患者的独立预后不良因素[15]。法国ALFA-9802研究比较了HD-Ara-C与Ara-C 500 mg/m2共6 d联合米托蒽醌和依托泊苷共3 d的疗效,结果显示在预后中等组HD-Ara-C作为巩固治疗的无事件生存率与OS均显著优于对照组[16]。本研究患者预计3年DFS和OS率分别为45%和62%。预后中等组与预后良好组的中位DFS时间分别为33个月和未达到,而中位OS时间两组均未达到,两组之间DFS和OS差异均无统计学意义,提示HD-Ara-C可能使预后中等组患者明显获益。而预后不良组以及FLT3突变患者的DFS和OS均明显差于非预后不良组和FLT3野生型患者,提示对于分子遗传学明确高危患者,尤其是FLT3突变患者,常规巩固化疗可能不能获益,应寻求更加积极的治疗手段,如allo-HSCT等。目前NCCN指南推荐对于初治AML患者应进行3~4个疗程HD-Ara-C巩固治疗。本研究也证实,使用2个疗程以上HD-Ara-C巩固治疗患者的DFS、OS均明显优于仅巩固治疗1个疗程患者。
AML在老年人中发病率逐年升高,而年龄是AML的独立预后不良因素[17]。这一方面与年龄大患者并发症多,不能耐受强化疗有关,另一方面很多临床试验并不纳入老年患者。而本研究纳入患者的最高年龄为70岁,超过60岁患者占11.1%。体能状况好的超过60岁患者可以很好耐受HD-Ara-C,不良反应并无明显增加。同时,单因素分析中,年龄并非影响DFS和OS的独立预后因素,因此提示,体能状态好、无严重合并症的预后良好组及预后中等组老年AML患者可以从HD-Ara-C的巩固化疗中获益。
总之,本研究结果证实,至少使用两个疗程的HD-Ara-C巩固治疗对于危险度预后良好组和预后中等组的AML患者疗效较好,并不明显增加不良反应。体能状态好、可以耐受大剂量化疗的老年患者也可从HD-Ara-C的巩固治疗中获益。
References
- 1.Burnett AK, Hills RK, Milligan DW, et al. Attempts to optimize induction and consolidation treatment in acute myeloid leukemia: results of the MRC AML12 trial[J] J Clin Oncol. 2010;28(4):586–595. doi: 10.1200/JCO.2009.22.9088. [DOI] [PubMed] [Google Scholar]
- 2.Mandelli F, Vignetti M, Suciu S, et al. Daunorubicin versus mitoxantrone versus idarubicin as induction and consolidation chemotherapy for adults with acute myeloid leukemia: the EORTC and GIMEMA Groups Study AML-10[J] J Clin Oncol. 2009;27(32):5397–5403. doi: 10.1200/JCO.2008.20.6490. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Fernandez HF, Sun Z, Yao X, et al. Anthracycline dose intensification in acute myeloid leukemia[J] N Engl J Med. 2009;361(13):1249–1259. doi: 10.1056/NEJMoa0904544. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Mayer RJ, Davis RB, Schiffer CA, et al. Intensive postremission chemotherapy in adults with acute myeloid leukemia. Cancer and Leukemia Group B[J] N Engl J Med. 1994;331(14):896–903. doi: 10.1056/NEJM199410063311402. [DOI] [PubMed] [Google Scholar]
- 5.Swerdlow SH, Campo E, Harris NL, et al. WHO classification of tumours of haematopoietic and lymphoid tissues[M] 4th, ed. Lyon: IARC Press; 2008. pp. 109–139. [Google Scholar]
- 6.张 之南, 沈 悌. 血液病诊断及疗效标准[M] 2版. 北京: 科学出版社; 1998. pp. 169–194. [Google Scholar]
- 7.O'Donnell MR, Abboud CN, Altman J, et al. NCCN Clinical Practice Guidelines Acute myeloid leukemia[J] J Natl Compr Canc Netw. 2012;10(8):984–1021. doi: 10.6004/jnccn.2012.0103. [DOI] [PubMed] [Google Scholar]
- 8.Löwenberg B, Downing JR, Burnett A. Acute myeloid leukemia[J] N Engl J Med. 1999;341(14):1051–1062. doi: 10.1056/NEJM199909303411407. [DOI] [PubMed] [Google Scholar]
- 9.Bishop JF, Matthews JP, Young GA, et al. A randomized study of high-dose cytarabine in induction in acute myeloid leukemia[J] Blood. 1996;87(5):1710–1717. [PubMed] [Google Scholar]
- 10.Weick JK, Kopecky KJ, Appelbaum FR, et al. A randomized investigation of high-dose versus standard-dose cytosine arabinoside with daunorubicin in patients with previously untreated acute myeloid leukemia: a Southwest Oncology Group study[J] Blood. 1996;88(8):2841–2851. [PubMed] [Google Scholar]
- 11.Schaich M, Röllig C, Soucek S, et al. Cytarabine dose of 36 g/m2 compared with 12 g/m2 within first consolidation in acute myeloid leukemia: results of patients enrolled onto the prospective randomized AML96 study[J] J Clin Oncol. 2011;29(19):2696–2702. doi: 10.1200/JCO.2010.33.7303. [DOI] [PubMed] [Google Scholar]
- 12.Kim DS, Kang KW, Lee SR, et al. Comparison of consolidation strategies in acute myeloid leukemia: high-dose cytarabine alone versus intermediate-dose cytarabine combined with anthracyclines[J] Ann Hematol. 2015;94(9):1485–1492. doi: 10.1007/s00277-015-2389-9. [DOI] [PubMed] [Google Scholar]
- 13.李 红艺, 岳 寒, 魏 旭东, et al. 含大剂量阿糖胞苷方案强化治疗伴t(8;21)和正常核型急性髓系白血病M2患者疗效比较[J] 中华血液学杂志. 2008;29(2):110–112. doi: 10.3321/j.issn:0253-2727.2008.02.009. [DOI] [PubMed] [Google Scholar]
- 14.Mrózek K, Marcucci G, Nicolet D, et al. Prognostic significance of the European LeukemiaNet standardized system for reporting cytogenetic and molecular alterations in adults with acute myeloid leukemia[J] J Clin Oncol. 2012;30(36):4515–4523. doi: 10.1200/JCO.2012.43.4738. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Kottaridis PD, Gale RE, Frew ME, et al. The presence of a FLT3 internal tandem duplication in patients with acute myeloid leukemia (AML) adds important prognostic information to cytogenetic risk group and response to the first cycle of chemotherapy: analysis of 854 patients from the United Kingdom Medical Research Council AML 10 and 12 trials[J] Blood. 2001;98(6):1752–1759. doi: 10.1182/blood.v98.6.1752. [DOI] [PubMed] [Google Scholar]
- 16.Thomas X, Elhamri M, Raffoux E, et al. Comparison of high-dose cytarabine and timed-sequential chemotherapy as consolidation for younger adults with AML in first remission: the ALFA-9802 study[J] Blood. 2011;118(7):1754–1762. doi: 10.1182/blood-2011-04-349258. [DOI] [PubMed] [Google Scholar]
- 17.Juliusson G, Lazarevic V, Hörstedt AS, et al. Acute myeloid leukemia in the real world: why population-based registries are needed[J] Blood. 2012;119(17):3890–3899. doi: 10.1182/blood-2011-12-379008. [DOI] [PMC free article] [PubMed] [Google Scholar]


