Abstract
目的
探讨多参数流式细胞术(MFC)检测微小残留病(MRD)在我国初诊多发性骨髓瘤(MM)患者中的可行性及其预后意义。
方法
回顾性分析2013年6月至2015年6月106例采用MFC进行MRD检测连续收治的初诊MM患者的临床资料。
结果
①106例患者中48例(45.3%)MRD转为阴性,中位达MRD阴性时间为3个月。接受自体造血干细胞移植(ASCT)患者MRD转阴率显著高于未接受ASCT患者(62.2%对36.2%,χ2=6.536,P=0.011)。②48例完全缓解(CR)患者中7例(14.6%)MRD持续阳性,这7例患者中5例已疾病进展,中位无进展生存(PFS)时间为19个月,3例死亡,中位总生存(OS)时间为28个月,MRD持续阳性CR患者的PFS及OS时间均明显短于MRD转阴CR患者(P值均<0.05)。③中位随访38个月,MRD转阴患者的预后显著优于阳性患者,二者中位PFS时间分别为未达到和17个月(P<0.001),中位OS均未达到(P<0.001)。根据MRD水平将患者分为四组:≥1%、0.1%~<1%、0.01%~<0.1%和阴性,结果显示随着MRD水平的降低,患者PFS及OS时间有逐渐延长趋势。④多因素分析显示,MRD是影响MM患者PFS[HR=0.133(95% CI 0.062~0.288),P<0.001]和OS[HR=0.156(95% CI 0.050~0.484),P=0.001]的独立预后因素。根据MRD、细胞遗传学情况将患者分为4组,结果显示MRD转阴的高危患者预后(PFS及OS)明显好于MRD阳性的高危患者(P<0.05),而与MRD转阴的标危患者预后相近(P>0.05)。
结论
ASCT患者中MFC检测的MRD转阴率更高。MRD是MM患者的独立预后因素,根据MRD水平可以对患者预后进行分层。MRD转阴的细胞遗传学高危患者的预后与标危患者相近。MFC检测MRD值得在临床推广应用。
Keywords: 多发性骨髓瘤, 微小残留病, 多参数流式细胞术
Abstract
Objective
To assess the feasibility and prognostic value of the minimal residual disease (MRD) evaluated by multiparameter flow cytometry (MFC) in the newly diagnosed multiple myeloma (MM) patients of China.
Methods
Clinical data of 106 consecutively newly diagnosed MM patients with MRD data were retrospectively analyzed in a single center in China from June 2013 to June 2015.
Results
①Of 106 patients, 48 (45.3%) achieved MRD negativity. The median time to MRD-negative was 3 months. More patients undergoing autologous stem cell transplantation (ASCT) achieved MRD negativity compared with non-ASCT patients (62.2% vs 36.2%, χ2=6.536, P=0.011). ②Of 48 patients in complete remission (CR), 7 (14.6%) was MRD positive, 5 of them showed disease progression (PD) during the follow-up, and 3 died. The median progression free survival (PFS) was 19 months, and the median overall survival (OS) was 28 months, both were significantly shorter than the CR patients with MRD-negative (P<0.05). ③At a median follow-up of 38 months, MRD-negative patients showed significantly superior outcomes compared with MRD positive ones, the PFS was not reach versus 17 months and the OS was not reach for both (P<0.001). Patients were grouped into 4 categories according to their MRD levels: 1% or higher, 0.1% to less than 1%, 0.01% to less than 0.1%, or negative. It showed that the outcomes (PFS and OS) tended to be improved along with the tumor depletion. ④Multivariate prognostic analysis showed that MRD was a powerful independent prognostic factor for PFS[HR=0.133 (95% CI 0.062–0.288), P<0.001] and OS[HR=0.156 (95% CI 0.050–0.484), P=0.001]. According to MRD and cytogenetics, the patients were classified into 4 groups. High risk patients with MRD negative presented a significantly better outcome than high risk patients with MRD-positive, and a similar one to the standard risk patients with MRD-negative.
Conclusion
MRD negativity by MFC was more popular in MM patients undergoing ASCT. MRD was an independent prognostic factor in MM. And the prognosis of MM patients can be stratified according to the level of MRD. MRD-negative patients with high risk cytogenetics presented a similar outcome to the standard risk ones. MRD by MFC should therefore be considered more widely applied in the clinic.
Keywords: Multiple myeloma, Minimal residual disease, Multiparameter flow cytometry
近十余年来,随着新药以及自体造血干细胞移植(ASCT)的广泛应用,多发性骨髓瘤(MM)的疗效得到了显著提高[1]。经过规范治疗,约75%的初诊患者可以获得非常好的部分缓解(VGPR)及以上疗效。因此,需要更加敏感的检测微小残留病(MRD)的技术手段,来深入了解患者缓解程度,指导后续的治疗选择。多参数流式细胞术(MFC)由于具有广泛的可获得性和适用性、检测时间短、简便、费用低等特点,逐渐成为MRD检测的标准方法。近期欧美国家的多个研究显示,在初诊或复发/进展、移植或非移植、细胞遗传学高危或标危MM患者中,MFC检测MRD都具有很好的预后意义[2]。我国这方面工作开展较晚,尚缺乏MFC检测MRD的大系列研究。本中心自2010年开始进行MFC检测MM患者MRD的探索,2013年以后对患者进行系统的MRD检测。本研究对106例具有MRD资料的初诊MM患者进行分析,探讨在我国应用MFC检测MRD的可行性及其预后意义。
病例与方法
1.病例:2013年6月至2015年6月在我院治疗的106例初诊MM患者,所有患者均符合中国MM诊治指南(2015年修订)中MM诊断标准[3]。所有患者均接受了初诊及后续至少1次骨髓MFC检测。男75例,女31例。患者中位年龄56(35~78)岁,其中16例(15.1%)患者年龄>65岁。90例年龄≤65岁的患者中37例(41.1%)进行了一线ASCT。高危间期荧光原位杂交(iFISH)异常定义为伴有P53缺失、IgH/FGFR3易位和IgH/MAF易位3个iFISH异常之一,患者中26例伴有高危iFISH异常。90例(84.9%)患者接受以硼替佐米为基础的诱导治疗,21 d为1个治疗周期。16例(15.1%)患者接受以免疫调节剂为基础的诱导治疗,28 d为1个周期。本研究符合1964年Helsinki宣言的各项规定,经我院伦理委员会批准,并获得了患者的知情同意。
2.MFC检测:所有患者都在初诊时通过骨髓MFC检测异常浆细胞。之后诱导治疗期间每2个周期评估疗效,并通过骨髓MFC复查MRD。诱导及强化治疗结束后每3个月复查MRD。1年后每6个月复查MRD。本研究中仅对治疗后2年内MRD进行统计。具体检测方法如下:①抗体组合:两管法,第1管CD81、CD19、CD56、CD27、CD200、CD20、CD38、CD45;第2管cκ、cλ、CD138、CD28、CD117、CD19、CD38、CD45;②样本制备及检测:取200 µl骨髓液(5×105个细胞),加入上述胞膜抗体,避光孵育30 min;加入红细胞裂解液,混匀后离心洗涤弃上清;将沉淀溶于300 µl PBS缓冲液,过滤后上流式细胞仪(美国BD公司产品)进行检测。获取500 000个有核细胞进行检测。以骨髓中存在正常造血细胞成分及正常浆细胞为标本合格,检测到≥30个异常浆细胞为阳性,检测敏感度为10−4。
3.疗效标准及随访:入选患者基础数据来源于病例资料及数据库。随访资料收集于治疗过程的历次访视。随访截止时间为2017年8月31日。疗效评估采用国际骨髓瘤工作组(IMWG)的标准,即分为完全缓解(CR)、VGPR、部分缓解(PR)、微小缓解(MR)、疾病稳定(SD)、疾病进展(PD)。总体反应率(ORR)定义为PR及以上缓解[4]。总生存(OS)时间为从诊断之日起至患者死亡或随访终点的间隔时间。无进展生存(PFS)时间为从确诊之日起至疾病进展、复发或死亡的间隔时间。
4.统计学处理:生存分析采用Kaplan-Meier法,显著性检验采用Log-rank法,并用Cox-regression进行多参数分析,率的比较采用χ2检验,均数比较采用独立t检验或方差分析的双侧检验,P<0.05为差异有统计学意义。采用SPSS13.0软件进行统计学分析。
结果
1.临床特征相关性分析:期间共进行有效MRD检测401次,平均每例检测3.8次。106例患者中48例(45.3%)MFC检测MRD转为阴性,中位达MRD阴性时间为治疗后3(1.5~24)个月,其中仅5例(10.4%)患者在治疗9个月以后MRD转为阴性。
就患者初诊临床特征进行的分析显示:不同性别、分期、细胞遗传学危险度分层的MM患者其MRD转阴率差异无统计学意义(P值均>0.05);>65岁患者的MRD转阴率仅为25.0%,但与≤65岁患者差异无统计学意义。就治疗情况进行的分析显示:接受ASCT患者MRD转阴率显著高于未接受ASCT患者(χ2=6.536,P=0.011);免疫调节剂诱导治疗(13例以沙利度胺为基础,3例以来那度胺为基础)患者的MRD转阴率较接受硼替佐米者偏低(31.3%对47.8%,P>0.05)(表1)。
表1. 不同临床特征患者MRD转阴率.
| 特征 | 例数 | MRD转阴例数(%) | χ2值 | P值 |
| 性别 | 2.889 | 0.133 | ||
| 男 | 75 | 30(40.0) | ||
| 女 | 31 | 18(58.1) | ||
| 年龄 | 3.129 | 0.077 | ||
| ≤65岁 | 90 | 44(48.9) | ||
| >65岁 | 16 | 4(25.0) | ||
| ISS分期 | 0.431 | 0.511 | ||
| Ⅰ/Ⅱ期 | 54 | 26(48.1) | ||
| Ⅲ期 | 48 | 20(41.7) | ||
| 高危iFISH异常 | 0.218 | 0.640 | ||
| 是 | 26 | 14(53.8) | ||
| 否 | 62 | 30(48.4) | ||
| 浆细胞白血病 | 0.383 | 0.536 | ||
| 是 | 5 | 3(60.0) | ||
| 否 | 96 | 44(45.8) | ||
| 髓外受累 | 0.002 | 0.961 | ||
| 是 | 15 | 7(46.7) | ||
| 否 | 87 | 40(46.0) | ||
| R-ISS分期 | 0.080 | 0.778 | ||
| Ⅰ/Ⅱ期 | 70 | 34(48.6) | ||
| Ⅲ期 | 20 | 9(45.0) | ||
| 诱导治疗 | 1.498 | 0.221 | ||
| 硼替佐米 | 90 | 43(47.8) | ||
| 免疫调节剂 | 16 | 5(31.3) | ||
| ASCT | 6.536 | 0.011 | ||
| 是 | 37 | 23(62.2%) | ||
| 否 | 69 | 25(36.2%) | ||
| 巩固和(或)维持 | 0.392 | 0.531 | ||
| 是 | 72 | 40(55.6%) | ||
| 否 | 11 | 5(45.5%) |
注:MRD:微小残留病;ISS:国际分期体系;R-ISS:修改的国际分期体系;ASCT:自体造血干细胞移植;高危间期荧光原位杂交(iFISH)异常:伴有P53缺失、IgH/FGFR3易位和IgH/MAF易位3个iFISH异常之一
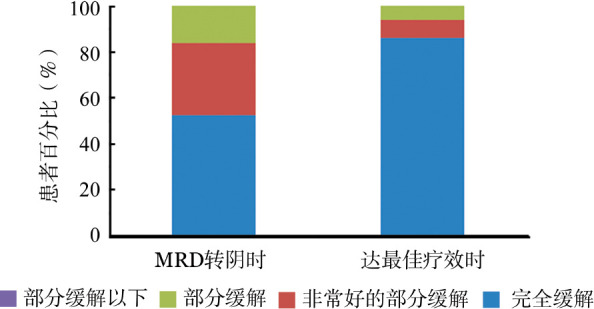
2.MRD与传统CR的关系:初次检测到MRD转阴时,48例患者中23例(47.9%)未达到CR。之后,16例患者后续获得CR,最终仅7例(14.6%)MRD转阴患者未达到CR(图1)。这7例患者中,2例伴有髓外肿块;1例ASCT后MRD转为阴性,但4个月后PD;1例74岁患者,仅予以BD(硼替佐米、地塞米松)方案治疗,期间MRD有反复;其余3例ASCT后巩固维持治疗中MRD转为阴性。与其他获得CR的MRD转阴患者相比,这7例患者PFS时间缩短(中位PFS时间30个月对未达到,P=0.007),OS时间相近(均为未达到,P=0.639)。
图1. 48例微小残留病(MRD)转阴患者的传统疗效.
106例患者中48例获得CR,其中7例(14.6%)MRD始终阳性。随访过程中5例患者已经PD,中位PFS时间为19个月,其中3例死亡,中位OS时间为28个月。MRD持续阳性CR患者的PFS及OS时间均明显短于MRD转阴的CR患者(P<0.05)。
在48例MRD转阴患者中,26例(54.2%)获得MRD阴性先于达到最佳疗效,10例(20.8%)同时获得MRD阴性和最佳疗效,12例(25.0%)先达最佳疗效。
3.预后分析:中位随访38个月,患者总体中位PFS时间为30个月,中位OS时间尚未达到。
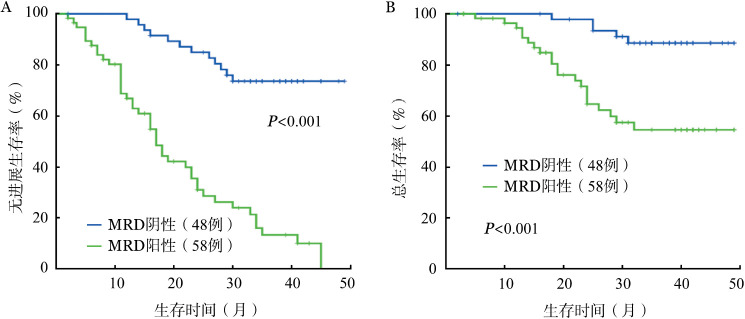
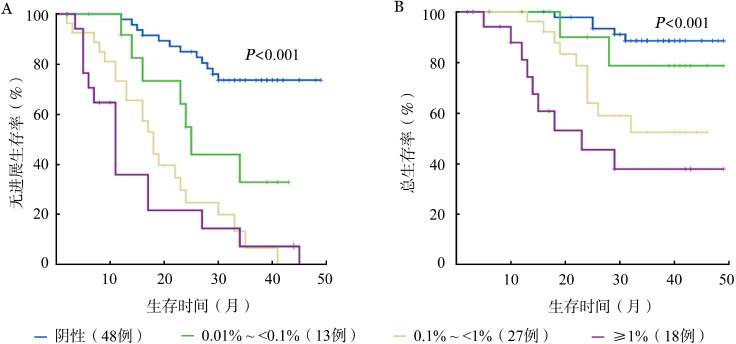
MRD转阴患者的预后显著优于阳性患者,二者的中位PFS时间分别为未达到和17个月,中位OS时间均未达到(P值均<0.001)(图2)。以治疗后3、6、9个月为节点进行的分析显示,之前与之后MRD转阴的患者间PFS、OS差异均无统计学意义(P值均>0.05)。根据MRD水平将患者分为四组:≥1%、0.1%~<1%、0.01%~<0.1%和阴性。阴性组的PFS、OS明显优于前两组(P<0.05)。随着MRD水平的降低,患者PFS及OS时间逐渐延长(图3)。
图2. 微小残留病(MRD)阴性与阳性患者的无进展生存(A)和总生存(B)情况.
图3. 不同微小残留病(MRD)水平患者的无进展生存(A)和总生存(B)情况.
单因素分析显示,MRD持续阳性、未行ASCT、高危iFISH异常、髓外受累、未达到CR或以上疗效、R-ISS分期Ⅲ期是PFS和OS的预后危险因素(P值均<0.05)。多因素分析显示,影响患者PFS的独立预后危险因素依次为MRD持续阳性[HR=0.133(95% CI 0.062~0.288),P<0.001]、未行ASCT [HR=0.363(95%CI 0.171~0.772),P=0.008]和高危iFISH异常[HR=0.406(95% CI 0.213~0.774),P=0.006]。影响患者OS的独立预后危险因素依次为MRD持续阳性[HR=0.156(95% CI 0.050~0.484),P=0.001]、高危iFISH异常[HR=0.227(95%CI 0.087~0.590),P=0.002]。
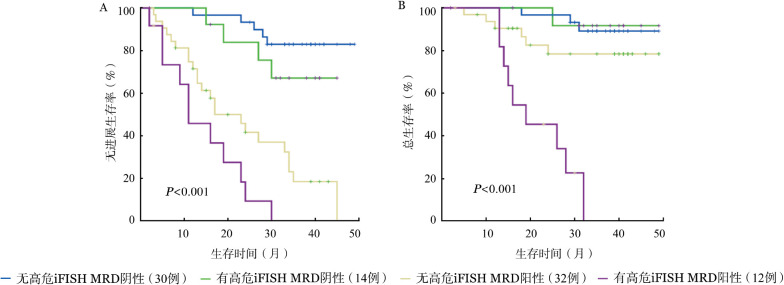
根据有无高危iFISH异常、是否MRD转阴将患者分为4组,结果显示在具有高危iFISH异常的群体中,MRD转阴患者的PFS和OS明显好于MRD阳性患者(P<0.05),而与无高危iFISH异常的MRD阴性患者相比差异无统计学意义(P>0.05)(图4)。
图4. 根据是否具有高危iFISH异常、是否微小残留病(MRD)转阴将患者分为4组的无进展生存(A)和总生存(B)情况.
讨论
在造血系统恶性疾病中,尽量充分地杀灭肿瘤细胞对于控制疾病、治愈疾病具有重要的意义。近十余年来,越来越多的证据提示MRD水平可以作为评估MM治疗效果、预后的生物指标。检测MRD的技术手段主要有MFC、分子学方法及影像学方法。MFC适用于约97%的患者,适合常规实验室检测,因此得到了广泛的应用[5]。目前,全球已有大量证据表明MFC检测的MRD阴性可以作为预测MM患者PFS和OS的重要指标[6]–[11]。本研究中我们统计了我院采用8色流式细胞术检测MRD工作的部分成果,在敏感度为10−4的情况下,尽管只有106例患者,结果显示MRD是影响患者PFS、OS最重要的预后因素,其作用独立于疾病分期、诱导治疗方案、细胞遗传学危险度分层和常规CR之外。并且不同的MRD水平对患者的预后有进一步分层的作用,其效果明显好于传统的疗效评估体系(结果未列出)。
此外,虽然MFC检测MRD的临床研究很多,但是不同研究结果间存在很大差异,很难相互比较,主要表现在:①敏感度不同:10−4~10−6不等;②研究人群不同:获得CR的患者、获得血清学疗效的患者、全部患者等;③检测时间点不同:诱导治疗结束、ASCT后100 d、ASCT后3~6个月等。总体上,MRD转阴率在不同方案中由11%~77%不等[6]–[11]。本研究显示系统治疗的患者随访2年内总体MRD转阴率为45.3%,接受ASCT患者的MRD转阴率为62.2%,这与MRC Ⅸ和PETHEMA/GEM临床试验的结果类似[6],[9]。目前对MRD监测的时间点并没有统一。我们对此进行观察显示,MRD转为阴性的中位时间是治疗后3个月,90%的患者在治疗9个月以内MRD转为阴性,之前或之后取得MRD阴性的患者预后差异无统计学意义。提示在今后的临床工作中注意以治疗后9个月为节点观察患者MRD的情况。
本研究诱导治疗阶段每2个周期复查骨髓MRD,结果显示54.2%的患者都是先获得MRD阴性,即肿瘤细胞消减后,才随访到最佳疗效。这可能与M蛋白的半衰期较长有关,但最终MRD阴性的患者多数能够获得血清学CR,与既往研究结果相符[10]。在本研究中,除随访时间不足者外,我们仅观察到了4例患者MRD转为阴性而没有获得CR,其中2例伴有髓外肿块;1例MRD转为阴性4个月后疾病进展;1例仅接受硼替佐米、地塞米松两药治疗,期间MRD有反复。提示这些患者的MRD转阴具有局灶、一过性、深度不足的特点。因此,临床工作中我们需要结合整体影像学和MRD阴性维持时间来进一步判断预后。当然,未来努力改善MFC的检测深度,也是非常重要的。此外,本研究中CR患者的MRD阳性率为14.6%,与MRC Ⅸ临床试验(14.5%)类似,较多数研究偏低(文献中3%~46%,Meta分析中为32%)[6]–[11],考虑与多次检测及检测深度偏低有关。虽然获得CR,MRD持续阳性患者与阴性患者相比预后显著较差。
既往多个研究及本研究结果均显示ASCT能够使更多的患者获得MRD阴性[9],[11]–[12]。由于MRD阳性患者预期PFS时间较短(Meta分析中为26个月,本文为17个月),提示这部分患者很大可能在3年内需要再次治疗,所以多数学者建议诱导治疗后MRD阳性的患者进行一线ASCT,以避免治疗不足影响其生存获益[2],[11],[13]。而对于诱导治疗后MRD阴性的患者,是否推迟ASCT,目前仍有很大争议。本研究结果显示,移植是影响患者PFS、OS的保护因素,而且其在PFS中具有独立预后意义。也就是即使诱导治疗后MRD阴性的患者,进行ASCT仍然可以使PFS得到进一步改善,OS有改善趋势。这提示我们,所有的检测手段均有其检测阈值和局限性,并不能反映肿瘤的完全清除。在我国目前的检测及治疗情况下,尚无充足证据提示可以在MRD阴性的患者中推迟ASCT。
高危iFISH异常在MM中的预后意义已经得到确认。既往少数研究中同时分析了MRD和高危iFISH异常的情况,结果显示MRD在不同危险度患者中均具有很好的预后意义[6],[11],[14]–[16]。对于MRD转阴的伴高危iFISH异常患者,既往文献中中位PFS时间为26~38个月,中位OS时间为72~128个月,在我们的研究中,这类患者的中位PFS和OS时间均未达到,其预后与不伴有高危iFISH异常的MRD转阴患者差异无统计学意义。对于MRD持续阳性的伴高危iFISH异常患者,既往研究中中位PFS时间为6~14个月,中位OS时间为19~26个月。本研究中这类患者的中位PFS时间为11个月,中位OS时间仅19个月,与文献结果类似。提示对于初诊时具有高危遗传学特征的患者需要区别对待,如果患者能够达到MRD阴性,其预后可能与标危患者差异不大。而对于MRD持续阳性的高危患者,鉴于其预期生存期时间很难超过3年,有理由早期给予更强有力的治疗。因为患者例数少,以上结果仍有待大规模以MRD为驱动的临床研究证实。
综上,我们的研究结果显示,目前MRD是MM患者中最重要的预后因素,优于传统的疗效评价体系,并且根据MRD水平可以对患者预后进行分层。ASCT患者MRD转阴率明显高于非ASCT患者。结合细胞遗传学进行的分析显示,MRD转阴的伴高危细胞遗传学异常患者其预后与标危患者无明显差异。以上结果提示MFC检测MRD在MM中切实可行、有效,值得在临床推广应用。
Funding Statement
基金项目:国家自然科学基金重点项目(81630007、81400175);天津市科技支撑计划重大项目(12ZCDZSY17600);协和青年基金(2017320023)
Fund program: Key Program of National Natural Science Foundation of China (81630007, 81400175); the Key Technologies R & D Program of Tianjin (12ZCDZSY17600); Youth Foundation of the PUMC (2017320023)
References
- 1.邱 录贵, 安 刚. 多发性骨髓瘤的现状与展望[J] 中华血液学杂志. 2011;32(10):649–651. doi: 10.3760/cma.j.issn.0253-2727.2011.10.001. [DOI] [PubMed] [Google Scholar]
- 2.Landgren O, Devlin S, Boulad M, et al. Role of MRD status in relation to clinical outcomes in newly diagnosed multiple myeloma patients: a meta-analysis[J] Bone Marrow Transplant. 2016;51(12):1565–1568. doi: 10.1038/bmt.2016.222. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.中国医师协会血液科医师分会, 中华医学会血液学分会, 中国医师协会多发性骨髓瘤专业委员会. 中国多发性骨髓瘤诊治指南(2015年修订)[J] 中华内科杂志. 2015;54(12):1066–1070. doi: 10.3760/cma.j.issn.0578-1426.2015.12.020. [DOI] [Google Scholar]
- 4.Kumar S, Paiva B, Anderson KC, et al. International Myeloma Working Group consensus criteria for response and minimal residual disease assessment in multiple myeloma[J] Lancet Oncol. 2016;17(8):e328–e346. doi: 10.1016/S1470-2045(16)30206-6. [DOI] [PubMed] [Google Scholar]
- 5.Rihova L, Vsianska P, Bezdekova R, et al. Minimal residual disease assessment in multiple myeloma by multiparametric flow cytometry[J] Klin Onkol. 2017;30(Supplementum2):21–28. doi: 10.14735/amko20172S21. [DOI] [PubMed] [Google Scholar]
- 6.Rawstron AC, Child JA, de Tute RM, et al. Minimal residual disease assessed by multiparameter flow cytometry in multiple myeloma: impact on outcome in the Medical Research Council Myeloma IX Study[J] J Clin Oncol. 2013;31(20):2540–2547. doi: 10.1200/JCO.2012.46.2119. [DOI] [PubMed] [Google Scholar]
- 7.Korde N, Roschewski M, Zingone A, et al. Treatment with carfilzomib-lenalidomide-dexamethasone with lenalidomide extension in patients with smoldering or newly diagnosed multiple myeloma[J] JAMA Oncol. 2015;1(6):746–754. doi: 10.1001/jamaoncol.2015.2010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Paiva B, Puig N, García-Sanz R, et al. Is this the time to introduce minimal residual disease in multiple myeloma clinical practice?[J] Clin Cancer Res. 2015;21(9):2001–2008. doi: 10.1158/1078-0432.CCR-14-2841. [DOI] [PubMed] [Google Scholar]
- 9.Lahuerta JJ, Paiva B, Vidriales MB, et al. Depth of response in multiple myeloma: a pooled analysis of three PETHEMA/GEM clinical trials[J] J Clin Oncol. 2017;35(25):2900–2910. doi: 10.1200/JCO.2016.69.2517. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Paiva B, Vidriales MB, Cerveró J, et al. Multiparameter flow cytometric remission is the most relevant prognostic factor for multiple myeloma patients who undergo autologous stem cell transplantation[J] Blood. 2008;112(10):4017–4023. doi: 10.1182/blood-2008-05-159624. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Munshi NC, Avet-Loiseau H, Rawstron AC, et al. Association of minimal residual disease with superior survival outcomes in patients with multiple myeloma: a meta-analysis[J] JAMA Oncol. 2017;3(1):28–35. doi: 10.1001/jamaoncol.2016.3160. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Gupta R, Kumar L, Dahiya M, et al. Minimal residual disease evaluation in autologous stem cell transplantation recipients with multiple myeloma[J] Leuk Lymphoma. 2017;58(5):1234–1237. doi: 10.1080/10428194.2016.1228930. [DOI] [PubMed] [Google Scholar]
- 13.Braunstein M, Niesvizky R. Deferring autologous stem cell transplantation for consolidation of minimal residual disease in multiple myeloma[J] Semin Oncol. 2016;43(6):709–711. doi: 10.1053/j.seminoncol.2016.11.006. [DOI] [PubMed] [Google Scholar]
- 14.Paiva B, Gutiérrez NC, Rosiñol L, et al. High-risk cytogenetics and persistent minimal residual disease by multiparameter flow cytometry predict unsustained complete response after autologous stem cell transplantation in multiple myeloma[J] Blood. 2012;119(3):687–691. doi: 10.1182/blood-2011-07-370460. [DOI] [PubMed] [Google Scholar]
- 15.Chakraborty R, Muchtar E, Kumar SK, et al. Impact of post-transplant response and minimal residual disease on survival in myeloma with high-risk cytogenetics[J] Biol Blood Marrow Transplant. 2017;23(4):598–605. doi: 10.1016/j.bbmt.2017.01.076. [DOI] [PubMed] [Google Scholar]
- 16.Sonneveld P, Avet-Loiseau H, Lonial S, et al. Treatment of multiple myeloma with high-risk cytogenetics: a consensus of the International Myeloma Working Group[J] Blood. 2016;127(24):2955–2962. doi: 10.1182/blood-2016-01-631200. [DOI] [PMC free article] [PubMed] [Google Scholar]