Abstract
目的
探讨抗CD19 CAR-T细胞治疗难治复发B细胞肿瘤的疗效和不良反应。
方法
2015年12月至2017年7月北京大学第三医院血液科收治的10例患者,包括难治复发的急性B淋巴细胞白血病(B-ALL)6例,难治复发的B细胞非霍奇金淋巴瘤(NHL)4例,采用抗CD19 CAR-T细胞治疗后观察治疗效果及不良反应。
结果
输注后第28天进行近期疗效评估,其中6例ALL患者4例(66.7%)完全缓解(CR),1例(16.7%)部分缓解(PR);总反应率(ORR)为83.3%。3例弥漫大B细胞淋巴瘤(DLBCL)患者1例达CR。1例套细胞淋巴瘤(MCL)患者大部分病灶消失,亦有顽固病灶呈进展状态。10例患者均发生细胞因子释放综合征(CRS),主要表现为发热;其中1例患者出现中枢神经系统症状,1例患者出现多脏器功能衰竭,经治疗不良反应均治愈。
结论
抗CD19 CAR-T细胞治疗难治复发B细胞血液系统肿瘤有效,不良反应可控。
Keywords: 抗CD19 CAR-T细胞, B细胞肿瘤, 治疗结果
Abstract
Objective
To investigate the outcomes of anti-CD19 CAR-T cell for relapsed and refractory B cell malignancies.
Methods
Ten patients with relapsed and refractory B cell acute lymphocytic leukemia (B-ALL) and non-Hodgkin's lymphoma (NHL), diagnosed in the Department of Hematology of Peking University third Hospital from December 2015 to July 2017, were treated with anti-CD19 CAR-T cell therapy, and the efficacy and safety were analyzed.
Results
Efficacy was assessed on the 28th day after cell infusion, including 66.7% (4/6) of complete remission (CR) for patients with ALL, 16.7% (1/6) of partial remission (PR), and 83.3% (5/6) of overall response rate (ORR). For NHL patients, CR was 33.3% (1/3) and most of the lesions disappeared in a patient with mantle cell lymphoma, but residual lesion presented persistent state. After infusion of anti-CD19 CAR-T cells, the main side effect was cytokine release syndrome (CRS) and fever. One patient presented with aphasia and the other one had multiple organ failure, which were improved after treatment. No patients died of CRS.
Conclusion
anti-CD19 CAR-T cell for relapsed and refractory B cells hematological malignancies is safe, and the most problematic side effect is CRS, which can be controlled by therapy.
Keywords: Anti-CD19 CAR-T cell, B cell hematological malignancies, Treatment outcomes
由于新疗法及新药物的不断涌现,血液系统肿瘤的疗效大大提高,但仍有部分患者会成为难治或复发病例。CAR-T细胞治疗作为一种新的免疫治疗手段,在部分患者中取得了较好的疗效,给复发难治肿瘤患者带来生存希望。我们对在我院接受抗CD19 CAR-T细胞治疗的肿瘤患者进行疗效及相关不良反应分析,以探讨这一新兴技术在临床中的应用。
病例与方法
一、病例资料
选取2015年12月至2017年7月我科收治的难治复发急性B淋巴细胞白血病(B-ALL)和难治复发非霍奇金淋巴瘤(NHL)患者,患者的诊断依据WHO2008年造血与淋巴组织肿瘤分类标准,按临床试验入组及排除标准对患者进行筛选。主要的入组及排除标准:肿瘤细胞表面存在CD19表达;无中枢神经系统白血病;无不可控制或需要静脉药物治疗的真菌、细菌、病毒或其他感染;无重要脏器功能衰竭。B-ALL患者在接受CAR-T细胞治疗前均复查骨髓及流式细胞术免疫分型,白血病细胞免疫分型为CD19阳性;淋巴瘤患者均重新复核病理检查结果,肿瘤细胞免疫组化表型为CD19阳性。入组患者对于临床研究内容完全知情,并签署知情同意书。本研究经我院医学科学研究伦理委员会审批,批号为(2015)医伦审第(182)号,(2017)药伦审第(016-01)号。
二、CAR-T细胞治疗
1.预处理方案:采用FC方案,具体为氟达拉滨25 mg/m2×3 d,环磷酰胺250 mg/m2×3 d。
2.处理流程:患者在回输前第14天,进行外周血淋巴细胞采集,送实验室进行基因修饰;所有CAR-T细胞经上海斯丹赛生物技术有限公司制备,结构式为scFv/CD8/CD137/CD3ζ;使用转录的病毒为慢病毒;回输前第4天患者接受FC预处理方案;回输前1天休息;回输当天予以非激素类抗过敏药物预防过敏反应,主要为吲哚美辛栓及盐酸异丙嗪。
3.检测指标:分别在输注后第1~7、14、21、28天检测血清细胞因子水平;第1、7、14、21、28天检测骨髓肿瘤细胞数;每日检测患者的体温、血常规等变化。同时收集患者一般资料,包括性别、年龄、体重、疾病,接受抗CD19 CAR-T细胞治疗前的治疗情况及肿瘤负荷情况,回输后抗CD19 CAR-T细胞在体内含量变化情况,最终的疗效及生存情况。
三、疗效和不良反应评价
CAR-T细胞输注后第28天时进行近期疗效评估,评估标准采用NCCN指南中疗效评估标准。细胞因子释放综合征(CRS)诊断标准参考Lee等[1]提出的标准,分为4级。其他不良反应的评估采用WHO抗癌药物急性与亚急性不良反应分度标准。
四、随访
全部患者均通过电话和门诊规律随访至2017年7月。失访病例以失访时间为随访终点。开始治疗至疾病进展或任何原因引起死亡的间隔时间为无进展生存(PFS)时间。
五、统计学处理
计量资料采用Kolmogorov-Smirnov对其进行正态性检验,符合正态分布的计量资料采用均数±标准差进行统计描述,不符合正态分布的计量资料,采用M(P25,P75)进行统计描述。计数资料采用例数(%)进行统计描述。
结果
一、临床特征
共有10例患者接受了抗CD19 CAR-T细胞治疗,患者临床特征详见表1。其中男4例,女6例;中位年龄33.5(25~69)岁。ALL 6例、NHL 4例。ALL患者中3例为Ph+ B-ALL。NHL患者中3例为弥漫大B细胞淋巴瘤(DLBCL),均为非生发中心亚型(non-GCB),1例为母细胞型套细胞淋巴瘤(MCL)。
表1. 10例接受抗CD19 CAR-T细胞治疗患者的临床特征.
| 例号 | 性别 | 年龄(岁) | 体重 (kg) | CAR-T治疗前复发次数 | 确诊到CAR-T治疗时间(月) | 肿瘤负荷 | 疾病类型 | 回输CAR-T细胞数量(×106/kg) | CAR-T细胞基因转染率(%) | CAR-T细胞回输后第28天治疗效果 | 最终生存情况 | PFS(月) | CRS级别 | 回输后第30天外周血CAR-T细胞(%) |
| 1 | 男 | 26 | 70 | 3 | 58 | 骨髓原始细胞0.061 | Ph+ALL | 4.0 | 20.0 | CR | 存活 | 18 | 3 | 6.27 |
| 2 | 女 | 30 | 58 | 1 | 10 | 骨髓原始细胞0.795 | ALL | 3.0 | 45.0 | CR | 存活 | 14 | 4 | 15.21 |
| 3 | 女 | 32 | 56 | / | 5 | 骨髓原始细胞0.296 | ALL | 7.0 | 45.0 | PR | 死亡 | 3 | 3 | 7.61 |
| 4 | 男 | 26 | 63 | 1 | 6 | 骨髓原始细胞0.767 | ALL | 1.2 | 30.0 | NR | 死亡 | 1 | 1 | 0 |
| 5 | 男 | 35 | 50 | 1 | 24 | 骨髓原始细胞0.100 | Ph+ALL | 7.0 | 12.0 | CR | 存活 | 12 | 1 | 5.54 |
| 6 | 女 | 62 | 46 | 2 | 36 | 骨髓原始细胞0.265 | Ph+ALL | 3.1 | 31.0 | CR | 存活 | 2 | 1 | - |
| 7 | 女 | 69 | 65 | / | 12 | 难治 | MCL | 0.3 | 35.8 | PD | 死亡 | 2 | 1 | 16.65 |
| 8 | 女 | 25 | 57 | / | 15 | 纵隔包块 | DLBCL | 5.0 | 26.0 | PD | 存活 | 1 | 1 | - |
| 9 | 女 | 56 | 61 | / | 5 | >10 cm腹腔包块 | DLBCL | 6.1 | 44.2 | CR | 存活 | 2 | 1 | <0.01 |
| 10 | 男 | 68 | 72 | / | 6 | 纵隔包块 | DLBCL | 4.6 | 15.0 | PD | 死亡 | 1 | 1 | - |
注:PFS:无进展生存;CRS:细胞因子释放综合征;ALL:急性淋巴细胞白血病;MCL:套细胞淋巴瘤;DLBCL:弥漫大B细胞淋巴瘤;CR:完全缓解;PR:部分缓解;NR:未缓解;PD:疾病进展;/:难治;-:未检测
10例均为难治复发患者。10例患者中,5例在治疗过程中曾获得完全缓解(CR)后复发,其中1例为第3次复发,1例为第2次复发;其余5例患者在治疗过程中未获得CR,最佳疗效仅为部分缓解(PR),为难治患者。患者从确诊到接受抗CD19 CAR-T细胞治疗的中位时间为11(5~58)个月。
CAR-T细胞治疗前6例ALL患者骨髓原始细胞中位数为0.280(0.061~0.795)。3例Ph+B-ALL未见伴发其他染色体异常,余3例ALL患者中,1例为复杂核型,另2例均存在7号染色体易位。3例DLBCL患者中1例存在10 cm以上肿瘤,2例存在纵隔包块;ⅣB期2例、ⅢB期1例;2例适用aIPI评分为中高危组,1例适用IPI评分为高危组。MCL患者MIPI评分亦为高危组。
二、CAR-T细胞制备、回输情况
回输CAR-T细胞总量中位数为4.27×106/kg(0.30×106/kg,6.93×106/kg)。基因转染率中位数为30.51%(12%,45%)。第1个疗程回输时,5例患者分2次回输,其余5例患者均一次性回输。2例患者接受了第2个疗程细胞回输;1例患者至随访结束时共接受5个疗程CAR-T细胞回输。
三、CRS
10例患者均发生CRS,其中1级7例(NHL 4例,ALL 3例),3级2例(均为ALL),4级1例(ALL)。
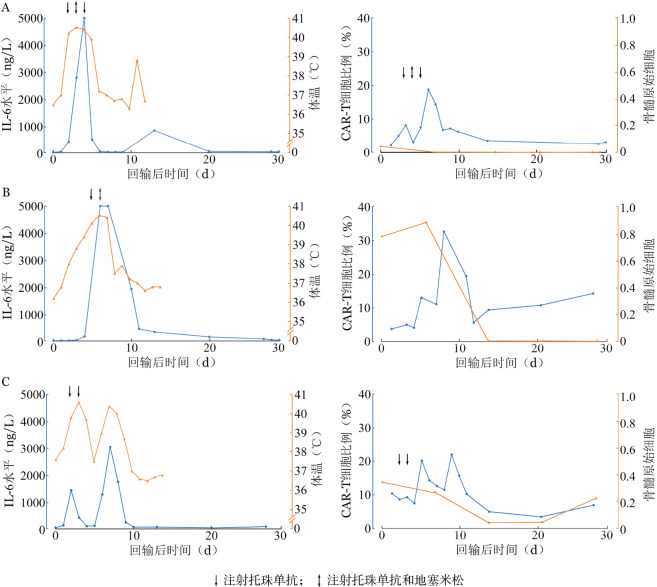
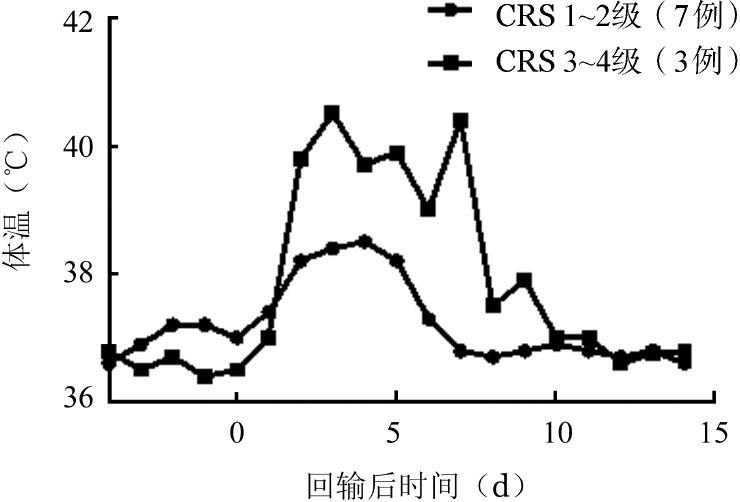
1.发热:10例患者均出现发热。发热可开始于回输后第1、2天,持续约1周,14 d内体温均恢复正常。3例患者出现持续性高热,予托珠单抗注射液(2例联合地塞米松)治疗后恢复正常。3例患者CAR-T细胞回输后体温及同期IL-6、外周血CAR-T细胞及骨髓原始细胞的变化详见图1。CRS 1~2级组(7例)和CRS 3~4级(3例)组每日最高体温的中位数,在回输后第2~7天内可见明显差异(图2)。患者发热时间与预处理后骨髓抑制时间相重叠。1例患者仅回输当天出现发热,后再未出现发热。
图1. 例1~3患者(A、B、C)CAR-T细胞回输后体温、IL-6、外周血CAR-T细胞及骨髓原始细胞变化情况.
图2. CAR-T细胞回输后不同细胞因子释放综合征(CRS)诊断分组患者每日最高体温中位数变化情况.
2.脏器毒性:1例患者出现失语,发生在回输后第2天,持续约24 h伴持续性高热,予糖皮质激素及托珠单抗注射液多次,逐渐缓解(图1中第1例患者)。1例患者出现心力衰竭、呼吸衰竭、肿瘤溶解综合征伴肾功能衰竭,予升压药物及无创呼吸机辅助呼吸、补液利尿等治疗,并予托珠单抗注射液及地塞米松后,脏器功能均恢复正常水平(图1中第2例患者)。
3.细胞因子水平:对CRS的监测主要是通过监测细胞因子(包括IL-2、IL-4、IL-6、IL-10、IL-17A、IFN-γ、TNF-α、TNF-β、G-CSF、GM-CSF)水平。发生CRS时IL-6、INF-γ水平明显升高。在不同程度的CRS组中IL-2、IL-10、IFN-γ水平最高值存在差异[1~2级组IL-2最高值为5.0 ng/L(3.8 ng/L,7.0 ng/L),3~4级组3例患者分别为21.9、11.4、20.0 ng/L;1~2级组IL-10最高值为26.7 ng/L(11.0 ng/L,59.2 ng/L),3~4级组3例患者分别为94.7、982.4、134.6 ng/L;1~2级组IFN-γ最高值为35.7 ng/L(16.6 ng/L,911.0 ng/L);3~4级组3例患者分别为2 446.3、4 419.8、2 332.2 ng/L]。但不同疾病组中仅TNF-α最高值水平差异明显,B-ALL组低于NHL组[B-ALL组中位数为16.05 ng/L(3.95 ng/L,62.45 ng/L)、NHL组中位数为177.40 ng/L(54.18 ng/L,370.00 ng/L)。
4.不同程度CRS组治疗前免疫功能状况:CRS 1~2级组中位回输细胞数量为4.58×106/kg(1.24×106/kg,6.15×106/kg),基因转染率为30%(15%,35%);CRS 3~4级组3例患者回输细胞数量分别为3.96×106/kg、3.00×106/kg、6.93×106/kg,基因转染率分别为20%、45%、45%。分析不同程度CRS组患者治疗前免疫功能情况,发现CRS 1~2级组中位CD4+/CD8+细胞百分比为0.68%(0.44%,1.00%),CRS 3~4级组3例患者分别为1.10%、1.58%、1.29%,发生3~4级CRS患者治疗前体内CD4+/CD8+细胞百分比更高。
四、其他不良反应
1.血液学不良反应:给予FC预处理方案后,1例患者出现3度白细胞减少,无发热,予以观察;1例患者出现3度白细胞减少并发热,予以广谱抗生素治疗;余8例患者均出现4度白细胞减少并发热,按白细胞减少情况给予G-CSF,并予广谱抗生素治疗。血红蛋白虽有一定程度下降,仅3例患者需少量间断输注红细胞(均为ALL)。10例患者均出现血小板减少,其中0度1例、2度2例、4度7例(ALL 4例,NHL 3例),6例需输血小板支持治疗(ALL 4例,NHL 2例)。
2.非血液学不良反应:1例患者出现多脏器功能衰竭(呼吸衰竭、心力衰竭、肝功能异常、肾功能衰竭、肿瘤溶解综合征),予无创呼吸机辅助通气、补液及2种升压药物升压治疗,多种保肝药物治疗,并予床旁血液透析。1周后患者各项指标均恢复正常。余9例患者,未发生明显肝肾不良反应,未观测到明显凝血功能异常。
五、近期疗效
第28天进行近期疗效评估,其中6例ALL患者CR 4例(66.7%),PR 1例(16.7%),总反应率(ORR)为83.3%。NHL患者中,3例DLBCL患者1例达CR,1例MCL患者大部分病灶消失,仅有一处顽固病灶呈进展状态。在B-ALL患者中,有效病例均为前期治疗有效并长期生存的患者;在NHL患者中,所有病例均为前期治疗未缓解病例,而有效病例来自于更早接受CAR-T细胞治疗的患者。
六、远期疗效
10例患者中,4例死亡(2例B-ALL、1例MCL、1例DLBCL),6例存活(4例B-ALL、2例DLBCL)。存活的4例B-ALL患者中,2例接受allo-HSCT,1例予以反复CAR-T细胞治疗,至随访结束已进行5个疗程CAR-T细胞输注,再次达到PR,1例仅随访2个月。4例死亡患者3例为CAR-T细胞治疗无效患者,最终疾病进展死亡;1例近期疗效评估为PR,后疾病进展,再次予CAR-T细胞输注仍无效,最终疾病进展死亡。无因CRS死亡病例。
讨论
CAR-T细胞治疗已广泛应用于临床[2],文献报道在ALL中CR率为88%[3],在NHL中CR率为57.1%(4/7)[4]。本研究中ALL有效率为83.3%,NHL有效率为33.3%。接近文献报道水平。NHL的有效率较ALL低,考虑与NHL存在实体瘤块,CAR-T细胞不易进入有关[5]。目前日本已研发出新型CAR-T细胞[6],可进入肿瘤组织内,并诱导机体本身T细胞及DC细胞进入肿瘤组织,协同发挥抗肿瘤作用,在多种肿瘤的动物模型中已取得100%疗效。该技术的临床应用或可改善CAR-T细胞在NHL中的疗效。
从CAR-T细胞治疗介入时机来看,本研究中ALL有效病例多出现在前期治疗有效并长期生存的患者。该结果与Kochenderfer等[4]在NHL患者中的研究结果类似。而本研究中的NHL均为难治患者,从发病初到CAR-T细胞治疗前从未达到CR,其中取得较好治疗效果病例均为更早接受CAR-T细胞治疗的患者。推测这可能与患者自身免疫功能状态有关,而这种免疫功能差异可能与不同发病机制有关,并可影响采集及制备的CAR-T细胞功能,亦可影响CAR-T细胞回输后自身免疫系统的调动。
CAR-T细胞回输后,最常见也是潜在最严重的不良反应是CRS。研究显示未发生CRS的患者很难从CAR-T细胞治疗中获益,而发生CRS的患者对CAR-T细胞治疗更容易产生反应[2],[7]–[9]。但是并没有数据表明,CRS的严重程度与CAR-T细胞的治疗效果存在必然相关性,考虑与CAR-T细胞回输前肿瘤负荷等混杂因素干扰有关[10]。Maude等[11]认为CRS的严重程度与回输前肿瘤负荷相关。Lee等[7]提出CAR-T细胞在体内的扩增与临床疗效及CRS的严重程度密切相关。本研究中10例患者也存在CRS严重程度的差异,B-ALL较NHL易发生严重CRS,6例ALL患者中,半数发生3~4级CRS,考虑与CAR-T细胞和肿瘤细胞接触的密切程度有关。但因例数过少,在不同CRS组间无明显疗效差异。对于回输前外周血肿瘤负荷高的第2例ALL患者,回输后确实发生了最严重的CRS,导致多脏器功能衰竭。符合既往文献报道。
发生CRS需有指标进行描述及检测,目前广泛使用的客观指标为细胞因子。Davila等[2]认为IFN-γ、IL-6、IL-5、IL-10、Flt-3L、GM-CSF、Fracktalkine这7个细胞因子水平变化与严重CRS诊断密切相关,并制定出严重CSR诊断标准。本研究中3~4级CRS组患者IL-2、IL-10、IFN-γ最高值均明显高于1~2级CRS组,证实其为观测CRS反应良好的实验室监测指标。同时我们发现在不同疾病组中TNF-α最高值中位数存在差异,因而在现有不同CRS分级标准制定体系中,或可加入不同肿瘤细胞生物学特征及肿瘤免疫系统不同等因素,制定出肿瘤特异性CRS监测指标及分级标准[12]。现在的研究热点在于找到能准确有效区分CRS反应程度的细胞因子,并制定分层诊疗策略[12]–[15],或便于临床的检测指标(目前多项研究建议使用CRP[2],[7]);而难点在于预测CRS反应。
我们通过对治疗前患者免疫功能状态的监测发现,治疗前存在更高CD4+/CD8+细胞百分比患者,治疗后出现CRS的级别亦较高。该项指标或可成为预测CRS反应的指标,有待大规模临床试验的验证。这很容易让人联想到近期采用的CD4+∶CD8+细胞等比制备CAR-T细胞的方法,研究者认为,如此制备CAR-T细胞再联合利于CAR-T细胞植入的FC方案,可以减少细胞的输注剂量,减少CRS不良反应的发生,但同时可以取得与既往研究相当的治疗效果[16]。CD4+∶CD8+细胞的等比制备,以及FC方案的植入效果优于环磷酰胺单药,或可间接证明治疗前患者免疫功能状态,影响CAR-T细胞的制备、回输后在体内的扩增及CRS的产生,值得今后给予更多的关注。
CAR-T细胞相关脑病综合征(CRES)也是大家所关注的焦点。其临床表现形式多样,但发病机制仍不明确。Davila等[2]的研究显示,在发生脑病的患者脑脊液中未检测到CAR-T细胞,他们认为CNS反应为T细胞介导的广义的炎症反应,而非CAR-T细胞的直接毒性反应。Maude等[17]2014年报道发生脑病的患者中,脑脊液检测未发现感染及白血病细胞;其2015年的报道显示发生脑病的患者,在脑脊液中可以检测出CAR-T细胞,但不是所有检出患者均发生脑病,所以认为脑病的发病机制不详,且IL-6拮抗剂效果欠佳[10]。我们观察到1例发生CRES的患者,患者否认既往有CNS累及,但治疗前未再检测。在大剂量糖皮质激素及多次托珠单抗治疗下,症状持续24 h后逐渐缓解,因患者配合度差,未能检测发作当时脑脊液情况。已有学者明确提出,脑脊液中可检测出CAR-T细胞,但亦可检测到CNS肿瘤细胞消失[7]。虽然存在严重CRES反应的可能性,但是CAR-T细胞可进入CNS,可成为清除CNS疾病残存的新手段。下一步,或可考虑进行鞘内注射,但其安全性、注射剂量仍待探讨。
综上所述,抗CD19 CAR-T细胞在治疗难治复发B细胞血液系统肿瘤方面具有应用前景,其治疗过程中不良反应可控,安全性良好。对于前期治疗曾达缓解并长期生存的ALL患者推荐使用CAR-T细胞治疗,对于难治的NHL患者,则建议更早介入CAR-T细胞治疗。患者在接受CAR-T细胞治疗前机体免疫功能状态或可预测CRS反应严重级别。
References
- 1.Lee DW, Gardner R, Porter DL, et al. Current concepts in the diagnosis and management of cytokine release syndrome[J] Blood. 2014;124(2):188–195. doi: 10.1182/blood-2014-05-552729. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Davila ML, Riviere I, Wang X, et al. Efficacy and toxicity management of 19-28z CAR T cell therapy in B cell acute lymphoblastic leukemia[J] Sci Transl Med. 2014;6(224):224ra25. doi: 10.1126/scitranslmed.3008226. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.鹿 萍, 郝 莎, 袁 卫平, et al. 嵌合抗原受体——癌症免疫治疗的新希望[J] 中华医学杂志. 2015;95(4):311–314. doi: 10.3760/cma.j.issn.0376-2491.2015.04.017. [DOI] [Google Scholar]
- 4.Kochenderfer JN, Dudley ME, Kassim SH, et al. Chemotherapy-refractory diffuse large B-cell lymphoma and indolent B-cell malignancies can be effectively treated with autologous T cells expressing an anti-CD19 chimeric antigen receptor[J] J Clin Oncol. 2015;33(6):540–549. doi: 10.1200/JCO.2014.56.2025. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Enblad G, Karlsson H, Loskog AS. CAR T-cell therapy: the role of physical barriers and immunosuppression in lymphoma[J] Hum Gene Ther. 2015;26(8):498–505. doi: 10.1089/hum.2015.054. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Adachi K, Kano Y, Nagai T, et al. IL-7 and CCL19 expression in CAR-T cells improves immune cell infiltration and CAR-T cell survival in the tumor[J] Nat Biotechnol. 2018;36(4):346–351. doi: 10.1038/nbt.4086. [DOI] [PubMed] [Google Scholar]
- 7.Bonati LH, Dobson J, Featherstone RL, et al. Long-term outcomes after stenting versus endarterectomy for treatment of symptomatic carotid stenosis: the International Carotid Stenting Study (ICSS) randomised trial[J] Lancet. 2015;385(9967):529–538. doi: 10.1016/S0140-6736(14)61184-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Grupp SA, Kalos M, Barrett D, et al. Chimeric antigen receptor-modified T cells for acute lymphoid leukemia[J] N Engl J Med. 2013;368(16):1509–1518. doi: 10.1056/NEJMoa1215134. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.江 慧雯, 梅 恒, 胡 豫. 嵌合抗原受体T细胞治疗相关细胞因子释放综合征的管理[J] 中华血液学杂志. 2017;38(10):907–912. doi: 10.3760/cma.j.issn.0253-2727.2017.10.019. [DOI] [Google Scholar]
- 10.Maude SL, Teachey DT, Porter DL, et al. CD19-targeted chimeric antigen receptor T-cell therapy for acute lymphoblastic leukemia[J] Blood. 2015;125(26):4017–4023. doi: 10.1182/blood-2014-12-580068. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Maude SL, Frey N, Shaw PA, et al. Chimeric antigen receptor T cells for sustained remissions in leukemia[J] N Engl J Med. 2014;371(16):1507–1517. doi: 10.1056/NEJMoa1407222. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Park JH, Geyer MB, Brentjens RJ. CD19-targeted CAR T-cell therapeutics for hematologic malignancies: interpreting clinical outcomes to date[J] Blood. 2016;127(26):3312–3320. doi: 10.1182/blood-2016-02-629063. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Hay KA, Hanafi LA, Li D, et al. Kinetics and biomarkers of severe cytokine release syndrome after CD19 chimeric antigen receptor-modified T-cell therapy[J] Blood. 2017;130(21):2295–2306. doi: 10.1182/blood-2017-06-793141. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Frey NV, Porter DL. Cytokine release syndrome with novel therapeutics for acute lymphoblastic leukemia[J] Hematology Am Soc Hematol Educ Program. 2016;2016(1):567–572. doi: 10.1182/asheducation-2016.1.567. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Neelapu SS, Tummala S, Kebriaei P, et al. Chimeric antigen receptor T-cell therapy - assessment and management of toxicities[J] Nat Rev Clin Oncol. 2018;15(1):47–62. doi: 10.1038/nrclinonc.2017.148. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Turtle CJ, Hanafi LA, Berger C, et al. Immunotherapy of non-Hodgkin's lymphoma with a defined ratio of CD8+ and CD4+ CD19-specific chimeric antigen receptor-modified T cells[J] Sci Transl Med. 2016;8(355):355ra116. doi: 10.1126/scitranslmed.aaf8621. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Maude SL, Barrett D, Teachey DT, et al. Managing cytokine release syndrome associated with novel T cell-engaging therapies[J] Cancer J. 2014;20(2):119–122. doi: 10.1097/PPO.0000000000000035. [DOI] [PMC free article] [PubMed] [Google Scholar]