Abstract
目的
研究KIT D816突变对伴t(8;21)初次复发急性髓系白血病(AML)挽救化疗疗效的影响。
方法
回顾性分析自2010年1月至2017年10月10家医院血液科收治的伴t(8;21)初次复发AML接受挽救化疗患者的临床特征,计算其1个疗程挽救化疗完全缓解(CR2)率,分析其与KIT突变的相关性。
结果
共68例患者纳入本研究,所有患者初诊时均进行了KIT基因突变检测,KIT基因突变阳性33例,其中26例为KIT D816突变。复发后1个疗程挽救化疗CR2率为44.1%。KIT D816突变组的1个疗程挽救治疗CR2率明显低于非KIT D816突变组(23.1%对57.1%,χ2=7.559,P=0.006)。第1次完全缓解(CR1)维持期≥12个月组CR2率显著高于CR1维持期<12个月组(74.1%对31.9%,χ2=9.192,P=0.002)。CR1维持期与KIT D816突变存在显著相关性,CR1维持期≥12个月组中KIT D816突变患者比例显著低于CR1维持期<12个月组(19.0%对46.8%,χ2=4.737,P=0.030)。KIT D816突变组复发后2年总生存率与非KIT D816突变组相比差异无统计学意义[(28.2±15.7)%对(55.1±11.1)%,P=0.060]。
结论
初诊时KIT D816突变与较短CR1维持期显著相关,是伴t(8;21)AML复发后CR2率的不良影响因素,可以作为其挽救治疗疗效的预测指标。KIT D816突变对伴t(8;21)复发AML治疗方案的选择有一定的指导意义。
Keywords: 突变, 基因,KIT, 白血病,髓样,急性, 复发, 预后
Abstract
Objective
To evaluate the impact of KIT D816 mutation on the salvage therapy in relapsed acute myeloid leukemia (AML) with t(8;21) translocation.
Methods
The characteristics of the first relapsed AML with t(8;21) translocation from 10 hospitals were retrospectively collected, complete remission (CR2) rate after one course salvage chemotherapy and the relationship between KIT mutation and CR2 rate was analyzed.
Results
68 cases were enrolled in this study, and 30 cases (44.1%) achieved CR2. All patients received KIT mutation detection, and KIT D816 mutation was identified in 26 cases. The KIT D816 positive group had significantly lower CR2 compared with non-KIT D816 group (23.1% vs 57.1%, χ2=7.559, P=0.006), and patients with longer CR1 duration achieved significantly higher CR2 than those with CR1 duration less than 12 months (74.1% vs 31.9%, χ2=9.192, P=0.002). KIT D816 mutation was tightly related to shorter CR1 duration. No significant difference of 2 years post relapse survival was observed between KIT D816 mutation and non-KIT D816 mutation group.
Conclusion
KIT D816 mutation at diagnosis was an adverse factor on the salvage therapy in relapsed AML with t(8;21) translocation, significantly related to shorter CR1 duration, and can be used for prediction of salvage therapy response. KIT D816 mutation could guide the decision-making of salvage therapy in relapsed AML with t(8;21) translocation.
Keywords: Mutation; Gene, KIT; Leukemia, myeloid, acute; Recurrence; Prognosis
伴t(8;21)急性髓系白血病(AML)是AML中预后较好的一个亚型,但仍有40%~60%的患者最终复发,且复发后总生存(OS)较差。既往研究显示KIT基因突变尤其是位于Exon17上的D816突变是伴t(8;21)AML的主要不良预后因素,患者中位缓解期短,累积复发率高[1]–[5],NCCN指南中将伴有KIT D816突变的核心结合因子相关AML(CBF-AML)归于中危组[6]。但KIT D816突变对于复发患者疗效的影响目前尚未可知。本研究回顾性分析68例伴t(8;21)初次复发AML患者临床特征,评价KIT D816突变对其挽救化疗疗效的影响。
病例与方法
1.病例:68例伴t(8;21)复发AML患者来自于国内10家医院的血液科,年龄≥15岁,所有患者均经染色体核型分析检测到t(8;21)(q22;q22)或PCR、FISH方法检测AML1-ETO融合基因阳性。所有患者均为初次骨髓形态学复发,至少接受1个疗程的挽救化疗并能评价疗效。KIT基因突变采用Sanger测序方法检测,挽救化疗方案由各中心根据患者的个体情况确定,其中包含中大剂量阿糖胞苷(Ara-C)(≥0.5 g·m−2·d−1)14例、标准剂量Ara-C(100~200 mg·m−2·d−1)40例、小剂量Ara-C(<100 mg·m−2·d−1)14例。
2.疗效标准:骨髓形态学复发定义为治疗获得完全缓解(CR)后骨髓涂片形态学分类白血病细胞比例超过有核细胞的0.05。CR的判断标准参照《血液病诊断及疗效标准(第三版)》[7]。
3.随访:采用查阅病例方法随访,自骨髓形态学复发时开始随访,截止时间为2017年11月1日。中位随访时间为4.9(0.2~49.6)个月。
4.统计学处理:采用SPSS24.0和GraphPad Prism5软件进行统计学分析。组间率和构成比的比较采用χ2检验。应用Logisitic回归方法进行挽救化疗缓解率影响因素分析。生存分析采用Kaplan-Meier方法,组间差异检验采用Log-rank法。P<0.05为差异有统计学意义。
结果
1.患者临床特征:68例伴t(8;21)AML初次骨髓形态学复发患者纳入本研究。其中男36例,女32例,中位初诊年龄为38.5(15~63)岁,初诊时WBC 9.27(1.35~69.49)×109/L,CD56表达阳性率为89.6%(43/48),46.0%(29/63)伴附加染色体异常,中位复发年龄为39.5(16~63)岁,复发时WBC 3.53(0.45~55.76)×109/L,中位CR1维持期为7.3(0.5~71.2)个月。
2.KIT基因突变情况:所有患者初诊时均进行了KIT基因突变检测,KIT基因突变阳性33例(48.5%),其中26例(38.2%)存在KIT D816突变(其中2例同时存在N822K突变),另有3例单独N822K突变,3例Exon 8突变,1例Exon 11突变。
3.挽救化疗缓解情况及影响因素分析:经1个疗程挽救化疗后,30例(44.1%)患者获得CR2。获得CR2组与未获得CR2组临床特征比较见表1。
表1. 经1个疗程挽救化疗后获得第2次完全缓解(CR2)与未获得CR2患者临床特征比较.
| 临床特征 | CR2组(30例) | 未获得CR2组(38例) | χ2/t值 | P值 |
| 男性[例(%)] | 13(43.3) | 23(60.5) | 1.989 | 0.158 |
| 复发年龄[岁,M(范围)] | 35(16~61) | 44(16~63) | −1.073 | 0.287 |
| 初诊时WBC[×109/L,M(范围)] | 8.64(1.35~32.94) | 9.79(2.60~69.49) | −1.562 | 0.123 |
| CD56表达(阳性例数/检测例数) | 17/20 | 26/28 | 0.760 | 0.383 |
| 附加染色体异常(阳性例数/检测例数) | 9/26 | 20/37 | 2.323 | 0.128 |
| 达CR1所需疗程数[例(%)] | 0.372 | 0.542 | ||
| 1个 | 24(80.0) | 28(73.7) | ||
| ≥2个 | 6(20.0) | 10(26.3) | ||
| 复发时WBC[×109/L,M(范围)] | 3.50(1.03~17.00) | 3.53(0.45~55.76) | −0.708 | 0.482 |
| CR1维持期[月,M(范围)] | 10.9(1.3~71.2) | 6.7(0.5~20.0) | 2.270 | 0.030 |
| 挽救化疗阿糖胞苷剂量[例(%)] | ||||
| 中大剂量组 | 7(23.3) | 7(18.4) | ||
| 标准剂量组 | 19(63.3) | 21(55.3) | ||
| 低剂量组 | 4(13.3) | 10(26.3) | 1.755 | 0.416 |
| KIT D816突变阳性[例(%)] | 6(20.0) | 20(52.6) | 7.559 | 0.006 |
患者性别、CD56表达、诊断时合并附加染色体异常、复发时年龄、达CR1所需疗程数、初诊和复发时外周血WBC对挽救化疗缓解率均无显著影响。CR1维持期对挽救化疗缓解率存在显著影响,获得CR2患者的CR1维持期显著长于未获CR2患者。CR1维持期≥12个月组CR2率为71.4%,而CR1维持期<12个月组仅为31.9%,差异有统计学意义(χ2=9.192,P=0.002)。CR1维持期与KIT D816突变存在显著相关性,CR1维持期≥12个月组的KIT D816突变阳性率为19.0%,而CR1维持期<12个月组高达46.8%(χ2=4.737,P=0.030)。
4.KIT基因突变对伴t(8;21)复发AML疗效的影响:KIT D816突变组挽救化疗CR2率最低,仅为23.1%,其他KIT基因突变型(包括Exon17 N822K、Exon8、Exon 11等)CR2率为57.1%,其中单独Exon17 N822K突变和Exon 8突变患者均为66.7%,1例Exon11突变患者未缓解,而KIT野生型患者CR2率为57.1%,与其他KIT基因突变型相同,因此我们将其他KIT基因突变型与KIT基因野生型患者合为非KIT D816突变组进行统计学分析。结果显示在伴t(8;21)复发AML患者中,KIT D816突变组挽救治疗CR2率显著低于非KIT D816突变组(χ2=7.559,P=0.006)。两组临床特征比较见表2。KIT D816突变组患者发病年龄偏大,疾病进展较快,CR1维持期显著短于非KIT D816突变组。此外,KIT D816突变患者CR1维持期也短于其他KIT突变型患者[5.7(0.5~20.0)个月对7.9(3.5~33.6)个月,t=−1.731,P=0.093]。
表2. KIT D816突变和非KIT D816突变组临床特征比较.
| 临床特征 | KIT D816突变组 (26例) | 非KIT D816突变组 (42例) | χ2/t值 | P值 |
| 男性[例(%)] | 12(46.2) | 24(57.1) | 0.778 | 0.378 |
| 初诊年龄[岁,M(范围)] | 44(19~63) | 34.5(15~58) | 2.002 | 0.049 |
| 初诊时WBC[×109/L,M(范围)] | 9.90(2.60~32.94) | 8.81(1.35~69.49) | 0.293 | 0.771 |
| 初诊时外周血原始细胞[M(范围)] | 0.405(0~0.790) | 0.325(0~0.780) | 0.200 | 0.843 |
| CD56表达(阳性例数/检测例数) | 21/21 | 22/27 | 2.583 | 0.108 |
| 复发时WBC[×109/L,M(范围)] | 3.535(1.03~55.76) | 3.40(0.45~26.89) | 0.272 | 0.787 |
| 复发时外周血原始细胞[M(范围)] | 0.020(0~0.720) | 0.045(0~0.820) | 0.380 | 0.706 |
| CR1维持期[月,M(范围)] | 5.7(0.5~20.0) | 10.2(2.3~71.2) | −2.374 | 0.021 |
| CR2[例(%)] | 6(23.1) | 24(57.1) | 7.559 | 0.006 |
注:CR1、CR2分别为第1、2次完全缓解
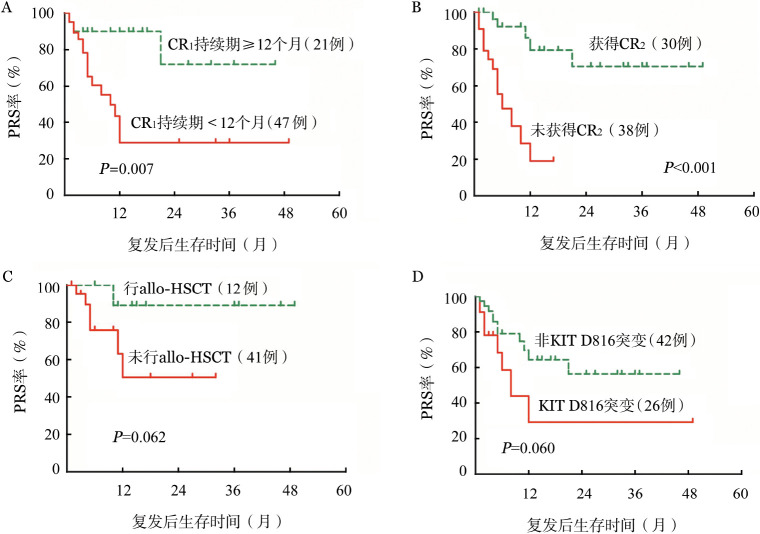
5.KIT D816突变对复发后无进展生存(PRS)的影响:本研究中伴t(8;21)白血病复发后中位随访期仅为4.9(0.2~49.6)个月,2年PRS率为(47.3±9.4)%。CR1维持期、是否获得CR2是影响PRS的主要因素(图1A、B),而是否伴KIT突变、CD56表达、复发年龄、初诊时WBC、是否合并附加染色体异常以及复发后染色体核型改变对PRS无显著影响。复发后是否行allo-HSCT有随访资料的患者53例,其中12例行allo-HSCT,其2年PRS率高于未行allo-HSCT患者[(88.9±10.5)%对(47.0±15.3)%,P=0.062](图1C),获得CR2患者移植率显著高于未获得CR2患者(47.6%对9.5%,P=0.006)。合并KIT D816突变有不良预后趋势,KIT D816突变组复发后2年PRS率为(28.2±15.7)%,而非KIT D816突变组为(55.1±11.1)%,但差异无统计学意义(P=0.060)图1D)。
图1. 伴t(8;21)急性髓系白血病患者复发后无进展生存(PRS)影响因素分析.
A~D分别为第1次完全缓解(CR1)维持期、是否获得第2次CR(CR2)、是否行allo-HSCT及KIT D816突变对PRS的影响
讨论
KIT基因位于染色体4q11-12,编码表达KIT蛋白(SCF受体),与干细胞因子结合后形成受体二聚化,激活下游信号通路,调节细胞增殖与分化。KIT基因突变是伴t(8;21)AML中的常见突变,发生率为12.7%~47.2%[2]–[3],[8]–[13],大多数突变位于Exon 17,发生率为18%~37.4%[1]–[3],[11],其中主要突变类型为D816,发生率为10%~34.6%[1]–[5],[8]–[10],[12]–[13],其次为N822K突变,发生率为8%左右[2],[9],[12]。有研究报道采用更加敏感的等位基因特异性PCR方法Exon17突变检出率高达63.5%[14]。
伴t(8;21)AML中KIT Exon17突变常伴随高WBC、高AML1-ETO融合基因转录本、骨髓中高白血病细胞比例,部分研究显示KIT Exon17突变者CD56表达率更高[1],本研究中KIT Exon17突变型CD56表达率高于Exon17野生型(95.7%对84.0%),其中D816突变型均表达CD56,但差异无统计学意义。此外,本研究发现KIT D816突变型患者发病年龄高于非KIT D816突变型,既往研究显示成人伴t(8;21)AML患者KIT D816突变发生率虽高于儿童患者(27.3%对18.8%),但差异无统计学意义[2]。
KIT Exon17突变型较KIT野生型患者中位缓解期短,累积复发率高达80%以上,是影响伴t(8;21)AML患者OS的主要不良因素[1]–[2],其中D816突变型较其他KIT突变型预后更差。体外实验表明D816突变比N822K突变具有更强的促进细胞增殖和抗凋亡作用[15]。Kim等[5]的研究显示伴t(8;21)AML中KIT D816突变者2年OS和无事件生存(EFS)率均显著低于其他突变型和KIT野生型患者[(25.0±15.3)%对(80.3±4.9)%,P<0.001;(25.0±15.3)%对(68.7±5.8)%,P=0.002]。Cairoli等[10]发现伴KIT D816突变型患者复发率高于其他突变型和KIT野生型患者(分别为90.0%、57.1%、35.3%),2年OS率仅为25.0%,显著低于KIT野生型患者(76.5%)。Yui等[13]也得出类似的研究结论,在CBF-AML中KIT D816突变者无复发生存(RFS)率显著低于KIT N822K突变和KIT野生型患者(分别为22.0%、53.8%、56.7%,P=0.002),OS显示出同样趋势(分别为38.5%、77.8%、77.2%,P<0.001),在伴t(8;21)AML患者中,KIT D816突变者3年RFS和OS率分别为17.1%和39.8%,而非KIT D816突变组分别为52.0%和72.3%。
既往报道中伴t(8;21)AML复发后再诱导化疗缓解率仅为45%~52%[16]–[17],本研究中复发后再诱导化疗CR率为44.1%,与文献报道相近。多数报道中KIT突变对于初始诱导化疗缓解率无显著影响[3],[5],也有研究显示KIT Exon17突变患者初始诱导缓解率低于无KIT突变患者[1],但对复发后挽救性化疗疗效影响尚无报道。我们的研究结果显示KIT D816突变患者再诱导化疗缓解率显著低于非KIT D816突变患者,此外CR1维持期依然是影响挽救化疗疗效的主要因素,但CR1维持期与KIT D816突变具有显著相关性,KIT D816突变患者CR1维持期更短,可以将该突变作为伴t(8;21)AML复发后挽救治疗疗效的早期预测指标和复发后治疗方案的选择依据。
NCCN指南中将伴KIT突变t(8;21)AML归为中危组,ELN指南则不考虑是否存在KIT突变,将其归入预后良好组。结合本研究和既往研究结果,我们认为KIT D816突变患者复发率高,复发后疗效差,归入预后中等组更为合适。对于伴有KIT D816突变的患者,应积极考虑在CR1期行allo-HSCT。
由于KIT基因突变在t(8;21)AML中发生率较高,且疗效差强人意,针对KIT基因的靶向治疗联合化疗或许会改善疗效。伊马替尼虽对KIT N822K突变有抑制作用,但对D816突变无效[18]。而达沙替尼能与KIT激酶活化构象的ATP结合位点相结合,对N822K和D816突变均具有抑制作用。在具有D816V突变的系统性肥大细胞增多症患者中,达沙替尼联合化疗取得很好的疗效,不仅缓解率高,而且RFS期延长[19]。达沙替尼联合化疗或许会提高伴KIT D816突变t(8;21)AML挽救治疗效果。
总之,伴t(8;21)AML尤其是伴有KIT D816突变患者复发后挽救治疗缓解率低,预后较差,获得CR2和进行allo-HSCT能改善其预后。
Funding Statement
基金项目:天津市科技计划(15ZXLCSY00010)
Fund program: Science and Technology Project of Tianjin(15ZXLCSY00010)
References
- 1.Park SH, Chi HS, Min SK, et al. Prognostic impact of c-KIT mutations in core binding factor acute myeloid leukemia[J] Leuk Res. 2011;35(10):1376–1383. doi: 10.1016/j.leukres.2011.06.003. [DOI] [PubMed] [Google Scholar]
- 2.Qin YZ, Zhu HH, Jiang Q, et al. Prevalence and prognostic significance of c-KIT mutations in core binding factor acute myeloid leukemia: a comprehensive large-scale study from a single Chinese center[J] Leuk Res. 2014;38(12):1435–1440. doi: 10.1016/j.leukres.2014.09.017. [DOI] [PubMed] [Google Scholar]
- 3.Paschka P, Marcucci G, Ruppert AS, et al. Adverse prognostic significance of KIT mutations in adult acute myeloid leukemia with inv(16) and t(8;21): a Cancer and Leukemia Group B Study[J] J Clin Oncol. 2006;24(24):3904–3911. doi: 10.1200/JCO.2006.06.9500. [DOI] [PubMed] [Google Scholar]
- 4.Schnittger S, Kohl TM, Haferlach T, et al. KIT-D816 mutations in AML1-ETO-positive AML are associated with impaired event-free and overall survival[J] Blood. 2006;107(5):1791–1799. doi: 10.1182/blood-2005-04-1466. [DOI] [PubMed] [Google Scholar]
- 5.Kim HJ, Ahn HK, Jung CW, et al. KIT D816 mutation associates with adverse outcomes in core binding factor acute myeloid leukemia, especially in the subgroup with RUNX1/RUNX1T1 rearrangement[J] Ann Hematol. 2013;92(2):163–171. doi: 10.1007/s00277-012-1580-5. [DOI] [PubMed] [Google Scholar]
- 6.National Comprehensive Cancer Network. Clinical practice guidelines in oncology (NCCN Guidelines): acute myeloid leukemia. Version 1. 2018. www.nccn.org/professionals/physician_gls/default.aspx. [DOI] [PubMed]
- 7.张 之南, 沈 悌. 血液病诊断及疗效标准[M] 3版. 北京: 科学出版社; 2007. pp. 106–134. [Google Scholar]
- 8.Care RS, Valk PJ, Goodeve AC, et al. Incidence and prognosis of c-KIT and FLT3 mutations in core binding factor (CBF) acute myeloid leukaemias[J] Br J Haematol. 2003;121(5):775–777. doi: 10.1046/j.1365-2141.2003.04362.x. [DOI] [PubMed] [Google Scholar]
- 9.Nanri T, Matsuno N, Kawakita T, et al. Mutations in the receptor tyrosine kinase pathway are associated with clinical outcome in patients with acute myeloblastic leukemia harboring t(8;21)(q22;q22)[J] Leukemia. 2005;19(8):1361–1366. doi: 10.1038/sj.leu.2403803. [DOI] [PubMed] [Google Scholar]
- 10.Cairoli R, Beghini A, Grillo G, et al. Prognostic impact of c-KIT mutations in core binding factor leukemias: an Italian retrospective study[J] Blood. 2006;107(9):3463–3468. doi: 10.1182/blood-2005-09-3640. [DOI] [PubMed] [Google Scholar]
- 11.丁 子轩, 沈 宏杰, 缪 竞诚, et al. C-kit、NPM1、FLT3基因突变在656例中国急性髓系白血病患者中的分布及其对预后的影响[J] 中华血液学杂志. 2012;33(10):829–834. doi: 10.3760/cma.j.issn.0253-2727.2012.10.011. [DOI] [PubMed] [Google Scholar]
- 12.Duployez N, Marceau-Renaut A, Boissel N, et al. Comprehensive mutational profiling of core binding factor acute myeloid leukemia[J] Blood. 2016;127(20):2451–2459. doi: 10.1182/blood-2015-12-688705. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Yui S, Kurosawa S, Yamaguchi H, et al. D816 mutation of the KIT gene in core binding factor acute myeloid leukemia is associated with poorer prognosis than other KIT gene mutations[J] Ann Hematol. 2017;96(10):1641–1652. doi: 10.1007/s00277-017-3074-y. [DOI] [PubMed] [Google Scholar]
- 14.Jang W, Yoon JH, Park J, et al. Significance of KIT exon 17 mutation depends on mutant level rather than positivity in core-binding factor acute myeloid leukemia[J] Blood Cancer J. 2016;6:e387. doi: 10.1038/bcj.2015.116. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Omori I, Yamaguchi H, Miyake K, et al. D816V mutation in the KIT gene activation loop has greater cell-proliferative and anti-apoptotic ability than N822K mutation in core-binding factor acute myeloid leukemia[J] Exp Hematol. 2017;52:56–64.e4. doi: 10.1016/j.exphem.2017.05.003. [DOI] [PubMed] [Google Scholar]
- 16.Khan M, Cortes J, Qiao W, et al. Outcomes of patients with relapsed core binding factor-positive acute myeloid leukemia[J] Clin Lymphoma Myeloma Leuk. 2018;18(1):e19–19e25. doi: 10.1016/j.clml.2017.09.017. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Kurosawa S, Miyawaki S, Yamaguchi T, et al. Prognosis of patients with core binding factor acute myeloid leukemia after first relapse[J] Haematologica. 2013;98(10):1525–1531. doi: 10.3324/haematol.2012.078030. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.陈 森, 王 莉红, 饶 青, et al. 伊马替尼体外诱导Kasumi-1细胞增殖、分化与凋亡作用[J] 中华血液学杂志. 2005;26(8):449–452. doi: 10.3760/j:issn:0253-2727.2005.08.001. [DOI] [PubMed] [Google Scholar]
- 19.Ustun C, Corless CL, Savage N, et al. Chemotherapy and dasatinib induce long-term hematologic and molecular remission in systemic mastocytosis with acute myeloid leukemia with KIT D816V[J] Leuk Res. 2009;33(5):735–741. doi: 10.1016/j.leukres.2008.09.027. [DOI] [PubMed] [Google Scholar]