自然杀伤(natural killer,NK)细胞是固有免疫系统的一部分,是机体抵御病毒感染、肿瘤细胞生长及转移的第一道防线[1]。而NK细胞的异源反应性更是目前研究的热点。临床上,HLA不相合造血干细胞移植(HSCT)中,“licensed” NK细胞具有异源反应性。而“non-licensed” NK细胞在富于细胞因子的造血环境下,也可能发生活化。这也说明,尽管供受者抑制型KIR/HLA配体不相合,NK细胞自身“licensing”和“education”功能,也可使得NK细胞活化[2]。我们前期对活化型KIR与配体进行研究,发现活化型KIR2DS1基因能有效介导NK细胞杀伤树突细胞(DC),且来自HLA-C1纯合子、KIR2DS1阳性的NK细胞在体外实验中能被C2组靶细胞显著激活[3]–[4]。我们研究经体外修饰供者NK细胞的抑制型KIR,即封闭CD158受体表位前后对受者DC的杀伤作用,并进一步探索供受者KIR/HLA模式,为临床单倍体异基因HSCT(allo-HSCT)筛选最佳供者提供分子依据。
对象与方法
1.药物和试剂:RosetteSep NK细胞富集试剂盒(加拿大Stemcell公司产品),RPMI 1640培养液及10%胎牛血清(美国Gibco公司产品),淋巴细胞分离液(中国医学科学院生物工程研究所产品),重组人白细胞介素2(rhIL-2)、重组人白细胞介素15(rhIL-15)及肿瘤坏死因子α(TNF-α)均为美国PeproPech公司产品,人AB血清购于天津灏洋生物公司,DNA提取试剂盒、HLA-Cw、KIR分型试剂盒为美国Invitrogen公司产品,Taq酶(美国Promega公司产品),Cell Counting Kit-8(CCK8试剂盒)为上海碧云天生物研究所产品,CD158a、CD158b mAb为美国BD公司产品,流式细胞仪及标记抗体为美国Beckman-Coulter公司产品。
2.研究对象:2010年5月至2014年12月于山西医科大学附属肿瘤医院接受单倍体allo-HSCT的急性白血病患者及供者各5例。
3.KIR基因分型检测:采用PCR-SSP法对KIR基因型进行检测。PCR缓冲液150 µl、双蒸水50 µl、DNA样本25 µl,Taq酶1.7 µl,混匀后分装至KIR分型试剂盒中。扩增条件为95 °C预变性5 min; 95 °C变性30 s, 68 °C退火30 s, 72 °C延伸90 s, 30个循环;4 °C保存。PCR仪扩增产物经15 g/L琼脂糖凝胶电泳7 min。成像后根据阳性条带及Score软件对结果进行分析。
4.HLA-Cw分型检测:采用SBT法对HLA-Cw位点进行分型检测。DNA样本经PCR产物扩增、纯化及测序反应后上ABI 3730 DNA序列分析仪检测;并采用Assign SBT 3.6+软件分析测序结果。根据HLA-Cw表位将受者DC分为C1、C2、C1/C2组。
5.封闭供者NK细胞CD158表位NK细胞培养14 d后取浓度为1×106/ml的NK细胞100 µl,加入CD158a、CD158b单克隆抗体(0、10、20 µg/ml)将混合细胞悬液置于37 °C、5% CO2条件下孵育30 min,封闭KIR2DL1、KIR2DL2/L3。
6.封闭供者NK细胞CD158表位前后对受者DC的杀伤作用:进行杀伤活性测定前,根据供者KIR基因分析结果显示对表现KIR2DS1阳性的供者NK细胞进行封闭。采用CCK-8比色法检测供者NK细胞的杀伤活性,靶细胞为DC,调整细胞密度为1 ×105/ml,按照不同效靶细胞比(1∶1、5∶1、10∶1)分别接种于96孔板上(每组设3个复孔),并设靶细胞孔、效应细胞孔及空白对照孔,每孔均为100 µl,充分振荡混匀后,于3 °C、5%CO2条件下培养24 h,后向每孔加入CCK-8 10 µl,振荡混匀后,在37 °C、5% CO2条件下培养4 h上酶标仪检测各孔在波长为450 nm处(600 nm校准)吸光度(A)值。
7.统计学处理:采用SPSS 20.0软件,计量资料以均数±标准差表示,两组资料数据比较采用t检验,多组之间采用方差分析。P<0.05为差异有统计学意义。
结果
一、NK细胞分离鉴定结果
健康供者NK细胞分选后,流式细胞术检测结果显示,外周血NK细胞纯度比例由(19.80±3.71)%提高到(93.10±2.94)%。
二、NK细胞增殖情况分析
分选后的NK细胞随着时间延长细胞数量增加,培养第7天、第14天扩增倍数分别为27.14±1.96、48.93±2.26。NK细胞培养期间在镜下观察细胞生长状态良好,细胞活力均在98%以上。
三、DC鉴定
1.DC形态变化:DC于培养第2天细胞体积变大、变形,出现梭形及树枝样等形态;第5天后细胞开始聚集,有部分细胞周围可见细小毛刺,且少数细胞开始悬浮;培养第7天,大多数细胞开始悬浮不再贴壁生长,于倒置光学显微镜下可见细胞周围有大量长而粗的树枝样突起,即为典型的DC形态。
2.DC免疫表型分析:培养第5、7天采用流式细胞术检测DC表面特异性标志,结果显示,培养第5天及第7天DC表面的共刺激分子CD80和CD86表达率分别由(52.42±2.43)%升至(91.99±1.21)%及(65.62±1.83)%升至(83.05±1.46)%,HLA-DR表达率由(72.58±2.11)%升至(83.58±0.97)%,特异性分子标志物CD1a表达率则由(87.21±2.35)%下降为(70.43±1.54)%,成熟分子标志物CD83表达率由(42.72±2.12)%升高为(85.83±3.47)%。
四、经抗CD158单克隆抗体修饰前后NK细胞对DC的杀伤作用
选择CD158表位封闭前后的供者NK细胞对受者DC的杀伤作用进行分析比较,结果显示,在效靶比(1∶1、5∶1、10∶1)范围内,封闭前后供者NK细胞对受者DC均具有杀伤作用,且随着效靶比的增加杀伤作用增强;同一效靶比,封闭后NK细胞对DC的杀伤作用高于封闭前,差异具有统计学意义(P<0.05)(图1)。
图1. 封闭CD158受体表位前后供者NK细胞对受者DC的杀伤作用(每组设3个复孔).
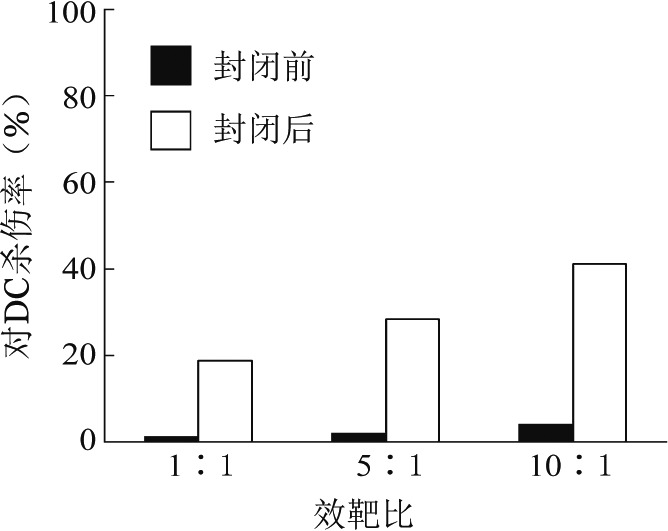
且在10∶1效靶比情况下,随封闭抗体浓度增高,对DC的杀伤活性增高[(3.82±1.07)%对(38.57±3.26)%],差异均具有统计学意义(P<0.05)。
五、供者NK细胞KIR2DL1对不同表位DC的杀伤作用
根据供受者KIR及HLA-Cw检测结果,将受者DC分为C1、C2、C1/C2组,经抗CD158b单抗单纯封闭KIR2DL2/L3受体表位,在同一效靶比(10∶1)下,供受者KIR2DL1对C1组DC杀伤效果优于受者为C2及C1/C2组;用不同浓度的CD158a单抗封闭KIR,随封闭抗体浓度的增加,杀伤效果增强(表1)。
表1. 单抗封闭KIR2DL2/L3后KIR2DL1对不同表位DC的杀伤率(%).
| 组别 | 样本数 | 抗体浓度(µg/ml) |
|||
| 0 | 5 | 10 | 20 | ||
| C1 | 3 | 3.93a | 18.91a | 22.47a | 40.43a |
| C2 | 1 | 2.86 | 4.28 | 11.54 | 15.62 |
| C1/C2 | 1 | 3.58 | 6.13 | 15.49 | 17.14 |
注:a:三组数据的均数
讨论
KIR主要分布于NK细胞表面,其配体为HLA-Ⅰ类抗原(HLA-A、HLA-B和HLA-C),其中以HLA-C类抗原最为主要。KIR分为活化型与抑制型两大类,在正常情况下,抑制型KIR与配体的亲和性强于活化型KIR,与自身靶细胞HLA-Ⅰ类分子结合,抑制了NK细胞的活化,使正常细胞避免自身免疫。抑制型信号和活化型信号之间相互作用,共同影响NK细胞活化的阈值及细胞毒活性[5]。活化阈值较低会导致NK细胞和T细胞的高活性,免疫状态被活化,而这种过度免疫状态可导致急性移植物抗宿主病(aGVHD)的发生。目前认为,NK细胞表面标志为CD3−、CD16+、CD56+[6],本实验我们通过NK细胞富集试剂盒分选NK细胞并对以上特异性表面抗体进行标记,纯化后NK细胞达91.1%,满足实验需求。另外,将分选后的NK细胞在细胞因子的刺激下扩增培养,培养14 d扩增(48.93±2.26)倍,说明体外可以获得高效扩增的NK细胞。
在HSCT早期,移植物抗原刺激宿主体内的APC,从而诱导供者T淋巴细胞活化,导致严重aGVHD。DC被认为是人体内最主要且功能最强的APC,因此在aGVHD发生过程中,清除受者体内DC,是减轻aGVHD发生的关键[7]。在allo-HSCT中,由于供受者KIR/HLA不相合,供者NK细胞的异源反应性被激活,KIR传递活化信号从而激活NK功能溶解靶细胞,介导GVL效应并有效杀伤受者DC减轻GVHD的发生,有利于移植物植入,是目前研究的热点[8]。
CD158是KIR家族主要成员,分为CD158a和CD158b。CD158a分子主要为KIR2DL1,CD158b分子主要为KIR2DL2/L3。这些KIR是NK细胞表面重要的iKIR,可通过结合靶细胞HLA-C位点抑制NK细胞的杀伤活性。因此理论上通过封闭CD158分子可使iKIR无法传递抑制信号,从而激活NK细胞杀伤活性。而且在动物实验中,运用单克隆抗体封闭iKIR可导致NK细胞活化,促进了NK杀伤效应[9]。
我们前期对活化型KIR与配体进行研究,发现活化型KIR2DS1基因能有效介导NK细胞杀伤DC,且来自HLA-C1纯合子、KIR2DS1阳性的NK细胞在体外实验中能被C2组靶细胞显著激活[3]–[4]。本实验中,我们将重点放在抑制型KIR的研究上。国内窦立萍等[10]研究结果显示,KIR2DL1、KIR2DL2/L3的基因分布频率为95%以上,其中KIR2DL1为100%。相关研究结果显示,供者KIR2DL1是引起NK细胞异源反应活性的主要iKIR,其与活化型KIR2DS1均识别C2表位靶细胞,但KIR2DL1与C2表位有更强的亲和力,移植早期异源活性iKIR高表达可增加GVHD的风险,但iKIR低表达则可导致白血病复发[11]。本研究中我们选择单倍体allo-HSCT供者外周血NK细胞及接受移植患者的DC作为研究对象,并对5对供受者KIR/HLA进行分型检测。为避免活化型KIR2DS1阳性对研究结果的影响,体外运用KIR2DS1单抗对5例供者NK细胞进行封闭处理。实验中,体外运用不同浓度CD158单克隆抗体对KIR2DL1、KIR2DL2/L3进行封闭,探索封闭抑制型受体KIR2DL1及KIR2DL2/L3前后对受者DC的杀伤作用。杀伤结果显示,同一效靶比(10∶1)下,封闭供者NK细胞抑制性受体后,杀伤受者DC的活性明显提高,增加封闭抗体浓度可提高杀伤活性。
研究发现,与KIR2DL1 +NK具有特异性杀伤C1/C1靶细胞不同,而KIR2DL2细胞识别C1、C2配体,异源反应活性弱[12]–[13]。国内报道显示,中国汉族人群绝大多数人均携带HLA-C1基因,allo-HSCT人群出现KI2DL2/L3不合的概率仅占0.03%[10]。本研究根据供受者KIR和HLA-Cw分型结果,将受者分为C1、C2及C1 /C2。考虑KIR2DL2/L3异源反应性差及可识别C1、C2配体的特点,对其进行单一封闭,单纯分析KIR2DL1对HLA不同表位的杀伤作用,发现在同一效靶比(10∶1)下,供受者KIR2DL1/C1组对靶细胞杀伤效果高于受者为C2及C1 /C2组,用不同浓度的CD158a单抗进行封闭,随封闭抗体浓度的增加,杀伤效果增强,与国外研究结果[13]相符。
本研究我们初步探究了KIR/HLA错配对NK细胞功能的影响,并为临床allo-HSCT选择供者提供了一定的实验支持。但由于样本量有限,存在个体差异性。而且NK细胞表面存在多种受体,其相互之间协同与拮抗关系有待进一步深入探索。
Funding Statement
基金项目:山西省科技厅基础研究计划(2013011056-4);太原市科技项目(12016909)
References
- 1.Tanriver Y, Diefenbach A. Transcription factors controlling development and function of innate lymphoid cells[J] Int Immunol. 2014;26(3):119–128. doi: 10.1093/intimm/dxt063. [DOI] [PubMed] [Google Scholar]
- 2.Bigley AB, Rezvani K, Chew C, et al. Acute exercise preferentially redeploys NK-cells with a highly-differentiated phenotype and augments cytotoxicity against lymphoma and multiple myeloma target cells[J] Brain Behav Immun. 2014;39:160–171. doi: 10.1016/j.bbi.2013.10.030. [DOI] [PubMed] [Google Scholar]
- 3.章 娟, 关 涛, 苏 丽萍, et al. KIR2DS1介导同种异体自然杀伤细胞对树突状细胞杀伤作用的研究[J] 白血病·淋巴瘤. 2014;23(11):673–676. [Google Scholar]
- 4.王 静, 关 涛, 苏 丽萍, et al. KIR2DS1受体对人类NK细胞杀伤白血病细胞的作用研究[J] 白血病·淋巴瘤. 2014;23(7):393–396. [Google Scholar]
- 5.Bakker AB, Wu J, Phillips JH, et al. NK cell activation: distinct stimulatory pathways counterbalancing inhibitory signals[J] Hum Immunol. 2000;61(1):18–27. doi: 10.1016/s0198-8859(99)00160-3. [DOI] [PubMed] [Google Scholar]
- 6.Freud AG, Yu J, Caligiuri MA. Human natural killer cell development in secondary lymphoid tissues[J] Semin Immunol. 2014;26(2):132–137. doi: 10.1016/j.smim.2014.02.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Cruijsen M, Lübbert M, Wijermans P, et al. Clinical Results of Hypomethylating Agents in AML Treatment[J] J Clin Med. 2014;25:4(1):1–17. doi: 10.3390/jcm4010001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Langenkamp U, Siegler U, Jörger S, et al. Human acute myeloid leukemia CD34 + CD38- stem cells are susceptible to allorecognition and lysis by single KIR-expressing natural killer cells[J] Haematologica. 2009;94:1590–1594. doi: 10.3324/haematol.2009.005967. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Tajima K, Matsumoto N, Ohmori K, et al. Augmentation of NK cell-mediated cytotoxicity to tumor cells by inhibitory NK cell receptor blockers[J] Int Immunol. 2004;16(3):385–393. doi: 10.1093/intimm/dxh021. [DOI] [PubMed] [Google Scholar]
- 10.窦 立萍, 达 万明, 赵 丹丹, et al. 中国汉族人群中KIR分布规律及其在HLA相合亲缘造血干细胞移植中的作用[J] 中华医学杂志. 2007;87(44):3111–3114. [PubMed] [Google Scholar]
- 11.Morishima Y, Yabe T, Matsuo K, et al. Effects of HLA allele and killer immunoglobulin-like receptor ligand matching on clinical outcome in leukemia patients undergoing transplantation with T-cell-replete marrow from an unrelated donor[J] Biol Blood Marrow Transplant. 2007;13(3):315–328. doi: 10.1016/j.bbmt.2006.10.027. [DOI] [PubMed] [Google Scholar]
- 12.Schönberg K, Sribar M, Enczmann J, et al. Analyses of HLA-C-specific KIR repertoires in donors with group A and B haplotypes suggest a ligand-instructed model of NK cell receptor acquisition[J] Blood. 2011;117(1):98–107. doi: 10.1182/blood-2010-03-273656. [DOI] [PubMed] [Google Scholar]
- 13.Pende D, Marcenaro S, Falco M, et al. Anti-leukemia activity of alloreactive NK cells in KIR ligand-mismatched haploidentical HSCT for pediatric patients: evaluation of the functional role of activating KIR and redefinition of inhibitory KIR specificity[J] Blood. 2009;113(13):3119–3129. doi: 10.1182/blood-2008-06-164103. [DOI] [PubMed] [Google Scholar]


