Abstract
目的
探讨修订的国际分期系统(R-ISS)在真实世界中对初诊多发性骨髓瘤(MM)患者的适用性。
方法
回顾性分析2010年5月至2015年4月新诊断的202例MM患者的临床资料。所有患者均接受基于硼替佐米或沙利度胺为主的方案诱导治疗至少4个疗程。以国际分期系统(ISS)为对照,分析R-ISS的预后意义。
结果
202例患者中,男124例,女78例,中位年龄57(28~81)岁。中位随访31个月,采用R-ISS分期,Ⅰ、Ⅱ、Ⅲ期患者分别为56、108、38例,中位总体生存(OS)时间分别为未达到、61个月和38个月,三期间差异有统计学意义(P=0.001);采用ISS分期,Ⅰ、Ⅱ、Ⅲ期患者分别为62、70、70例,中位OS时间分别为58、52和40个月,三期间差异有统计学意义(P=0.001)。采用Cox预后风险模式分析发现:R-ISS预后Ⅲ对Ⅰ、Ⅱ对Ⅰ期的HR值分别为9.606和4.038,P值分别为0.008和0.029;ISS预后的HR值分别为4.127和2.877,P值分别为0.070和0.005。亚组分析结果显示,未行移植(P=0.003)、接受硼替佐米为主的方案治疗(P=0.010)及年龄小于65岁(P=0.001)R-ISS不同分期患者的OS时间差异均有统计学意义。
结论
R-ISS能更好地区分初诊MM患者的OS时间,尤其对于接受硼替佐米治疗为主、年轻、未行移植患者的预后评估价值较为突出,对中国MM患者具有重要的预后价值。
Keywords: 多发性骨髓瘤, R-ISS 分期系统, 预后
Abstract
Objective
To assess the prognostic value of revised international staging system (R-ISS) for multiple myeloma (MM) in real world.
Methods
A total of 202 newly diagnosis symptomatic MM patients were enrolled from May 2010 to April 2015 and the clinical data were retrospectively analyzed. All the patients received at least four courses of bortezomib-based or thalidomide-based induction therapy.
Results
With a median follow-up of 31 months, the cohort included 56 cases in R-ISSⅠ, 108 in R-ISS Ⅱ, and 38 in R-ISS Ⅲ, and the median OS was not reached/61/38 months, respectively (P=0.001). According to the ISS system, 62 patients were classified in ISS-Ⅰ, 70 in ISS-Ⅱ and 70 in ISS-Ⅲ, with the median OS was 58, 52 and 40 months, respectively (P=0.001). The relative risk (HR) of R-ISS stage Ⅲ vs Ⅰ, Ⅱ vs Ⅰ were 9.606 (P=0.008) and 4.038 (P=0.029). The HR of Ⅲ vs Ⅰ, Ⅱ vs Ⅰ of ISS system were 4.127 (P=0.070) and 2.877 (P=0.005). In the subgroup analysis, R-ISS predicted survival for patients who were not transplanted (P=0.003), receiving bortezomib-based therapy (P=0.010), and patients younger than 65 years (P=0.001).
Conclusion
R-ISS system could better predict prognosis for OS in unselected nonclinical trial myeloma patients than ISS system, especially for the younger patients, patients with bortezomib-based therapy, and patients without transplantation.
Keywords: Multiple myeloma, R-ISS system, Prognosis
近年来,随着靶向新药及自体造血干细胞移植的广泛应用,多发性骨髓瘤(multiple myeloma,MM)患者的预后得到了极大的改善,但不同患者的预后仍有极大的差异。国际分期系统(International Staging System,ISS)在新药时期已不能完全满足目前临床需求。因此在2015年,国际骨髓瘤工作组依据11个临床试验中心的数据,总结了4 445例新诊断的MM患者的临床资料,更新修订了ISS,即R-ISS(Revised International Staging System)[1]。R-ISS纳入了细胞遗传学因素和血清LDH作为判断预后的指标。R-ISS是基于临床研究数据分析提出的,在真实世界中是否同样有效,仍有待我们探讨。因此,本研究我们探讨R-ISS在真实世界MM患者中的应用价值
病例与方法
1.一般资料:回顾性分析2010年5月至2015年4月我院收治的202例初诊MM患者的临床资料。所有患者均收集性别、年龄、血尿M蛋白定量、白蛋白、β2微球蛋白(β2-MG)、LDH、HGB、WBC及细胞遗传学改变等基线资料。
2.FISH检测:①CD138阳性浆细胞标本制备:留取患者初诊时15~20 ml骨髓液,密度梯度分离法分离单个核细胞。采用免疫磁珠法分离CD138阳性细胞。②FISH探针:FISH常规检测位点为IgH易位、17p−、13q−、1q21+、t(11;14)、t(14;16)、t(4;14),所用探针均购自英国CYTOCELL公司。③判定标准及阳性阈值:在荧光显微镜下观察结果,每个样本每个探针观测200个间期细胞的荧光杂交信号。采用俄罗斯VideoTest公司的FISH分析软件进行图像分析。参考值参照欧洲骨髓瘤工作组设定标准,以17p−≥20%、13q−≥20%、1q21+≥20%作用阳性判定阈值。将出现17p−≥20%、t(4;14)≥20%和t(14;16)≥20%中至少一项异常时,定义为存在高危细胞遗传学改变。
3.分期系统标准:ISS标准参照文献[2]:Ⅰ期:β2-MG <3.5 mg/L和血清白蛋白>35 g/L;Ⅱ期:介于Ⅰ、Ⅲ期之间;Ⅲ期:β2-MG≥5.5 mg/L。R-ISS标准参照文献[1]:Ⅰ期:符合ISS分期Ⅰ期标准,LDH正常和FISH检查正常;Ⅱ期:介于R-ISS的Ⅰ、Ⅲ期之间;Ⅲ期:符合ISS分期Ⅲ期标准,或合并LDH增高,或合并FISH检查异常显示为高危,即17p−,和/或t(4;14),和/或t(14;16)。
4.治疗:所有患者均接受新药为基础的联合化疗方案,诱导治疗至少4个疗程。①以硼替佐米为基础的方案治疗176例(87.1%),其中,CBD(硼替佐米+环磷酰胺+地塞米松)方案88例(43.6%)、PAD(硼替佐米+表柔比星+地塞米松)方案31例(15.3%)、VD(硼替佐米+地塞米松)方案20例(10.0%)、V-DECP(硼替佐米+顺铂+环磷酰胺+依托泊苷+地塞米松)方案37例(18.3%);②以沙利度胺为基础方案治疗26例(12.9%),其中,TD(沙利度胺+地塞米松)方案4例(2.0%)、TAD(沙利度胺+表柔比星+地塞米松)方案6例(3.0%)、TCD(沙利度胺+环磷酰胺+地塞米松)方案10例(4.9%)、T-DECP(沙利度胺+顺铂+环磷酰胺+依托泊苷+地塞米松)方案6例(3.0%)。
5.研究方法:202例MM患者诊断明确后采集基线临床资料,而后分别接受基于硼替佐米或者沙利度胺为主方案的诱导治疗至少4个疗程,评估疗效。根据患者年龄、状况、是否适合移植、疗效等情况进行后续移植或者巩固强化治疗,并进行随访。以总体生存(OS)时间作为主要研究终点(定义为患者从诊断至任何原因导致的死亡时间),疾病无进展生存(PFS)时间为次要研究终点(定义为初诊至一线方案进展或末次随访时间)。采用R-ISS对患者进行分期,探索R-ISS在中国MM患者的适用性。
6.统计学处理:采用SPSS19.0软件进行统计学分析。生存曲线绘制采用极限乘积法(Kaplan-Meier法),单因素生存曲线比较用Log-rank检验,多因素生存分析采用Cox比例风险回归模型。以P<0.05为差异有统计学意义。
结果
1. 一般临床特征:202例MM患者中,男124例,女78例,中位年龄57(28~81)岁。一般临床特征详见表1。
表1. 202例多发性骨髓瘤患者的一般临床特征.
| 临床特征 | 例数(%) |
| 年龄≥65岁 | 48(23.8) |
| 男性 | 124(61.4) |
| 贫血 | 136(67.3) |
| 白蛋白<35 g/L | 78(38.6) |
| β2微球蛋白≥3.5 mg/L | 101(50.0) |
| 血肌酐≥176 µmol/L | 44(21.8) |
| 血钙≥2.75 mmol/L | 24(11.9) |
| LDH≥245 U/L | 32(15.8) |
| FISH | |
| IgH易位≥5% | 163(80.7) |
| t(4;14)≥20% | 43(21.3) |
| t(11;14)≥20% | 40(19.8) |
| t(14;16)≥20% | 3(1.5) |
| 17p− | 25(12.4) |
| 13q− | 85(42.1) |
| 1q21+ | 115(56.9) |
| M蛋白类型 | |
| IgG型 | 95(47.0) |
| IgA型 | 45(22.3) |
| IgD型 | 21(10.4) |
| 轻链型 | 37(18.3) |
| 不分泌型 | 4(2.0) |
| 治疗方案 | |
| 硼替佐米为基础方案 | 176(87.1) |
| 沙利度胺为基础方案 | 26(12.9) |
| 自体造血干细胞移植 | 40(19.8) |
注:贫血:男性HGB<120 g/L,女性HGB<110 g/L
2. 不同分期系统对患者OS评估的适用性分析:中位随访31(1~62)个月。采用R-ISS分期,Ⅰ、Ⅱ、Ⅲ期患者分别为56(27.7%)、108(53.5%)、38例(18.8%),中位OS时间分别为未达到、61(95%CI 46~71)个月和38(95%CI 21~54)个月,三期间差异有统计学意义(χ2=15.894,P=0.001)(图1);采用ISS分期,Ⅰ、Ⅱ、Ⅲ期患者分别为62(30.7%)、70(34.6%)、70例(34.6%),中位OS时间分别为58(95%CI 54~63)、52(95%CI 46~58)和40(95%CI 29~48)个月,三期间差异有统计学意义(χ2=14.563,P=0.001)。
图1. 国际预后分期系统(R-ISS)不同分期的多发性骨髓瘤患者总体生存曲线比较.
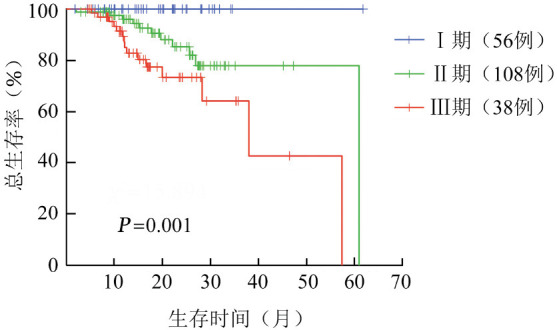
3. 不同分期系统对患者预后的价值分析:采用Cox预后风险模式分析发现,R-ISS预后Ⅲ期对Ⅰ期、Ⅱ期对Ⅰ期的HR值分别为9.606和4.038,P值分别为0.008和0.029;ISS预后的HR值分别为4.127和2.877,P值分别为0.070和0.005(表2)。
表2. 采用Cox预后风险模式分析不同分期系统对患者预后的价值.
| 影响因素 | HR(95% CI) | P值 |
| 国际预后分期系统 | ||
| Ⅱ期对Ⅰ期 | 2.877(1.374~6.022) | 0.005 |
| Ⅲ期对Ⅰ期 | 4.127(0.891~19.115) | 0.070 |
| 修订的国际预后分期系统 | ||
| Ⅱ期对Ⅰ期 | 4.038(1.441~11.320) | 0.029 |
| Ⅲ期对Ⅰ期 | 9.606(1.265~72.934) | 0.008 |
4. 亚组分析中R-ISS不同分期患者的预后比较:对于未行移植、接受硼替佐米为主方案及年轻的患者,R-ISS均展示了其在OS预后评估中的重要价值。亚组分析结果显示,未行移植(χ2=15.087,P=0.003)、接受硼替佐米为主的方案治疗(χ2=13.017,P=0.010)及年龄小于65岁(χ2=19.658,P=0.001)R-ISS不同分期患者的OS时间差异均有统计学意义(图2)。由于接受沙利度胺和移植的患者在本研究中例数尚少,R-ISS不同分期患者的OS时间的无明显差异。
图2. 亚组分析中修订的国际预后分期系统(R-ISS)不同分期患者的总体生存曲线比较.
A:未移植组;B:移植组;C:硼替佐米治疗组;D:沙利度胺治疗组;E:年龄<65岁组;F:年龄≥65岁组
单因素分析结果显示,β2-MG≥3.5 mg/L(χ2=11.744,P=0.001)、LDH≥245 U/L(χ2=14.101,P<0.001)、17p−≥20%(χ2=4.944,P=0.026)、1q21+≥20%(χ2=4.250,P=0.039)与较短的OS时间显著相关。
多因素分析结果显示,1q21+是影响患者OS的独立预后因素(HR=2.370,95%CI 1.134~3.995,P=0.013)。
5.R-ISS对患者PFS评估的适用性分析:结果显示三期患者间PFS时间差异无统计学意义(χ2=5.003,P=0.083)(图3)。在诊断后的最初2年,R-ISSⅠ期与Ⅱ期患者较难区分,Ⅰ、Ⅱ期患者PFS时间优于Ⅲ期患者。但2年后Ⅱ期患者疾病状态趋于稳定,PFS优于Ⅰ期患者,也许与诱导治疗后患者巩固维持治疗方案不同有关,从而导致其分期的偏移。
图3. 修订的国际预后分期系统(R-ISS)不同分期患者的无进展生存曲线比较.

讨论
在本研究中,我们通过对202例初诊MM患者临床资料进行回顾性研究,探讨了R-ISS在MM患者中的适用性,并与ISS系统进行比较,证实R-ISS评估预后的效率高于ISS。
ISS是2005年国际骨髓瘤工作组依据11 470例MM患者的数据提出的分期系统,它包含两个简单、客观的指标:白蛋白与β2-MG[2]。ISS提出的背景是传统药物治疗时期,且ISS不含细胞遗传学因素,β2-MG水平受肾功能不全影响,不能完全真实反映患者的疾病负荷和细胞遗传学特征[3]。目前研究显示,骨髓瘤细胞遗传学异常可反映骨髓瘤细胞的生物学特性,是影响患者预后最重要的因素之一[4]。FISH可检测骨髓瘤细胞分裂间期的常见染色体异常,如17p−、1q21+、13q−、IgH易位、t(11;14)、t(4;14)等[5]–[6]。研究证实17p−可导致p53缺失,而p53基因是机体最重要的抑癌基因之一,出现17p−的患者,预后不良[7]–[8]。文献报道t(4;14)与t(14;16)在MM患者中的比率分别为15%和5%,17p−比率为10%[9]–[11]。而在本组患者中,t(4;14)、t(14;16)、17p−比率分别为21.3%、19.8%和12.4%,除t(14;16)外,t(4;14)和17p−发生率均明显高于既往报道,提示该组患者具有高危的细胞遗传学异常的比例更高,预后更差[12]。这也可能部分解释本组患者R-ISS三期间患者PFS时间差异无统计学意义。在初诊患者中,10%~15%合并高LDH血症,在分期系统中增加LDH可在ISSⅠ期和Ⅲ期的患者中,进一步区分预后不良的患者[13]–[14],而在本组患者中高LDH比率为15.8%,与既往报道一致。
在R-ISS中,将ISSⅠ期的患者分为预后相对较好组和预后相对较差组,分别进一步分为R-ISS Ⅰ期和Ⅱ期。本研究中ISS分期中的部分Ⅰ、Ⅲ期患者进入到R-ISS的Ⅱ期,R-ISS系统中Ⅱ期患者明显增多,Ⅲ期患者比例明显减少。在单因素分析中,ISS、FISH[t(4;14)、17p−]及LDH是影响患者OS的独立因素,验证对于初诊的MM患者,整合以上预后因素后的R-ISS,能更好地预测患者的OS。在生存分析中,我们的数据证实R-ISS系统可以明显地区别患者OS的差异(P=0.001)。进一步行Cox预后风险模式评估R-ISS的效率,R-ISS预后Ⅲ期对Ⅰ期的HR值为9.606,明显高于ISS中的Ⅲ期对Ⅰ期中的4.127;同样,R-ISS较原ISS中Ⅱ期对Ⅰ期,HR值增加近乎两倍,证实R-ISS评估患者OS的预后价值优于ISS分期。
因本研究收集的接受移植及沙利度胺治疗的患者例数尚少,未观察到R-ISS不同分期患者OS及PFS的差异具有统计学意义,仍需扩大样本进一步验证此评估体系。
Funding Statement
基金项目:上海市卫计委卫生系统第二批重要疾病联合攻关重点项目(2014ZYJB0004);国家自然科学基金(81470360);“十二五”国家科技支撑计划(2014BAI09B12)
Fund programs:Shanghai Municipality Health System Key Joint Research Project on Important Dims of the Second Batch(2014ZYJB0004),National Natural Science Foundation of China(81470360), Key Projects in the National Science & Technology Pillar Program during the Twelfth Five-year Plan Period(2014BAI09B12)
References
- 1.Palumbo A, Avet-Loiseau H, Oliva S, et al. Revised International Staging System for Multiple Myeloma: A Report From International Myeloma Working Group[J] J Clin Oncol. 2015;33(26):2863–2869. doi: 10.1200/JCO.2015.61.2267. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Greipp PR, San MJ, Durie BG, et al. International staging system for multiple myeloma[J] J Clin Oncol. 2005;23(15):3412–3420. doi: 10.1200/JCO.2005.04.242. [DOI] [PubMed] [Google Scholar]
- 3.Bataille R, Annweiler C, Beauchet O. Multiple myeloma international staging system: “staging” or simply “aging” system?[J] Clin Lymphoma Myeloma Leuk. 2013;13(6):635–637. doi: 10.1016/j.clml.2013.07.003. [DOI] [PubMed] [Google Scholar]
- 4.Boyd KD, Ross FM, Chiecchio L, et al. A novel prognostic model in myeloma based on co-segregating adverse FISH lesions and the ISS: analysis of patients treated in the MRC Myeloma IX trial[J] Leukemia. 2012;26(2):349–355. doi: 10.1038/leu.2011.204. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Fonseca R, Bergsagel PL, Drach J, et al. International Myeloma Working Group molecular classification of multiple myeloma: spotlight review[J] Leukemia. 2009;23(12):2210–2221. doi: 10.1038/leu.2009.174. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Keats JJ, Reiman T, Maxwell CA, et al. In multiple myeloma, t(4;14)(p16;q32) is an adverse prognostic factor irrespective of FGFR3 expression[J] Blood. 2003;101(4):1520–1529. doi: 10.1182/blood-2002-06-1675. [DOI] [PubMed] [Google Scholar]
- 7.Merz M, Hielscher T, Seckinger A, et al. Baseline characteristics, chromosomal alterations, and treatment affecting prognosis of deletion 17p in newly diagnosed myeloma[J] Am J Hematol. 2016;91(11):E473–473E477. doi: 10.1002/ajh.24533. [DOI] [PubMed] [Google Scholar]
- 8.Fonseca R, Monge J, Dimopoulos MA. Staging and prognostication of multiple myeloma[J] Expert Rev Hematol. 2014;7(1):21–31. doi: 10.1586/17474086.2014.882224. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Chng WJ, Price-Troska T, Gonzalez-Paz N, et al. Clinical significance of TP53 mutation in myeloma[J] Leukemia. 2007;21(3):582–584. doi: 10.1038/sj.leu.2404524. [DOI] [PubMed] [Google Scholar]
- 10.Stewart AK, Bergsagel PL, Greipp PR, et al. A practical guide to defining high-risk myeloma for clinical trials, patient counseling and choice of therapy[J] Leukemia. 2007;21(3):529–534. doi: 10.1038/sj.leu.2404516. [DOI] [PubMed] [Google Scholar]
- 11.Weinhold N, Kirn D, Seckinger A, et al. Concomitant gain of 1q21 and MYC translocation define a poor prognostic subgroup of hyperdiploid multiple myeloma[J] Haematologica. 2016;101(3):e116–119. doi: 10.3324/haematol.2015.136929. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Palumbo A, Bringhen S, Mateos MV, et al. Geriatric assessment predicts survival and toxicities in elderly myeloma patients: an International Myeloma Working Group report[J] Blood. 2015;125(13):2068–2074. doi: 10.1182/blood-2014-12-615187. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Gkotzamanidou M, Kastritis E, Gavriatopoulou MR, et al. Increased serum lactate dehydrongenase should be included among the variables that define very-high-risk multiple myeloma[J] Clin Lymphoma Myeloma Leuk. 2011;11(5):409–413. doi: 10.1016/j.clml.2011.07.001. [DOI] [PubMed] [Google Scholar]
- 14.Terpos E, Katodritou E, Roussou M, et al. High serum lactate dehydrogenase adds prognostic value to the international myeloma staging system even in the era of novel agents[J] Eur J Haematol. 2010;85(2):114–119. doi: 10.1111/j.1600-0609.2010.1466.x. [DOI] [PubMed] [Google Scholar]



