Abstract
目的
比较评估初诊时血清游离轻链比值(rFLC)及差值(dFLC)对多发性骨髓瘤(MM)患者预后的价值。
方法
收集整理2012年1月至2016年3月有FLC检测记录的479例初治MM患者的相关临床资料,采用四分位间距法将rFLC、dFLC进行分组。将rFLC分别为3组:≤14.828、14.828~364.597、≥364.597。将dFLC分为3组:≤112.85 mg/L、112.85~2 891.83 mg/L、≥2 891.83 mg/L。随后分别对不同分组进行预后分析比较。使用Kaplan-Meier进行无进展生存(PFS)和总生存期(OS)比较,使用Cox回归进行单因素、多因素预后相关性分析。
结果
不同截断范围rFLC或dFLC患者的OS及PFS差异均有统计学意义。rFLC≤14.828组OS明显优于其他两组(未达到对61个月对47个月,P=0.019);PFS与rFLC 14.828~364.597组相比,差异无统计学意义(P=0.227),与rFLC≥364.597相比,差异有统计学意义(P=0.024)。dFLC≤112.85 mg/L组与其他两组相比PFS、OS差异均有统计学意义。单因素、多因素分析显示rFLC仅与患者OS显著相关,而dFLC与患者OS、PFS均显著相关。4年OS率比较,rFLC≤14.828组4年OS率达90.84%,明显高于其他两组(59.29%、62.26%);dFLC≤112.85 mg/L组4年OS率达89.97%,明显高于其他两组(41.32%、71.95%)(P<0.05)。
结论
对于初治MM患者,不同截断范围的rFLC、dFLC对患者生存预后影响不同。其中rFLC≤14.828或dFLC≤112.85 mg/L,其生存预后差异更为明显,且具有更低的死亡风险,危险比也更低。以此截断值判断患者预后较为理想。
Keywords: 多发性骨髓瘤, 血清游离轻链, 预后
Abstract
Objective
To evaluate the prognostic value of serum free light chain ratio (rFLC) and difference (dFLC) in patients with multiple myeloma (MM).
Methods
Clinical data of 479 cases of newly diagnosed MM patients with FLC test records referred to our hospital from January 2012 to March 2016 were collected. rFLC preferred cut-off values were selected as≤14.828,14.828-364.597, ≥364.597 according to the literatures. The dFLC was divided into ≤112.85,112.85-2891.83, ≥2891.83 mg/L three groups. The rFLC and dFLC values among the death, the non-death, the progress and the non-progress groups were compared by t test. The correlation analysis showed that the rFLC and dFLC values were related to the death or progression of the disease. Logistic regression was used to analyze the correlation between each factor and death or progression. Univariate survival analysis (PFS) and total survival (OS) were performed using Kaplan-Meier. Single-variable and multivariate prognostic analysis were performed using Cox model.
Results
The cutoff values of rFLC less than 14.828 or dFLC less than or equal to 112.85 mg/L impacted most significant on OS and PFS of the patients (P<0.05). Different rFLC cut-off values between two groups showed that when rFLC=14.828, OS was significantly better than the other two groups (NR vs 61 & 47 months, P=0.019); different dFLC cut-off values between two groups disclosed that PFS and OS were statistically significant when dFLC less than or equal to 112.85 mg/L compared with the other two groups (P<0.05). The 4-year PFS/OS rates in the initial dFLC≤112.85 mg/L and rFLC≤14.828 groups was significantly higher than of the other two groups.
Conclusion
Different cutoff levels of rFLC and dFLC might have obviously effects on the prognoses of patients with newly diagnosed MM. The difference of survival prognosis would be more pronounced when rFLC≤14.828 or dFLC≤112.85 mg/L with lower risk of death and lower risk ratio, which might be ideal cutoff value for determining the prognosis of these patients.
Keywords: Multiple myeloma, Serum free light chain, Prognostic
多发性骨髓瘤(MM)是一种克隆性浆细胞异常增殖的恶性疾病,是血液系统最常见恶性肿瘤之一,多发于老年人,目前仍无法治愈,且近10年来,其发病率仍在不断上升[1]–[3]。但近年随着新药不断问世及检测手段的提高,MM的诊断和治疗得以不断改进和完善[4]–[5]。其中,21世纪初,血清游离轻链检测的问世,因其在评价预后、进展风险及治疗MM或相关浆细胞病(PCD)方面的重要意义及优势而逐步得到更多的重视[6]–[8]。而血清游离轻链比值(rFLC)对于MM患者的预后价值得到认可,被认为是独立的预后因素[7]–[9]。但对于初诊时rFLC及差值(dFLC)对于患者预后的影响差别目前尚无明确结论[10]。我们回顾性分析单中心497例初诊MM患者的临床资料,旨在对初诊MM患者rFLC、dFLC的最佳截断值的判定及二者对患者生存预后意义的价值区别进行初步探讨。
病例与方法
1.病例:收集2011年1月至2016年4月确诊并入住我院接受治疗的479例新诊断MM患者的临床资料。入组患者参照美国国立综合癌症网(National Comprehensive Cancer Network, NCCN)MM诊疗指南进行诊断和治疗。479例患者中接受以硼替佐米为基础化疗方案治疗者337例(70.3%),接受以沙利度胺为基础化疗方案治疗者59例(12.3%),接受其他方案化疗者83例(17.4%)。在诱导化疗后行自体造血干细胞移植治疗者69例(14.4%)。
2.随访和疗效评估:采用门诊、住院病历查阅及电话联系方式进行随访。随访起止时间为2011年1月1日至2016年4月1日,中位随访时间为18.5(1.1~62.7)个月。总生存(OS)时间定义为从患者诊断明确到死亡或随访截止日期。治疗后疗效评价采用2017年修订的中国MM诊治指南,分为完全缓解(CR)、严格意义的CR(sCR)、非常好的部分缓解(VGPR)、部分缓解(PR)、疾病稳定(SD)、微小缓解(MR)、疾病进展(PD)。
3.统计学处理:采用SPSS 19.0软件、R3.4.1软件进行统计学分析。计量资料比较采用两独立样本的非参数检验(Mann Whitney U检验),计数资料的比较采用独立样本R*C列联表资料的卡方检验。生存分析应用Kaplan-Meier检验,组间比较应用Log-rank检验,单因素分析和多因素分析应用Cox比例风险回归模型,采用Pearson相关系数进行简单相关性分析。以P<0.05为差异有统计学意义。
结果
1.一般特征:479例MM患者中,男295例,女184例,中位年龄61(23~96)岁。M蛋白分型:IgA型114例(23.8%),IgG型231例(48.2%),IgD型45例(9.4%),轻链型87例(18.2%)。κ轻链型248例(50.9%),λ轻链型231例(49.1%)。患者基本特征及单因素生存分析结果见表1。
表1. 479例多发性骨髓瘤患者生存单因素分析.
| 变量 | 例数 | 中位进展期(月) | χ2值 | P值 | 中位生存期(月) | χ2值 | P值 |
| 性别 | 4.151 | 0.042 | 0.525 | 0.469 | |||
| 男性 | 295 | 39.31 | - | ||||
| 女性 | 184 | 54.01 | - | ||||
| 年龄(岁) | 0.074 | 0.785 | 0.550 | 0.458 | |||
| <65 | 330 | 39.93 | - | ||||
| ≥65 | 149 | 29.93 | 61.10 | ||||
| 肾功能 | 3.126 | 0.077 | 0.011 | 0.917 | |||
| 正常 | 380 | 44.97 | - | ||||
| 不全 | 99 | 28.43 | - | ||||
| M蛋白类型 | 11.924 | 0.008 | 2.545 | 0.467 | |||
| IgA | 114 | 54.27 | 61.10 | ||||
| IgG | 233 | 37.23 | - | ||||
| IgD | 45 | 28.43 | - | ||||
| 轻链 | 87 | - | - | ||||
| 轻链类型 | 2.727 | 0.099 | 0.006 | 0.938 | |||
| λ | 231 | 39.93 | - | ||||
| κ | 248 | 50.87 | 50.23 | ||||
| DS分期 | 1.857 | 0.395 | 2.02 | 0.364 | |||
| Ⅰ期 | 9 | - | - | ||||
| Ⅱ期 | 38 | - | - | ||||
| Ⅲ期 | 431 | 37.23 | - | ||||
| ISS分期 | 12.329 | 0.002 | 17.143 | <0.001 | |||
| Ⅰ期 | 145 | 71.80 | 61.10 | ||||
| Ⅱ期 | 149 | 59.20 | 53.78 | ||||
| Ⅲ期 | 185 | 29.20 | |||||
| R-ISS分期 | 0.003 | 0.000 | |||||
| Ⅰ期 | 85 | 59.20 | 58.85 | ||||
| Ⅱ期 | 209 | 29.20 | 56.30 | ||||
| Ⅲ期 | 185 | 39.93 | 44.10 | ||||
| 高LDH | 0.814 | 0.367 | 1.618 | 0.203 | |||
| 否 | 399 | 37.23 | - | ||||
| 是 | 80 | 44.97 | 61.10 | ||||
| 贫血 | 3.674 | 0.055 | 1.879 | 0.170 | |||
| 否 | 140 | - | - | ||||
| 是 | 339 | 37.23 | 61.10 | ||||
| 高钙 | 0.543 | 0.461 | 6.468 | 0.011 | |||
| 否 | 378 | 37.23 | - | ||||
| 是 | 101 | 54.27 | 61.10 | ||||
| 移植 | 2.784 | 0.095 | 0.177 | 0.674 | |||
| 无 | 411 | 36.23 | 61.10 | ||||
| 有 | 68 | 59.20 | - |
注:-:未做
2.分析按不同截断值对rFLC、dFLC分组的预后价值:对本中心479例患者的rFLC、dFLC数据进行初步分析,因其为偏态分布的连续性变量,故运用四分位间距法进行初步组距分组,以期望获取对于患者而言,出现生存差异的rFLC、dFLC的大致截断值范围,并比较分析不同截断范围对患者预后的影响差异。不同分组比较结果提示对患者OS而言,不同截断值rFLC/dFLC组间差异均有统计学意义,但对患者PFS而言,仅dFLC分组比较差异存在统计学意义(表2)。Cox单因素分析显示dFLC不同截断值在OS、PFS比较中较rFLC对患者生存差异影响更显著,HR值更高(表3)。多因素分析结果提示,不同分组rFLC/dFLC均为患者预后相关因素(表4)。
表2. 四分位间距分组后初诊时血清游离轻链比值(rFLC)及差值(dFLC)对总生存(OS)、无进展生存(PFS)的影响.
| 变量 | 例数 | 中位进展期(月) | χ2值 | P值 | 中位生存期(月) | χ2值 | P值 | |
| rFLC | 5.340 | 0.069 | 8.699 | 0.013 | ||||
| ≤14.828 | 119 | 71.80 | ||||||
| 14.828~364.597 | 241 | 50.87 | 61.10 | 5.601 | 0.018 | |||
| ≥364.597 | 119 | 29.93 | 47.05 | 8.450 | 0.004 | |||
| dFLC(mg/L) | 8.63 | 0.013 | 11.172 | 0.004 | ||||
| ≤112.85 | 119 | 71.80 | ||||||
| 112.85~2 891.83 | 240 | 31.23 | 50.233 | 11.909 | 0.001 | |||
| ≥2 891.83 | 120 | 32.97 | 7.030 | 0.008 | ||||
表3. 四分位间距法分组法时血清游离轻链比值(rFLC)及差值(dFLC)对生存预后的影响比较.
| 变量 | PFS |
OS |
|||||||||
| B | SE | Wald | P值 | HR(95%CI) | B | SE | Wald | P值 | HR(95%CI) | ||
| rFLC | 5.234 | 0.073 | 7.940 | 0.019 | |||||||
| ≤14.828 | 1.00 | 1.00 | |||||||||
| 14.828~364.597 | 0.306 | 0.253 | 1.461 | 0.227 | 1.36(0.83~2.23) | 0.963 | 0.416 | 5.362 | 0.021 | 2.62(1.16~5.92) | |
| ≥364.597 | 0.615 | 0.273 | 5.087 | 0.024 | 1.85(1.08~3.16) | 1.224 | 0.435 | 7.918 | 0.005 | 3.40(1.45~7.98) | |
| dFLC(mg/L) | 8.301 | 0.016 | 9.753 | 0.008 | |||||||
| ≤112.85 | 1.00 | 1.00 | |||||||||
| 112.85~2 891.83 | 0.606 | 0.268 | 5.111 | 0.024 | 1.83(1.08~3.10) | 1.377 | 0.441 | 9.752 | 0.002 | 3.27(1.67~9.41) | |
| ≥2 891.83 | 0.809 | 0.283 | 8.171 | 0.004 | 2.25(1.29~3.91) | 1.185 | 0.473 | 6.277 | 0.012 | 3.96(1.29~8.27) | |
注:PFS:无进展生存;OS:总生存
表4. 血清游离轻链比值(rFLC)/差值(dFLC)不同分组多因素Cox分析.
| 变量 | PFS |
OS |
|||||
| HR | 95%CI | P值 | HR | 95%CI | P值 | ||
| rFLC | 0.012a | 0.000a | |||||
| ≤14.828 | 0.032a | 0.164 | |||||
| 14.828~364.597 | 1.173 | 1.093~3.469 | 0.554 | 2.219 | 0.975~5.050 | 0.058 | |
| ≥364.597 | 1.947 | 0.692~1.987 | 0.024a | 2.051 | 0.824~5.101 | 0.122 | |
| DS分期 | 0.872 | 0.053~1.441 | 0.594 | 1.021 | 0.509~2.046 | 0.954 | |
| ISS分期 | 1.927 | 0.864~4.296 | 0.109 | 0.571 | 0.239~1.364 | 0.208 | |
| R-ISS分期 | 0.700 | 0.273~1.794 | 0.457 | 4.508 | 1.352~15.024 | 0.014a | |
| 高危遗传学 | 1.109 | 0.684~1.796 | 0.675 | 0.966 | 0.535~1.746 | 0.909 | |
| 高LDH | 0.629 | 0.359~1.101 | 0.104 | 1.098 | 0.584~2.066 | 0.771 | |
| 贫血 | 1.066 | 0.639~1.776 | 0.807 | 0.872 | 0.436~1.745 | 0.699 | |
| 高钙 | 0.077 | 0.483~1.214 | 0.257 | 1.564 | 0.911~2.686 | 0.105 | |
| 肾功能不全 | 0.977 | 0.605~1.577 | 0.924 | 1.800 | 1.041~3.111 | 0.035a | |
| dFLC | 0.026a | 0.001a | |||||
| ≤112.85 mg/L | 0.087 | 0.744 | |||||
| 112.85~2891.83 mg/L | 1.249 | 0.766~2.036 | 0.372 | 1.257 | 0.545~2.437 | 0.711 | |
| ≥2891.83 mg/L | 1.803 | 1.050~3.096 | 0.033a | 1.152 | 0.545~2.437 | 0.711 | |
| DS分期 | 0.907 | 0.550~1.496 | 0.703 | 1.117 | 0.561~2.227 | 0.752 | |
| ISS分期 | 1.987 | 0.893~4.419 | 0.092 | 0.584 | 0.245~1.393 | 0.225 | |
| R-ISS分期 | 0.691 | 0.270~1.765 | 0.439 | 4.575 | 1.376~15.204 | 0.013a | |
| 高危遗传学 | 1.126 | 0.698~1.819 | 0.626 | 1.006 | 0.560~1.807 | 0.983 | |
| 高LDH | 0.639 | 0.365~1.120 | 0.118 | 1.102 | 0.589~2.060 | 0.761 | |
| 贫血 | 1.076 | 0.646~1.793 | 0.778 | 0.870 | 0.438~1.729 | 0.691 | |
| 高钙 | 0.773 | 0.485~1.231 | 0.278 | 1.556 | 0.906~2.672 | 0.109 | |
| 肾功能不全 | 0.988 | 0.621~1.594 | 0.959 | 1.931 | 1.123~3.321 | 0.017a | |
注:PFS:无进展生存;OS:总生存。aP<0.05
四分位间距法分组后,不同截断范围rFLC患者OS差异有统计学意义,但对于患者PFS,组间比较差异无统计学意义。不同截断值dFLC对于患者OS、PFS比较差异均存在统计学意义。
四分位间距分组后,rFLC不同截断值在PFS中≥364.597时HR 1.85(P=0.024),在OS中,当rFLC≥364.597时HR 3.40(P=0.005)。dFLC不同截断值在OS、PFS比较中差异均有统计学意义。
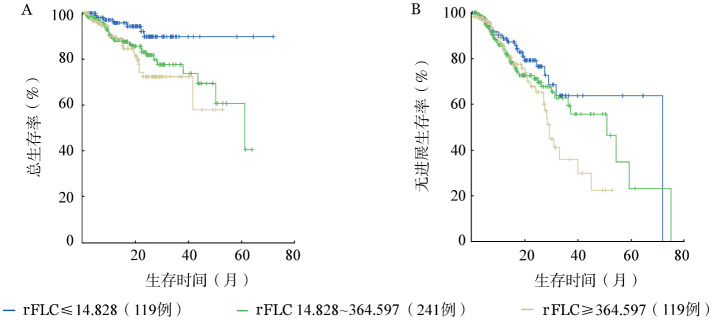
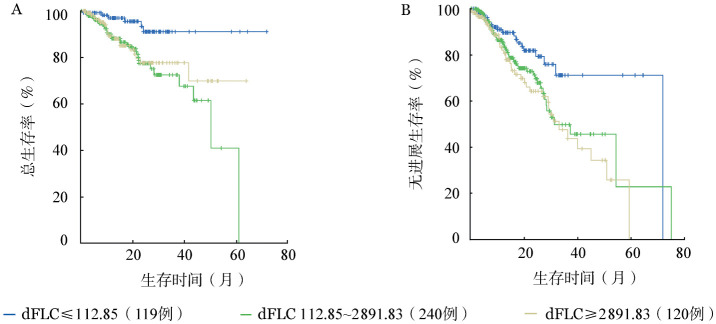
四分位间距法分组时,当rFLC为≤14.828时或dFLC为≤112.85 mg/L时对患者生存影响最为显著。当rFLC不同截断范围3组两两比较结果示:rFLC≤14.828组OS明显优于其他两组(未达到对61对47个月,P=0.019)(图1A);rFLC≤14.828组与14.828~364.597组相比,PFS差异无统计学意义(P=0.227),与≥364.597组相比差异有统计学意义(P=0.024)(图1B)。dFLC≤112.85 mg/L组与其他两组相比OS、PFS差异均有统计学意义(P<0.05)(图2A、2B)。
图1. 当血清游离轻链比值(rFLC)不同截断范围3组两两比较生存结果.
A:总体生存;B:无进展生存
图2. 当血清游离轻链差值(dFLC)不同截断值3组两两比较生存结果.
A:总体生存;B:无进展生存
3.4年OS率比较:rFLC≤14.828组4年OS率为90.84%,明显高于其他两组(59.29%、62.26%)(P<0.05);dFLC≤112.85 mg/L组4年OS率为89.97%,明显高于其他两组(41.32%、71.95%)(P<0.05)。
讨论
血清游离轻链(sFLC)测定已成为MM诊断、疗效判定的重要工具。有资料表明sFLC是MGUS、冒烟型骨髓瘤和MM的预后标志。在MGUS、SMM患者中,sFLC进行性增高及异常的κ/λ比值预示进展为骨髓瘤可能性很大[11]–[12]。FLC是对血清免疫球蛋白游离轻链的检测,在筛查MM或相关浆细胞疾病时,FLC检测均表现出比血清蛋白电泳和血清免疫固定电泳更高的敏感性[13]–[15]。随着对该检测的认识加深及广泛运用,后续更多的文献认为,对于不同的浆细胞疾病,如MGUS、冒烟型骨髓瘤、MM等,其初治时不同范围rFLC值,对于患者的生存预后存在着明显的差异。如Snozek等[16]在对1995至1998年间790例活动性骨髓瘤患者的调查研究发现,基线rFLC<0.03或>32(479例)的患者比rFLC介于0.03~32(311例)的患者预后差,平均生存期分别为30及39个月。对于MGUS或冒烟型骨髓瘤患者而言,rFLC的异常范围定义又有所不同[17]–[18]。
本研究中通过四分位间距法分组,选取rFLC、dFLC的不同截断范围值,对患者生存预后进行比较分析,拟在明确对于初治MM患者,rFLC与dFLC对于生存预后的影响是否存在差异?以及优化两者对生存预后影响的最优截断值的判定,帮助患者更有效地评估疾病预后。
单因素分析结果显示,我中心随访479例MM患者,存在生存差异的因素有ISS分期、R-ISS分期及不同截断值分组的rFLC、dFLC,进一步说明rFLC/dFLC对于初治患者预后判定存在价值。四分位间距分组后,当rFLC≤14.828时或dFLC≤112.85 mg/L时,与其他两组相比PFS、OS差异有统计学意义(P<0.05)。提示异常比值/差值范围内的患者生存差异明显,仍需进一步分析明确其特点,以求帮助进一步优化患者预后分层。本研究通过相关预后因素的比较发现,rFLC≤14.828或dFLC≤112.85 mg/L组的患者,较另二组患者而言,存在更低的DS、ISS或R-ISS分期,提示另2组患者拥有更高的肿瘤负荷。但是除外分期因素的其他相关预后指标比较显示,更高截断值分组的患者,仅表现为贫血发生率较低截断值组的患者更为明显,而在高钙血症、高LDH、肾功能不全、高危遗传学等因素等比较中差异均无明显统计学意义。这似乎又说明,低截断值组的患者拥有更长的生存时间,与其是否单独存在某种高危因素并无关系。
2007年Kyrtsonis等[19]对94例初诊MM患者sFLCR与预后的关系进行研究,首次报道了sFLCR异常是MM独立的不良预后因素。而相关FLC与无关FLC的差别(dFLC)则被认为在疾病疗效评估方面意义较rFLC更为重要。对于初治时dFLC是否同样可以预测患者的生存差异我们不得而知。本研究证实,dFLC与rFLC同样具有判定预后的价值,且其在初治患者OS及PFS的评估中,组间比较差异较rFLC更为显著。本研究不同截断值分组的纳入肾功能不全患者比例差异无统计学意义,但在多因素Cox分析结果提示,rFLC/dFLC均是预测患者疾病进展的独立相关因素,与OS相关的预测因素在dFLC中除外R-ISS分期,则还包含肾功能不全,可见两者存在一定相关性。2015年Cohen等[20]在对49例单克隆免疫球蛋白沉积病患者进行回顾性研究发现,同样接受硼替佐米4.5周期治疗的这些患者(包括1例华氏巨球蛋白血症、10例MM、38例轻链型肾病),其治疗前eFGR和dFLC是预测生存预后的相关因素,其中dFLC<40 mg/L是唯一能预测肾脏反应的因素。故dFLC对于肾功能不全的初治MM患者的价值需要进一步研究证实。
我们认为,对于初治MM患者而言,rFLC、dFLC对初治患者生存预后影响显著。对于疾病进展可作为独立的预后因素,对于OS时间,需要联合R-ISS分期、dFLC或需要联合肾功能情况来更好地判定患者预后情况。其中rFLC≤14.828或dFLC≤112.85 mg/L或是生存预后判定的最优截断值。
References
- 1.Kumar SK, Rajkumar SV, Dispenzieri A, et al. Improved survival in multiple myeloma and the impact of novel therapies[J] Blood. 2008;111(5):2516–2520. doi: 10.1182/blood-2007-10-116129. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Granell M, Calvo X, Garcia-Guiñón A, et al. Prognostic impact of circulating plasma cells in patients with multiple myeloma: implications for plasma cell leukemia definition[J] Haematologica. 2017;102(6):1099–1104. doi: 10.3324/haematol.2016.158303. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Kumar SK, Anderson KC. Immune therapies in multiple myeloma[J] Clin Cancer Res. 2016;22(22):5453–5460. doi: 10.1158/1078-0432.CCR-16-0868. [DOI] [PubMed] [Google Scholar]
- 4.Tate J, Mollee P, Gill D. Serum free light chains for monitoring multiple myeloma[J] Br J Haematol. 2005;128(3):405–406; author reply 406-407. doi: 10.1111/j.1365-2141.2004.05338.x. [DOI] [PubMed] [Google Scholar]
- 5.Orlowski RZ, Lonial S. Integration of novel agents into the care of patients with multiple myeloma[J] Clin Cancer Res. 2016;22(22):5443–5452. doi: 10.1158/1078-0432.CCR-16-0861. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Dispenzieri A, Kyle R, Merlini G, et al. International Myeloma Working Group guidelines for serum-free light chain analysis in multiple myeloma and related disorders[J] Leukemia. 2009;23(2):215–224. doi: 10.1038/leu.2008.307. [DOI] [PubMed] [Google Scholar]
- 7.Kyrtsonis MC, Vassilakopoulos TP, Kafasi N, et al. Prognostic value of serum free light chain ratio at diagnosis in multiple myeloma[J] Br J Haematol. 2007;137(3):240–243. doi: 10.1111/j.1365-2141.2007.06561.x. [DOI] [PubMed] [Google Scholar]
- 8.Özkurt ZN, Sucak GT, Akı ŞZ, et al. Early Prognostic value of monitoring serum free light chain in patients with multiple myeloma undergoing autologous stem cell transplantation[J] Cancer Invest. 2017;35(3):195–201. doi: 10.1080/07357907.2016.1270958. [DOI] [PubMed] [Google Scholar]
- 9.Graziani MS, Merlini G. Serum free light chain analysis in the diagnosis and management of multiple myeloma and related conditions[J] Expert Rev Mol Diagn. 2014;14(1):55–66. doi: 10.1586/14737159.2014.864557. [DOI] [PubMed] [Google Scholar]
- 10.Dispenzieri A. Biology, treatment, and time[J] Blood. 2008;112(8):2999–3000. doi: 10.1182/blood-2008-06-160531. [DOI] [PubMed] [Google Scholar]
- 11.Kyle RA, Durie BG, Rajkumar SV, et al. Monoclonal gammopathy of undetermined significance (MGUS) and smoldering (asymptomatic) multiple myeloma: IMWG consensus perspectives risk factors for progression and guidelines for monitoring and management[J] Leukemia. 2010;24(6):1121–1127. doi: 10.1038/leu.2010.60. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Rajkumar SV, Landgren O, Mateos MV. Smoldering multiple myeloma[J] Blood. 2015;125(20):3069–3075. doi: 10.1182/blood-2014-09-568899. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Nowrousian MR, Brandhorst D, Sammet C, et al. Serum free light chain analysis and urine immunofixation electrophoresis in patients with multiple myeloma[J] Clin Cancer Res. 2005;11(24 Pt 1):8706–8714. doi: 10.1158/1078-0432.CCR-05-0486. [DOI] [PubMed] [Google Scholar]
- 14.Dejoie T, Attal M, Moreau P, et al. Comparison of serum free light chain and urine electrophoresis for the detection of the light chain component of monoclonal immunoglobulins in light chain and intact immunoglobulin multiple myeloma[J] Haematologica. 2016;101(3):356–362. doi: 10.3324/haematol.2015.126797. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Dejoie T, Corre J, Caillon H, et al. Serum free light chains, not urine specimens, should be used to evaluate response in light-chain multiple myeloma[J] Blood. 2016;128(25):2941–2948. doi: 10.1182/blood-2016-07-726778. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Snozek CL, Katzmann JA, Kyle RA, et al. Prognostic value of the serum free light chain ratio in newly diagnosed myeloma: proposed incorporation into the international staging system[J] Leukemia. 2008;22(10):1933–1937. doi: 10.1038/leu.2008.171. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Rajkumar SV, Kyle RA, Therneau TM, et al. Serum free light chain ratio is an independent risk factor for progression in monoclonal gammopathy of undetermined significance[J] Blood. 2005;106(3):812–817. doi: 10.1182/blood-2005-03-1038. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Leng S, Lentzsch S. High-risk smoldering myeloma: Perspective on watchful monitoring[J] Semin Oncol. 2016;43(6):697–699. doi: 10.1053/j.seminoncol.2016.11.001. [DOI] [PubMed] [Google Scholar]
- 19.Kyrtsonis MC, Vassilakopoulos TP, Kafasi N, et al. Prognostic value of serum free light chain ratio at diagnosis in multiple myeloma[J] Br J Haematol. 2007;137(3):240–243. doi: 10.1111/j.1365-2141.2007.06561.x. [DOI] [PubMed] [Google Scholar]
- 20.Cohen C, Royer B, Javaugue V, et al. Bortezomib produces high hematological response rates with prolonged renal survival in monoclonal immunoglobulin deposition disease[J] Kidney Int. 2015;88(5):1135–1143. doi: 10.1038/ki.2015.201. [DOI] [PubMed] [Google Scholar]