Abstract
目的
检测microRNA-181a(miR-181a)在急性淋巴细胞白血病(ALL)患儿中的表达水平,并研究其在ALL细胞株CCRF-CEM细胞及耐药株CEM-C1细胞中的功能。
方法
采用实时荧光定量PCR方法检测ALL患儿骨髓样本、ALL细胞株CCRF-CEM细胞及其耐药株CEM-Cl细胞中miR-181a的表达水平。采用电穿孔转染的方法抑制耐药株CEM-C1细胞并上调非耐药株CCRF-CEM细胞中miR-181a的表达,予不同浓度梯度(终浓度分别为0.01、0.1、1、10、100、1 000 ng/ml)喜树碱处理后,采用CCK-8法观察各浓度梯度喜树碱处理后细胞的存活情况,绘制细胞增殖抑制曲线并计算半数抑制浓度(IC50)。
结果
初诊-复发组患儿初诊及复发骨髓样本miR-181a相对表达水平(4.84±2.71及6.53±2.20)均高于对照组(1.41±0.53)(P=0.017、0.001),初诊-完全缓解组患儿初诊骨髓样本miR-181a水平(7.58±2.50)较对照组明显升高(P=0.000),而完全缓解后miR-181a水平下降至1.35±0.35,与对照组比较差异无统计学意义(P=0.863)。CEM-C1细胞miR-181a相对表达水平(−4.39±0.08)较CCRF-CEM细胞(−2.32±0.03)明显升高(P=0.000)。转染miR-181a抑制剂CEM-C1细胞较转染阴性对照组增殖抑制率明显升高(P<0.05),IC50分别为30.61、2 255.00 ng/ml,耐药指数(RI)=73.67。miR-181a过表达CCRF-CEM细胞较阴性对照组增殖抑制率明显降低(P<0.05),IC50分别为126.60、1.34 ng/ml,RI=94.26。
结论
ALL患儿骨髓及CEM-C1细胞中miR-181a异常高表达,抑制CEM-C1细胞中miR-181a的表达可明显增加CEM-C1细胞的药物敏感性,在CCRF-CEM细胞中上调miR-181a的表达能明显增加CCRF-CEM细胞的耐药性。
Keywords: 白血病,淋巴样, 儿童, 微RNAs, 抗药性,肿瘤
Abstract
Objective
To investigate the expression of miR-181a in bone marrow (BM) samples of pediatric acute lymphoblastic leukemia (ALL) and explore the mechanism of miR-181a on ALL cell line CCRF-CEM and drug resistance cell line CEM-C1.
Methods
BM samples were obtained from 18 patients where matched samples at initial diagnosis and first BM relapse or complete remission were available. BM samples and cord blood samples (normal controls) were used to confirm the differential expression of miRNA-181a by quantitative real-time polymerase chain reaction (qRT-PCR). The expressions of miR-181a in both CCRF-CEM and its mutidrug-resistant counterpart CEM-C1 cells were also detected. Then, CCK-8 assay was performed to quantify the effects of miR-181a on CEM-C1 and CCRF-CEM cells growth and viability.
Results
Up-regulated miR-181a with higher fold changes in both initial diagnosis (4.84±2.71, 7.58±2.50) and relapsed samples (6.53±2.20) compared to normal controls(1.41±0.53) (P=0.017, 0.000, 0.001, respectively) were observed, whereas the miR-181a expression in the samples of CR (1.35±0.35) compared to normal control showed no significant difference (P=0.863). The miR-181a expression level was higher in CEM-C1 cells (−4.39±0.08) than of in CCRF-CEM cells (−2.32 ± 0.03) (P=0.000). CCK-8 assay revealed that suppression of miR-181a in CEM-C1 cells by transfecting the specific inhibitor of miR-181a led to significantly higher cellular proliferation inhibition rate than negative control cells (P<0.05), IC50 were 30.61 ng/ml and 2 255.00 ng/ml with RI as 73.67. While increased miR-181a in CCRF-CEM cells led to significantly lower CPIR than negative control cells (P<0.01), IC50 were 126.60 ng/ml and 1.34 ng/ml with RI as 94.26.
Conclusion
Upregulation of miR-181a might play an important role in the development of drug resistance in CEM-C1 cells, and knockdown of miR-181a could sensitize CEM-C1 cells to camptothecin; Meanwhile increased expression of miR-181a could promote CCRF-CEM drug resistance. These results suggested that suppression of miR-181a expression might provide a promising therapeutic in drug resistance of leukaemia.
Keywords: Leukemia, lymphocytic; Child; MicroRNAs; Drug resistance, neoplasm
多药联合强化疗及骨髓移植很大程度上提高了儿童急性淋巴细胞白血病(ALL)的治愈率,但仍有一部分ALL患儿治疗失败[1]。白血病细胞耐药是导致白血病治疗失败最重要的原因,研究白血病细胞耐药的生物学特征有助于寻找难治性白血病的有效治疗方法[2]。microRNA(miRNA)参与细胞增殖、分化、凋亡、生长发育及肿瘤发生等众多生物过程[3]。越来越多的研究表明,miRNA通过调控耐药相关基因或者原癌、抑癌基因表达,在肿瘤细胞的化疗敏感性方面发挥重要作用[4]–[5]。
在前期研究中,我们发现一组与儿童ALL复发及预后相关的miRNA[6]–[7],其中miR-181a在儿童ALL中异常高表达,但功能及作用机制尚不明确。为进一步阐明miR-181a在儿童ALL中的功能,我们检测了ALL患儿骨髓样本中miR-181a的表达,并研究了miR-181a在ALL细胞株CCRF-CEM细胞及耐药株CEM-C1细胞中的功能,以期阐明miR-181a在ALL细胞耐药中的作用,为儿童ALL的治疗提供新的思路。
对象和方法
1.研究对象:收集2009年1月至2011年12月中山大学第一附属医院诊治的初诊ALL患儿配对骨髓标本(同一患儿初诊-复发或初诊-完全缓解的2份骨髓标本为1对配对标本)18对,其中初诊-复发标本8对,初诊-完全缓解标本10对。18例ALL患儿中男12例,女6例,初诊时中位年龄6岁(3个月~14岁6个月)。诊断分型及疗效判断参考文献[8]标准,其中FAB分型L1 5例、L2 9例、L3 4例,免疫分型B-ALL 11例、T-ALL 7例。所有患儿均使用ALL ICB-FM2002方案[8]治疗。以5份健康孕妇捐献的脐血标本为正常对照。本研究通过中山大学临床研究伦理委员会的批准,所有受试对象或其监护人均签署知情同意书。
2.细胞株及细胞培养:人ALL细胞株CCRF-CEM细胞及其相应的耐药株CEM-C1细胞均购自中国科学院细胞库。细胞接种于含有15%胎牛血清、100 U/ml青霉素、100 U/ml链霉素的RPMI 1640培养液中,置于37°C、5%CO2培养箱中培养。
3.电穿孔转染法转染ALL细胞株:取对数生长期CEM-C1及CCRF-CEM细胞,调整细胞密度为106/孔,应用Gene Pulser Xcell™电穿孔系统(美国Bio-Rad公司产品),将100 pmol micrOFF™ miR-181a抑制剂、micrOFF™ miRNA抑制剂阴性对照以10 µl体系电击转入CEM-C1细胞,将100 pmol miR-181a模拟物、miRNA模拟物阴性对照以10 µl体系电击转入CCRF-CEM细胞。电转条件:1 350 V,35 ms,1次电击。将电击完毕的细胞接种于12孔板中,1 ml完全培养基置于37°C、5%CO2的培养箱中继续培养24 h用于后续实验。每组设3个复孔,实验重复3次。
4.实验分组及细胞增殖水平检测:取对数生长期CCRF-CEM、CEM-C1、转染miR-181a抑制剂CEM-C1(anti-miR-181a)、转染miRNA抑制剂阴性对照CEM-C1(anti-miR-NC)、转染miR-181a模拟物CCRF-CEM(miR-181a过表达)及转染miRNA模拟物阴性对照CCRF-CEM(miR-NC)细胞,调整细胞密度为5×104/孔,接种于96孔板,分别加入不同浓度(终浓度分别为0.01、0.1、1、10、100、1 000 ng/ml)喜树碱,并设置空白对照。每组设3个复孔,实验重复3次。培养22 h后每孔加入10 µl CCK-8(日本同仁公司产品),继续培养2 h,应用多功能酶标仪检测450 nm处吸光度(A)值,以630 nm处A值为参比波长。根据公式计算细胞增殖抑制率、半数抑制浓度(IC50)及耐药指数(RI)。
经验证,CCRF-CEM细胞及CEM-C1细胞IC50分别为2.32及3 488.00 ng/ml,CEM-C1 RI为1 500,证实CEM-C1细胞对喜树碱有很强的耐药性。
5.RNA提取及cDNA合成:按照TRIzol(美国Invitrogen公司产品)说明书提取患儿骨髓样本及正常对照RNA,采用M-MLV逆转录试剂盒(日本TaKaRa公司产品),应用含有茎环结构的逆转录引物(引物序列:GTCGTATCCAGTGCAGGGTCC-GAGGTATTCGCACTGGATACGACACTCAC,由深圳华大基因股份有限公司合成)合成cDNA。反应体系:总RNA 5 µl、miR-181a RT引物1.8 µl、U6 RT引物1.8 µl、dNTP 5 µl、5×M-MLV逆转录缓冲液6 µl、逆转录酶0.25 µl、RNA酶抑制剂0.6 µl,补DEPC水至30 µl。反应条件:16°C 30 min,42°C 45 min,85°C 2 min。
6.实时荧光定量PCR检测miR-181a的表达:采用SYBR PrimeScript™ RT-PCR试剂盒(日本TaKaRa公司产品)检测miR-181a的表达。引物序列:miR-181a上游引物:5′-GCGGTAACATTC-AACGCTGTCG-3′,下游引物:5′-GTGCAGGG-TCCGAGGT-3′;内参U6上游引物:5′-CGCTT-CGGCAGCACATATA-3′,下游引物:5′-TTCACG-AATTTGCGTGTCAT-3′。引物均由深圳华大基因股份有限公司合成。反应体系:cDNA2 µl、上下游引物各0.4 µl、2×SYBR mix 10 µl。加DEPC水至20 µl。PCR采用两步法进行,在LightCycler480荧光定量PCR系统(瑞士罗氏公司产品)上进行检测。反应条件:95°C,3 min预变性;变性95°C,15 s,退火延伸60°C,30 s,共40个循环。独立实验重复3次,目的基因相对表达水平以2−ΔΔCt表示。
7.统计学处理:采用SPSS 16.0软件进行统计分析,结果以至少3次独立实验的x±s表达,方差齐性检验采用Levene检验,两样本组间的比较采用t检验,P<0.05为差异有统计学意义。
结果
1.miR-181a在ALL患儿骨髓样本及ALL细胞株中的表达:初诊-复发组中,患儿初诊及复发骨髓样本miR-181a相对表达水平分别为4.84±2.71、6.53±2.20,均显著高于对照组(1.41±0.53)(P值分别为0.017、0.001)。初诊-完全缓解组中,患儿初诊骨髓样本miR-181a水平为7.58±2.50,较对照组明显升高(P=0.000),而完全缓解骨髓样本miR-181a水平(1.35±0.35)下降,与对照组比较差异无统计学意义(P=0.863)。初诊-复发及初诊-完全缓解组患儿初诊骨髓样本miR-181a水平比较差异无统计学意义(P=0.069)。ALL耐药株CEM-C1细胞miR-181a表达水平为−4.39±0.08,较CCRF-CEM细胞(−2.32± 0.03)表达明显增高,差异有统计学意义(P=0.000)。
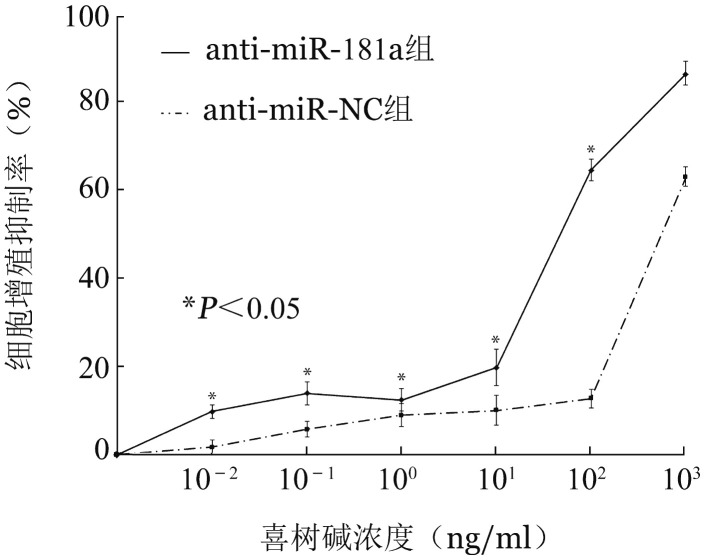
2.抑制miR-181a表达对CEM-C1细胞的作用:anti-miR-181a组miR-181a相对表达水平(−0.14± 0.12)较anti-miR-NC组细胞(−1.95±0.32)明显下降(P=0.000)。采用CCK-8法,观察各浓度梯度下细胞增殖情况,绘制细胞增殖抑制率曲线(图1)。结果显示,anti-miR-181a组细胞IC50=30.61 ng/ml,对照组anti-miR-NC组细胞IC50=2 255.00 ng/ml,RI= 73.67。可见抑制miR-181a表达后能显著增加耐药株CEM-C1细胞对喜树碱的敏感性。
图1. 不同浓度喜树碱处理24 h对转染miR-181a抑制剂(anti-miR-181a组)及转染miRNA抑制剂阴性对照(anti-miR-NC组)CEM-C1细胞增殖抑制的影响(每次实验设3个复孔,实验重复3次).
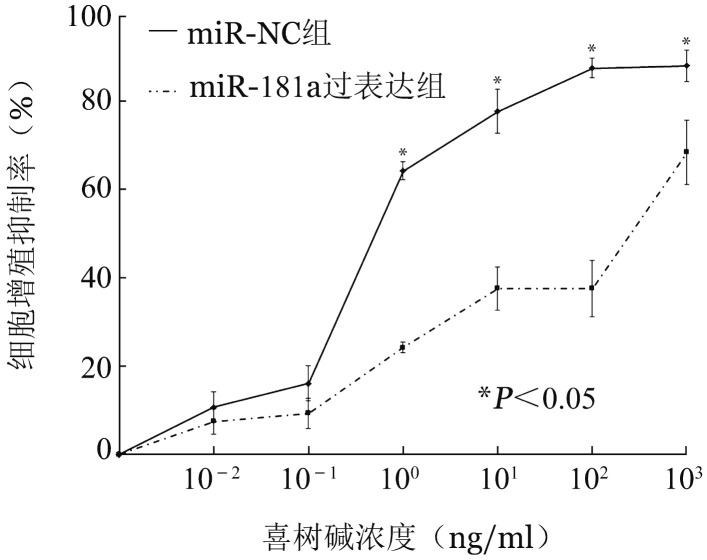
3.上调miR-181a表达对CCRF-CEM细胞的作用:miR-181a过表达组miR-181a的相对表达水平(−9.57±0.24)较miR-NC组细胞(−0.79±0.26)明显上调(P=0.000)。采用CCK-8法,观察各浓度梯度下细胞增殖情况,绘制细胞增殖抑制率曲线(图2)。结果显示,miR-181a过表达组细胞IC50=126.60 ng/ml,对照组miR-NC组细胞IC50=1.34 ng/ml,RI= 94.26。可见上调miR-181a表达后能显著增加CCRF-CEM细胞对喜树碱的耐药性。
图2. 不同浓度喜树碱处理24 h对转染miR-181a模拟物(miR-181a过表达组)及转染miRNA模拟物阴性对照(miR-NC组)CCRF-CEM细胞增殖抑制的影响(每次实验设3个复孔,实验重复3次).
讨论
多数ALL患者在化疗初期对药物敏感,但是初治缓解的患者经过一段长短不等的缓解期后大部分会复发,复发的白血病细胞对原方案药物很快产生耐药性,甚至对以前从未用过的、结构和作用机制完全不同的药物也产生交叉耐药性,即多耐药性(multidrug resistance, MDR)。白血病细胞耐药性的产生是导致化疗失败的重要原因之一。目前,临床上对ALL细胞耐药性还缺乏有效的对策,仅限于通过联合使用作用机制不同的药物来防止或延缓耐药细胞的过度增殖。但是,由于MDR细胞的存在,这一措施往往难以奏效。因此,探索更加积极有效的克服耐药性的途径已成为当前白血病研究中的重大课题[1]。近来,miRNA在肿瘤细胞耐药形成中发挥的作用已引起广泛关注。Si等[4]报道乳腺癌细胞系MCF7细胞中抑制miR-21的表达可增强MCF7细胞对拓扑替康的敏感性,Xia等[5]报道miR-15b、miR-16在多耐药胃癌细胞系SGC7901/VCR细胞中表达下调,上调其表达能增加SGC7901/VCR细胞对长春新碱的敏感性。
目前,不少研究团队报道了miR-181a在多种肿瘤的复发和耐药中发挥了重要作用。miRNA芯片结果显示,在多种肝癌耐药细胞株中miR-181a均有上调,可见miR-181a在肝癌细胞耐药中发挥作用[9]。Lwin等[10]报道,在非霍奇金淋巴瘤中,过表达miR-181a可抑制促凋亡蛋白Bim,从而在滤泡树突细胞药物抵抗中发挥作用。Ke等[11]报道在宫颈癌放疗不敏感的临床样本及细胞系中,miR-181a异常高表达,其通过靶向促凋亡蛋白激酶PRKCD抑制放射诱导的凋亡,减少G2/M期细胞阻滞。Ota等[12]检测291例乳腺癌患者miR-181a表达情况并随访分析,发现miR-181a在乳腺癌复发组中异常高表达,可作为独立预后因素,提示预后不良。我们的研究结果与以上研究报道一致。miR-181a在儿童ALL初发及复发患者中明显高表达,完全缓解组与正常对照组差异无统计学意义,这一结果表明miR-181a可能在ALL的发生及发展进程中发挥重要作用,或与白血病的复发有关。我们进一步研究miR-181a在ALL耐药细胞株的表达和功能发现,miR-181a在耐药株CEM-C1细胞中明显高表达,抑制miR-181a能明显增加CEM-C1细胞的药物敏感性;同时,上调ALL细胞株CCRF-CEM细胞中miR-181a能明显提高其对喜树碱的耐药性。
然而,也有少量研究表明miR-181a在提高肿瘤细胞药物敏感性上发挥作用。miR-181a在柔红霉素抵抗的白血病细胞系K562/A029细胞及阿糖胞苷抵抗的白血病细胞系HL-60/Ara-C细胞中均表达下调,过表达miR-181a能靶向BCL-2促进细胞凋亡,从而提高白血病细胞对柔红霉素、阿糖胞苷的敏感性[13]–[14]。这与我们的研究结果相反,分析原因可能是肿瘤类型、肿瘤细胞微环境、靶基因的差异及miRNA本身作用的复杂性,导致同一miRNA在不同肿瘤甚至同种肿瘤中发挥的不同甚至完全相反的作用[14]。鉴于此,可通过更大样本研究对miR-181a在不同类型的肿瘤中的功能进行更全面更深入的探讨。
miRNA通过与靶基因mRNA的3′非编码区特异结合在转录后水平调控基因的表达,参与众多生物过程。目前miR-181a已经鉴定的靶基因有Bim[10]、K-ras[15]、Bcl-2[13]–[14]、Prox1[16]、hox A11[17]等。在ALL细胞耐药中,miR-181a通过与哪些靶基因结合,从何发挥作用尚待进一步研究。
本研究中,我们对miR-181a在ALL患儿中的表达及其在ALL细胞株CCRF-CEM细胞、耐药株CEM-C1细胞的作用进行了初步的探讨,发现miR-181a可能与儿童ALL复发及细胞耐药性有关,并证实过表达miR-181a能提高CCRF-CEM细胞的耐药性,抑制miR-181a表达能增加CEM-C1细胞对喜树碱的敏感性,为难治性白血病的治疗提供了新的思路。
Funding Statement
基金项目:国家自然科学基金(81272310)
References
- 1.Mody R, Li S, Dover DC, et al. Twenty-five-year follow-up among survivors of childhood acute lymphoblastic leukemia: a report from the Childhood Cancer Survivor Study[J] Blood. 2008;111(12):5515–5523. doi: 10.1182/blood-2007-10-117150. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Nørgaard JM, Hokland P. Biology of multiple drug resistance in acute leukemia[J] Int J Hematol. 2000;72(3):290–297. [PubMed] [Google Scholar]
- 3.Pasquinelli AE, Hunter S, Bracht J. MicroRNAs: a developing story[J] Curr Opin Genet Dev. 2005;15(2):200–205. doi: 10.1016/j.gde.2005.01.002. [DOI] [PubMed] [Google Scholar]
- 4.Si ML, Zhu S, Wu H, et al. miR-21-mediated tumor growth[J] Oncogene. 2007;26(19):2799–2803. doi: 10.1038/sj.onc.1210083. [DOI] [PubMed] [Google Scholar]
- 5.Xia L, Zhang D, Du R, et al. miR-15b and miR-16 modulate multidrug resistance by targeting BCL2 in human gastric cancer cells[J] Int J Cancer. 2008;123(2):372–379. doi: 10.1002/ijc.23501. [DOI] [PubMed] [Google Scholar]
- 6.Zhang H, Luo XQ, Zhang P, et al. MicroRNA patterns associated with clinical prognostic parameters and CNS relapse prediction in pediatric acute leukemia[J] PLoS One. 2009;4(11):e7826. doi: 10.1371/journal.pone.0007826. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.徐 令, 梁 燕妮, 罗 学群, et al. miRNA表达与儿童急性淋巴细胞白血病预后及复发的相关性研究[J] 中华血液学杂志. 2011;32(3):178–181. [Google Scholar]
- 8.中华医学会儿科学分会血液组, 中华儿科杂志编辑委员会. 小儿急性淋巴细胞白血病诊疗建议(第三次修订草案)[J] 中华儿科杂志. 2006;44(5):392–395. [Google Scholar]
- 9.Zhuo L, Liu J, Wang B, et al. Differential miRNA expression profiles in hepatocellular carcinoma cells and drug-resistant sublines[J] Oncol Rep. 2013;29(2):555–562. doi: 10.3892/or.2012.2155. [DOI] [PubMed] [Google Scholar]
- 12.Ota D, Mimori K, Yokobori T, et al. Identification of recurrencerelated microRNAs in the bone marrow of breast cancer patients[J] Int J Oncol. 2011;38(4):955–962. doi: 10.3892/ijo.2011.926. [DOI] [PubMed] [Google Scholar]
- 10.Lwin T, Lin J, Choi YS, et al. Follicular dendritic cell-dependent drug resistance of non-Hodgkin lymphoma involves cell adhesion-mediated Bim down-regulation through induction of microRNA-181a[J] Blood. 2010;116(24):5228–5236. doi: 10.1182/blood-2010-03-275925. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Li H, Hui L, Xu W. miR-181a sensitizes a multidrug-resistant leukemia cell line K562/A02 to daunorubicin by targeting BCL-2[J] Acta Biochim Biophys Sin (Shanghai) 2012;44(3):269–277. doi: 10.1093/abbs/gmr128. [DOI] [PubMed] [Google Scholar]
- 14.Bai H, Cao Z, Deng C, et al. miR-181a sensitizes resistant leukaemia HL-60/Ara-C cells to Ara-C by inducing apoptosis[J] J Cancer Res Clin Oncol. 2012;138(4):595–602. doi: 10.1007/s00432-011-1137-3. [DOI] [PubMed] [Google Scholar]
- 15.Shin KH, Bae SD, Hong HS, et al. miR-181a shows tumor suppressive effect against oral squamous cell carcinoma cells by downregulating K-ras[J] Biochem Biophys Res Commun. 2011;404(4):896–902. doi: 10.1016/j.bbrc.2010.12.055. [DOI] [PubMed] [Google Scholar]
- 16.Kazenwadel J, Michael MZ, Harvey NL. Prox1 expression is negatively regulated by miR-181 in endothelial cells[J] Blood. 2010;116(13):2395–2401. doi: 10.1182/blood-2009-12-256297. [DOI] [PubMed] [Google Scholar]
- 11.Ke G, Liang L, Yang JM, et al. MiR-181a confers resistance of cervical cancer to radiation therapy through targeting the proapoptotic PRKCD gene[J] Oncogene. 2013;32(25):3019–3027. doi: 10.1038/onc.2012.323. [DOI] [PubMed] [Google Scholar]
- 17.Li YG, Zhang PP, Jiao KL, et al. Knockdown of microRNA-181 by lentivirus mediated siRNA expression vector decreases the arrhythmogenic effect of skeletal myoblast transplantation in rat with myocardial infarction[J] Microvasc Res. 2009;78(3):393–404. doi: 10.1016/j.mvr.2009.06.011. [DOI] [PubMed] [Google Scholar]