Abstract
目的
了解原发胃肠道黏膜相关淋巴组织结外边缘区B细胞淋巴瘤(MALT淋巴瘤)患者临床特征及预后情况。
方法
回顾性分析90例原发胃肠道MALT淋巴瘤患者资料,对患者临床特征和相关预后因素进行分析。
结果
90例患者中胃内起病者78例,非胃内起病者12例。国际预后指数(IPI)评分0~2分者80例,3~5分者10例。与胃内起病者比较,非胃内起病者多为IPI 3~5分的高危患者(7.7%对33.3%,P=0.025)、幽门螺旋杆菌(Hp)感染率显著降低(50.0%对87.2%,P<0.01)。IPI评分0~2分的低危患者可选择抗Hp治疗、手术、放疗及化疗等治疗,其中化疗可提高患者无进展生存(PFS)率。接受化疗的高危患者3年总生存(OS)率达100.0%。单因素分析结果显示,ECOG评分(P=0.006)、Musshoff分期(P=0.008)、IPI评分(P=0.000)、LDH水平(P=0.019)和是否接受化疗(P=0.026)是影响患者PFS率的相关因素。多因素分析结果显示IPI评分(3~5分)(OR=8.325,95%CI 3.171~21.853,P= 0.000)和是否接受化疗(OR=0.319,95% CI 0.121~0.838,P=0.020)是影响患者PFS率的独立预后因素,ECOG评分(≥2分)是影响患者OS率的独立预后因素(OR=5.092,95% CI1.005~25.788,P=0.049)。
结论
原发胃肠道MALT淋巴瘤是一种低度恶性的淋巴瘤,以低危患者多见,多数患者可获得长期生存。低危患者可选择放疗或抗Hp治疗作为起始治疗方案,高危患者应选择化疗。
Keywords: 淋巴瘤,B细胞,边缘区, 生物医学研究, 预后
Abstract
Objective
To evaluate the clinical characteristics and prognostic factors of patients with primary gastro-intestinal marginal zone lymphoma (MALT).
Methods
Retrospective aualysis was performed in 90 patients diagnosed with primary gastro-intestinal MALT lymphoma clinical characteristics and survival analyses.
Results
Among 90 patients, 78 cases were originated from the stomach and 12 cases with extra-gastric origin. Eighty patients were classified as low-risk (IPI score 0–2), and 10 patients high-risk (IPI score 3–5). Compared to gastric MALT patients, extra-gastric cases presented with higher IPI score (7.7% vs 33.3%, P=0.025) and higher Hp infection rate (50.0% vs 87.2%, P<0.01). Treatment options for low risk patients (IPI score 0–2) included Hp eradication, surgery, radiotherapy and chemotherapy. Chemotherapy could improve progression-free survival (PFS) in low-risk patients. For high-risk patients, those receiving chemotherapy had 100% 3-year overall survival (OS). Univariate analysis revealed that ECOG (P=0.006), Musshoff staging (P=0.008), IPI score (P=0.000), elevated LDH (P=0.019) and chemotherapy (P=0.026) were correlated with PFS. Multivariate analysis showed that higher IPI score (IPI 3–5) (OR=8.325, 95% CI 3.171–21.853, P=0.000) and chemotherapy (OR=0.319, 95% CI 0.121–0.838, P=0.020) were independent prognostic factors for PFS. ECOG (≥2) was independent prognostic factor for OS (OR=5.092, 95%CI 1.005–25.788, P=0.049).
Conclusion
Primary gastro-intestinal MALT lymphoma was an indolent subtype of non-Hodgkin's lymphoma. Patients usually had low risk IPI and achieved long-term survival. Frontline therapy for low-risk patients was radiotherapy or Hp eradication, and chemotherapy for high-risk ones.
Keywords: Lymphoma, B-cell, marginal zone; Biomedical research; Prognosis
黏膜相关淋巴组织结外边缘区B细胞淋巴瘤(MALT淋巴瘤)是一组起源于淋巴结边缘区的惰性B细胞淋巴瘤,约占所有非霍奇金淋巴瘤(NHL)的7.6%[1]–[2]。MALT淋巴瘤最常发生于消化道,尤其是胃部,亦可发生于消化道其他部位,包括食管、小肠、结肠、直肠等。由于其临床表现缺乏特异性,易被误诊[3]。近年来研究发现其发病原因与慢性炎症相关,尤其是幽门螺旋杆菌(Hp)感染为该类疾病发病的危险因素[4]。随着对该疾病认识的逐渐增加,治疗方法从单纯的手术切除逐渐过渡至抗Hp治疗、放疗、化疗及免疫治疗等。然而,如何在不影响患者总体疗效的前提下,优化个体化治疗策略,目前尚缺乏统一的认识。我们回顾性分析了90例原发胃肠道MALT淋巴瘤患者临床特征和生存情况,现报告如下。
病例和方法
1.病例:收集2002年1月至2013年12月在我院确诊的90例原发胃肠道MALT淋巴瘤患者的临床资料,包括年龄、性别、临床表现、辅助检查(如胃镜、肠镜、病理和免疫组化、实验室检查、影像学检查等结果),跟踪随访患者的临床分期、治疗、转归及预后。所有患者均经病理学检查确诊,非手术患者的诊断主要依靠消化道内镜下活检组织病理学检查结果,手术患者以手术标本的病理学检查结果为准。疾病分型参照2008年WHO淋巴造血组织分型标准[1],疾病分期采用Musshoff改良的Ann Arbor分期系统[5]。Hp感染的诊断依靠胃镜下黏膜组织的病理学检查。国际预后指数(IPI)是评估患者预后的重要指标之一。本研究中我们设定患者IPI评分0~2分为低危组,IPI评分3~5分为高危组。
2.治疗情况:90例患者的治疗方式包括抗Hp治疗(38例,42.2%)、手术(34例,37.8%)、放疗(14例,15.6%)和化疗(46例,51.1%)。接受抗Hp治疗者采用质子泵抑制剂联合抗生素的三联方案或四联方案,38例患者中,18例联合化疗,9例患者联合放疗。34例接受手术治疗者中,23例行胃大部切除术,3例行全胃切除术,8例行小肠/回盲部切除术。14例接受放疗者均接受受累野部位25~35 Gy的放疗。46例接受化疗者均采用CHOP(环磷酰胺、阿霉素、长春新碱、泼尼松)或类似方案。28例(31.1%)患者接受利妥昔单抗联合化疗治疗,其中8例患者联合手术及化疗,20例患者联合化疗。疗效判断依照国际工作组(IWG)标准评定[6]。
3.生存随访:90例患者的随访方式主要包括门诊复查和(或)电话随访。随访截止日期为2014年5月31日,中位随访时间为30.4(2.5~127.4)个月。疾病无进展生存(PFS)时间定义为从初诊时间至第一次进展、复发或死亡的时间。总生存(OS)时间定义为从初诊时间至死亡或末次随访时间。
4.统计学处理:采用SPSS 22.0软件进行统计分析。两组临床特征之间分类变量采用χ2检验,患者的生存分析采用Kaplan-Meier法检验,单因素生存分析采用Log-rank检验,对单因素分析中有意义的临床特征进行COX多因素回归分析。P<0.05为差异有统计学意义。
结果
1.患者一般情况:90例患者中男49例,女41例,中位年龄54.5(18~89)岁。患者的临床特征及治疗方法见表1。胃内起病患者78例(86.7%),非胃内起病患者12例(13.3%)(包括肠道起病者9例,食管起病者2例,直肠起病者1例)。患者主要症状包括:腹痛、腹部不适、体重减轻、发热、纳差、恶心、呕吐、吞咽困难等。90例患者中IPI评分3~5分者(即高危患者)10例(11.1%)。非胃内起病患者高危患者比例高于胃内起病者(33.3%对7.7%,P= 0.025)。90例患者中有74例(82.2%)感染Hp,其中胃内起病者Hp感染率显著高于非胃内起病者(87.2%对50.0%,P<0.01)。其余两组患者间临床特征、生化检查结果与治疗方法差异无统计学意义(P值均>0.05)。
表1. 90例原发胃肠道黏膜相关淋巴组织结外边缘区B细胞淋巴瘤患者的临床特征及预后单因素分析.
| 临床特征 | 起病部位[例(%)] |
疾病无进展生存 |
总生存 |
|||||
| 胃内 | 非胃内 | P值 | OR(95% CI) | P值 | OR(95% CI) | P值 | ||
| 性别 | 男 | 42(53.8) | 7(58.3) | 1.000 | 1.223(0.486~3.081) | 0.669 | 1.301(0.236~7.161) | 0.762 |
| 女 | 36(46.2) | 5(41.7) | ||||||
| 年龄(岁) | >60 | 29(37.2) | 7(58.3) | 0.210 | 1.661(0.686~4.025) | 0.261 | 0.548(0.099~3.018) | 0.489 |
| ≤60 | 49(62.8) | 5(41.7) | ||||||
| ECOG评分 | 0~1分 | 69(88.5) | 9(75.0) | 0.197 | 3.698(1.468~9.318) | 0.006 | 5.092(1.005~25.788) | 0.049 |
| ≥2分 | 9(11.5) | 3(25.0) | ||||||
| Musshoff分期 | 1~2期 | 58(74.4) | 7(58.3) | 0.302 | 3.342(1.377~8.111) | 0.008 | 1.648(0.288~9.409) | 0.574 |
| 3~4期 | 20(25.6) | 5(41.7) | ||||||
| IPI评分 | 0~2分 | 72(92.3) | 8(66.7) | 0.025 | 8.128(3.046~21.686) | 0.000 | 2.538(0.263~24.488) | 0.421 |
| 3~5分 | 6(7.7) | 4(33.3) | ||||||
| B症状 | 有 | 24(30.8) | 6(50.0) | 0.204 | 2.205(0.913~5.325) | 0.079 | 1.615(0.324~8.063) | 0.559 |
| 无 | 54(69.2) | 6(50.0) | ||||||
| HGB(g/L) | <120 | 43(55.1) | 8(66.7) | 0.542 | 0.697(0.284~1.711) | 0.431 | 0.427(0.077~2.354) | 0.328 |
| ≥120 | 35(44.9) | 4(33.3) | ||||||
| 白蛋白(g/L) | <35 | 22(28.2) | 5(41.7) | 0.335 | 2.318(0.963~5.580) | 0.061 | 1.473(0.255~8.521) | 0.665 |
| ≥35 | 56(71.8) | 7(58.3) | ||||||
| LDH | 正常 | 72(92.3) | 10(83.3) | 0.289 | 3.359(1.217~9.273) | 0.019 | 1.423(0.155~13.016) | 0.755 |
| 升高 | 6(7.7) | 2(16.7) | ||||||
| Hp感染 | 阳性 | 68(87.2) | 6(50.0) | 0.006 | 4.130(0.552~30.868) | 0.167 | 24.937(0.001~1 154 289.530) | 0.557 |
| 阴性 | 10(12.8) | 6(50.0) | ||||||
| 抗Hp治疗 | 是 | 36(46.2) | 2(16.7) | 0.065 | 0.882(0.351~2.215) | 0.789 | 1.626(0.327~8.077) | 0.552 |
| 否 | 42(53.8) | 10(83.3) | ||||||
| 手术 | 是 | 26(33.3) | 8(66.7) | 0.051 | 1.584(0.654~3.837) | 0.309 | 0.439(0.080~2.411) | 0.344 |
| 否 | 52(66.7) | 4(33.3) | ||||||
| 放疗 | 是 | 13(16.7) | 1(8.3) | 0.683 | 0.039(0.000~10.502) | 0.255 | 0.043(0.000~5 513 877.440) | 0.742 |
| 否 | 65(83.3) | 11(91.7) | ||||||
| 化疗 | 是 | 39(50.0) | 7(58.3) | 0.759 | 0.334(0.127~0.879) | 0.026 | 0.556(0.108~2.859) | 0.483 |
| 否 | 39(50.0) | 5(41.7) | ||||||
| 利妥昔单抗治疗 | 是 | 24(30.8) | 4(33.3) | 1.000 | 0.622(0.207~1.867) | 0.397 | 0.393(0.045~3.400) | 0.396 |
| 否 | 54(60.2) | 8(66.7) | ||||||
注:ECOG评分:美国东部肿瘤协作组体力状态评分;IPI:国际预后指数;B症状:包括发热、盗汗、体重减轻;LDH正常值范围为91~192 U/L;Hp:幽门螺旋杆菌
2.疗效分析:90例患者中有71例(78.9%)获得完全缓解(CR),14例(15.6%)获得部分缓解(PR),治疗总反应率达94.5%。5例(5.6%)患者达到疾病稳定(SD)。
按不同治疗方法进行分类,38例接受抗Hp治疗者中32例(84.2%)获得CR;34例接受手术治疗者中25例(73.5%)获得CR;14例接受放疗者中13例(92.9%)获得CR;46例接受化疗者中35例(76.1%)获得CR。各治疗组患者间CR率差异无统计学意义(P值均>0.05)。
3.生存及预后分析:截至末次随访日期,共有6例患者死于疾病复发/进展。有20例(22.2%)患者出现疾病复发/进展。患者总体3年预计PFS率为(75.9±5.3)%,OS率为(98.4±1.6)%;5年预计PFS率为(65.6±7.2)%,OS率为(88.2±5.9)%。中位PFS时间及中位OS时间均未达到。
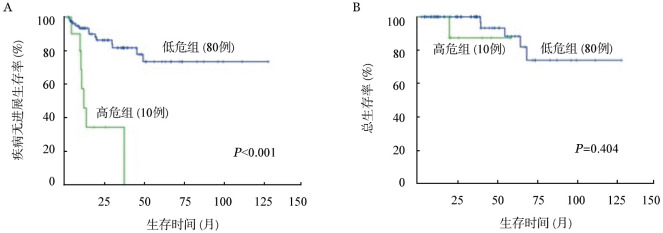
IPI低危和高危组患者比较:3年预计PFS率分别为(81.7±5.2)%和(34.3±15.9)%,5年预计PFS率分别为(73.2±7.3)%和100.0%,差异有统计学意义(χ2=24.382,P<0.01);3年预计OS率分别为100.0%和(87.5±11.7)%,5年预计OS率分别为(88.4±6.4)%和100.0%,差异无统计学意义(χ2=0.697,P=0.404)(图1)。
图1. 黏膜相关淋巴组织结外边缘区B细胞淋巴瘤不同危险度分组患者疾病无进展生存(A)与总生存(B)比较.
10例IPI高危患者中,4例接受抗Hp治疗者3例存活;5例接受手术治疗者均存活;6例接受化疗治疗者均存活;无患者接受放疗。80例IPI低危患者中,34例接受抗Hp治疗,51例接受手术治疗,14例接受放疗,40例接受化疗治疗。按接受不同治疗方法对低危组患者进行分组比较,接受化疗者PFS率高于未接受化疗者(χ2=6.100,P=0.014)(表2)。
表2. 不同治疗方法对低危组患者总生存(OS)和疾病无进展生存(PFS)率的影响(%,x±s).
| 治疗方法 | 例数 | 3年PFS率 | 5年PFS率 | P值 | 3年OS率 | 5年OS率 | P值 | |
| 抗Hp治疗 | 是 | 34 | 80.8±9.0 | 80.8±9.0 | 0.622 | 100.0 | 90.9±8.7 | 0.958 |
| 否 | 46 | 81.9±6.4 | 70.0±9.5 | 100.0 | 86.8±8.9 | |||
| 手术 | 是 | 51 | 81.8±7.4 | 66.1±11.7 | 0.501 | 100.0 | 90.0±9.5 | 0.560 |
| 否 | 29 | 79.9±7.6 | 79.9±7.6 | 100.0 | 87.5±8.3 | |||
| 放疗 | 是 | 14 | 100.0 | 100.0 | 0.073 | 100.0 | 100.0 | 0.613 |
| 否 | 66 | 72.2±5.9 | 62.2±7.5 | 98.1±1.8 | 87.6±6.1 | |||
| 化疗 | 是 | 40 | 88.8±6.1 | 88.8±6.1 | 0.014 | 100.0 | 89.5±7.0 | 0.658 |
| 否 | 40 | 74.5±8.3 | 46.5±16.7 | 100.0 | 83.3±15.2 | |||
| 利妥昔单抗治疗 | 是 | 24 | 92.9±6.9 | 92.9±6.9 | 0.086 | 100.0 | 88.9±10.5 | 0.467 |
| 否 | 56 | 77.7±6.1 | 64.5±10.1 | 100.0 | 87.3±8.7 | |||
注:Hp:幽门螺旋杆菌
对患者性别、年龄、ECOG评分、Musshoff分期、IPI评分、B症状、血红蛋白水平、白蛋白水平、LDH水平、Hp感染情况及各种治疗方法等指标进行单因素生存分析。结果显示,ECOG评分(P=0.006)、Musshoff分期(P=0.008)、IPI评分(P=0.000)、LDH水平(P=0.019)和是否接受化疗(P=0.026)是影响患者PFS的相关因素;ECOG评分(P=0.049)是影响患者OS的相关因素(表1)。
将单因素分析中差异有统计学意义的因素纳入多因素分析,结果显示IPI评分(3~5分)(OR= 8.325,95%CI3.171~21.853,P=0.000)和是否接受化疗(OR=0.319,95% CI 0.121~0.838,P=0.020)为影响患者PFS的独立预后因素,ECOG评分(≥2分)为影响患者OS的独立预后因素(OR=5.092,95% CI 1.005~25.788,P=0.049)。
讨论
原发于消化道的MALT淋巴瘤属结外NHL,其恶性程度相对较低,肿瘤大多生长局限、进展缓慢,患者预后相对良好。该类疾病多于胃内起病,亦可发生于消化道其他部位,包括食道、小肠、结肠、直肠等。目前国内外对于不同起病部位患者相关临床特征、生存及预后的相关研究较少。在本研究中我们发现,非胃内原发的消化道MALT淋巴瘤患者起病时IPI高危比例大于胃内原发MALT淋巴瘤患者。我们认为可做如下解释:非胃内原发消化道MALT淋巴瘤因为起病部位不常见,患者临床症状、体征经常缺乏特异性表现,检查手段对于临床医院要求较高。尤其是发生于肠道的病灶,病理取材依赖于肠镜下活检,或者经外科手术获得,故而造成诊断困难,发现疾病时已处于疾病进展阶段。目前随着各种检查技术的发展,如常规胃肠道内镜以及消化道超声内镜引导下活检等技术的发展,有望提高该部分患者的疾病诊断率[7]–[8]。此外,借助影像学与核医学的技术,尤其是PET-CT检查,可对疾病病灶的良、恶性判断有所帮助。
Hp感染目前被普遍认为与MALT淋巴瘤发病密切相关,尤其是在胃MALT淋巴瘤患者中Hp感染率可高达90%[9]。在我们的研究中,胃内原发患者Hp感染率达87.2%,与文献报道基本相符。但非胃内原发患者Hp感染率仅为50.0%,明显低于胃MALT淋巴瘤(P<0.05)。因此,非胃内原发MALT淋巴瘤的发生可能有其他潜在病因存在,有待进一步探究。
目前对于大部分早期MALT淋巴瘤患者,抗Hp治疗方案已经被广泛接受。Zullo等[10]对来自32项研究的1 408例患者进行荟萃分析,结果显示对MALT淋巴瘤患者行抗Hp治疗,总缓解率达77.5%。此外,既往研究表明,局部放疗可获得超过90%的CR率,大部分患者可获得长期生存[11]。在本研究中,低危组患者对抗Hp治疗及放疗的治疗反应较好,患者可获得长期生存。尤其是14例放疗组患者中无一例出现疾病进展/复发或死亡。各治疗组患者间CR率差异未达到统计学意义,可能与放疗组患者人数较少相关。后续有待增加放疗患者行前瞻性随访研究。
高危组患者目前普遍的治疗选择为CHOP方案±利妥昔单抗治疗。本研究中,化疗组患者5年预计OS率达到100.0%,提示全身化疗对于高危MALT淋巴瘤患者非常必要。然而,本研究中高危患者例数较少,需要进一步扩大样本进一步研究。
近年来,如何在不影响患者疗效及预后的前提下,尽量减少化疗相关不良反应,甚至通过非化疗手段治疗MALT淋巴瘤患者,成为国内外相关领域的研究热点。Martielli等[12]单独采用利妥昔单抗治疗MALT淋巴瘤患者,CR率为46%,PR率为31%,总反应率为77%。此外,随着来那度胺、Ibrutinib、Bendamusine、Idelalisib的研发及应用,也可为MALT淋巴瘤患者的个体化治疗带来新的尝试[13]。
Funding Statement
基金项目:国家自然科学基金(81325003)
References
- 1.Sabattini E, Bacci F, Sagramoso C, et al. WHO classification of tumours of haematopoietic and lymphoid tissues in 2008: an overview[J] Pathologica. 2010;102(3):83–87. [PubMed] [Google Scholar]
- 2.Zinzani PL. The many faces of marginal zone lymphoma[J] Hematology Am Soc Hematol Educ Program. 20122012:426–432. doi: 10.1182/asheducation-2012.1.426. [DOI] [PubMed] [Google Scholar]
- 3.Sagaert X, De Wolf-Peeters C, Noels H, et al. The pathogenesis of MALT lymphomas: where do we stand?[J] Leukemia. 2007;21(3):389–396. doi: 10.1038/sj.leu.2404517. [DOI] [PubMed] [Google Scholar]
- 4.Farinha P, Gascoyne RD. Helicobacter pylori and MALT lymphoma[J] Gastroenterology. 2005;128(6):1579–1605. doi: 10.1053/j.gastro.2005.03.083. [DOI] [PubMed] [Google Scholar]
- 5.Kong SH, Kim MA, Park DJ, et al. Clinicopathologic features of surgically resected primary gastric lymphoma[J] World J Gastroenterol. 2004;10(8):1103–1109. doi: 10.3748/wjg.v10.i8.1103. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Cheson BD, Pfistner B, Juweid ME, et al. Revised response criteria for malignant lymphoma[J] J Clin Oncol. 2007;25(5):579–586. doi: 10.1200/JCO.2006.09.2403. [DOI] [PubMed] [Google Scholar]
- 7.Nonaka K, Ishikawa K, Arai S, et al. A case of gastric mucosaassociated lymphoid tissue lymphoma in which magnified endoscopy with narrow band imaging was useful in the diagnosis[J] World J Gastrointest Endosc. 2012;4(4):151–156. doi: 10.4253/wjge.v4.i4.151. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Ibuka T, Araki H, Sugiyama T, et al. Diagnosis of the jejunoileal lymphoma by double-balloon endoscopy[J] World J Gastrointest Endosc. 2013;5(3):111–116. doi: 10.4253/wjge.v5.i3.111. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Bertoni F, Coiffier B, Salles G, et al. MALT lymphomas: pathogenesis can drive treatment[J] Oncology (Williston Park) 2011;25(12):1134–1142, 1147. [PubMed] [Google Scholar]
- 10.Zullo A, Hassan C, Cristofari F, et al. Effects of Helicobacter pylori eradication on early stage gastric mucosa-associated lymphoid tissue lymphoma[J] Clin Gastroenterol Hepatol. 2010;8(2):105–110. doi: 10.1016/j.cgh.2009.07.017. [DOI] [PubMed] [Google Scholar]
- 11.Lin ML, Wirth A, Chao M, et al. Radiotherapy for low-grade gastric marginal zone lymphoma: a retrospective study[J] Intern Med J. 2007;37(3):172–180. doi: 10.1111/j.1445-5994.2006.01291.x. [DOI] [PubMed] [Google Scholar]
- 12.Martinelli G, Laszlo D, Ferreri AJ, et al. Clinical activity of rituximab in gastric marginal zone non-Hodgkin's lymphoma resistant to or not eligible for anti-Helicobacter pylori therapy[J] J Clin Oncol. 2005;23(9):1979–1983. doi: 10.1200/JCO.2005.08.128. [DOI] [PubMed] [Google Scholar]
- 13.Joshi M, Sheikh H, Abbi K, et al. Marginal zone lymphoma: old, new, targeted, and epigenetic therapies[J] Ther Adv Hematol. 2012;3(5):275–290. doi: 10.1177/2040620712453595. [DOI] [PMC free article] [PubMed] [Google Scholar]