Abstract
目的
评价血清IgD定量检测在IgD型多发性骨髓瘤(MM)患者疗效评估中的意义。
方法
纳入29例临床疗效达到严格意义完全缓解(sCR)、完全缓解(CR)和非常好的部分缓解(VGPR)的IgD型MM患者,采用全自动SPAplus特定蛋白分析仪(散射免疫比浊法)进行IgD定量及血清游离轻链(sFLC)检测,结合同期血清免疫固定电泳(IFE)M蛋白检测结果评价IgD定量检测在疗效评估中的意义。
结果
①sCR组(12例)、CR组(5例)、VGPR组(12例)分别有1、2、4例患者IgD定量结果异常升高。②全部29例患者中位随访24.7(8.6~41.5)个月,sCR组、CR组、VGPR组的中位无进展生存(PFS)期分别为38.5、34.1、15.5个月,sCR组与VGPR组差异有统计学意义(P=0.022),CR组与VGPR组差异有统计学意义(P=0.018),sCR组与CR组差异无统计学意义(P=0.846);sCR组、CR组、VGPR组的总生存(OS)期分别为41.5、37.7、19.1个月,差异无统计学意义(P>0.05)。③6例患者sFLC比值及IgD定量均异常升高(A组),10例患者sFLC比值异常或IgD定量异常升高(B组),13例患者sFLC比值及IgD定量正常(C组)。A组PFS期短于C组(7.8个月对43.9个月,P=0.033),B组与A、C组差异无统计学意义(33.7个月对7.8个月,P=0.404;33.7个月对43.9个月,P=0.121)。A、B、C组的OS期分别为11.8、37.5、47.1个月,差异无统计学意义(P>0.05)。
结论
达到VGPR及以上疗效的IgD型MM患者仍存在IgD水平异常;联合应用IgD定量与sFLC及IFE检测可预测VGPR及以上疗效IgD型MM患者的PFS。
Keywords: 多发性骨髓瘤, 免疫球蛋白D, 免疫球蛋白轻链, 预后
Abstract
Objective
To investigate the significance of serum IgD quantitation in evaluation of clinical efficacy in IgD myeloma.
Methods
Serum IgD and free light chain (sFLC) levels were determined by immune scatter turbidimetry with SPA plus analysis machine in 29 patients with IgD multiple myeloma (MM) achieving VGPR or better response following previous treatments. The concurrent immunofixation electrophoresis (IFE) results were also incorporated and analyzed.
Results
Increased IgD levels were detected in 1 of 12 patients achieving sCR, 2 of 5 patients achieving CR and 4 of 12 patients achieving VGPR, respectively. The median progression-free survival (PFS) was 38.5 months, 34.1 months and 15.5 months for patients achieving sCR, CR and VGPR, respectively, with a significant difference between sCR and VGPR groups (P=0.022), and between CR and VGPR groups (P=0.018). There was no difference in overall survival (OS) among sCR, CR and VGPR groups (P>0.05). The median PFS were 7.8, 33.7 and 43.9 months, respectively for the patients with both abnormal sFLC ratios and IgD levels (6 cases, Group A), with either abnormal sFLC ratios or increased IgD levels (10 cases, Group B) or with normal sFLC ratios and IgD levels (13 cases, Group C). A significant PFS benefit of Group A over Group C was found (P=0.033), and no differences in terms of OS among three groups (P>0.05).
Conclusion
IgD levels may remain abnormal in IgD MM patients who have achieved VGPR or better response, and IgD quantitation represented a useful assay complementary to the current lab examinations. IgD quantitation assay was of significance in clinical efficacy evaluation and survival judgement, and should be incorporated into the evaluation parameters used for IgD MM in addition to sFLC and IFE assays.
Keywords: Multiple myeloma, Immunoglobulin D, Immunoglobulin light chains, Prognosis
多发性骨髓瘤(multiple myeloma,MM)是一种恶性浆细胞克隆增殖性疾病,以单克隆免疫球蛋白或其片段异常增多引起骨破坏、肾损害等一系列临床症状为主要特征。根据其增生的浆细胞分泌的免疫球蛋白重链的不同,可将MM分为轻链型、IgG型、IgA型、IgM型、IgD型和IgE型,其中IgD型较为少见(占4%~6%)[1]。目前MM的常规疗效评价指标包括血清蛋白电泳、免疫固定电泳(immune fixation electrophoresis, IFE)和血清游离轻链(serum free light chain,sFLC)[2]–[3]。Zagouri等[4]研究发现IgD定量检测有助于IgD型MM患者的评估疗效和预后判断。在本研究中,我们对29例化疗后达到非常好的部分缓解(VGPR)及以上疗效IgD型MM患者进行血清IgD定量检测,结合sFLC和IFE结果评估IgD定量检测在MM患者预后评估中的应用价值。
病例与方法
1.病例:2011年3月至2015年7月在我院治疗后达VGPR以上疗效的29例IgD型MM患者纳入本研究。男23例,女6例,中位年龄56(39~74)岁。根据文献[5]标准评价疗效:①严格意义完全缓解(sCR):血清和尿IFE检测示M蛋白阴性、游离轻链比值(rFLC)正常以及免疫组织化学或免疫荧光技术证实骨髓中无单克隆浆细胞;②完全缓解(CR):血清和尿IFE检测示M蛋白阴性,软组织浆细胞瘤消失,骨髓中浆细胞比例≤5%;③VGPR:血清蛋白电泳不能检出M蛋白,血清和尿IFE检测示M蛋白阳性。29例患者中VGPR 12例,CR 5例,sCR 12例。
2.主要试剂与仪器:轻链к/λ检测试剂盒、IgD定量试剂盒、样本稀释液Ⅱ、全自动SPAplus特定蛋白分析仪均购自英国The Binding Site公司。
3.散射免疫比浊法定量检测IgD及sFLC:采集患者空腹静脉血3~5 ml,置于真空分离凝胶促凝剂管中,3 000×g离心10 min,取上层血清分装入EP管中,−20 °C保存待测。检测前室温解冻,用SPAplus特定蛋白分析仪检测FLCк、FLCλ和IgD,按照试剂盒说明书进行操作。根据FLCк和FLCλ结果计算rFLC。
参照试剂盒说明书设定参考值范围:FLCк 3.3~19.4 mg/L,FLCλ 5.7~26.3 mg/L,rFLC 0.26~1.65,IgD 7.7~132.1 mg/L。
4.随访:疗效评估完成后开始对患者进行随访,截止日期为2015年7月1日,中位随访时间为24.7(8.6~41.5)个月。无进展生存(PFS)期:获得VGPR至疾病进展或死亡的时间;总生存(OS)期:获得VGPR至死亡的时间。
5.统计学处理:采用SPSS17.0软件进行数据分析。生存分析采用Kaplan-Meier法,以P<0.05为差异有统计学意义。
结果
1.rFLC及IgD定量检测结果:29例IgD型MM患者一般资料、IgD及FLC检测结果见表1。12例sCR患者rFLC均正常,1例IgD定量检测异常升高(>132.10 mg/L);5例CR患者rFLC全部异常(>1.650或<0.260),其中2例IgD定量检测异常升高(>132.10 mg/L);12例VGPR患者中有10例rFLC异常(>1.650或<0.260),4例IgD定量检测异常升高(>132.10 mg/L)。
表1. 29例疗效为VGPR及以上IgD型多发性骨髓瘤患者的血清游离轻链(sFLC)及IgD检测结果.
| 例号 | 性别 | 年龄(岁) | M蛋白 | 疗效 | IgD(mg/L) | sFLC |
||
| к(mg/L) | λ(mg/L) | к/λ比值 | ||||||
| 1 | 女 | 62 | − | sCR | 13.10 | 10.05 | 15.28 | 0.658 |
| 2 | 男 | 64 | − | sCR | 180.11 | 58.20 | 208.72 | 0.279 |
| 3 | 女 | 74 | − | sCR | 12.07 | 9.17 | 16.48 | 0.556 |
| 4 | 男 | 56 | − | sCR | 7.79 | 19.51 | 17.94 | 1.087 |
| 5 | 女 | 57 | − | sCR | 8.17 | 12.66 | 14.45 | 0.876 |
| 6 | 男 | 56 | − | sCR | 21.24 | 8.87 | 20.48 | 0.433 |
| 7 | 女 | 70 | − | sCR | 18.65 | 28.75 | 19.85 | 1.448 |
| 8 | 男 | 39 | − | sCR | 9.34 | 28.73 | 21.21 | 1.354 |
| 9 | 男 | 60 | − | sCR | 68.78 | 17.40 | 35.16 | 0.495 |
| 10 | 女 | 56 | − | sCR | 123.84 | 7.670 | 24.39 | 0.314 |
| 11 | 男 | 40 | − | sCR | 23.05 | 7.52 | 10.07 | 0.747 |
| 12 | 男 | 62 | − | sCR | 112.94 | 31.18 | 48.52 | 0.643 |
| 13 | 男 | 46 | − | CR | 76.96 | 512.15 | 18.78 | 27.271 |
| 14 | 女 | 53 | − | CR | 73.57 | 8.83 | 319.09 | 0.028 |
| 15 | 男 | 43 | − | CR | 10.89 | 10.67 | 161.06 | 0.066 |
| 16 | 男 | 50 | − | CR | 138.16 | 34.61 | 158.91 | 0.218 |
| 17 | 男 | 50 | − | CR | 188.76 | 11.20 | 9 715.80 | 0.001 |
| 18 | 男 | 68 | + | VGPR | 18.57 | 33.52 | 34.45 | 0.973 |
| 19 | 男 | 48 | + | VGPR | 146.41 | 5.08 | 110.34 | 0.046 |
| 20 | 男 | 56 | + | VGPR | 14.35 | 0.85 | 14.77 | 0.057 |
| 21 | 男 | 57 | + | VGPR | 9.88 | 14.01 | 1 076.00 | 0.013 |
| 22 | 男 | 54 | + | VGPR | 92.51 | 7.30 | 13.76 | 0.530 |
| 23 | 男 | 52 | + | VGPR | 34.94 | 0.84 | 386.44 | 0.002 |
| 24 | 男 | 60 | + | VGPR | 116.54 | 0.97 | 1 228.00 | 0.001 |
| 25 | 男 | 51 | + | VGPR | 158.49 | 304.88 | 7.89 | 38.641 |
| 26 | 男 | 64 | + | VGPR | 163.98 | 4.87 | 1 383.00 | 0.003 |
| 27 | 女 | 64 | + | VGPR | 189.91 | 21.49 | 95.51 | 0.225 |
| 28 | 男 | 60 | + | VGPR | 82.243 | 38.54 | 389.49 | 0.099 |
| 29 | 男 | 40 | + | VGPR | 13.64 | 99 102.00 | 22.06 | 4 492.384 |
注:sCR:严格意义完全缓解;CR:完全缓解;VGPR:非常好的部分缓解;−:检测结果阴性;+:检测结果阳性
2.不同疗效组患者的生存比较:sCR、CR、VGPR组的中位PFS期分别为38.5、34.1、15.5个月,sCR组与VGPR组比较差异有统计学意义(P=0.022),CR组与VGPR组比较差异有统计学意义(P=0.018),sCR组与CR组差异无统计学意义(P=0.846)(图1)。sCR、CR、VGPR组的OS期分别为41.5、37.7、19.1个月,两两比较差异均无统计学意义(P>0.05)。
图1. 不同疗效IgD型多发性骨髓瘤患者的无进展生存曲线.
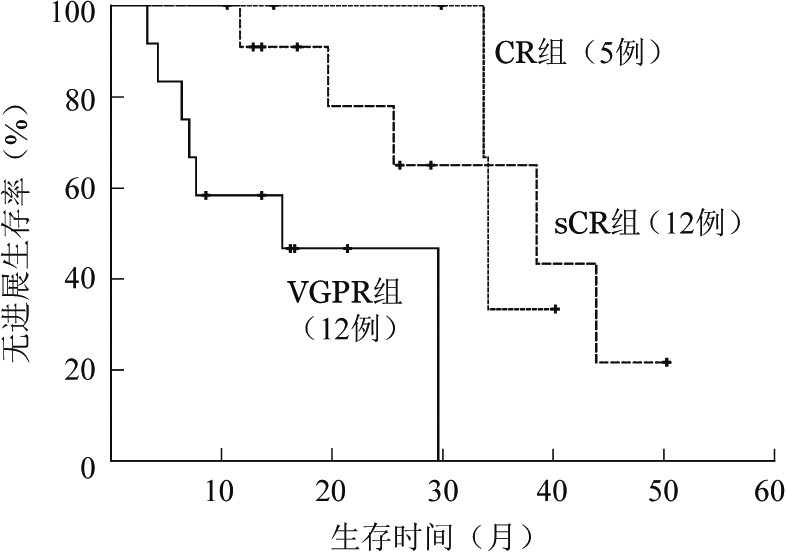
sCR:严格意义完全缓解;CR:完全缓解;VGPR:非常好的部分缓解
3.不同rFLC及IgD检测结果患者的生存比较:根据rFLC及IgD检测结果将本组患者分为①A组(6例):rFLC及IgD定量均异常升高(rFLC>1.650,IgD>132.10 mg/L);②B组(10例):rFLC异常(>1.650或<0.260)或IgD定量异常升高(>132.10 mg/L);③C组(13例):rFLC及IgD定量均正常。A组PFS期短于C组(7.8个月对43.9个月,P=0.033),B组与A、C组差异无统计学意义(33.7个月对7.8个月,P=0.404;33.7个月对43.9个月,P=0.121)(图2)。A、B、C组的OS期分别为11.8、37.5、47.1个月,两两比较差异均无统计学意义(P>0.05)。
图2. 游离轻链比值(rFLC)及IgD水平对疗效达非常好的部分缓解及以上IgD型多发性骨髓瘤患者无进展生存的影响.
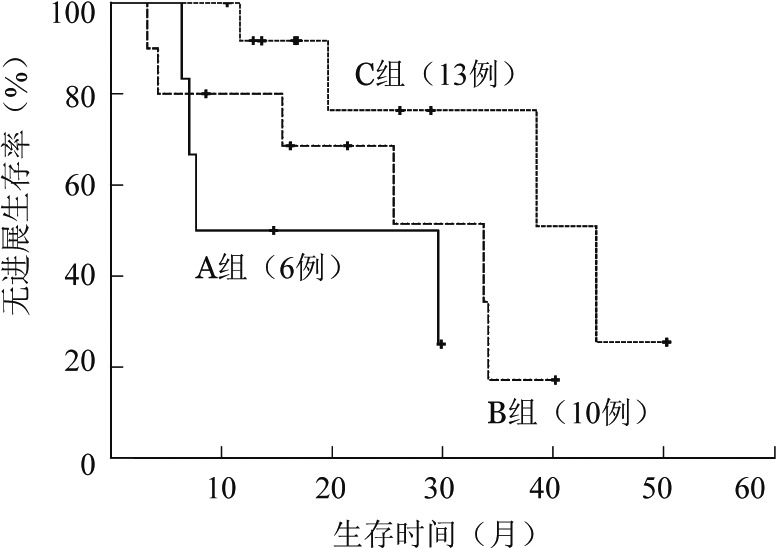
A组:rFLC及IgD定量均异常升高(rFLC>1.650,IgD>132.10 mg/L);B组:rFLC异常(>1.650或<0.260)或IgD异常升高(>132.10 mg/L);C组:rFLC及IgD均正常
讨论
国外IgD型MM发病率低,相关研究文献较少,目前国内暂无IgD定量检测方面报道。目前国内主要依靠血清蛋白电泳、IFE和sFLC对IgD型MM患者进行诊断及疗效评估[6]。血清蛋白电泳为传统M蛋白检测方法,检测灵敏度为1.3 g/L,当M蛋白处于较低分子量水平时,形成的条带可能会落在β区域附近与β区重叠,γ区不出现异常单株峰,从而得出假阴性结果而造成漏诊[7]。IFE为经典的M蛋白定性方法,检测灵敏度为25 mg/L,可同时观察不同类型的M蛋白(IgG、IgA、IgM、IgD及IgE)[8]。散射免疫比浊法进行IgD定量及sFLC检测的灵敏度均为0.1 mg/L[4],[9],远高于血清蛋白电泳及IFE。在本研究中我们采用散射免疫比浊法对治疗后达VGPR及以上疗效的IgD型MM患者进行IgD定量检测,结果显示临床疗效达CR甚至sCR的患者IgD定量仍异常增高,与文献[10]结果相似,提示IgD定量检测在IgD型MM患者的疗效评估及预后判断中具有非常重要的价值。
本组病例中,rFLC和IgD定量均正常的MM患者PFS期长于IgD定量和rFLC结果均异常的患者(P<0.05)。rFLC和IgD定量检测是两个独立的观察指标,对于分泌IgD型单克隆免疫球蛋白和sFLC的MM患者(IgD型MM且sFLC异常),这两个指标往往都有异常。由于个体差异及不同化疗药物对不同克隆类型浆细胞效果的差异,部分患者在治疗过程中单克隆免疫球蛋白明显下降而sFLC仍异常,部分患者sFLC明显下降而单克隆免疫球蛋白仍异常;当患者疾病缓解后复发时,少部分患者会出现单克隆类型变异[11],所以IgD定量检测对于现行常规检测方法是一个有益的补充,同时结合sFLC的检测,可非常精确地判断IgD型MM患者体内的残留肿瘤负荷,而当IgD定量检测与sFLC及IFE联合应用更可用于预测此类型患者的PFS期。
本研究结果显示,在常规方法评估疗效为VGPR、CR、sCR的IgD型MM患者中仍可检测到血清IgD水平异常,说明血清IgD定量检测对于常规的疗效评估方法是有益而必要的补充。因此,我们建议联合应用IFE、sFLC和IgD定量检测作为IgD型MM患者诊断与疗效的评估方法。本研究结果尚需进行大样本并延长随访时间的前瞻性临床研究加以验证。
References
- 1.Wang H, Gao C, Xu L, et al. Laboratory characterizations on 2007 cases of monoclonal gammopathies in East China[J] Cell Mol Immunol. 2008;5(4):293–298. doi: 10.1038/cmi.2008.36. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Rajkumar SV, Dimopoulos MA, Palumbo A, et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma[J] Lancet Oncol. 2014;15(12):e538–548. doi: 10.1016/S1470-2045(14)70442-5. [DOI] [PubMed] [Google Scholar]
- 3.Pandey S, Kyle RA. Unusual myelomas: a review of IgD and IgE variants[J] Oncology (Williston Park) 2013;27(8):798–803. [PubMed] [Google Scholar]
- 4.Zagouri F, Kastritis E, Symeonidis AS, et al. Immunoglobulin D myeloma: clinical features and outcome in the era of novel agents[J] Eur J Haematol. 2014;92(4):308–312. doi: 10.1111/ejh.12255. [DOI] [PubMed] [Google Scholar]
- 5.Durie BG, Harousseau JL, Miguel JS, et al. International uniform response criteria for multiple myeloma[J] Leukemia. 2006;20(9):1467–1473. doi: 10.1038/sj.leu.2404284. [DOI] [PubMed] [Google Scholar]
- 6.刘 彦, 克 晓燕, 王 晶, et al. IgD型多发性骨髓瘤的临床疗效分析[J] 中国实验血液学杂志. 2014;22(6):1628–1632. doi: 10.7534/j.issn.1009-2137.2014.06.024. [DOI] [PubMed] [Google Scholar]
- 7.Vladutiu AO. Immunoglobulin D: properties, measurement, and clinical relevance[J] Clin Diagn Lab Immunol. 2000;7(2):131–140. doi: 10.1128/CDLI.7.2.131-140.2000. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.汪 薇, 阎 有功, 张 利方, et al. IgD型多发性骨髓瘤实验室检查特征[J] 临床血液学杂志. 2015;28(1):16–18. doi: 10.13201/j.issn.1004-2806.2015.01.005. [DOI] [Google Scholar]
- 9.Mead GP, Carr-Smith HD, Drayson MT, et al. Serum free light chains for monitoring multiple myeloma[J] Br J Haematol. 2004;126(3):348–354. doi: 10.1111/j.1365-2141.2004.05045.x. [DOI] [PubMed] [Google Scholar]
- 10.Pisani F, Petrucci MT, Giannarelli D, et al. IgD multiple myeloma a descriptive report of 17 cases: survival and response to therapy[J] J Exp Clin Cancer Res. 2012;31:17. doi: 10.1186/1756-9966-31-17. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Batinić J, Perić Z, Šegulja D, et al. Immunoglobulin heavy/light chain analysis enhances the detection of residual disease and monitoring of multiple myeloma patients[J] Croat Med J. 2015;56(3):263–271. doi: 10.3325/cmj.2015.56.263. [DOI] [PMC free article] [PubMed] [Google Scholar]


