Abstract
目的
分析MLL基因重排成人急性髓系白血病(AML)的临床、实验室特征及预后情况。
方法
回顾性分析2010年1月至2016年12月确诊的92例MLL基因重排成人AML患者的临床和实验室资料。
结果
1 417例成人AML(不包括急性早幼粒细胞白血病,均采用FISH方法进行了MLL基因重排分析)患者中检出92例(6.5%)MLL基因重排患者,男女性别比为1∶1,诊断时中位年龄为35.5(15~64)岁,中位WBC 21.00(0.42~404.76)×109/L。按FAB分型标准,78例(84.8%)患者属于急性单核细胞白血病。32例患者检测了11种MLL常见伙伴基因,其中MLL/AF9阳性9例(28.1%),MLL/AF6阳性5例(15.6%),MLL/ELL阳性5例(15.6%),MLL/AF10阳性2例(6.3%),MLL/SETP6阳性1例(3.1%),余10例(31.3%)患者的伙伴基因未知。83例患者可进行疗效分析,中位随访时间为10.3(0.3~74.0)个月,完全缓解(CR)率为85.5%,中位总生存(OS)和无复发生存(RFS)时间分别为15.4和13.1个月,2年OS和RFS率分别为36.6%和29.5%。31例患者进行了异基因造血干细胞移植(allo-HSCT),移植患者的2年OS和RFS率分别为57.9%和52.7%,未移植患者分别为21.4%和14.9%,差异均有统计学意义(P值均<0.001)。进行伙伴基因检测的患者中,9例MLL/AF9阳性患者中位随访时间为6.0(4.1~20.7)个月,3例(33.3%)进行了allo-HSCT;23例非MLL/AF9阳性患者中位随访时间为7.8(0.3~26.6)个月,14例(60.1%)进行了allo-HSCT。两组患者的1年OS率分别为38.1%和55.5%,差异无统计学意义(P=0.688)。多因素分析显示起病时WBC(RR=1.825,95% CI 1.022~3.259,P=0.042)、是否1个疗程达CR(RR=0.130,95% CI 0.063~0.267,P<0.001)以及是否移植(RR=0.169,95% CI 0.079~0.362,P<0.001)为影响MLL基因重排AML患者OS的独立预后因素。
结论
MLL基因重排成人AML多见于急性单核细胞白血病,MLL/AF9是最常见的伙伴基因。该类型白血病常规化疗虽然缓解率尚可,但极易复发,allo-HSCT可以改善其预后。
Keywords: 白血病,髓样,急性, MLL基因重排, 预后
Abstract
Objective
To analyze the clinical and laboratory characteristics, and prognosis of adult acute myeloid leukemia (AML) patients with MLL gene rearrangements.
Methods
The medical records of 92 adult AML patients with MLL gene rearrangements from January 2010 to December 2016 were retrospectively analyzed.
Results
92 cases (6.5%) with MLL gene rearrangements were identified in 1 417 adult AML (Non-M3) patients, the median age of the patients was 35.5 years (15 to 64 years old) with an equal sex ratio, the median WBC were 21.00(0.42–404.76)×109/L, and 78 patients (84.8%) were acute monoblastic leukemia according to FAB classification. Eleven common partner genes were detected in 32 patients, 9 cases (28.1%) were MLL/AF9(+), 5 cases (15.6%) were MLL/AF6(+), 5 cases (15.6%) were MLL/ELL(+), 2 cases (6.3%) were MLL/AF10(+), 1 case (3.1%) was MLL/SETP6(+), and the remaining 10 patients' partner genes weren't identified. Of 92 patients, 83 cases with a median follow-up of 10.3 (0.3–74.0) months were included for the prognosis analysis, the complete remission (CR) rate was 85.5% (71/83), the median overall survival (OS) and relapse free survival (RFS) were 15.4 and 13.1 months, respectively. Two-year OS and RFS were 36.6% and 29.5%, respectively. Of 31 patients underwent allogeneic hematopoietic stem-cell transplantation (allo-HSCT), two-year OS and RFS for patients received and non-received allo-HSCT were 57.9% and 21.4%, 52.7% and 14.9%, respectively (P<0.001). Among patients with partner genes tested, 9 of 32 cases (28.1%) were MLL/AF9(+), the median follow-up was 6.0(4.1–20.7) months. 3 patients with MLL/AF9 underwent allo-HSCT. 23 cases (71.9%) were non-MLL/AF9(+), the median follow-up was 7.8 (0.3–26.6) months. 14 patients (60.1%) with non-MLL/AF9 underwent allo-HSCT. One-year OS for patients with MLL/AF9 and non-MLL/AF9 were 38.1% and 55.5%, respectively (P=0.688). Multivariate analysis revealed that high WBC (RR=1.825, 95% CI 1.022–3.259, P=0.042), one cycle to achieve CR (RR=0.130, 95% CI 0.063–0.267, P<0.001), post-remission treatment with allo-HSCT (RR=0.169, 95% CI 0.079–0.362, P<0.001) were independent prognostic factors affecting OS.
Conclusion
AML with MLL gene rearrangements was closely associated with monocytic differentiation, and MLL/AF9 was the most frequent partner gene. Conventional chemotherapy produced a high response rate, but likely to relapse, allo-HSCT may have the potential to further improve the prognosis of this group of patients.
Keywords: Leukemia, myeloid, acute; MLL rearrangement; Prognosis
混合谱系白血病(mixed lineage leukemia,MLL)基因定位于11号染色体长臂2区3带(11q23),由Ziemin-van der Poel等[1]于1991年首次报道。MLL基因重排是造血系统恶性肿瘤中常见的遗传学改变,可见于急性白血病、骨髓增生异常综合征等[2]。MLL基因重排有易位、部分串联重复(PTD)、缺失、插入和倒置几种形式,其中易位最常见[3]。易位形成的MLL融合蛋白引起转录调控异常及诱导MLL下游的目的基因如HOX、EPHA7、MEIS、PBX等异常表达,从而影响造血分化,导致白血病等的发生[4]。MLL基因重排的急性髓系白血病(AML)约占成人AML的5%,具有缓解率低、容易复发、预后差的临床特征[5]。我们对我中心2010年1月至2016年12月收治的MLL基因重排AML患者进行了回顾性分析,现将其特征和预后报道如下。
病例与方法
1.病例:2010年1月至2016年12月我中心收治经细胞形态学、免疫学、遗传学、分子生物学(MICM)诊断分型标准[6]–[7]确诊的AML[不包括急性早幼粒细胞白血病(APL)]患者共1 417例。所有患者均进行了常规细胞遗传学分析(conventional cytogenetical analysis, CCA),并采用FISH技术检测了MLL基因重排。2014年以后收治的患者采用RQ-PCR技术检测了11种常见的MLL伙伴基因。由于FISH技术具有敏感性高、特异性强的优点,一直被推荐为MLL基因重排筛查的首选方法[8]。在1 417例AML(不包括APL)患者中,采用FISH技术筛出MLL基因重排患者92例,占AML(不包括APL)患者的6.5%。其中,9例患者诊断明确后回当地医院治疗,余83例患者在我中心接受系统治疗,可进行疗效分析。
2.免疫表型分析:取患者骨髓(肝素抗凝)5 ml,裂解红细胞,常规进行相关抗体标记,PBS洗涤后上机(FACS Calibur多色流式细胞仪为美国BD公司产品)检测。
3.CCA检查:取患者骨髓(肝素抗凝)5 ml,常规24 h的短期培养后,进行R显带分析染色体核型。异常核型依据《人类细胞遗传学国际命名体制(ISCN2013)》进行描述。
4.FISH检测MLL基因重排:取患者骨髓(肝素抗凝)2 ml,直接法收获间期细胞,选择美国Vysis公司双色分离MLL探针,按说明书进行操作,对患者标本进行检测。Olympus荧光显微镜观察间期细胞的荧光信号,计数500个间期细胞。对20例正常人骨髓标本进行MLL探针检测,计算出Cutoff值(<2.17%)。正常信号为两个黄色(红绿重叠)信号,1黄1红1绿信号为典型阳性信号,若出现黄色信号数量增加,表明MLL基因拷贝数扩增。
5.RQ-PCR法筛查MLL融合基因:2014年4月以后收治的32例患者同时采用RQ-PCR检测11种常见的MLL伙伴基因(MLL/AF4、MLL/AF6、MLL/AF9、MLL/AF10、MLL/AF17、MLL/ELL、MLL/ENL、MLL/SETP6、MLL/AF1q、MLL/AF1p、MLL/AFX)。取患者少量骨髓标本,Ficoll淋巴细胞分离液分离骨髓单个核细胞,提取RNA后逆转录合成cDNA,PCR方法检测上述融合基因。
6.基因突变检测:2014年11月以前收治的64例患者采用一代测序法检测了AML常见基因突变,包括:FLT3-ITD、FLT3-TKD、CEBPA-TAD、CEBPA-bZIP、NPM1、C-kit、DNMT3A。2014年11月以后收治的28例患者采用超高多重PCR外显子富集技术进行高通量基因测序,检测112种血液系统肿瘤相关基因突变,测序的平均深度为800×。
7.治疗:诱导治疗方案为包含蒽环/蒽醌类、阿糖胞苷(Ara-C)和(或)高三尖杉酯碱(HHT)的联合化疗。完全缓解(CR)后给予巩固化疗,方案包括中大剂量Ara-C或标准剂量Ara-C联合蒽环类、HHT的化疗方案。有移植条件者,尽量在第1次CR(CR1)期行异基因造血干细胞移植(allo-HSCT)。复发或持续不缓解患者,根据病情选择AAC(阿克拉霉素、Ara-C、环磷酰胺)、MAC(米托蒽醌、Ara-C、环磷酰胺)或FLAG(氟达拉滨、Ara-C、G-CSF)等挽救治疗方案。疗效评估标准参考文献[6]。
8.随访:通过电话或病案查询方式进行随访,83例可进行疗效分析患者随访至2017年1月31日,无一例失访。总生存(OS)时间指从确诊之日起至随访截止日止,死亡患者则计算至死亡日。无复发生存(RFS)时间指从CR之日起至复发或任何原因引起的死亡日或随访截止日止。
9.统计学处理:采用SPSS 17.0软件进行统计学分析。计量资料以中位数(范围)表示,采用秩和检验比较,计数资料组间比较应用卡方检验。OS、RFS的分析采用Kaplan-Meier法进行Log-rank检验,并绘制生存曲线。单因素分析P<0.05的因素进入Cox回归模型进行多因素分析,以确定独立预后因素。双侧P<0.05为差异有统计学意义。
结果
1.临床特征:92例MLL基因重排AML患者中,男46例(50%),女46例(50%),其中治疗相关的AML 4例。诊断时中位年龄为35.5(15~64)岁,中位WBC 21.00(0.42~404.76)×109/L,中位HGB 89.5(46~152)g/L,中位PLT 54(2~238)×109/L,中位LDH 351.5(141~11 402)U/L。按FAB分型诊断,M2 6例(6.5%),M4 8例(8.7%),M5 78例(84.8%),可见MLL基因重排的AML多见于急性单核细胞白血病。68例(73.9%)患者起病时合并出凝血异常,主要表现为纤溶亢进,有6例(6.5%)患者符合DIC的诊断标准[9]。3例(3.3%)患者起病时合并皮肤浸润。
2.免疫表型特征:92例MLL基因重排AML患者多数表达髓系抗原CD33(100.0%)、CD117(90.6%)、CD13(76.5%)、CD38(84.7%)以及CD123(85.6%),造血干/祖细胞表面标志HLA-DR(75.3%)、CD34(44.7%)表达率较低。因大多数患者属于急性单核细胞白血病,单核细胞分化标志CD64(84.7%)、CD11b(57.6%)以及CD4(55.3%)表达率亦较高。超过1/3的患者还同时表达NK细胞标志CD56(37.6%)。
3.细胞遗传学及分子生物学特征:92例患者均进行了CCA检查,除4例因细胞增殖不佳无分裂象以外,余88例患者的染色体核型分布情况见表1。其中20例患者的染色体核型为del(11q23),结合这些患者MLL基因的FISH信号分析,只有4例患者为真正的11q23缺失,余16例患者均为典型的MLL探针阳性信号(1黄1红1绿),说明MLL基因发生重排,只是由于CCA的检出能力所限,无法确定易位位点。
表1. 88例MLL基因重排成人急性髓系白血病患者的染色体核型分布情况.
| 染色体核型 | 例数(%) |
| 正常核型 | 28(31.8) |
| del(11q23) | 20(22.7) |
| 非11q23的其他克隆性异常 | 13(14.8) |
| t(11;19)(q23;p13) | 7(8.0) |
| t(6;11)(q27;q23) | 6(6.8) |
| t(9;11)(p22;q23) | 6(6.8) |
| t(10;11)(p12;q23) | 4(4.5) |
| t(11;17)(q23;q21) | 2(2.3) |
| t(10;14;11)(p13;q24;q23) | 1(1.1) |
| inv (11q23) | 1(1.1) |
32例患者检测了11种MLL常见伙伴基因,其中MLL/AF9阳性9例(28.1%),MLL/AF6阳性5例(15.6%),MLL/ELL阳性5例(15.6%),MLL/AF10阳性2例(6.3%),MLL/SETP6阳性1例(3.1%),余10例(31.3%)患者的伙伴基因不在上述11种常见伙伴基因之列。22例伙伴基因阳性的患者,CCA检出相应染色体易位12例,符合率为54.5%。
4.基因突变特征:64例患者采用一代测序方法检测了AML常见的基因突变,合并FLT3-TKD突变5例(7.8%),FLT3-ITD突变1例(1.6%),CEBPA-TAD突变2例(3.1%)、C-kit突变1例(1.6%)。采用二代测序方法检测112种血液系统肿瘤相关基因突变的28例患者中,27例(96.4%)患者共合并43种突变,每例患者中位合并突变数为3(1~7)个,出现频率较高的几种突变依次为NRAS(28.6%)、ASXL1(28.6%)、TET2(17.9%)、KRAS(17.9%)等。
5.疗效分析:92例患者中,83例可进行疗效分析,中位随访时间为10.3(0.3~74.0)个月,中位OS和RFS时间分别为15.4和13.1个月,2年OS和RFS率分别为36.6%和29.5%。其中4例患者在诱导化疗期间死亡(诱导治疗相关死亡率4.8%),1个疗程CR率为79.5%(66/83),2个疗程CR率为84.3%(70/83),3个疗程CR率为85.5%(71/83)。31例患者进行了allo-HSCT,CR1期移植26例,CR2期移植3例,未缓解状态下移植2例。获得CR的患者,44例(62.0%,44/71)复发,其中骨髓复发35例,髓外复发4例,骨髓以及髓外同时复发5例。髓外复发部位主要为中枢神经系统和皮肤。
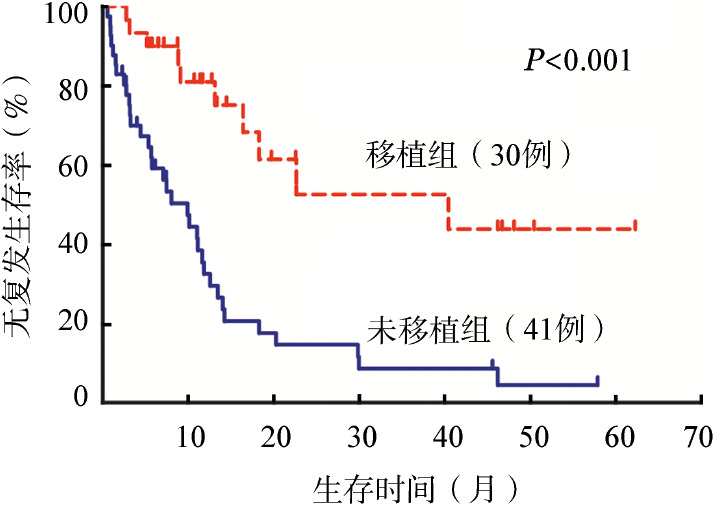
移植组患者的中位随访时间为14.7(6.6~74.0)个月,未移植组患者的中位随访时间为9.0(0.3~59.1)个月。移植组患者的2年OS和RFS率分别为57.9%和52.7%,未移植组患者2年OS和RFS率分别为21.4%和14.9%,差异均具有统计学意义(P值均<0.001)(图1、2)。
图1. MLL基因重排成人急性髓系白血病移植组和未移植组的总生存曲线.
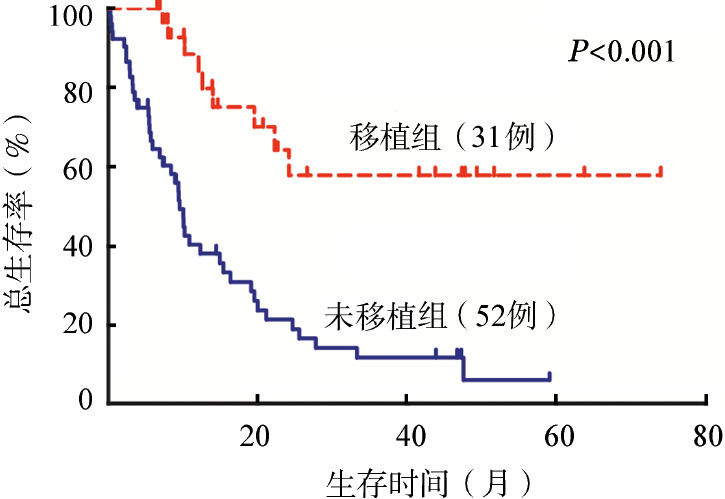
图2. MLL基因重排成人急性髓系白血病移植组和未移植组的无复发生存曲线.
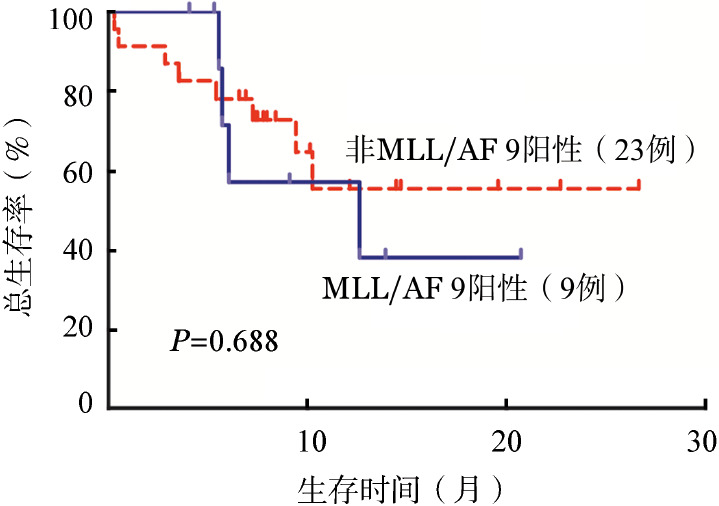
进行伙伴基因检测的患者中,MLL/AF9阳性患者9例(28.1%),7例患者获得CR;中位随访时间为6.0(4.1~20.7)个月,复发4例(57.1%);3例(33.3%,3/9)进行allo-HSCT者,2例持续CR,1例移植后因移植物抗宿主病(GVHD)死亡。非MLL/AF9阳性患者23例,19例患者获得CR;中位随访时间为7.8(0.3~26.6)个月,8例(42.1%)患者复发;14例(60.1%,14/23)行allo-HSCT者,12例持续CR,2例移植后复发死亡。MLL/AF9阳性与非MLL/AF9阳性患者1年OS率分别为38.1%和55.5%,差异无统计学意义(P=0.688)(图3)。
图3. MLL/AF9阳性与非MLL/AF9阳性急性髓系白血病患者的总生存曲线.
6.预后因素分析:通过单因素Kaplan-Meier分析影响83例患者OS的预后因素,结果见表2。年龄、起病时WBC、HGB、是否1个疗程达CR以及是否移植是影响患者OS的预后因素。将P<0.05的因素纳入Cox回归模型进行多因素分析,发现起病时WBC(RR=1.825,95% CI 1.022~3.259,P=0.042)、是否1个疗程达CR(RR=0.130,95% CI 0.063~0.267,P<0.001)、是否移植(RR=0.169,95% CI 0.079~0.362,P<0.001)为影响患者OS的独立预后因素。
表2. 单因素分析影响MLL基因重排成人急性髓系白血病患者总生存(OS)的预后因素.
| 因素 | 例数 | 中位OS时间(月) | P值 |
| 年龄 | 0.007 | ||
| ≤35岁 | 43 | 19.6 | |
| >35岁 | 40 | 10.3 | |
| 性别 | 0.923 | ||
| 男 | 41 | 19.6 | |
| 女 | 42 | 14.0 | |
| 起病时WBC | 0.006 | ||
| ≤60×109/L | 60 | 20.0 | |
| >60×109/L | 23 | 9.4 | |
| 起病时HGB | 0.074 | ||
| ≤75 g/L | 22 | 24.7 | |
| >75 g/L | 61 | 12.6 | |
| 起病时PLT | 0.103 | ||
| ≤50×109/L | 39 | 12.4 | |
| >50×109/L | 44 | 22.3 | |
| 起病时LDH | 0.467 | ||
| ≤500 U/L | 60 | 15.4 | |
| >500 U/L | 23 | 14.0 | |
| 是否1个疗程达完全缓解 | <0.001 | ||
| 是 | 66 | 20.0 | |
| 否 | 17 | 5.6 | |
| 是否移植 | <0.001 | ||
| 是 | 31 | 未达到 | |
| 否 | 52 | 9.6 |
讨论
2001版WHO造血与淋巴组织肿瘤分类中,首次将AML伴11q23/MLL异常作为一个独立亚型(归入伴重现性细胞遗传学异常的AML)提出[10]。目前已发现的MLL基因重排多达120种以上,其中近80种确定了相应的伙伴基因。Meyer等[11]报道在272例MLL基因重排成人AML患者中,MLL/AF9[t(9;11)(p22;q23)]患者71例(26.1%),MLL/PTD患者64例(23.5%),MLL/AF6[t(6;11)(q27;q23)]患者33例(12.1%),MLL/ELL[t(11;19)(q23;p13.1)]患者29例(10.7%),MLL/AF10[t(10;11)(p12;q23)]患者20例(7.4%),MLL/ENL[t(11;19)(q23;p13.3)]患者12例(4.4%),余47例患者为其他少见或未知类型的伙伴基因。虽然我中心未检测MLL/PTD,但常见MLL伙伴基因的检出率与国外文献报道类似。
目前检测MLL基因重排的常用方法有CCA、FISH以及PCR法。CCA法虽然能检出具体的易位染色体,但却有可能因细胞增殖不佳而导致分析失败,且不能发现隐匿性易位[12]。FISH方法虽然特异性、敏感性均较高,但不能鉴定与其易位的伙伴染色体。PCR法虽然可以直接检测融合基因,但由于MLL的伙伴基因多达80余种,而目前大多数医院却只能检测其中数种最常见的融合基因。在本研究中,CCA检出相应染色体易位的符合率只有54.5%,使用PCR方法检测11种最常见伙伴基因的32例患者中,有10例(31.3%)患者的伙伴基因仍未知。因此,在实际临床工作中,这三种检测MLL基因重排的方法互为补充,三者联用可以最大限度避免漏诊。
近来关于MLL基因重排白血病合并基因突变的研究显示,超过45%的患者会同时合并基因突变,最常见的基因突变为涉及RAS基因通路的突变,如NRAS、KRAS、PTPN11等[13]–[15]。这些突变对该类白血病的预后影响尚存在争议,但对白血病的治疗可能提供了一个新的治疗靶点。本研究中,虽然使用二代测序方法进行突变检测的患者数量有限,但已可看出涉及RAS基因通路突变的高发生率与文献报道类似。至于这些突变的预后意义有待于进一步积累病例及研究。
本研究中,进行allo-HSCT的患者较常规化疗患者具有更好的OS以及RFS,因此对于MLL基因重排的AML患者应在CR1期积极推荐allo-HSCT。但需要注意的是,国外文献报道,不同形式的MLL基因重排患者移植的疗效差别很大,并不是所有的患者都能通过移植改善预后。来自EBMT骨髓登记处的研究报道,t(9;11)、t(11;19)、t(10;11)和t(6;11)的患者allo-HSCT后2年的OS率分别为(64±6)%、(73±10)%、(40±13)%和(24±11)%(P<0.001)。多因素分析显示,t(10;11)和t(6;11)的MLL基因重排形式是影响患者移植后预后的独立危险因素,即使对于CR1期进行移植的患者,这种影响因素也存在[16]。由于本研究中进行伙伴基因检测的患者偏少,亚组分析结果并未显示不同MLL基因重排患者移植后的疗效差别。但鉴于国外文献报道t(10;11)和t(6;11)患者移植后2年的复发率接近50%,对于这两类患者应重视移植后复发的预防。
t(9;11)和(或)MLL/AF9阳性的AML患者因缓解率和生存期好于其他类型MLL基因重排的AML患者[17]–[18],NCCN以及ELN指南均将其列为预后中危组[19]–[20]。但在我们的研究中,t(9;11)AML患者的生存情况似乎并不理想。可能是出于“预后中危组”的考虑,该组患者移植率低,导致复发率高,1年的OS率只有38.1%,与非t(9;11)的MLL基因重排AML患者相比,生存情况差异无统计学意义,这一结论也与国内外某些文献报道类似[21]–[22]。因此,对于t(9;11)AML患者,仍应推荐在CR1期行allo-HSCT。
综上,我们的研究结果显示,MLL基因重排成人AML多见于急性单核细胞白血病,MLL/AF9是最常见的伙伴基因。患者起病时WBC、是否1个疗程达CR、是否移植为影响OS的独立预后因素。MLL基因重排AML常规化疗虽然缓解率尚可,但极易复发,allo-HSCT可以改善其预后。
Funding Statement
基金项目:国家自然科学基金(81430004);天津市科技计划(15ZXLCSY00010);天津市应用基础与前沿技术研究计划(15JCYBJC25700);协和青年科研基金(2017320022)
Fund program: National Natural Science Foundation of China (81430004); Science and Technology Project of Tianjin (15ZXLCSY00010); Tianjin Major Research Program of Application Foundation and Advanced Technology (15JCYBJC25700); Peking Union Medical College Youth Fund (2017320022)
References
- 1.Zinmin-van der Poel S, McCabe NR, Gill HJ, et al. Identification of a gene, MLL, that spans the breakpoint in 11q23 translocations associated with human leukemias[J] Proc Natl Acad Sci U S A. 1991;88(23):10735–10739. doi: 10.1073/pnas.88.23.10735. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Ibrahim S, Estey EH, Pierce S, et al. 11q23 abnormalities in patients with acute myelogenous leukemia and myelodysplastic syndrome as detected by molecular and cytogenetic analyses[J] Am J Clin Pathol. 2000;114(5):793–797. doi: 10.1309/XY44-L8TE-PWU5-62MP. [DOI] [PubMed] [Google Scholar]
- 3.Harper DP, Aplan PD. Chromosomal rearrangements leading to MLL gene fusions: clinical and biological aspects[J] Cancer Res. 2008;68(24):10024–10027. doi: 10.1158/0008-5472.CAN-08-2208. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Krivtsov AV, Armstrong SA. MLL translocations, histone modifications and leukaemia stem-cell development[J] Nat Rev Cancer. 2007;7(11):823–833. doi: 10.1038/nrc2253. [DOI] [PubMed] [Google Scholar]
- 5.Grimwade D, Hills RK, Moorman AV, et al. Refinement of cytogenetic classification in acute myeloid leukemia: determination of prognostic significance of rare recurring chromosomal abnormalities among 5876 younger adult patients treated in the United Kingdom Medical Research Council trials[J] Blood. 2010;116(3):354–365. doi: 10.1182/blood-2009-11-254441. [DOI] [PubMed] [Google Scholar]
- 6.张 之南, 沈 悌. 血液病诊断及疗效标准[M] 2版. 北京: 科学出版社; 1998. pp. 169–194. [Google Scholar]
- 7.Swerdlow SH, Campo E, Harris NL. WHO classification of tumors of haematopoietic and lymphoid tissues[M] Lyon: IARC Press; 2008. pp. 109–145. [Google Scholar]
- 8.Balgobind BV, Zwaan CM, Pieters R, et al. The heterogeneity of pediatric MLL-rearranged acute myeloid leukemia[J] Leukemia. 2011;25(8):1239–1248. doi: 10.1038/leu.2011.90. [DOI] [PubMed] [Google Scholar]
- 9.中华医学会血液学分会血栓与止血学组. 弥散性血管内凝血诊断与治疗中国专家共识(2012年版)[J] 中华血液学杂志. 2012;33(11):978–979. doi: 10.3760/cma.j.issn.0253-2727.2012.11.022. [DOI] [Google Scholar]
- 10.Jaffe ES, Harris NL, Stein H, et al. World Health Organization of tumors, pathology & genetics, tumors of haematopoietic and lymphoid tissues[M] Lyon: IARC Press; 2001. pp. 86–87. [Google Scholar]
- 11.Meyer C, Hofmann J, Burmeister T, et al. The MLL recombinome of acute leukemias in 2013[J] Leukemia. 2013;27(11):2165–2176. doi: 10.1038/leu.2013.135. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.刘 旭平, 李 承文, 秦 爽, et al. 常规细胞遗传学分析和荧光原位杂交方法检测白血病11q23/MLL基因重排[J] 中国实验血液学杂志. 2005;13(5):798–803. doi: 10.3969/j.issn.1009-2137.2005.05.014. [DOI] [PubMed] [Google Scholar]
- 13.Balgobind BV, Zwaan CM, Pieters R, et al. The heterogeneity of pediatric MLL-rearranged acute myeloid leukemia[J] Leukemia. 2011;25(8):1239–1248. doi: 10.1038/leu.2011.90. [DOI] [PubMed] [Google Scholar]
- 14.Grossmann V, Schnittger S, Poetzinger F, et al. High incidence of RAS signalling pathway mutations in MLL-rearranged acute myeloid leukemia[J] Leukemia. 2013;27(9):1933–1936. doi: 10.1038/leu.2013.90. [DOI] [PubMed] [Google Scholar]
- 15.Andersson AK, Ma J, Wang J, et al. The landscape of somatic mutations in infant MLL-rearranged acute lymphoblastic leukemias[J] Nat Genet. 2015;47(4):330–337. doi: 10.1038/ng.3230. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Pigneux A, Labopin M, Maertens J, et al. Outcome of allogeneic hematopoietic stem-cell transplantation for adult patients with AML and 11q23/MLL rearrangement (MLL-r AML)[J] Leukemia. 2015;29(12):2375–2381. doi: 10.1038/leu.2015.143. [DOI] [PubMed] [Google Scholar]
- 17.Mrózek K, Heinonen K, Lawrence D, et al. Adult patients with de novo acute myeloid leukemia and t(9; 11)(p22; q23) have a superior outcome to patients with other translocations involving band 11q23: a cancer and leukemia group B study[J] Blood. 1997;90(11):4532–4538. [PubMed] [Google Scholar]
- 18.Krauter J, Wagner K, Schäfer I, et al. Prognostic factors in adult patients up to 60 years old with acute myeloid leukemia and translocations of chromosome band 11q23: individual patient data-based meta-analysis of the German Acute Myeloid Leukemia Intergroup[J] J Clin Oncol. 2009;27(18):3000–3006. doi: 10.1200/JCO.2008.16.7981. [DOI] [PubMed] [Google Scholar]
- 19.NCCN clinical practice guidelines in oncology. Acute myeloid leukemia. Version 3.2017 [DB/OL]. http://www.nccn.org/professionals/physician_gls/pdf/aml.pdf. [DOI] [PubMed]
- 20.Döhner H, Estey E, Grimwade D, et al. Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel[J] Blood. 2017;129(4):424–447. doi: 10.1182/blood-2016-08-733196. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.洪 佳琼, 岳 春燕, 朱 阳敏, et al. 79例11q23/MLL基因重排阳性成人急性髓系白血病的临床特征及预后分析[J] 中华血液学杂志. 2016;37(8):702–704. doi: 10.3760/cma.j.issn.0253-2727.2016.08.014. [DOI] [Google Scholar]
- 22.Schoch C, Schnittger S, Klaus M, et al. AML with 11q23/MLL abnormalities as defined by the WHO classification: incidence, partner chromosomes, FAB subtype, age distribution, and prognostic impact in an unselected series of 1897 cytogenetically analyzed AML cases[J] Blood. 2003;102(7):2395–2402. doi: 10.1182/blood-2003-02-0434. [DOI] [PubMed] [Google Scholar]


