Abstract
目的
观察泊洛沙姆188(P188)对体外三维(3D)培养诱导脐血单个核细胞向巨核细胞分化的影响。
方法
将分离的脐血单个核细胞分别接种于细胞瓶和细胞培养袋中,后者采用WIGGENS摇床模拟生物反应器进行3D培养。在巨核细胞诱导培养基中加入P188体外培养14 d,观察细胞形态、计数细胞数并计算细胞存活率,采用流式细胞术观察巨核细胞表面标志表达情况。
结果
与采用传统的细胞培养瓶二维(2D)培养诱导巨核细胞相比,2D+P188培养组巨核系CD41+、CD41+/CD61+、CD61+细胞数明显增加(P值均<0.01);在3D培养中加入P188,细胞体积变大,核形状不规则,胞质含紫红色颗粒,细胞分化更接近成熟。2D培养、3D培养及3D+P188培养组组间巨核细胞表面标志CD41、CD41/CD61、CD61表达水平差异有统计学意义(P值均<0.01)。LSD-t检验两两比较显示,与2D培养相比,3D培养诱导巨核细胞存活率及细胞数均降低(P值分别为0.018、0.027),3D+P188培养组细胞数、细胞存活率与2D和3D培养组比较差异均无统计学意义(P值均>0.05)。而3D培养组巨核细胞CD41/CD61表达水平为(36.30±1.27)%,高于2D培养组的(23.95±1.34)%(P=0.002),3D+P188培养组CD41/CD61表达水平更高[(59.45±1.20)%]。
结论
3D培养有利于巨核系祖细胞诱导分化,但细胞存活率低,加入P188,细胞生存状态好,且诱导效率更高。
Keywords: 巨核细胞, 泊洛沙姆, 生物反应器, 诱导分化
Abstract
Objective
To observe the effect of poloxamer 188 (P188) on megakaryocyte cultivation and induction from cord blood mononuclear cells in order to obtain more megakaryocyte progenitor cells (MPC).
Methods
The cord blood mononuclear cells were isolated and inoculated in cell culture bag or cell culture flask respectively. The WIGGENS shaker and cell culture bags were used to mimick WAVE Bioreactor for three-dimensional (3D) cell culture, and the P188 was added to induction medium, The cells were detected for morphology, surface marker, viability, and number on day 14.
Results
In the two-dimensional (2D) culture, CD41+, CD41+/CD61+, CD61+ megakaryocytic numbers increased significantly after adding P188 (all P<0.01). And in the 3D culture of adding P188, the cell volume became larger and the nuclear shape was irregular, the cytoplasm appeared magenta granules, and the megakaryocyte cells became more mature. By 3D culture, the expression of CD41/CD61 was (36.30±1.27)% vs (23.95±1.34)%, hence the differentiation for MPC was significantly higher than that in the 2D group (P<0.01). Furthermore, adding P188 in 3D culture resulted in highest differentiation efficiency for MPC [(59.45±1.20)%]. There were no significantly differences in terms of cell viability and cell number among 3D culture containing P188, 2D and 3D culture groups (all P>0.05).
Conclusion
3D culture was beneficial for the differentiation of MPC, but the cell viability was lower than 2D group; However, the satisfied cell growth and better induction efficiency were obtained by adding of P188, which might provide a new method of megakaryocytes production for clinical application.
Keywords: Megakaryocytes, Poloxamer, Bioreactors, Differentiation
血小板具有黏附、聚集和释放的功能,参与止血、维持血管壁完整、凝血和炎症反应等过程。多种原因可导致血小板减少,血小板的控制在血液病治疗中具有重要意义[1]。造血干/祖细胞具有自我更新和多向分化潜能,能够分化为巨核细胞,可作为补充血小板的新途径,以满足临床上对血小板的迫切需求[2]–[3]。由于脐血易于获得、增殖能力强、免疫原性低等特点,可作为造血干细胞的重要组织来源[4]–[6]。泊洛沙姆188(P188)是一种非离子型表面活性剂,具有稳定细胞、修复损伤细胞膜的作用。已有研究将P188作为载体材料与抗癌药物混合制备纳米复合凝胶[7]–[9]。为了规模化生产巨核细胞,本研究我们采用脐血单个核细胞进行体外三维(3D)培养,观察P188对诱导脐血单个核细胞向巨核细胞分化的影响,现报道如下。
材料与方法
1.研究材料:足月健康新生儿脐血3份,由北京脐血库提供;StemSpan无血清培养基为加拿大Stemcell公司产品;IL-3、IL-6、干细胞生长因子(SCF)为澳大利亚Peprotech公司产品;CD41-PE、CD61-FITC、IgG1-PE、IgG1-FITC抗体均为美国Biolegend公司产品。细胞培养袋:货号KB0005,300 ml,宝日医生物技术(北京)有限公司产品;WS-350跷跷板振荡器为德国Wiggens公司产品。
2.单个核细胞分离:取新鲜脐血60~100 ml,将6%羟乙基淀粉与脐血按1∶3比例混匀,室温沉降红细胞20~30 min,吸取上清,离心。将细胞悬于10 ml生理盐水中。分别将5 ml细胞悬液缓慢加入等体积的人淋巴细胞分离液表面,22 °C下740×g离心25 min。收集单个核细胞层,生理盐水洗涤,计数细胞,接种。
3.细胞培养和诱导分化:调整脐血单个核细胞密度为2×106/ml,分成4份,每份20 ml,分别采用二维(2D)、2D+P188、3D、3D+P188进行培养。传统2D培养采用细胞瓶静止培养,3D培养为细胞培养袋摇床振荡培养,角度5 °C,转速10 r/min,10 d后转速提高至14 r/min。采用巨核系诱导培养基(含SCF、IL-3、IL-6、TPO的StemSpan无血清培养)置于37 °C、5% CO2培养箱进行诱导培养,诱导第4、7、10天三分之一补充巨核系诱导培养液,体外诱导脐血单个核细胞14 d,计数细胞并计算细胞存活率。
4.细胞形态观察:倒置显微镜观察脐血单个核细胞诱导不同时间细胞的形态变化。瑞氏吉姆萨染色,普通光学显微镜观察诱导分化的巨核细胞。
5.流式细胞术检测细胞表面标志:取诱导分化14 d细胞,生理盐水洗涤后,加入A、B两管中,A管加入抗人CD41-PE、CD61-FITC抗体,B管加入抗人IgG1-PE、IgG1-FITC抗体作为阴性对照,同时设不加抗体的空白对照,4 °C反应30 min,上流式细胞仪检测细胞表面CD41、CD61表达情况。每组设3个复管,实验重复3次。
6.统计学处理:采用SPSS 24.0软件进行统计学分析。计量资料以均数±标准差表示(符合正态分布),两组间比较采用独立样本的t检验;多组间比较采用单因素方差分析,组内两两比较采用LSD-t检验。
结果
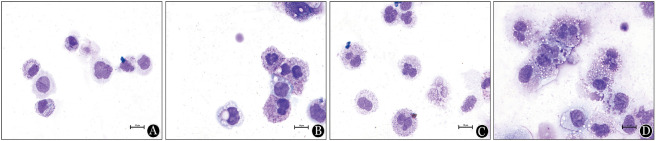
1.细胞形态:倒置显微镜观察诱导分化不同时间细胞形态。2D培养诱导4 d可见贴壁的梭形基质细胞,诱导7 d不贴壁的圆形细胞数量增多,细胞体积变大,诱导10 d细胞体积进一步增大且增殖并出现少量成团的细胞;3D培养细胞呈圆形,亦可见梭形或多角形细胞,7d以后细胞体积逐渐变大,易成团生长(图1)。诱导分化培养14 d后,2D培养大部分细胞体积小,颗粒型细胞少;2D+P188、3D和3D+P188培养,细胞体积大,核形状不规则,出现含紫红色颗粒的细胞,巨核细胞增加(图2)。
图1. 脐血单个核细胞二维(A)及三维(B)诱导培养10 d巨核系祖细胞形态(低倍).

图2. 二维(2D)、三维(3D)联合泊洛沙姆188(P188)体外培养诱导脐血单个核细胞14 d细胞形态观察(瑞氏吉姆萨染色,高倍).
A:2D培养;B:2D+P188培养;C:3D培养;D:3D+P188培养
2.细胞生物学检测:利用细胞培养瓶2D体外诱导培养14 d,观察P188对脐血单个核细胞分化为巨核细胞中的作用。与2D培养组相比,2D+P188培养组巨核系CD41+、CD41+/CD61+、CD61+细胞数明显增加(P值均<0.01)(表1)。
表1. 泊洛沙姆188(P188)在二维(2D)培养14 d诱导脐血单个核细胞向巨核细胞分化中的作用(x±s).
| 组别 | CD41+细胞数(×107) | CD41+/CD61+细胞数(×107) | CD61+细胞数(×107) |
| 2D培养 | 2.15±0.19 | 2.14±0.19 | 3.64±0.32 |
| 2D+P188培养 | 5.12±0.56 | 5.11±0.56 | 7.47±0.81 |
| t值 | −8.709 | −8.734 | −7.584 |
| P值 | 0.001 | 0.001 | 0.002 |
注:每组设3个复管,实验重复3次
为规模化制备巨核系细胞,采用细胞培养袋振荡的3D培养体系进行体外诱导巨核细胞,测定细胞存活率、细胞数以及巨核细胞表面标志CD41、CD41/CD61、CD61,结果见表2。2D培养、3D培养及3D+P188培养组细胞存活率差异有统计学意义(F=5.341,P=0.047),但组间细胞数差异无统计学意义(F=4.317,P=0.069);各组间CD41、CD41/CD61、CD61表达水平差异亦有统计学意义。采用LSD-t法进一步进行两两比较,结果显示,与2D培养相比,3D培养诱导巨核细胞存活率及细胞数均降低(P值分别为0.018、0.027),巨核系CD41、CD41/CD61、CD61表达水平均显著提高(P值均<0.01);3D+P188培养组中,其细胞数、存活率与2D和3D培养组相比差异均无统计学意义(P值均>0.05),但CD41、CD41/CD61表达水平均明显高于2D及3D培养组(P值均<0.01),晚期巨核系CD61表达水平高于2D培养组(P=0.001),但与3D培养组差异无统计学意义(P=0.102)。
表2. 二维(2D)、三维(3D)及联合泊洛沙姆188(P188)体外培养诱导脐血单个核细胞向巨核细胞分化的生物学检测(x±s).
| 组别 | 细胞存活率(%) | 细胞数(×107) | 巨核系表达水平(%) |
||
| CD41 | CD41/CD61 | CD61 | |||
| 2D培养 | 88.03±5.67 | 9.00±0.49 | 24.00±1.27 | 23.95±1.34 | 51.10±3.82 |
| 3D培养 | 79.40±0.30 | 7.23±0.90 | 36.30±1.27 | 36.30±1.27 | 80.60±2.69 |
| 3D+P188培养 | 82.43±0.25 | 8.37±0.79 | 59.45±1.20 | 59.45±1.20 | 86.95±0.64 |
| F值 | 5.341 | 4.317 | 414.923 | 400.143 | 98.887 |
| P值 | 0.047 | 0.069 | <0.001 | <0.001 | 0.002 |
注:每组设3个复管,实验重复3次
讨论
细胞治疗是近年来发展起来的生物治疗手段,其中造血干细胞移植开展最早、研究最为深入。血小板减少是临床治疗恶性血液性疾病过程中的重要并发症,目前尚无有效改善肿瘤放化疗后血小板减少的药物。临床常采用血小板输注以防止患者自发性出血,降低出血风险,保证药物疗效,但由于受发热、弥散性血管内凝血、脾功能亢进、存在HLA抗体、感染、发生免疫方面的并发症以及血小板输注无效等诸多因素的影响而限制了其临床应用,同时血小板来源不足。因此迫切需要寻找替代疗法。目前体外模拟或部分模拟体内的造血过程,诱导造血干细胞定向分化为巨核细胞已获得成功[10]–[11]。
为了获得大量的、可用于临床的巨核细胞产品,种子细胞的选择尤为重要。由于脐血含有大量不成熟、免疫功能较低的造血干细胞,且采集脐血对供者无损害,分离单个核细胞操作简便,污染率低,因此本研究我们采用脐血单个核细胞作为种子细胞。为了适用于临床应用,采用规模化生产并提高巨核细胞诱导效率是我们关注的重点。泊洛沙姆是一种非离子型高分子表面活性剂,主要作乳化剂、增溶剂、基因药物载体等药用辅料,P188是泊洛沙姆系列辅料中具有较好乳化性和安全性的一种[12]–[13]。P188能够减少细胞脆性,对细胞膜有稳定作用,在牙胚干细胞研究中可促进其成骨、成软骨和脂肪分化[14]–[15]。由此推测其在临床应用的安全性及对细胞膜保护作用有利于细胞的生存。
本研究我们在脐血单个核细胞培养诱导巨核细胞培养体系中加入P188,采用细胞培养袋振荡培养,探索3D培养过程中对巨核细胞产出的影响。结果显示,在传统的细胞培养瓶2D培养中加入P188,CD41+、CD41+/CD61+、CD61+细胞数明显高于2D培养组,表明加入P188可获得更多的巨核细胞。采用细胞培养袋波浪式摇动的3D培养与细胞瓶2D培养相比,巨核系CD41、CD41/CD61、CD61表达水平明显增加(P值均<0.01),加入P188效果更明显,表明3D培养有助于细胞表达,且P188对巨核细胞表达有明显的促进作用;但3D培养细胞存活率低于2D培养组(P<0.05),而3D+P188培养组则未见明显差异,推测是由于振荡培养产生的剪切力对细胞造成一定损伤,可尝试降低摇动转速,以获得更好的效果,而P188能够保护细胞膜,增强细胞膜稳定性,降低细胞脆性,从而使细胞保持良好的生长状态。因此,在巨核细胞培养诱导体系中加入P188,可获得更高的细胞分化效率。
Funding Statement
基金项目:国家高技术研究发展计划计划(2013AA020107);广州市健康医疗协同创新重大专项(201400000003);广东省前沿与关键技术创新专项(2015B020226001)
Fund program: National High Technology Research and Development Program of China (2013AA020107); Guangzhou Health Care and Cooperative Innovation Major Project (201400000003); Guangdong Frontier and Key Technology Innovation Project (2015B020226001)
References
- 1.杨 仁池. 从控制血小板的角度谈血液病的合理化治疗[J] 中华血液学杂志. 2012;33(9):699–700. doi: 10.3760/cma.j.issn.0253-2727.2012.09.002. [DOI] [Google Scholar]
- 2.Machlus KR, Italiano JE. The incredible journey: From megakaryocyte development to platelet formation[J] J Cell Biol. 2013;201(6):785–796. doi: 10.1083/jcb.201304054. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Bluteau O, Langlois T, Rivera-Munoz P, et al. Developmental changes in human megakaryopoiesis[J] J Thromb Haemost. 2013;11(9):1730–1741. doi: 10.1111/jth.12326. [DOI] [PubMed] [Google Scholar]
- 4.Nakahata T, Ogawa M. Hemopoietic colony-forming cells in umbilical cord blood with extensive capability to generate mono- and multipotential hemopoietic progenitors[J] J Clin Invest. 1982;70(6):1324–1328. doi: 10.1172/JCI110734. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Piacibello W, Sanavio F, Garetto L, et al. Extensive amplification and self-renewal of human primitive hematopoietic stem cells from cord blood[J] Blood. 1997;89(8):2644–2653. [PubMed] [Google Scholar]
- 6.孙 自敏. 非血缘脐血造血干细胞移植在成人应用中的对策[J] 中华血液学杂志. 2010;31(2):134–137. doi: 10.3760/cma.j.issn.0253-2727.2010.02.018. [DOI] [Google Scholar]
- 7.马 桂蕾, 张 琳华, 宋 存先. 紫杉醇聚己内酯/泊洛沙姆188载药纳米粒及其抗肿瘤活性[J] 生物医学工程与临床. 2009;13(6):481–485. doi: 10.3969/j.issn.1009-7090.2009.06.002. [DOI] [Google Scholar]
- 8.Chen YY, Wu HC, Sun JS, et al. Injectable and thermoresponsive self-assembled nanocomposite hydrogel for long-term anticancer drug delivery[J] Langmuir. 2013;29(11):3721–3729. doi: 10.1021/la400268p. [DOI] [PubMed] [Google Scholar]
- 9.Zhao L, Du J, Duan Y, et al. Curcumin loaded mixed micelles composed of Pluronic P123 and F68: preparation, optimization and in vitro characterization[J] Colloids Surf B Biointerfaces. 2012;97:101–108. doi: 10.1016/j.colsurfb.2012.04.017. [DOI] [PubMed] [Google Scholar]
- 10.Hatami J, Ferreira FC, da Silva CL, et al. Computational modeling of megakaryocytic differentiation of umbilical cord blood-derived stem/progenitor cells[J] Computers & Chemical Engineering. 2016;94(2):117–127. doi: 10.1016/j.compchemeng.2016.07.027. [DOI] [Google Scholar]
- 11.陈 琳, 谢 小燕, 刘 大庆, et al. 脐血巨核祖细胞体外诱导扩增的研究[J] 中华血液学杂志. 2014;35(3):187–190. doi: 10.3760/cma.j.issn.0253-2727.2014.03.002. [DOI] [PubMed] [Google Scholar]
- 12.王 猛, 张 钧寿, 周 建平. 注射用辅料泊洛沙姆188[J] 药学与临床研究. 2007;15(1):10–13. doi: 10.3969/j.issn.1673-7806.2007.01.003. [DOI] [Google Scholar]
- 13.Bae WK, Park MS, Lee JH, et al. Docetaxel-loaded thermoresponsive conjugated linoleic acid-incorporated poloxamer hydrogel for the suppression of peritoneal metastasis of gastric cancer[J] Biomaterials. 2013;34(4):1433–1441. doi: 10.1016/j.biomaterials.2012.10.077. [DOI] [PubMed] [Google Scholar]
- 14.Doğan A, Yalvaç ME, Şahin F, et al. Differentiation of human stem cells is promoted by amphiphilic pluronic block copolymers[J] Int J Nanomedicine. 2012;7:4849–4860. doi: 10.2147/IJN.S31949. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Baek EJ, Kim HS, Kim JH, et al. Stroma-free mass production of clinical-grade red blood cells (RBCs) by using poloxamer 188 as an RBC survival enhancer[J] Transfusion. 2009;49(11):2285–2295. doi: 10.1111/j.1537-2995.2009.02303.x. [DOI] [PubMed] [Google Scholar]