Abstract
目的
探讨接受IA10[去甲氧柔红霉素(IDA)10 mg·m−2·d−1×3 d联合阿糖胞苷(Ara-C)100 mg·m−2·d−1×7 d]作为诱导方案且未接受异基因造血干细胞移植(allo-HSCT)的成人急性髓系白血病(AML)患者的预后影响因素。
方法
回顾2008年1月至2016年2月收治的接受IA10作为诱导化疗方案、获得形态学无白血病状态(MLFS)后未接受allo-HSCT的198例AML(不包括急性早幼粒细胞白血病)连续病例,分析诊断时特征、首次获得MLFS时血细胞恢复程度、首次获得MLFS时和巩固1个疗程后微小残留病(MRD)水平对预后的影响。
结果
198例患者中,男96例(48.5%),中位年龄42(18~62)岁。SWOG分组:低危45例(22.7%),中危104例(52.5%),高危24例(12.1%),危险度未知25例(12.6%)。FLT3-ITD突变阳性28例(14.1%)。完全缓解(CR,MLFS伴ANC≥1×109/L和PLT≥100×109/L)168例(84.8%),CRp(MLFS伴PLT未恢复)16例(8.1%),CRi(MLFS伴ANC和PLT均未恢复)14例(7.1%)。131例(66.2%)存活患者中位随访时间15(1~70)个月,2年累积复发率(CIR)、无病生存(DFS)、总生存(OS)率分别为45.2%、46.9%、62.9%,中位复发、DFS、OS时间分别为34、20、37个月。在所有获得MLFS的患者中进行多因素分析,FLT3-ITD突变阳性和CRi是影响患者CIR、DFS、OS的共同不利因素;SWOG危险度为高危是影响患者CIR和DFS的共同不利因素;单体核型是影响患者OS的独立危险因素。分析接受巩固治疗≥1个疗程的患者,FLT3-ITD突变阳性和SWOG危险度为高危是影响患者CIR、DFS、OS的共同不利因素;外周血原始细胞≥0.50和巩固治疗1个疗程后MRD阳性[FCM和(或)WT1 mRNA阳性]是影响患者CIR和DFS的共同不利因素;CRi是影响患者DFS和OS的共同不利因素。
结论
对于接受IA10作为诱导方案且获得MLFS后未接受allo-HSCT的初治成人AML患者,初诊时不良的遗传学特征和CRi是影响患者总体预后的不利因素。此外,外周血原始细胞比例高、单体核型和巩固治疗1个疗程后MRD阳性也与预后不良相关。
Keywords: 白血病,髓样,急性, 去甲氧柔红霉素, 预后
Abstract
Objective
To explore outcomes in adult with de novo acute myeloid leukemia (AML) received IA10 (10 mg/m2 d1–3 idarubicin plus cytarabine 100 mg/m2 d1–7) regimen as induction chemotherapy.
Methods
From January 2008 to February 2016, data of consecutive newly-diagnosed AML (non-M3) adults treated with IA10 who achieved morphologic leukemia-free state (MLFS) but not accepted allogeneic hematopoietic stem cell transplantation (allo-HSCT) were assessed retrospectively.
Results
A total of 198 patients were included in this study with 96 (48.5%) male and a median age of 42 years old (range, 18–62 years old). Using the SWOG cytogenetic classification, 45 (22.7%), 104 (52.5%), 24 (12.1%) and 25 (12.6%) patients belonged to favorable, intermediate, unfavorable and unknown categories, respectively. 6 (3.0%) patients had monosomal karyotype, and 28 (14.1%) positive FLT3-ITD mutation. A complete remission (CR, defined as MLFS with ANC≥1×109/L and PLT≥100×109/L) achieved in 168 (84.8%) patients, a CRp (defined as MLFS with incomplete PLT recovery) in 16 (8.1%) and a CRi (defined as MLFS with incomplete ANC and PLT recovery) in 14 (7.1%). With a median follow-up period of 15 months (range, 1 to 70 months) in survivors, the probabilities of cumulative incident of relapse (CIR), disease free survival (DFS) and overall survival (OS) rates at 2-year were 45.2%, 46.9% and 62.9%, respectively; the median durations of relapse, DFS and OS were 34, 20 and 37 months respectively. At the time of achieving first MLFS, multivariate analyses showed that positive FLT3-ITD mutation and CRi were common adverse factors affecting CIR, DFS and OS; unfavorable-risk of SWOG criteria was an adverse factor affecting CIR and DFS; monosomal karyotype was associated with shorter OS. After first consolidation therapy, FLT3-ITD mutation positive and unfavorable-risk of SWOG criteria had negatively impact on CIR, DFS and OS; peripheral blasts ≥0.50 and positive MRD (defined as RQ-PCR WT1 mRNA ≥0.6% or any level of abnormal blast population detected by flow cytometry) after first consolidation therapy were common adverse factors affecting CIR and DFS; CRi was an adverse factor affecting DFS and OS.
Conclusion
In adult with de novo AML received IA10 regimen as induction regimen, unfavorable molecular markers or cytogenetics at diagnosis and CRi independently predicted poor outcome. In addition, a higher percentage of peripheral blasts, monosomal karyotype and positive MRD after first consolidation therapy had negatively impact on outcomes.
Keywords: Leukemia, myeloid, acute; Idarubicin; Prognosis
去甲氧柔红霉素(IDA)联合阿糖胞苷(Ara-C)(IA“3+7”)方案是公认的初发急性髓系白血病(AML)[不包括急性早幼粒细胞白血病(APL)]患者的诱导治疗方案之一。目前,国内外指南推荐IDA剂量为12 mg·m−2·d−1×3 d,Ara-C剂量为100~200 mg·m−2·d−1×7 d[1]–[3],完全缓解(CR)率为60%~80%。国内报道中,IDA剂量为6~12 mg·m−2·d−1×3 d。既往我所研究结果显示,初发成人AML患者IDA 10 mg IA方案组第1个疗程CR率为78.9%,显著高于IDA 8 mg IA方案组,而且,IDA剂量是影响第1个疗程缓解率的独立因素之一[4]。本研究中我们回顾分析了以IA10(IDA 10 mg·m−2·d−1×3 d联合Ara-C 100 mg·m−2·d−1×7 d)作为诱导治疗方案且未接受异基因造血干细胞移植(allo-HSCT)的成人AML患者的治疗结果,探讨影响预后的因素。
病例与方法
一、病例
2008年1月至2016年2月,我所收治的初治成人AML(不包括APL)连续病例748例中,382例(51.4%)以IA10作为诱导化疗方案,其中7例(1.8%)早期死亡,2例(0.5%)无法评估。373例可评估的患者中,198例(53.1%)获得形态学无白血病状态(MLFS)后未接受allo-HSCT患者纳入研究。
二、白血病相关检查方法
所有初诊患者均进行细胞形态学、免疫学、遗传学、分子生物学(MICM)检查[5]。
1.细胞遗传学分析:骨髓标本经G显带法分析染色体核型,根据《人类细胞遗传学国际命名体制(ISCN,1995)》进行核型分析。单体核型定义为在一个克隆内存在两个常染色体单体或一个常染色体单体伴有其他常染色体结构异常。参考SWOG标准[6]进行危险度预后分组。
2.免疫学分析:采用8色免疫标记法流式细胞术检测分析骨髓细胞免疫表型。结合抗体采用CD34-FITC/CD13-PE/CD117-PerCP/CD33-APC/HLA-DR-APC-CY7/CD45-V500,CD38/CD7/CD56抗体用于初步诊断为AML的病例[7]。
3.分子生物学检测:分子生物学检测包括NPM1、FLT3-ITD基因突变,AML1-ETO、CBFβ-MYH11、PML-RARα、混合谱系白血病(MLL)相关融合基因和WT1 mRNA。WT1 mRNA水平采用RQ-PCR检测[8],内参照基因选用ABL基因。WT1 mRNA水平(%)=(WT1拷贝数/ABL拷贝数)×100%。
三、治疗方案
1.诱导治疗:本研究中,所有患者均使用IA10作为首次诱导化疗方案。具体方案为:IDA 10 mg/m2第1~3天,Ara-C 100 mg/m2第1~7天。获得部分缓解(PR)患者采用原方案再诱导,未缓解者换用其他方案。
2.获得MLFS后治疗:以原方案巩固后,给予3~4个疗程高剂量Ara-C(2 g/m2,每12 h 1次,第1~3天),之后接受DA、MA、HAA或AE等方案化疗,巩固治疗至少6个疗程。
四、MRD检测
在每次化疗后监测MRD。根据患者初诊时免疫表型确定白血病相关免疫表型(LAIP),采用流式细胞术(FCM)检测LAIP和(或)以RQ-PCR评估WT1 mRNA水平作为MRD的监测指标。FCM检测敏感度为10−4,本所骨髓标本WT1 mRNA正常值为<0.6%。
五、随访
主要采用门诊随访及电话随访方式,随访截止日期为2016年3月31日。
六、评估指标
早期死亡:在疗效评估前死亡。无法评估:在疗效评估前失访。疗效评估标准参见文献[9]–[10]。MLFS:白血病的症状和体征消失,白细胞分类中无白血病细胞,骨髓中原始粒细胞<0.050,无髓外白血病。根据中性粒细胞绝对计数(ANC)和PLT将MLFS分为:①完全缓解(CR),定义为MLFS伴ANC和PLT均恢复(ANC≥1.0×109/L且PLT≥100×109/L);②CRp,定义为MLFS伴PLT<100×109/L;③CRi,定义为MLFS伴ANC<1.0×109/L且PLT<100×109/L。无病生存(DFS)时间:获得MLFS患者,从MLFS之日至复发或MLFS状态下死亡或随访截止的时间。总生存(OS)时间:从开始治疗至死亡或随访截止的时间。评估累积复发率(CIR)、DFS和OS。
七、统计学处理
连续变量通过ROC曲线确定影响复发和生存的界值。ROC曲线不能确定界值者采用中位数作为界值。影响CIR、DFS和OS的因素采用Kaplan-Meier生存分析法并进行Log-rank检验,P<0.2的因素进入Cox回归模型进行多因素分析。P<0.05为差异有统计学意义。CIR采用竞争风险模型R软件分析。其余分析采用SPSS 17.0软件进行统计。
结果
1.患者发病时的疾病特征:198例获得MLFS后未接受allo-HSCT的患者中,男96例(48.5%),中位年龄42(18~62)岁。SWOG分组:低危45例(22.7%),中危104例(52.5%),高危24例(12.1%),危险度未知25例(12.6%)。FAB分型:M0 1例(0.5%)、M1 4例(2.0%)、M2 136例(68.7%)、M4 34例(17.2%)、M5 21例(10.6%)、M6 2例(1.0%)。单体核型6例(3.0%),初诊时WT1 mRNA≥0.6%的患者181例(91.4%),FLT3-ITD突变阳性28例(14.1%),NPM1突变阳性51例(25.8%)。CR 168例(84.8%),CRp 16例(8.1%),CRi 14例(7.1%)。
2.复发和生存:131例(66.2%)存活患者中位随访时间15(1~70)个月,74例复发,67例死亡,其中58例(86.6%)死于复发。2年CIR、DFS、OS率分别为45.2%、46.9%、62.9%,中位复发、DFS、OS时间分别为34、20、37个月。
3.MRD水平:198例患者中,在首次获得MLFS时190例(96.0%)进行了FCM检测,129例(67.9%)阴性;164例(82.8%)进行了WT1 mRNA检测,102例(62.2%)阴性。159例(80.3%)同时进行了FCM和WT1 mRNA检测,3例(1.5%)FCM和WT1 mRNA均未测。
首次获得MLFS后,16例未进行后续治疗,其中11例在巩固治疗前复发,1例死于肺部感染,4例失访。巩固治疗1个疗程后,182例患者中161例(88.5%)进行了FCM检测,131例(81.4%)阴性;133例(73.1%)进行了WT1 mRNA检测,99例(74.4%)阴性。129例(70.9%)同时进行了FCM和WT1 mRNA检测,17例(9.3%)FCM和WT1 mRNA均未测。
4.预后影响因素:以复发或死亡为终点,根据ROC曲线或中位数确定患者初诊时连续变量界值如下:年龄为40岁,WBC、HGB、PLT分别为10×109/L、100 g/L、50×109/L,外周血和骨髓原始细胞比例分别为0.50、0.60,初诊时WT1 mRNA水平为23.0%。
前期研究显示,FCM和WT1 mRNA水平均为影响患者预后的因素,而且,FCM和WT1 mRNA均为阴性的患者预后最佳,FCM或WT1 mRNA阳性与两者均为阳性的患者预后差异无统计学意义[11]。由于并非所有患者均评估了FCM和WT1 mRNA水平,因此MRD水平分为四组:FCM和WT1 mRNA均阴性,只检测FCM或WT1 mRNA且为阴性,FCM和(或)WT1 mRNA阳性,FCM和WT1 mRNA均未检测。
单因素分析患者发病时特征、首次诱导治疗后是否获得MLFS、获MLFS时血细胞计数恢复情况、获MLFS时和巩固1个疗程后MRD水平对复发和生存的影响,结果见表1。
表1. 影响接受IA10作为诱导方案且获得MLFS后未接受allo-HSCT的初治成人AML患者预后的单因素分析.
| 因素 | 例数 | 累积复发 |
无病生存 |
总生存 |
|||
| 率(%) | P值 | 率(%) | P值 | 率(%) | P值 | ||
| 外周原始细胞 | 0.037 | 0.089 | 0.830 | ||||
| ≥0.50 | 105 | 55.4 | 37.2 | 57.4 | |||
| <0.50 | 93 | 37.8 | 55.4 | 68.0 | |||
| WBC | 0.031 | 0.196 | 0.597 | ||||
| ≥10×109/L | 126 | 51.3 | 42.7 | 59.8 | |||
| <10×109/L | 72 | 38.0 | 52.5 | 65.2 | |||
| HGB | 0.393 | 0.745 | 0.152 | ||||
| <100 g/L | 134 | 43.8 | 46.4 | 58.9 | |||
| ≥100 g/L | 64 | 55.9 | 44.1 | 72.8 | |||
| SWOG分组 | 0.072 | 0.043 | 0.413 | ||||
| 未知 | 25 | 85.1 | 9.2 | 32.9 | |||
| 高危 | 24 | 82.0 | 10.7 | 27.4 | |||
| 中危 | 104 | 42.0 | 53.9 | 68.9 | |||
| 低危 | 45 | 36.3 | 59.0 | 69.8 | |||
| 单体核型 | 0.230 | 0.096 | 0.070 | ||||
| 是 | 6 | 100.0 | 0 | 2.0 | |||
| 否 | 192 | 45.4 | 47.7 | 63.0 | |||
| FLT3-ITD突变 | <0.001 | <0.001 | 0.004 | ||||
| 阳性 | 28 | 87.5 | 11.8 | 27.8 | |||
| 阴性 | 169 | 39.2 | 52.5 | 67.2 | |||
| NPM1突变 | 0.004 | 0.021 | 0.214 | ||||
| 阴性(NPM1−FLT3−/+) | 158 | 49.9 | 42.2 | 60.4 | |||
| 阳性(NPM1+FLT3−) | 39 | 34.8 | 62.4 | 66.2 | |||
| 首次诱导化疗后是否获得MLFS | 0.040 | 0.020 | 0.609 | ||||
| 否 | 51 | 63.1 | 31.2 | 67.6 | |||
| 是 | 147 | 41.1 | 51.1 | 60.8 | |||
| 获MLFS时血细胞恢复程度 | <0.001 | <0.001 | <0.001 | ||||
| CRi | 14 | 48.6 | 16.1 | 31.2 | |||
| CRp | 16 | 43.5 | 53.0 | 69.3 | |||
| CR | 168 | 45.3 | 48.6 | 65.2 | |||
| 获得MLFS时MRD | 0.158 | 0.052 | 0.222 | ||||
| FCM和(或)WT1 mRNA阳性 | 91 | 52.0 | 40.5 | 58.9 | |||
| 未检测 | 3 | 33.3 | 66.7 | 66.7 | |||
| 只检测FCM或WT1且为阴性 | 28 | 45.7 | 49.0 | 65.8 | |||
| FCM和WT1 mRNA均阴性 | 76 | 45.8 | 47.6 | 62.9 | |||
| 巩固1个疗程后MRD | 0.007 | 0.003 | 0.070 | ||||
| FCM和(或)WT1 mRNA阳性 | 50 | 61.9 | 33.2 | 55.5 | |||
| 未检测 | 17 | 36.2 | 49.3 | 65.2 | |||
| 只检测FCM或WT1且为阴性 | 31 | 36.8 | 60.2 | 70.5 | |||
| FCM和WT1 mRNA均阴性 | 84 | 42.4 | 48.2 | 62.6 | |||
注:IA10:去甲氧柔红霉素10 mg·m−2·d−1×3 d联合阿糖胞苷100 mg·m−2·d−1×7 d;MLFS:形态学无白血病状态;allo-HSCT:异基因造血干细胞移植;AML:急性髓系白血病;CRi:MLFS伴ANC<1.0×109/L且PLT<100×109/L;CRp:MLFS伴PLT<100×109/L;CR:MLFS伴ANC和PLT均恢复;MRD:微小残留病;FCM:流式细胞术
198例患者中,1例患者初诊时未检测FLT3-ITD突变,1例未检测NPM1突变,所以在196例具有完整基线指标且获得MLFS的患者中进行多因素分析,结果显示:FLT3-ITD阳性和CRi是影响患者CIR、DFS和OS的共同不利因素;SWOG危险度分层高危是影响患者CIR和DFS的共同不利因素;单体核型是影响患者OS的独立危险因素(表2)。
表2. 影响接受IA10作为诱导方案且获得MLFS后未接受allo-HSCT的初治成人AML患者预后的多因素分析.
| 因素 | 所有患者(196例) |
巩固≥1个疗程患者(180例) |
||||||||||
| 累积复发 |
无病生存 |
总生存 |
累积复发 |
无病生存 |
总生存 |
|||||||
| HR (95%CI) | P值 | HR (95%CI) | P值 | HR (95%CI) | P值 | HR (95%CI) | P值 | HR (95%CI) | P值 | HR (95%CI) | P值 | |
| 外周原始细胞≥0.50 | 1.8 (1.0~3.2) | 0.033 | 1.7 (1.0~2.7) | 0.042 | ||||||||
| FLT3-ITD突变阳性 | 3.4 (2.0~5.8) | <0.001 | 2.8 (1.7~4.8) | <0.001 | 2.7 (1.5~4.8) | 0.001 | 3.0 (1.6~5.4) | <0.001 | 2.7 (1.5~4.7) | 0.001 | 2.2 (1.1~4.1) | 0.017 |
| 单体核型 | 3.6 (1.1~11.7) | 0.034 | ||||||||||
| SWOG危险度分层 | 0.011 | 0.002 | 0.050 | 0.015 | 0.010 | |||||||
| 高危 | 2.5 (1.1~5.3) | 0.022 | 2.5 (1.3~5.1) | 0.008 | 2.4 (1.0~5.7) | 0.051 | 2.4 (1.1~5.3) | 0.025 | 3.7 (1.5~9.1) | 0.005 | ||
| 未知 | 1.5 (0.7~3.4) | 0.292 | 1.5 (0.7~3.0) | 0.290 | 1.7 (0.7~4.2) | 0.248 | 1.5 (0.7~3.3) | 0.347 | 1.9 (0.7~4.8) | 0.182 | ||
| 中危 | 0.8 (0.4~1.6) | 0.577 | 0.8 (0.5~1.5) | 0.511 | 0.9 (0.4~1.8) | 0.779 | 0.9 (0.5~1.6) | 0.638 | 1.2 (0.6~2.4) | 0.678 | ||
| 低危(参照) | ||||||||||||
| MLFS时血细胞计数 | 0.018 | <0.001 | <0.001 | 0.006 | 0.008 | |||||||
| CRi | 3.5 (1.4~8.5) | 0.006 | 5.5(2.7~10.9) | <0.001 | 4.2 (2.0~8.7) | <0.001 | 3.9 (1.5~9.9) | 0.005 | 4.2(1.5~11.6) | 0.005 | ||
| CRp | 0.8 (0.3~1.9) | 0.635 | 0.8 (0.3~1.7) | 0.501 | 0.7 (0.3~2.0) | 0.548 | 0.5 (0.2~1.3) | 0.169 | 0.4 (0.1~1.6) | 0.194 | ||
| CR(参照) | ||||||||||||
| 巩固1个疗程后MRD | 0.062 | 0.016 | ||||||||||
| FCM和(或)WT1阳性 | 2.1 (1.2~3.9) | 0.013 | 2.3 (1.3~3.9) | 0.003 | ||||||||
| 未检测 | 1.0 (0.3~2.8) | 0.928 | 1.4 (0.6~3.4) | 0.487 | ||||||||
| 只检测FCM或WT1且为阴性 | 1.19 (0.5~2.3) | 0.820 | 0.9 (0.5~1.8) | 0.818 | ||||||||
| FCM和WT1均阴性(参照) | ||||||||||||
注:IA10:去甲氧柔红霉素10 mg·m−2·d−1×3 d联合阿糖胞苷100 mg·m−2·d−1×7 d;MLFS:形态学无白血病状态;allo-HSCT:异基因造血干细胞移植;AML:急性髓系白血病;CRi:MLFS伴ANC<1.0×109/L且PLT<100×109/L;CRp:MLFS伴PLT<100×109/L;CR:MLFS伴ANC和PLT均恢复;MRD:微小残留病;FCM:流式细胞术
在180例接受≥1个疗程巩固治疗的患者中进行多因素分析,纳入巩固治疗1个疗程后MRD水平,结果显示:FLT3-ITD阳性和SWOG危险度分层高危是影响患者CIR、DFS和OS的共同不利因素;外周原始细胞≥0.50和巩固治疗1个疗程后MRD阳性(FCM和/或WT1 mRNA阳性)是影响CIR和DFS的共同不利因素;CRi是影响DFS和OS的共同不利因素(表2)。
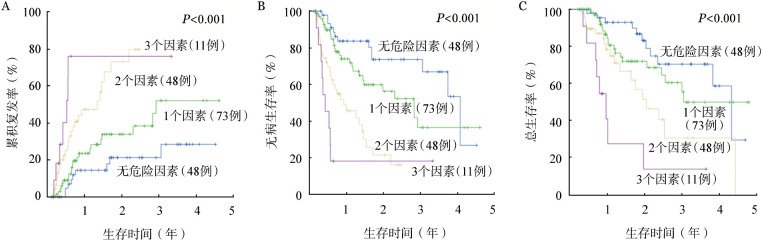
5.具有不同危险因素患者的预后:根据影响CIR、DFS或OS的5个危险因素(外周原始细胞≥0.50、FLT3-ITD突变阳性、SWOG危险度分层高危、CRi和巩固1个疗程后MRD阳性)将180例患者分为4组:无危险因素组(48例,26.7%)、1个危险因素组(73例,40.6%)、2个危险因素组(48例,26.7%)、3个危险因素组(11例,6.1%)。4组患者2年CIR分别为21.2%、33.8%、73.1%、76.1%,2年DFS率分别为73.7%、56.4%、21.5%、18.2%,2年OS率分别为83.1%、72.0%、51.5%、13.6%,中位复发时间分别为未达和35、16、6个月,中位DFS时间分别为49、34、11、5个月,中位OS时间分别为52、37、25、12个月,差异均具有统计学意义(P值均<0.001)(图1)。无危险因素组和1个危险因素组CIR、DFS、OS率差异均无统计学意义,2个危险因素组和3个危险因素组CIR和DFS率差异无统计学意义。
图1. 具有不同危险因素患者的累积复发(A)、无病生存(B)和总生存(C)曲线.
注:危险因素包括外周原始细胞≥0.50、FLT3-ITD 突变阳性、SWOG危险度分层高危、CRi和巩固1个疗程后微小残留病阳性
因AML伴NPM1+FLT3-ITD−患者为SWOG危险度非预后良好型,38例NPM1突变阳性(NPM1+ FLT3-ITD−)患者的分布如下:无危险因素组12例(31.6%)、1个危险因素组22例(57.9%)、2个危险因素组4例(10.5%)、3个危险因素组0例(P=0.002)。绝大多数AML伴NPM1+FLT3-ITD−患者处于≤1个危险因素组。
讨论
我们的研究结果显示,接受IA10作为诱导治疗方案且未接受allo-HSCT的AML连续病例,FLT3-ITD突变阳性和CRi是影响患者CIR、DFS、OS的共同不利因素;SWOG危险分层高危是影响CIR和DFS的共同不利因素;单体核型是影响OS的独立危险因素。当延长追踪时间,考虑巩固1个疗程MRD水平时,FLT3-ITD突变阳性、SWOG危险分层高危和CRi仍是影响患者预后的独立危险因素,巩固治疗1个疗程后MRD阳性(FCM和/或WT1 mRNA阳性)、外周原始细胞≥0.50是影响CIR和DFS的共同不利因素。
尽管“3+7”方案为是国内外公认的初治AML诱导化疗的首选方案,IDA的推荐剂量为12 mg·m−2·d−1×3 d[1]–[2],由于中国社会经济因素的限制,我所和国内多数中心采用的是10 mg·m−2·d−1×3 d[4],取得了与文献报道IDA 12 mg IA方案相似的缓解率。
目前,定量检测MRD常用的方法包括FCM检测LAIP[12]–[17]和RQ-PCR检测特异性融合基因或泛白血病基因的表达,如WT1 mRNA[18]–[21]等,已有报道同时使用FCM和WT1 mRNA水平评估MRD[22]–[24]。因本研究为回顾性研究,并非所有患者均定期以FCM或WT1 mRNA检测了MRD,所以我们联合FCM和WT1 mRNA评估MRD,以提高评估率和检测敏感率。迄今,到底哪一个时间点和哪个界值用于MRD的评估最有预后价值并无定论。本研究中,因巩固治疗2个疗程后检测MRD的病例相对较少,所以我们只评估了首次获得MLFS时和巩固治疗1个疗程后的MRD水平。国内外多项研究证实,CR时MRD是影响预后的因素[12]–[14],[16],[18],[20],[23],但巩固疗程中或巩固治疗结束后MRD水平的预后价值更为重要[12]–[13],[15],[24]。本研究得出相似的结论:巩固1个疗程后MRD水平是影响复发和生存的重要因素,而非首次获得MLFS时。既往我所对使用不同方案的352例初治AML患者进行研究,发现MLFS时血常规恢复程度影响复发和生存,MRD并不影响预后[25];而对于292例非预后良好型患者,MLFS时MRD和血常规恢复程度均有预后意义[11]。因我们发现与减低剂量的化疗方案相比,标准剂量方案(如IDA 10 mg)有利于获得高比例、深程度早期治疗反应[26],所以此次我们统一方案,研究包含预后良好型在内的所有危险度患者,进一步确认了MLFS时血常规恢复程度的预后意义,同时发现巩固治疗1个疗程后的MRD水平影响复发和生存。提示,研究对象和时间点不同,MRD意义不同,应寻找特定治疗方案下的MRD评估时间点。此外,SWOG危险度为高危、FLT3-ITD突变阳性、单体核型和外周原始细胞比例高与预后不良相关,本研究再次证实了这些结论。
本研究有以下缺陷:为回顾性研究,并非所有获得MLFS的患者均规律监测了MRD水平,患者选择移植或化疗是非随机的,患者常因经济问题、身体状况差、缓解后短时间内复发失去移植机会而选择化疗,有可能影响了预后。
总之,对于接受IA10作为诱导治疗方案且获得MLFS后未接受allo-HSCT的初治成人AML患者,初诊时不良的分子细胞遗传学特征和CRi是影响患者总体预后的不利因素。此外,外周血原始细胞比例高、单体核型和巩固治疗1个疗程后MRD阳性也与预后不良相关。
References
- 1.Döhner H, Estey E, Grimwade D, et al. Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel[J] Blood. 2017;129(4):424–447. doi: 10.1182/blood-2016-08-733196. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.NCCN clinical practice guidelines in oncology:acute myeloid leukemia (Version 1.2017) https://www.nccn.org/professionals/physician_gls/pdf/aml.pdf. [DOI] [PubMed]
- 3.中华医学会血液学分会白血病淋巴瘤学组. 成人急性髓系白血病(非急性早幼粒细胞白血病)中国诊疗指南(2017年版)[J] 中华血液学杂志. 2017;38(3):177–182. doi: 10.3760/cma.j.issn.0253-2727.2017.03.001. [DOI] [Google Scholar]
- 4.张 圆圆, 杨 申淼, 王 婧, et al. 去甲氧柔红霉素10和8 mg/m2联合阿糖胞苷治疗初发急性髓系白血病的比较性研究[J] 中华血液学杂志. 2015;36(3):225–229. doi: 10.3760/cma.j.issn.0253-2727.2015.03.011. [DOI] [Google Scholar]
- 5.张 之南, 沈 悌. 血液病诊断及疗效标准[M] 3版. 北京: 科学出版社; 2007. pp. 131–134. [Google Scholar]
- 6.Slovak ML, Kopecky KJ, Cassileth PA, et al. Karyotypic analysis predicts outcome of preremission and postremission therapy in adult acute myeloid leukemia: a Southwest Oncology Group/Eastern Cooperative Oncology Group study[J] Blood. 2000;96(13):4075–4083. [PubMed] [Google Scholar]
- 7.Zhao XS, Qin YZ, Liu YR, et al. The impact of minimal residual disease prior to unmanipulated haploidentical hematopoietic stem cell transplantation in patients with acute myeloid leukemia in complete remission[J] Leuk Lymphoma. 2017;58(5):1135–1143. doi: 10.1080/10428194.2016.1239264. [DOI] [PubMed] [Google Scholar]
- 8.Ruan GR, Li JL, Qin YZ, et al. Nucleophosmin mutations in Chinese adults with acute myelogenous leukemia[J] Ann Hematol. 2009;88(2):159–166. doi: 10.1007/s00277-008-0591-8. [DOI] [PubMed] [Google Scholar]
- 9.中华医学会血液学分会. 成人急性髓系白血病(非急性早幼粒细胞白血病)中国诊疗指南(2011年版)[J] 中华血液学杂志. 2011;32(11):804–807. doi: 10.3760/cma.j.issn.0253-2727.2011.11.021. [DOI] [Google Scholar]
- 10.Cheson BD, Bennett JM, Kopecky KJ, et al. Revised recommendations of the International Working Group for diagnosis, standardization of response criteria, treatment outcomes, and reporting standards for therapeutic trials in acute myeloid leukemia[J] J Clin Oncol. 2003;21(24):4642–4649. doi: 10.1200/JCO.2003.04.036. [DOI] [PubMed] [Google Scholar]
- 11.任 欣, 赵 婷, 王 婧, et al. 微小残留病在成人急性髓系白血病非预后良好型患者中的预后价值[J] 中华血液学杂志. 2017;38(7):578–585. doi: 10.3760/cma.j.issn.0253-2727.2017.07.005. [DOI] [Google Scholar]
- 12.Venditti A, Buccisano F, Del PG, et al. Level of minimal residual disease after consolidation therapy predicts outcome in acute myeloid leukemia[J] Blood. 2000;96(12):3948–3952. [PubMed] [Google Scholar]
- 13.Buccisano F, Maurillo L, Gattei V, et al. The kinetics of reduction of minimal residual disease impacts on duration of response and survival of patients with acute myeloid leukemia[J] Leukemia. 2006;20(10):1783–1789. doi: 10.1038/sj.leu.2404313. [DOI] [PubMed] [Google Scholar]
- 14.San MJF, Vidriales MB, López-Berges C, et al. Early immunophenotypical evaluation of minimal residual disease in acute myeloid leukemia identifies different patient risk groups and may contribute to postinduction treatment stratification[J] Blood. 2001;98(6):1746–1751. doi: 10.1182/blood.v98.6.1746. [DOI] [PubMed] [Google Scholar]
- 15.Buccisano F, Maurillo L, Spagnoli A, et al. Cytogenetic and molecular diagnostic characterization combined to postconsolidation minimal residual disease assessment by flow cytometry improves risk stratification in adult acute myeloid leukemia[J] Blood. 2010;116(13):2295–2303. doi: 10.1182/blood-2009-12-258178. [DOI] [PubMed] [Google Scholar]
- 16.刘 艳荣, 王 亚哲, 陈 珊珊, et al. 610例急性髓系白血病免疫表型和白血病相关免疫表型分析[J] 中华血液学杂志. 2007;28(11):731–736. doi: 10.3760/j.issn:0253-2727.2007.11.003. [DOI] [PubMed] [Google Scholar]
- 17.Chen X, Xie H, Wood BL, et al. Relation of clinical response and minimal residual disease and their prognostic impact on outcome in acute myeloid leukemia[J] J Clin Oncol. 2015;33(11):1258–1264. doi: 10.1200/JCO.2014.58.3518. [DOI] [PubMed] [Google Scholar]
- 18.Cilloni D, Renneville A, Hermitte F, et al. Real-time quantitative polymerase chain reaction detection of minimal residual disease by standardized WT1 assay to enhance risk stratification in acute myeloid leukemia: a European LeukemiaNet study[J] J Clin Oncol. 2009;27(31):5195–5201. doi: 10.1200/JCO.2009.22.4865. [DOI] [PubMed] [Google Scholar]
- 19.Cilloni D, Gottardi E, De Micheli D, et al. Quantitative assessment of WT1 expression by real time quantitative PCR may be a useful tool for monitoring minimal residual disease in acute leukemia patients[J] Leukemia. 2002;16(10):2115–2121. doi: 10.1038/sj.leu.2402675. [DOI] [PubMed] [Google Scholar]
- 20.Weisser M, Kern W, Rauhut S, et al. Prognostic impact of RT-PCR-based quantification of WT1 gene expression during MRD monitoring of acute myeloid leukemia[J] Leukemia. 2005;19(8):1416–1423. doi: 10.1038/sj.leu.2403809. [DOI] [PubMed] [Google Scholar]
- 21.秦 亚溱, 阮 国瑞, 李 金兰, et al. 定量检测WT1基因表达水平在急性髓系白血病微量残留病监测中的意义[J] 中华血液学杂志. 2005;26(11):649–652. doi: 10.3760/j:issn:0253-2727.2005.11.003. [DOI] [PubMed] [Google Scholar]
- 22.Zhao XS, Yan CH, Liu DH, et al. Combined use of WT1 and flow cytometry monitoring can promote sensitivity of predicting relapse after allogeneic HSCT without affecting specificity[J] Ann Hematol. 2013;92(8):1111–1119. doi: 10.1007/s00277-013-1733-1. [DOI] [PubMed] [Google Scholar]
- 23.Marani C, Clavio M, Grasso R, et al. Integrating post induction WT1 quantification and flow-cytometry results improves minimal residual disease stratification in acute myeloid leukemia[J] Leuk Res. 2013;37(12):1606–1611. doi: 10.1016/j.leukres.2013.07.005. [DOI] [PubMed] [Google Scholar]
- 24.Malagola M, Skert C, Borlenghi E, et al. Postremission sequential monitoring of minimal residual disease by WT1 Q-PCR and multiparametric flow cytometry assessment predicts relapse and may help to address risk-adapted therapy in acute myeloid leukemia patients[J] Cancer Med. 2016;5(2):265–274. doi: 10.1002/cam4.593. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.任 欣, 赵 婷, 王 婧, et al. 首次获得骨髓无白血病状态时血细胞恢复程度在成人急性髓系白血病患者中的预后意义[J] 中华血液学杂志. 2017;38(3):185–191. doi: 10.3760/cma.j.issn.0253-2727.2017.03.003. [DOI] [Google Scholar]
- 26.任 欣, 赵 婷, 王 婧, et al. 成人急性髓系白血病患者获得早期治疗反应的影响因素分析[J] 中华血液学杂志. 2017;38(10):871–877. [Google Scholar]