伴FGFR1异常的髓系和淋巴系肿瘤又称8p11骨髓增殖综合征(EMS),是一种罕见的侵袭性血液肿瘤,其致病机制主要为定位于染色体8p11的FGFR1基因发生断裂重排,与不同的对手基因形成融合,最终导致FGFR1的酪氨酸激酶异常激活,从而使正常造血细胞发生恶性转化[1]。2008年,8p11/FGFR1重排被作为特异性分类标志纳入WHO髓系与淋巴组织肿瘤分型。目前,国内外报道的FGFR1对手基因共有15种,最常见的为位于13q12的ZNF198,而MYO18A非常罕见,国内尚未检索到文献报道,国外仅报道1例,且无分子克隆研究[2]。现我们报告1例t(8;17)(p11;q23)/MYO18A-FGFR1阳性EMS患者,并对其受累基因进行全长克隆及鉴定。
病例资料
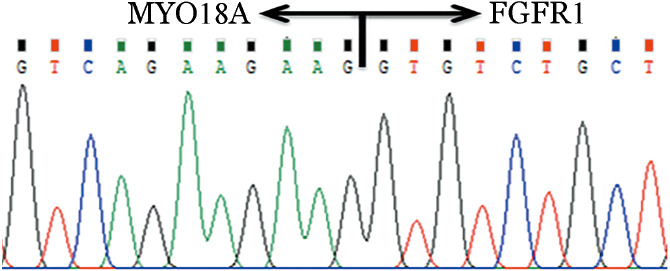
患者,男,52岁。2015年7月因乏力不适至当地医院查血常规示WBC 62.0×109/L、HGB 13.9 g/L、PLT 411×109/L。后多次复查血常规均提示白细胞明显升高,遂就诊于我院。查体:浅表淋巴结未触及肿大;扁桃体无肿大;胸骨无明显压痛,肝肋缘下未及,脾肋缘下3横指,质地中等。骨髓象:增生明显活跃,粒系占0.670,形态大致正常,嗜酸性粒细胞8%,嗜碱性粒细胞4%;红系占0.210,比例及形态大致正常,淋巴细胞占0.075,全片巨核细胞>100个,血小板大、中、小簇均可见。染色体核型:t(8;17)(p11;q24)。多重PCR未检测到29种常见白血病融合基因;FISH示FGFR1基因重排阳性。二代测序联合DNA-PCR未检测到常见51种肿瘤基因突变;转录组测序提示t(8;17)(p11;q23)相应受累基因分别为位于8p11上的FGFR1及位于17q24上的MYO18A;应用MY018A及FGFR1特异性引物(上游引物:5′-AGATAGTGAGGAGAGTCAGCG-3′,下游引物:5′-GTTGTAGCAGTATTCCAGCCC-3′)进行RT-PCR扩增,可见一清晰条带,经测序证实为MYO18A-FGFR1融合基因产物(图1),其断裂位点分别位于MYO18A的31号外显子和FGFR1的10号外显子(图2)。综合临床表现及实验室检查,按照2008年WHO髓系与淋巴系肿瘤分型标准,诊断为“考虑伴有FGFR1重排EMS”。患者拒绝静脉化疗,予干扰素皮下注射(300万U,每周3次),并根据白细胞水平不规律口服羟基脲,WBC(5~11)×109/L,但脾脏回缩不明显。2016年9月出现间断齿龈出血,复查骨髓象后诊断为“急性淋巴细胞白血病”。予以VP方案(长春地辛+泼尼松)诱导化疗,化疗结束2周复查骨髓未缓解。患者因病程中出现肺部感染,未再进一步诱导,于白血病转化3个月后死于疾病进展。
图1. RT-PCR检测MYO18A-FGFR1融合基因.

M:DNA Marker;1:正常阴性对照;2:MYO18A-FGFR1融合基因特异性产物(1 048 bp)
图2. 测序证实MYO18A和FGFR1的融合位点分别位于MYO18A的31号外显子及FGFR1的10号外显子.
为进一步研究MYO18A-FGFR1融合基因功能,我们以患者cDNA为模板,用含有重叠序列的8对引物(表1),通过KOD高保真酶(日本TOYOBO公司产品)进行全长扩增,得到的8个片段共同为模板,得到的产物在15 g/L的琼脂糖上进行电泳,观察到330、828、1 121、1 245、1 223、1 184、826和596 bp的目的片段(图3),与预期的片段大小一致。以8个片段的混合物为模板,以最外侧引物进行PCR扩增,产物在15 g/L琼脂糖凝胶上观察得到6 006 bp的目的条带(图4),TA克隆并克隆测序分析该融合基因保留了MYO18A的PDZ结构域和FGFR1的酪氨酸激酶结构域(图5)。
表1. MYO18A-FGFR1融合基因分段扩增引物的碱基位置、序列、退火温度及片段大小.
| 引物名称(碱基位置) | 序列(5′→3′) | 退火温度(°C) | 片段大小(bp) |
| F1(1) | 上游引物:ATGTTTAACCTAATGAAGAAAGACAAGGACA | 60 | 330 |
| R1(330) | 下游引物:CTCCTCACCCTTGAGGTCATCG | 59 | |
| F2(225) | 上游引物:CCTGCACCTGACTGACATTGACT | 60 | 828 |
| R2(1052) | 下游引物:TTCTCCGTCTCATTCCAGGCCTC | 61 | |
| F3(918) | 上游引物:GGTGCAGCCCATTCCAGAG | 59 | 1 121 |
| R3(2038) | 下游引物:CTTTGGTGGCTCCCGCA | 59 | |
| F4(1835) | 上游引物:AGCTCCACCTCAACCACTTGG | 60 | 1 245 |
| R4(3079) | 下游引物:GCTTCATCTGGATGCACAGTGACT | 60 | |
| F5(2904) | 上游引物:AATCATCAGCAACCTGTTTCTGGG | 59 | 1 223 |
| R5(4126) | 下游引物:CATACTTCAGCCGCCACTCG | 59 | |
| F6(4028) | 上游引物:TGGAAATGGAGGTGATGGAGGC | 60 | 1 184 |
| R6(5211) | 下游引物:ATACAAGGGACCATCCTGCGTG | 60 | |
| F7(4766) | 上游引物:AGATGGAGAGTCGGGATGAGGAG | 60 | 826 |
| R7(5591) | 下游引物:GACCACACATCACTCTGGTGGG | 60 | |
| F8(5411) | 上游引物:CAGCCAGGAATGTCCTGGTGA | 60 | 596 |
| R8(6006) | 下游引物:TCAGCGGCGTTTGAGTCC | 59 |
图3. 重叠PCR扩增后电泳结果.

M:DNA Marker;1~8为分别为引物F1R1、F2R2、F3R3、F4R4、F5R5、F6R6、F7R7、F8R8扩增产物
图4. MYO18A-FGFR1全长融合基因特异性产物.

M:DNA Marker;1:外侧引物扩增的MYO18A-FGFR1全长融合基因特异性产物(6 006 bp):2:对照
图5. 经克隆测序及比对分析的MYO18A-FGFR1融合蛋白结构示意图.
1:lys-rich;2:Interactin with acting;3:SH3-like;4:IQ
讨论及文献复习
EMS是一种罕见的、具有高的白血病转化率的侵袭性血液肿瘤,平均白血病转化时间仅为4.2个月[1],可见于任何年龄。常见临床表现包括乏力(35%)、盗汗(28%)、消瘦(18%)及发热(13%),分别有48%、15%的患者伴随全身淋巴结、局部淋巴结肿大,但纵隔淋巴结肿大并不常见;分别有58%、32%的患者伴有脾肿大、肝肿大,约28%的患者同时伴有肝脾肿大;主要实验室特征为:白细胞计数明显增高、骨髓中髓系高度增生、嗜酸细胞增多等[1]。
不同的FGFR1对手基因致EMS的临床表现不同,如伴t(8;13)(p11;q12)/ZNF198-FGFRl阳性患者常表现为淋巴结肿大和T淋巴母细胞淋巴瘤[7];伴t(8;22)(p11;ql1)/BCR-FGFRl阳性患者常呈现出白细胞增多、中性粒细胞增多、嗜碱性粒细胞增多等慢性髓性白血病(CML)样表现[3];伴t(8;9)(p11;q34)/CEP110-FGFRl阳性患者则常表现为皮疹、扁桃体肿大及单核细胞增多等[8]。伴t(8;17)(p11;q23)/MYO18A-FGFR1阳性的EMS患者目前国内外仅检索到1例文献报道,该患者为74岁老年女性,有类似CML病史两年,主要临床表现为反复发热、盗汗及3个月内体重减轻5 kg,骨髓形态学提示单核细胞、嗜酸细胞及嗜碱细胞增多[2]。本例患者慢性期病史1年,临床表现与既往报道类似,并在诊断1年后转化为急性淋巴细胞白血病。
既往研究显示,EMS的发病与FGFR1基因密切相关。FGFR1基因编码的相关蛋白是受体酪氨酸激酶家族成员之一,有3个免疫球蛋白样结构域,一个跨膜区和一个胞内酪氨酸激酶结构域,在非激活状态时以单体形式存在[9]。当FGFR1蛋白胞外受体与相应配体结合后可发生构象变化并诱发二聚化,从而激活下游信号传导途径,在调节细胞增殖、凋亡、迁移和细胞表型转化等方面发挥重要作用[10]。当FGFR1基因发生断裂重排时,保留胞内的酪氨酸激酶结构域,并与伙伴基因(如ZNF198)相互易位形成新的融合基因,干扰了FGFR1正常功能并使伙伴基因的正常功能丧失[11]。将FGFR1相关融合基因如ZNF198-FGFR1转染至Ba/F3细胞后,该细胞产生IL-3非依赖性生长,并使小鼠移植模型产生EMS临床表型[12]。
MYO18A基因定位于染色体17q24,约109 kb,其N段有PDZ结构域,该结构域能使蛋白之间相互作用,C段富含Coiled coil结构域,可介导蛋白间的相互作用,参与细胞的多项重要生命活动[13]。既往研究表明,MYO18A基因有多种剪切形式,在多种组织中广泛表达。MYO18A可与高尔基体分泌面膜上的GOLPH3结合,从而形成MYO18A/GOLPH3复合物,该复合物可促进高尔基体分泌面膜上分泌的液泡向细胞膜的转运,有证据表明MYO18A/GOLPH3复合物可增加细胞对DNA损伤的修复作用[14]。最近研究显示,MYO18A可通过结合高尔基体分泌面膜上的GOLPH3促进肿瘤的发生[15]。以上研究发现为肿瘤靶向治疗提供了新的分子靶点。本研究对MYO18A-FGFR1融合基因进行全长克隆及结构分析发现,MYO18A保留了PDZ结构域,FGFR1保留了酪氨酸激酶结构域,但二者之间的交互性作用机制尚在进一步研究中。近年来,高通量DNA深度测序已开始应用于血液肿瘤的多基因检测,但因EMS发病率低,关于FGFR1以外的协同基因事件尚未见大宗病例报道。Strati等[16]对7例伴FGFR1重排阳性的EMS患者进行深测序发现,78%(5/7)的患者携带RUNX1基因点突变,是最常见的伴随基因突变,但该组病例中无MYO18A-FGFR1阳性患者。本研究综合检测常见51种肿瘤基因突变均阴性,未见伴随基因事件。
目前,EMS尚无有效、统一的治疗方案,针对FGFR1的酪氨酸激酶抑制剂是目前研究的热点。Chase等[17]报道酪氨酸激酶抑制剂TKI258,通过抑制融合基因FGFR1激酶和下游通路活性,有效抑制转染ZNFl98-FGFR1和BCR-FGFR1的Ba/F3细胞增殖、也可抑制FGFR1OP2-FGFR1阳性的EMS细胞株KG-1的增殖和生长并促进其凋亡。Landberg等[18]对伴有BCR/FGF1阳性的EMS患者原代细胞进行药物抑制性研究,结果显示,ponatinib、TKI258及dasatinib均显示出较好的抑制效应。Verstovsek等[19]报道了1例伴CEP110-FGFR1阳性50岁男性患者,在口服FGFR1酪氨酸激酶抑制剂INCB054828后达完全分子学缓解,且耐受性良好。我们既往研究显示,小分子酪氨酸激酶抑制剂BGJ398能有效抑制伴FGFR1OP2-FGFR1阳性的KG-1细胞增殖并诱导其凋亡,抑制FGFR1蛋白表达并下调Bcl-2水平[20],但尚无EMS患者的临床用药报道。异基因造血干细胞移植仍是目前唯一有潜在治愈可能的治疗手段。
总之,t(8;17)(p11;q24)阳性的EMS患者同样具有侵袭性临床过程,其相关融合基因MYO18A-FGFR1在EMS中非常罕见,基因克隆分析保留了MYO18A及FGFR1主要功能域,其临床表现类似CML,易被误诊误治,应及时行分子遗传学检测以便尽早诊断。
Funding Statement
基金项目:国家自然科学基金青年基金(81500103);江苏省自然科学基金面上项目(BK-20151230);常州市高层次卫生人才培养工程(2016CZLJ027)
References
- 1.Jackson CC, Medeiros LJ, Miranda RN. 8p11 myeloproliferative syndrome: a review[J] Hum Pathol. 2010;41(4):461–476. doi: 10.1016/j.humpath.2009.11.003. [DOI] [PubMed] [Google Scholar]
- 2.Walz C, Chase A, Schoch C, et al. The t(8;17)(p11;q23) in the 8p11 myeloproliferative syndrome fuses MYO18A to FGFR1[J] Leukemia. 2005;19(6):1005–1009. doi: 10.1038/sj.leu.2403712. [DOI] [PubMed] [Google Scholar]
- 3.晁 红颖, 陈 苏宁, 张 日, et al. 伴FGFR1重排骨髓增殖性肿瘤一例报告并文献复习[J] 中华血液学杂志. 2014;35(10):951–953. doi: 10.3760/cma.j.issn.0253-2727.2014.10.018. [DOI] [PubMed] [Google Scholar]
- 4.李 志刚, 吴 敏媛, 赵 玮, et al. 多重RT-PCR方法同时检测29种白血病融合基因[J] 中华血液学杂志. 2003;24(5):256–258. doi: 10.3760/j:issn:0253-2727.2003.05.010. [DOI] [PubMed] [Google Scholar]
- 5.周 峰, 何 金媛, 章 艳, et al. 伴MYST3-CREBBP融合基因阳性的继发性白血病一例并文献复习[J] 白血病·淋巴瘤. 2017;26(10):623–625. doi: 10.3760/cma.j.issn.1009-9921.2017.10.011. [DOI] [Google Scholar]
- 6.周 峰, 陈 苏宁, 晁 红颖, et al. 伴ins(13;8)(q12;p11p23)8p11骨髓增殖综合征一例报告及其受累基因的研究[J] 中华血液学杂志. 2015;36(4):291–296. doi: 10.3760/cma.j.issn.0253-2727.2015.04.006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Matsumoto K, Morita K, Takada S, et al. A chronic myelogenous leukemia-like myeloproliferative disorder accompanied by T-cell lymphoblastic lymphoma with chromosome translocation t(8;13)(p11;q12): a Japanese case[J] Int J Hematol. 1999;70(4):278–282. [PubMed] [Google Scholar]
- 8.晁 红颖, 陈 苏宁, 周 民, et al. 伴CEP110-FGFR1融合基因阳性的8p11骨髓增殖综合征一例[J] 中华医学遗传学杂志. 2015;32(5):679–682. doi: 10.3760/cma.j.issn.1003-9406.2015.05.015. [DOI] [PubMed] [Google Scholar]
- 9.Katoh M, Nakagama H. FGF receptors: cancer biology and therapeutics[J] Med Res Rev. 2014;34(2):280–300. doi: 10.1002/med.21288. [DOI] [PubMed] [Google Scholar]
- 10.Macdonald D, Reiter A, Cross NC. The 8p11 myeloproliferative syndrome: a distinct clinical entity caused by constitutive activation of FGFR1[J] Acta Haematol. 2002;107(2):101–107. doi: 10.1159/000046639. [DOI] [PubMed] [Google Scholar]
- 11.Xiao S, McCarthy JG, Aster JC, et al. ZNF198-FGFR1 transforming activity depends on a novel proline-rich ZNF198 oligomerization domain[J] Blood. 2000;96(2):699–704. [PubMed] [Google Scholar]
- 12.Chen J, Deangelo DJ, Kutok JL, et al. PKC412 inhibits the zinc finger 198-fibroblast growth factor receptor 1 fusion tyrosine kinase and is active in treatment of stem cell myeloproliferative disorder[J] Proc Natl Acad Sci U S A. 2004;101(40):14479–14484. doi: 10.1073/pnas.0404438101. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Buschman MD, Field SJ. MYO18A: An unusual myosin[J] Adv Biol Regul. 2018;67:84–92. doi: 10.1016/j.jbior.2017.09.005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Farber-Katz SE, Dippold HC, Buschman MD, et al. DNA damage triggers Golgi dispersal via DNA-PK and GOLPH3[J] Cell. 2014;156(3):413–427. doi: 10.1016/j.cell.2013.12.023. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Makowska KA, Hughes RE, White KJ, et al. Specific myosins control actin organization, cell morphology, and migration in prostate cancer cells[J] Cell Rep. 2015;13(10):2118–2125. doi: 10.1016/j.celrep.2015.11.012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Strati P, Tang G, Duose DY, et al. Myeloid/lymphoid neoplasms with FGFR1 rearrangement[J] Leuk Lymphoma. 2017;9:1–5. doi: 10.1080/10428194.2017.1397663. [DOI] [PubMed] [Google Scholar]
- 17.Chase A, Grand FH, Cross NC. Activity of TKI258 against primary cells and cell lines with FGFR1 fusion genes associated with the 8p11 myeloproliferative syndrome[J] Blood. 2007;110:3729–3734. doi: 10.1182/blood-2007-02-074286. [DOI] [PubMed] [Google Scholar]
- 18.Landberg N, Dreimane A, Rissler M, et al. Primary cells in BCR/FGFR1-positive 8p11 myeloproliferative syndrome are sensitive to dovitinib, ponatinib, and dasatinib[J] Eur J Haematol. 2017;99(5):442–448. doi: 10.1111/ejh.12957. [DOI] [PubMed] [Google Scholar]
- 19.Verstovsek S, Subbiah V, Masarova L, et al. Treatment of the myeloid/lymphoid neoplasm with FGFR1 rearrangement with FGFR1 inhibitor[J] Ann Oncol. 2018;29(8):1880–1882. doi: 10.1093/annonc/mdy173. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.姜 玉, 晁 红颖, 张 修文, et al. 新酪氨酸激酶抑制剂BGJ398对白血病细胞株KG-1细胞的抑制效应研究[J] 中华血液学杂志. 2018;39(2):143–147. doi: 10.3760/cma.j.issn.0253-2727.2018.02.013. [DOI] [Google Scholar]



