Abstract
目的
分析成人早期前体T细胞急性淋巴细胞白血病(ETP-ALL)的临床、实验室特征及预后情况。
方法
回顾性分析2009年1月至2017年3月确诊的13例ETP-ALL患者的临床和实验室资料,并与非ETP的T-ALL(Non-ETP ALL)患者进行比较。
结果
75例T-ALL患者中,符合ETP-ALL诊断标准患者13例(17.3%),其中男10例(76.9%),女3例(23.1%),诊断时中位年龄为35(15~49)岁。与62例Non-ETP ALL患者相比,ETP-ALL患者的WBC、LDH、外周血原始细胞计数较低,胸腺肿物发生率更低,PLT水平更高。ETP-ALL与Non-ETP ALL患者1个疗程CR率分别为33.3%和90.1%,差异具有统计学意义(χ2=26.521,P<0.001)。两组患者的中位总生存(OS)时间分别为11.33(95%CI 0~28.46)和25.69(95% CI 11.98~39.41)个月,3年OS率分别为41.7%和40.7%(P=0.699)。两组患者的中位无事件生存(EFS)时间分别为1.51(95% CI 1.23~1.79)和21.36(95% CI 4.67~38.04)个月,3年EFS率分别为16.7%和39.5%(P=0.002),3年无复发生存(RFS)率分别为53.0%和52.0%(P=0.797)。多因素分析显示是否为ETP-ALL并不是影响T-ALL总体预后的独立因素,而是否合并中枢神经系统白血病、是否行异基因造血干细胞移植为T-ALL的独立预后因素。
结论
该研究为国内首次关于成人ETP-ALL特征以及预后分析的报道。在成人T-ALL患者中,ETP-ALL占17.3%,具有起病时肿瘤负荷不高,但1个疗程化疗CR率较低的临床特点。异基因造血干细胞移植有可能克服ETP-ALL的不良预后。
Keywords: 白血病,T淋巴细胞,急性, 预后, 成人
Abstract
Objective
To analyze the clinical, laboratory characteristics and prognosis of adult early T-cell precursor acute lymphoblastic leukemia (ETP-ALL).
Methods
The clinical data of 13 adult ETP-ALL patients from January 2009 to March 2017 were retrospectively analyzed and compared with non-ETP ALL patients.
Results
13 ETP-ALL patients (17.3%) were identified in 75 adult T-ALL patients, the median age of the patients was 35 years old (15 to 49 years) and 10 patients were male (76.9%). ETP-ALL patients had lower WBC count, LDH level, blasts in peripheral blood, lower incidence of thymic mass and higher PLT count compared to non-ETP ALL patients. The CR rate after one course induction chemotherapy for ETP-ALL and non-ETP ALL patients was 33.3% and 90.1%, respectively (χ2=26.521, P<0.001). The median overall survival (OS) was 11.33 (95%CI 0–28.46) and 25.69 (95%CI 11.98–39.41) months, respectively. The 3-year OS was 41.7% and 40.7%, respectively (P=0.699). The median event free survival (EFS) was 1.51 (95%CI 1.23–1.79) and 21.36 (95%CI 4.67–38.04) months, respectively. The 3-year EFS was 16.7% and 39.5%, respectively (P=0.002). The 3-year relapse free survival (RFS) was 53.0% and 52.0%, respectively (P=0.797). Multivariate analysis revealed that CNSL and allo-HSCT were independent risk factors affecting OS of T-ALL and ETP-ALL didn't affect the prognosis of T-ALL.
Conclusion
To our knowledge, this study is the first report on characteristics and prognosis of adult ETP-ALL patients in China. At total of 13 T-ALL patients (17.3%) were classified as having ETP-ALL. These patients had a lower leukemia burden and lower CR rate after one course induction compared to non-ETP ALL patients. Allo-HSCT can improve the prognosis of ETP-ALL.
Keywords: Leukemia, T lymphocyte, acute; Prognosis; Adult
早期前体T细胞急性淋巴细胞白血病(early T-cell precursor acute lymphoblastic leukemia,ETP-ALL)是2016年WHO淋巴造血组织肿瘤分类提出的一种T细胞急性淋巴细胞白血病(T-ALL)建议分类亚型[1]。ETP细胞起源于造血干细胞,是新由骨髓迁移到胸腺的细胞亚群,因此保留了一定的多向分化潜能[2]。ETP-ALL的诊断主要依靠免疫表型,其免疫表型的特点为T细胞分化抗原表达有限,而保留了干细胞以及髓系抗原,具体要求如下:cCD3(+),CD7(+),CD1a(−),CD8(−),CD34、CD117、HLA-DR、CD13、CD33、CD11b、CD65等干细胞或髓系抗原有一个或多个阳性,CD5通常阴性,即使阳性,幼稚细胞的表达率也<75%[3]。通过基因谱分析发现,ETP细胞与造血干细胞和髓系祖细胞具有一些共同点,即急性髓系白血病(AML)相关的基因突变,如FLT3、NRAS/KRAS、DNMT3A、IDH1、IDH2等在ETP-ALL患者中的发生率较高,而NOTCH1、CDKN1/2等常见于T-ALL的突变在ETP-ALL患者中的发生率较低[4]–[6]。文献报道,ETP-ALL占儿童T-ALL的12.0%~16.2%,在成人T-ALL中的发生率更高,可达22.1%[7],预后差于其他类型的T-ALL[2],[8]。国内尚未见成人ETP-ALL的文献报道,我们对我中心2009年1月至2017年3月收治的ETP-ALL患者进行了回顾性分析,并与非ETP的T-ALL(Non-ETP ALL)患者进行比较,现将其特征和预后报道如下。
病例与方法
1.病例:2009年1月至2017年3月我中心共收治初诊T-ALL患者75例。所有患者均按照WHO 2016标准[9]确诊,同时参照欧洲白血病免疫学分型协作组(EGIL)诊断标准除外急性混合表型白血病[10]。根据免疫表型进一步划分,符合ETP-ALL诊断标准[1]的患者共13例。
2.免疫表型分析:取患者骨髓或外周血(肝素抗凝)5 ml,溶解红细胞,常规进行相关抗体标记,PBS洗涤后上机(FACS Calibur多色流式细胞仪为美国BD公司产品)检测。
3.细胞遗传学分析:取患者骨髓(肝素抗凝)5 ml,常规24 h的短期培养后,进行R显带分析染色体核型。异常核型依据《人类细胞遗传学国际命名体制(ISCN2013)》进行描述。
4.基因突变检测:48例患者采用超高多重PCR外显子富集技术进行高通量基因测序,检测112种血液系统肿瘤相关基因突变,测序的平均深度为800×。
5.治疗:所有患者均接受VDCLP(长春新碱、柔红霉素、环磷酰胺、左旋门冬酰胺酶、泼尼松)方案的诱导化疗。获得完全缓解(CR)后给予强化巩固化疗,方案包括CAMLV(环磷酰胺、阿糖胞苷、巯嘌呤、左旋门冬酰胺酶、长春新碱)、大剂量甲氨蝶呤(HD-MTX)、MA(米托蒽醌、阿糖胞苷)、COATD(环磷酰胺、长春新碱、阿糖胞苷、依托泊苷、泼尼松)、VDLD(长春新碱、柔红霉素、左旋门冬酰胺酶、地塞米松)等共12个周期的巩固化疗。若1个疗程未达CR,可选择FA(氟达拉滨、阿糖胞苷)、CAMLV、HD-MTX-A(大剂量甲氨蝶呤联合大剂量阿糖胞苷)、VMCP(长春新碱、米托蒽醌、环磷酰胺、泼尼松)等挽救治疗方案。有移植条件者行异基因造血干细胞移植(allo-HSCT),无移植条件者化疗结束以后给予VMMP(长春新碱、甲氨蝶呤、巯嘌呤、泼尼松)方案维持治疗。采用三联药物(阿糖胞苷+甲氨蝶呤+地塞米松)鞘内注射预防中枢神经系统白血病(CNSL)。
6.随访:通过电话或病案查询方式进行随访,所有患者随访至2017年8月31日,中位随访时间为16.4(1.0~99.0)个月。总生存(OS)时间指从确诊之日起至随访截止日止,死亡患者则计算至死亡日止。无事件生存(EFS)时间指从确诊之日起至治疗失败、复发或死亡日止。无复发生存(RFS)时间指从CR之日起至复发或任何原因引起的死亡日止。
7.统计学处理:采用SPSS 17.0软件进行统计学分析。计量资料以中位数表示,采用秩和检验比较,计数资料组间比较应用卡方检验。OS、EFS、PFS的分析采用Kaplan-Meier法进行Log-rank检验并绘制生存曲线。单因素分析P<0.05的因素进入Cox回归模型进行多因素分析,以确定独立预后因素。P值采用双侧分析,P<0.05为差异有统计学意义。
结果
1.临床特征:75例T-ALL患者中,符合ETP-ALL诊断标准患者13例(17.3%)。其中,男10例(76.9%),女3例(23.1%),诊断时中位年龄为35(15~49)岁,中位WBC 5.58(1.11~237.27)×109/L,中位HGB 96(58~136)g/L,中位PLT 92(2~305)×109/L,中位LDH 162(75~542)U/L。与62例Non-ETP ALL患者相比,ETP-ALL患者WBC、LDH、外周血原始细胞计数以及胸腺肿物发生率更低,PLT水平更高,而两组患者在年龄、性别分布、HGB、骨髓原始细胞比例、移植情况等方面差异无统计学意义(表1)。13例ETP-ALL患者的免疫表型见表2。
表1. 早期前体T细胞急性淋巴细胞白血病(ETP-ALL)与Non-ETP ALL患者临床特征比较.
| 临床特征 | ETP-ALL(13例) | Non-ETP ALL(62例) | 统计量 | P值 |
| 年龄[岁,M(范围)] | 35(15~49) | 25.5(15~60) | 0.539 | 0.590 |
| 性别[例(%)] | 0.102 | 0.749 | ||
| 男 | 10(76.9) | 45(72.6) | ||
| 女 | 3(23.1) | 17(27.4) | ||
| WBC[×109/L,M(范围)] | 5.58(1.11~237.27) | 55.51(1.01~706.40) | 2.953 | 0.003 |
| HGB[g/L,M(范围)] | 96(58~136) | 105(40~159) | 1.449 | 0.147 |
| PLT[×109/L,M(范围)] | 92(2~305) | 41(8~371) | 2.863 | 0.004 |
| LDH[U/L,M(范围)] | 162(75~542) | 988(93~7470) | 4.609 | <0.001 |
| 纵隔肿物[例(%)] | 2(15.4) | 31(50.0) | 5.226 | 0.022 |
| 外周血原始细胞[×109/L,M(范围)] | 2.14(0~42.18) | 38.45(0~593.38) | 3.608 | <0.001 |
| 骨髓原始细胞[M(范围)] | 0.800(0.505~0.980) | 0.865(0.215~0.995) | 0.945 | 0.344 |
| 移植情况[例(%)] | 0.030 | 0.863 | ||
| 是 | 6(46.2) | 27(43.5) | ||
| 否 | 7(53.8) | 35(56.5) |
表2. 13例早期前体T细胞急性淋巴细胞白血病患者的免疫表型.
| 例号 | 免疫表型 |
| 1 | 表达CD34、CD117、CD7、TDT、CD2、cCD3、CD99,弱表达HLA-DR、CD38、CD33、CD13、CD123 |
| 2 | 表达CD34、CD38、CD7、CD13、CD123、CD56、CD10、cCD3、CD99,部分表达CD33、cCD79a |
| 3 | 强表达CD7,表达CD34、CD38、CD56、CD99,部分表达CD33、CD13、CD123、cCD3,弱表达CD117 |
| 4 | 表达CD34、CD38、CD7、CD33、CD123、CD56、CD99,弱表达D117、HLA-DR、CD13、cCD79a、cCD3、TDT |
| 5 | 表达CD7、CD13、CD123、CD99、TDT、cCD3、CD9、CD2,部分表达CD34、HLA-DR、CD38、CD36,弱表达CD117、CD15 |
| 6 | 表达CD34、CD38、CD33、CD7、CD123、CD99、cCD3,部分表达TDT |
| 7 | 表达CD7、cCD3、CD38、CD13、CD10、CD99,部分表达CD34、CD33、TDT、CD2,弱表达cCD79a |
| 8 | 表达CD7、CD38、CD11b、cCD3、CD99,弱表达CD34 |
| 9 | 表达CD7、CD38、CD2、cCD3,部分表达CD117、CD10、CD13 |
| 10 | 表达CD7、CD10、CD38、CD79a、CD13、CD56、CD2、cCD3,弱表达CD15、CD11b |
| 11 | 表达CD117、CD34、CD7、CD38、CD11b、CD33、CD56、cCD3 |
| 12 | 表达HLA-DR、CD117、CD7、CD38、CD2、cCD3、TDT,部分表达CD34、CD13 |
| 13 | 表达CD117、CD7、cCD3、CD38、CD11b,部分表达CD33 |
2.基因突变特征:48例T-ALL患者采用二代测序方法检测112种血液系统肿瘤相关基因突变,45例(93.8%)患者合并48种突变,每例患者合并突变中位数3(1~7)个。6例ETP-ALL患者进行了二代测序分析。常见基因突变在ETP-ALL与Non-ETP ALL患者中的发生情况见表3。
表3. 常见基因突变在早期前体T细胞急性淋巴细胞白血病(ETP-ALL)与Non-ETP ALL患者中的发生情况(%).
| 基因突变 | ETP-ALL(13例) | Non-ETP ALL(62例) |
| FLT3-ITD | 33.3 | 0 |
| NRAS | 33.3 | 9.5 |
| GATA | 33.3 | 2.4 |
| RNUNX1 | 16.7 | 0 |
| NOTCH1 | 16.7 | 50 |
| NOTCH2 | 0 | 16.7 |
| FBXW7 | 0 | 26.2 |
3.CR率:13例ETP-ALL患者中,有1例诊断后回当地治疗,其余12例均接受了系统治疗,1个疗程CR率为33.3%(4/12)。62例Non-ETP ALL患者中,有1例诊断后回当地治疗,其余61例均接受了系统治疗,1个疗程CR率为90.1%(55/61)。两组患者的1个疗程CR率差异有统计学意义(χ2=26.521,P<0.001)。1个疗程未缓解的ETP-ALL患者经2~4个周期化疗大部分最终获得CR,总的缓解率为91.7%(11/12)。
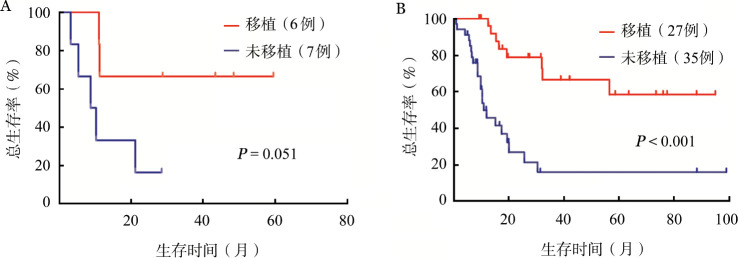
4.疗效分析:ETP-ALL与Non-ETP ALL患者的中位OS时间分别为11.33(95% CI 0~28.46)和25.69(95%CI 11.98~39.41)个月,3年OS率分别为41.7%和40.7%(P=0.699)(图1A)。两组患者的中位EFS时间分别为1.51(95%CI 1.23~1.79)和21.36(95%CI 4.67~38.04)个月,3年EFS率分别为16.7%和39.5%(P=0.002)(图1B)。ETP-ALL患者中最终有11例达CR,Non-ETP ALL患者中有57例达CR,3年RFS率分别为53.5%和52.0%(P=0.797)(图1C)。ETP-ALL患者中有6例(46.2%)进行了allo-HSCT,移植患者的中位OS时间尚未达到,未移植患者的中位OS时间为8.81(95%CI 2.93~14.68)个月,移植和未移植ETP-ALL患者的3年OS率分别为66.7%和16.7%(P=0.051)。Non-ETP ALL患者中有27例(43.5%)进行了allo-HSCT,移植患者的中位OS时间也尚未达到,未移植患者的中位OS时间为12.03(95%CI 4.88~19.17)个月,两组患者的3年OS率分别为66.7%和17.0%(P<0.001)(图2)。在所有T-ALL患者中,移植与未移植患者3年OS率分别为67.1%和15.5%(P<0.001)。
图1. 早期前体T细胞急性淋巴细胞白血病(ETP-ALL)与Non-ETP ALL患者的总生存(A)、无事件生存(B)及无复发生存曲线(C).

图2. 异基因造血干细胞移植对早期前体T细胞急性淋巴细胞白血病(ETP-ALL)(A)与Non-ETP ALL(B)总生存的影响.
5.预后因素分析:通过单因素Kaplan-Meier分析影响75例T-ALL患者OS的预后因素,结果见表4。是否合并CNSL、是否进行allo-HSCT是影响T-ALL患者OS的预后因素,而是否为ETP-ALL并不影响T-ALL的预后(P=0.699)。将P<0.05的因素纳入Cox回归模型进行多因素分析,发现是否合并CNSL(HR=5.295,95% CI 2.252~12.449,P<0.001)以及是否行allo-HSCT(HR=0.209,95% CI 0.097~0.449,P<0.001)均为T-ALL的独立预后因素。
表4. 单因素分析影响T细胞急性淋巴细胞白血病患者OS的预后因素.
| 因素 | 例数 | 中位OS时间(月) | 统计量 | P值 |
| 年龄 | 0.337 | 0.562 | ||
| <35岁 | 47 | 19.5 | ||
| ≥35岁 | 26 | 32.1 | ||
| 性别 | 2.772 | 0.096 | ||
| 男 | 53 | 19.3 | ||
| 女 | 20 | 未达到 | ||
| WBC(×109/L) | 0.034 | 0.854 | ||
| ≤100 | 50 | 21.2 | ||
| >100 | 23 | 30.5 | ||
| LDH(U/L) | 2.295 | 0.130 | ||
| ≤1000 | 42 | 30.5 | ||
| >1000 | 31 | 15.5 | ||
| 免疫分型 | 0.058 | 0.971 | ||
| 早期T | 47 | 21.2 | ||
| 胸腺T | 10 | 15.5 | ||
| 成熟T | 16 | 56.7 | ||
| 是否为ETP-ALL | 0.150 | 0.699 | ||
| 是 | 13 | 11.3 | ||
| 否 | 62 | 25.7 | ||
| 是否1个疗程达CR | 2.441 | 0.118 | ||
| 是 | 59 | 30.5 | ||
| 否 | 14 | 11.3 | ||
| 是否合并CNSL | 25.963 | <0.001 | ||
| 是 | 11 | 9.8 | ||
| 否 | 61 | 32.3 | ||
| 是否移植 | 22.256 | <0.001 | ||
| 是 | 33 | 未达到 | ||
| 否 | 40 | 11.0 |
注:OS:总生存;ETP-ALL:早期前体T细胞急性淋巴细胞白血病;CR:完全缓解;CNSL中枢神经系统白血病
讨论
2009年Coustan-Smith等[2]基于其他研究者关于T细胞的基础研究[11]–[13]首次提出部分T-ALL细胞起源于ETP细胞的假设,并通过免疫表型以及基因表达谱分析在儿童T-ALL中证实了ETP-ALL这一独特亚型的存在。ETP-ALL免疫表型特点为T细胞分化抗原(CD1a、CD8、CD5)有限并至少有一个干细胞或髓系抗原表达(CD34、CD117、HLA-DR、CD13、CD33、CD11b、CD65)。其临床特点包括起病时白细胞水平偏低,患者年龄偏大,诱导化疗反应差、缓解率低,长期生存差等[1]–[2]。
儿童ETP-ALL全基因组测序分析发现,ETP-ALL常合并以下类型突变:调节细胞因子受体和RAS通路的激活突变(NRAS、KRAS、FLT3、IL7R、JAK3、JAK1、SH2B3、BRAF);干扰造血(GATA3、ETV6、RUNX1、IKZF1、EP300)以及组蛋白修饰(EZH2、EED、SUZ12、SETD2、EP300)的失活突变。而对成人ETP-ALL基因谱的研究发现,除了上述儿童ETP-ALL常见突变以外,影响DNA甲基化的突变(DNMT3A、IDH1、IDH2、TET2、TET3、WT1)发生率也较高[5],[7]。这提示成人ETP-ALL较儿童ETP-ALL的生物学以及遗传特性更接近AML,去甲基化药物(如地西他滨)可能对该类患者具有一定的治疗前景,目前已有体外研究的证据支持[14]。本研究中,虽然进行二代测序检测的ETP-ALL患者例数较少,但仍能发现NRAS、FLT3-ITD突变发生率较高,这与文献报道一致。
目前关于ETP-ALL预后情况的文献报道,结果并不完全一致。部分研究认为ETP-ALL是一种高危T-ALL,预后较Non-ETP ALL差[2],[8],而部分研究则认为ETP-ALL较其他T-ALL的预后并无明显差异[15]。这一矛盾结果可能与不同研究的患者选择、化疗方案、移植比例等因素相关。本研究中,ETP-ALL与Non-ETP ALL患者1个疗程CR率差异极为明显(33.3%对90.1%),提示ETP-ALL患者对化疗的早期反应较差,而早期化疗反应本就是ALL预后的一个重要指标。两组患者最终在OS上差异无统计学意义,我们推测可能与以下几方面因素相关:我国T-ALL患者总体疗效偏差[16],本研究患者病例数较少,接近一半的ETP-ALL患者进行了allo-HSCT,以上因素的综合作用可能影响了ETP-ALL在T-ALL中的预后作用。国外文献报道成人T-ALL 5年OS率可达60%~70%[17],患者只有在合并相应高危因素时才选择allo-HSCT。而本研究结果显示,在所有T-ALL患者中,移植与未移植患者3年OS率分别为67.1%和15.5%(P<0.001),进行ETP-ALL与Non-ETP ALL亚组分析,allo-HSCT对OS的影响也十分明显。虽然ETP-ALL患者由于例数较少,allo-HSCT对OS的影响尚未达统计学差异,但生存曲线的趋势已经较为明显。因此,对于早期化疗反应差的ETP-ALL患者而言,allo-HSCT有可能克服其不良预后[7]。而对于Non-ETP ALL患者而言,通过化疗方案的改进能否达到同国外接近的疗效则有待于进一步研究。
目前检索国内文献尚未发现其他中心关于成人ETP-ALL的报道。我们的资料显示:ETP-ALL占成人T-ALL的17.3%,起病时白血病负荷较其他T-ALL低,1个疗程诱导化疗CR率低。ETP-ALL似乎并不影响T-ALL的预后(allo-HSCT有可能克服ETP-ALL的不良预后),而是否合并CNSL以及是否移植均为T-ALL的独立预后因素。
Funding Statement
基金项目:国家科技支撑计划(2014BAI09B12);国家科技重大专项课题(2017ZX09304024);天津市血液病临床医学研究中心(15ZXLCSY00010);协和青年科研基金(2017320022)
Fund program: National Science and Technology Pillar Program (2014BA109B12); National Science and Technology Major Project (2017ZX09304024); Tianjin Clinical Research Center for Blood Diseases (15ZXLCSY00010); Peking Union Medical College Youth Fund (2017320022)
References
- 1.Arber DA, Orazi A, Hasserjian R, et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia[J] Blood. 2016;127(20):2391–2405. doi: 10.1182/blood-2016-03-643544. [DOI] [PubMed] [Google Scholar]
- 2.Coustan-Smith E, Mullighan CG, Onciu M, et al. Early T-cell precursor leukaemia: a subtype of very high-risk acute lymphoblastic leukaemia[J] Lancet Oncol. 2009;10(2):147–156. doi: 10.1016/S1470-2045(08)70314-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: acute lymphoblastic leukemia[DB/OL]. VersionⅠ. 2017. https://www.nccn.org/professionals/physician_gls/pdf/all.pdf.
- 4.Zhang J, Ding L, Holmfeldt L, et al. The genetic basis of early T-cell precursor acute lymphoblastic leukaemia[J] Nature. 2012;481(7380):157–163. doi: 10.1038/nature10725. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Neumann M, Heesch S, Schlee C, et al. Whole-exome sequencing in adult ETP-ALL reveals a high rate of DNMT3A mutations[J] Blood. 2013;121(23):4749–4752. doi: 10.1182/blood-2012-11-465138. [DOI] [PubMed] [Google Scholar]
- 6.Neumann M, Heesch S, Gökbuget N, et al. Clinical and molecular characterization of early T-cell precursor leukemia: a high-risk subgroup in adult T-ALL with a high frequency of FLT3 mutations[J] Blood Cancer J. 2012;2(1):e55. doi: 10.1038/bcj.2011.49. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Bond J, Graux C, Lhermitte L, et al. Early Response-based therapy stratification improves survival in adult early thymic precursor acute lymphoblastic leukemia: a group for research on adult acute lymphoblastic leukemia study[J] J Clin Oncol. 2017;35(23):2683–2691. doi: 10.1200/JCO.2016.71.8585. [DOI] [PubMed] [Google Scholar]
- 8.Jain N, Lamb AV, O'Brien S, et al. Early T-cell precursor acute lymphoblastic leukemia/lymphoma (ETP-ALL/LBL) in adolescents and adults: a high-risk subtype[J] Blood. 2016;127(15):1863–1869. doi: 10.1182/blood-2015-08-661702. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Swerdlow SH, Campo E, Harris NL. WHO classification of tumors of haematopoietic and lymphoid tissues[M] Lyon: IARC Press; 2017. pp. 209–213. [Google Scholar]
- 10.Bene MC, Castoldi G, Knapp W, et al. Proposals for the immunological classification of acute leukemias. European Group for the Immunological Characterization of Leukemias (EGIL)[J] Leukemia. 1995;9(10):1783–1786. [PubMed] [Google Scholar]
- 11.Rothenberg EV, Moore JE, Yui MA. Launching the T-cell-lineage developmental programme[J] Nat Rev Immunol. 2008;8(1):9–21. doi: 10.1038/nri2232. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Bell JJ, Bhandoola A. The earliest thymic progenitors for T cells possess myeloid lineage potential[J] Nature. 2008;452(7188):764–767. doi: 10.1038/nature06840. [DOI] [PubMed] [Google Scholar]
- 13.Wada H, Masuda K, Satoh R, et al. Adult T-cell progenitors retain myeloid potential[J] Nature. 2008;452(7188):768–772. doi: 10.1038/nature06839. [DOI] [PubMed] [Google Scholar]
- 14.Lu BY, Thanawala SU, Zochowski KC, et al. Decitabine enhances chemosensitivity of early T-cell precursor-acute lymphoblastic leukemia cell lines and patient-derived samples[J] Leuk Lymphoma. 2016;57(8):1938–1941. doi: 10.3109/10428194.2015.1110747. [DOI] [PubMed] [Google Scholar]
- 15.Patrick K, Wade R, Goulden N, et al. Outcome for children and young people with Early T-cell precursor acute lymphoblastic leukaemia treated on a contemporary protocol, UKALL 2003[J] Br J Haematol. 2014;166(3):421–424. doi: 10.1111/bjh.12882. [DOI] [PubMed] [Google Scholar]
- 16.王 婧, 江 滨, 刘 开彦, et al. 2000-2013年成人急性淋巴细胞白血病患者疗效单中心分析[J] 中华血液学杂志. 2015;36(9):726–732. doi: 10.3760/cma.j.issn.0253-2727.2015.09.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Litzow MR, Ferrando AA. How I treat T-cell acute lymphoblastic leukemia in adults[J] Blood. 2015;126(7):833–841. doi: 10.1182/blood-2014-10-551895. [DOI] [PubMed] [Google Scholar]