高剂量治疗联合自体造血干细胞移植(high-dose therapy followed by autologous hematopoietic stem cell transplantation, HDT/ASCT)是霍奇金淋巴瘤(HL)的重要治疗方法之一。其中,高剂量的预处理治疗是发挥抗肿瘤作用的关键。目前,国内外各研究中心所采用的ASCT预处理治疗方案并不统一,尚缺乏大样本的随机对照研究比较不同预处理方案的有效性及安全性。以卡莫司汀为基础的高剂量化疗是目前最常用的预处理方案[1]–[4],包括CBV(环磷酰胺、卡莫司汀、足叶乙甙)、BEAM(卡莫司汀、足叶乙甙、阿糖胞苷、马法兰)和BEAC(卡莫司汀、足叶乙甙、阿糖胞苷、环磷酰胺)等方案。本研究旨在比较CBV、BEAM和BEAC预处理方案联合ASCT治疗HL的疗效及安全性。
病例与方法
1.病例资料:回顾性分析1997年12月至2012年12月我院采用HDT/ASCT治疗的32例经典型HL患者资料。患者均经病理检查明确诊断,符合WHO 2008标准造血和淋巴组织肿瘤分类标准,并具有完整的治疗和随访记录。
2.治疗方案:预处理方案:所有患者均未接受全身照射(TBI)或全身淋巴结照射(TLI)。CBV方案:环磷酰胺1 800 mg·m−2·d−1,静脉滴注,−3、−2 d;卡莫司汀450~600 mg/m2,静脉滴注,−7 d;足叶乙甙900~1 600 mg·m−2·d−1,静脉滴注,每12 h 1次,−6~−4 d。BEAM方案:卡莫司汀300 mg/m2,静脉滴注,−5 d;足叶乙甙800 mg·m−2·d−1,静脉滴注,每12 h 1次,−4~−2 d;阿糖胞苷1 600 mg/m2,静脉滴注,每12 h 1次,−4~−2 d;马法兰140~160 mg/m2,口服,−6 d。BEAC方案:卡莫司汀、足叶乙甙和阿糖胞苷用法用量同BEAM方案,环磷酰胺1 800 mg/m2,静脉滴注,−6 d。
对症支持治疗:移植第5天开始予重组人粒细胞集落刺激因子(rhG-CSF)5~10 µg·kg−1·d−1直到连续2 d外周血WBC≥1.0×109/L。其他支持治疗主要包括:成分血输注、抗感染治疗、肠外营养支持以及维持水、电解质、酸碱平衡等。
巩固治疗:诊断时伴有纵隔大肿块或移植前有病灶残存的患者,在移植后经放疗科评估予纵隔或残存部位的放疗。所有患者均未进行二次移植或维持性化疗等其他巩固治疗。
3.疗效与安全性评估:回输后连续2 d检测外周血WBC≥1.0×109/L或PLT≥50×109/L时,分别定义为白细胞植入和血小板植入。依据国际淋巴瘤工作组(IWC)疗效评价标准进行疗效评估,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)[5]。依据CTCAE 4.0进行安全性评估[6]。
4.随访:采用门诊或电话进行随访。末次随访时间为2015年11月4日,研究终点为无进展生存(PFS)和总生存(OS)。OS时间定义为自HDT/ASCT至任何原因死亡或末次随访的时间,PFS时间定义为自HDT/ASCT至疾病进展或死亡或末次随访的时间。
结果
1.临床特征:32例HL患者中,男21例,女11例,中位年龄24(13~52)岁。初治患者14例,复发/难治患者18例。其中CBV组13例,BEAM组8例,BEAC组11例。患者的年龄、性别、病理类型、Ann Arbor分期、B症状(发热、盗汗、体重减轻)、结外受累和移植前状态见表1,各组分布均衡。8例初治高危患者诱导化疗后达首次CR或不确定的完全缓解(CRu)状态接受ASCT,其中7例Ⅲ/Ⅳ期,1例ⅡB期。
表1. 高剂量治疗联合自体造血干细胞移植不同预处理方案霍奇金淋巴瘤患者的临床特征.
| 临床特征 | CBV方案(13例) | BEAM方案(8例) | BEAC方案(11例) |
| 年龄[岁,M(范围)] | 24(13~38) | 26.5(16~35) | 25.5(16~52) |
| 性别[例数(%)] | |||
| 女 | 5(38.5) | 2(25.0) | 4(36.4) |
| 男 | 8(61.5) | 6(75.0) | 7(63.6) |
| 病理类型[例数(%)] | |||
| 结节硬化型 | 5(38.5) | 5(62.5) | 4(36.4) |
| 混合细胞型 | 4(30.8) | 2(25.0) | 3(27.3) |
| 淋巴细胞丰富型 | 2(15.4) | 1(12.5) | 2(18.2) |
| 淋巴细胞消减型 | 0 | 0 | 2(18.2) |
| 无法分型 | 2(15.4) | 0 | 0 |
| Ann Arbor分期[例数(%)] | |||
| Ⅱ期 | 2(15.4) | 0 | 1(9.1) |
| Ⅲ期 | 4(30.8) | 3(37.5) | 4(36.4) |
| Ⅳ期 | 7(53.8) | 5(62.5) | 6(54.5) |
| B症状[例数(%)] | 10(76.9) | 4(50.0) | 4(36.4) |
| 结外受累[例数(%)] | 8(61.5) | 6(75.0) | 9(81.8) |
| 移植前状态[例数(%)] | |||
| 完全缓解/不确定的完全缓解 | 5(38.5) | 6(75.0) | 2(18.2) |
| 部分缓解 | 8(61.5) | 2(25.0) | 9(81.8) |
注:CBV:环磷酰胺、卡莫司汀、足叶乙甙;BEAM:卡莫司汀、足叶乙甙、阿糖胞苷、马法兰;BEAC:卡莫司汀、足叶乙甙、阿糖胞苷、环磷酰胺;B症状:发热、盗汗、体重减轻
2.造血重建情况:CBV、BEAM和BEAC三组患者移植后粒细胞植入时间分别为10(8~14)、11(8~12)和10(8~11)d,血小板植入时间分别为11(9~17)、12(8~18)和11(9~16)d,中位植入时间均相近。
3.预处理相关不良反应:纳入研究分析的预处理相关不良反应包括2级及以上的呕吐、黏膜炎、腹泻和发热,1级及以上的出血、皮疹、ALT/AST升高以及感染。最常见的非血液学毒性为肝脏毒性和消化道反应,其中8例BEAM组患者ALT/AST均升高。CBV、BEAM和BEAC三组上述预处理相关不良反应发生情况见表2。
表2. 高剂量治疗联合自体造血干细胞移植不同预处理方案霍奇金淋巴瘤患者预处理相关不良反应[例数(%)].
| 组别 | 例数 | 呕吐a | 黏膜炎a | 腹泻a | 发热a | 出血 | 皮疹 | ALT/AST升高 | 感染b |
| CBV组 | 13 | 9(69.2) | 5(38.5) | 5(38.5) | 6(46.2) | 0 | 4(30.8) | 9(69.2) | 7(53.8) |
| BEAM组 | 8 | 2(25.0) | 0 | 5(62.5) | 5(62.5) | 0 | 2(25.0) | 8(100.0) | 2(25.0) |
| BEAC组 | 11 | 7(63.6) | 3(27.3) | 2(18.2) | 6(54.5) | 2(18.2) | 3(27.3) | 6(54.5) | 5(45.5) |
注:CBV:环磷酰胺、卡莫司汀、足叶乙甙;BEAM:卡莫司汀、足叶乙甙、阿糖胞苷、马法兰;BEAC:卡莫司汀、足叶乙甙、阿糖胞苷、环磷酰胺。a2级及以上不良反应;b致病微生物培养阳性
4.生存分析:中位随访时间为61.8(3.6~181.1)个月,全部32例患者中14例治疗后出现疾病进展,至末次随访时,2例死亡,30例存活,5年估计PFS及OS率分别为58.3%(标准误:0.089)及96.9%(标准误:0.031)。CBV、BEAM和BEAC组的5年估计PFS率分别为69.2%(标准误:0.128)、46.9%(标准误:0.187)和54.5%(标准误:0.150)。CBV和BEAM组疗后5年内无一例死亡,BEAC组5年估计OS率为90.9%(标准误:0.087)(图1)。
图1. CBV、BEAM和BEAC三种预处理方案移植后霍奇金淋巴瘤患者的总生存(A)和无进展生存(B)曲线.
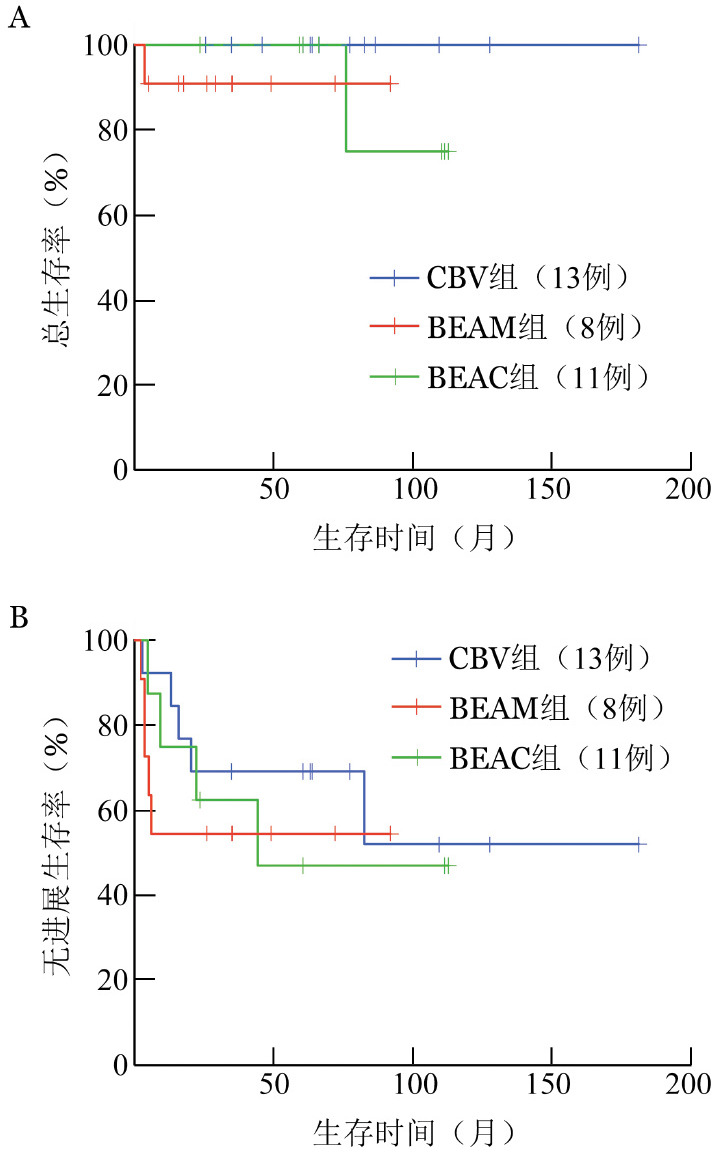
CBV:环磷酰胺、卡莫司汀、足叶乙甙;BEAM:卡莫司汀、足叶乙甙、阿糖胞苷、马法兰;BEAC:卡莫司汀、足叶乙甙、阿糖胞苷、环磷酰胺
讨论
预处理方案是ASCT的关键步骤,预处理方案中的药物组成、剂量强度与患者移植期间治疗相关不良事件的发生、移植后骨髓造血和免疫功能的重建时间以及远期生存情况密切相关。目前,ASCT预处理治疗方案并不统一,尚缺乏大型前瞻性随机对照研究比较不同预处理方案的有效性及安全性。因此,优化预处理方案一直是ASCT治疗淋巴瘤领域的研究热点。
含卡莫司汀方案是淋巴瘤常用的ASCT预处理方案。国外一些研究显示BEAM方案的疗效优于CBV方案[1]–[2]和BEAC方案[3]。然而,近年来BEAM方案中的药物之一马法兰在中国暂缺,因此探索与BEAM方案等效或更优的预处理方案具有重要意义。本研究我们回顾性分析了单中心32例接受ASCT治疗的经典型HL的疗效及安全性。纳入患者的中位年龄为24岁,最大年龄为52岁。研究结果显示对于年轻(<60岁)的HL患者,CBV、BEAM和BEAC三种高剂量预处理方案移植后患者的造血重建时间、不良反应发生率及长期生存均相近。
既往许多回顾性研究对上述三种预处理方案在淋巴瘤中的疗效进行了比较,但由于纳入患者的病理类型等临床特征以及具体药物剂量存在差异,并且多数研究未对初治和复发/耐药患者进行亚组分析,因此各研究的结果并不统一。William等[2]的回顾性研究显示,对于复发/难治HL,BEAM组的5年PFS率(92%对73%,P=0.002)和OS率(95%对87%,P=0.070)高于CBV组。Wang等[1]分析了72例非霍奇金淋巴瘤(NHL)和HL患者的资料,比较BEAM和CBV方案预处理的疗效,发现BEAM组的OS率(84%对60%)、PFS率(72%对58%)和无病生存(DFS)率(61%对43%)都高于CBV组,但差异无统计学意义。Jo等[3]在97例NHL患者中按照国际预后指数(IPI)评分进行匹配后发现,BEAM组OS和无事件生存(EFS)率高于BEAC组。而Jantunen等[4]对接受ASCT的71例NHL患者进行回顾性分析后发现BEAC和BEAM方案的患者生存情况差异无统计学意义。
由于CBV方案中卡莫司汀的剂量较BEAM及BEAC高,多数研究报道为600 mg/m2或更高,因此,肺毒性、黏膜炎及感染并发症等治疗相关毒性也更多见于报道[7]–[9]。Wang等[1]对接受BEAM或CBV方案预处理的淋巴瘤患者进行分析发现,BEAM组治疗相关腹泻的发生率更高(81%对51%,P=0.003);尽管黏膜炎的发生率CBV组(79%)和BEAM组(75%)差异无统计学意义,但BEAM组的程度更轻,有67%的患者发生轻度黏膜炎,而CBV组有74%的患者为中到重度。该研究中,CBV组卡莫司汀的剂量为600 mg/m2,该组卡莫司汀剂量相关器官毒性的发生率也更高,尤其是肝毒性(18%对6%),尽管限于样本量较少,差异无统计学意义,但值得注意的是CBV组有2例患者发生了致死性的肝静脉闭塞症。Puig等[10]对113例淋巴瘤(69例NHL、44例HL)患者进行回顾性分析,结果显示:CBV组的移植相关死亡率(TRM)(25%)显著高于BEAM组(7%),肝窦阻塞综合征在CBV组的发生率为11%,在BEAM组为0。值得注意的是,该研究CBV组中卡莫司汀的剂量为800 mg/m2,更高的治疗相关毒性可能与提高了卡莫司汀剂量有关。本研究中我们未发现肺毒性等严重的器官功能障碍,可能与卡莫司汀的剂量较其他研究报道偏低有关,本研究CBV方案中卡莫司汀的剂量仅为450~600 mg/m2。
为了减少卡莫司汀相关的治疗毒性,一些研究探索了替代卡莫司汀的移植预处理方案。2012年Kim等[11]报道了NEAM(米托蒽醌、足叶乙甙、阿糖胞苷和马法兰)方案联合ASCT治疗NHL的研究,中位EFS时间为17.9个月,TRM为2.9%,2年OS率为64.2%。Visani等[12]–[13]报道了BeEAM(苯达莫司汀、足叶乙甙、阿糖胞苷和马法兰)预处理方案在复发/难治性淋巴瘤中的初步结果,中位PFS和OS均未达到,3年的PFS率可达72%,治疗相关不良反应也在可耐受的范围。Musso等[14]报道FEAM(福莫司汀、足叶乙甙、阿糖胞苷和马法兰)与BEAM方案非血液学毒性发生率相似,主要4级不良反应为黏膜炎,移植后100 d内TRM为2.4%。由于随访时间较短,上述方案是否带来进一步生存获益尚需更长时间的随访和评估。
总之,本研究结果显示,对于年轻(<60岁)的经典型HL患者,CBV、BEAM和BEAC三种预处理方案的疗效和安全性相近。但由于本研究为单中心回顾性研究,样本量较少,结论尚待大样本随机对照研究进一步验证。
Funding Statement
基金项目:霍英东高等院校青年教师基金(B231996001);人事部归国留学人员启动基金(B311994001);卫生部优秀青年科技人才专项(B121994002);国家“九·五”攻关课题(A20199610396-906-01-12);高等学校博士学科点专项科研基金(20010023018、20050023045、B201995002)
References
- 1.Wang EH, Chen YA, Corringham S, et al. High-dose CEB vs BEAM with autologous stem cell transplant in lymphoma[J] Bone Marrow Transplant. 2004;34(7):581–587. doi: 10.1038/sj.bmt.1704637. [DOI] [PubMed] [Google Scholar]
- 2.William BM, Loberiza FR, Jr, Whalen V, et al. Impact of conditioning regimen on outcome of 2-year disease-free survivors of autologous stem cell transplantation for Hodgkin lymphoma[J] Clin Lymphoma Myeloma Leuk. 2013;13(4):417–423. doi: 10.1016/j.clml.2013.03.009. [DOI] [PubMed] [Google Scholar]
- 3.Jo JC, Kang BW, Jang G, et al. BEAC or BEAM high-dose chemotherapy followed by autologous stem cell transplantation in non-Hodgkin's lymphoma patients: comparative analysis of efficacy and toxicity[J] Ann Hematol. 2008;87(1):43–48. doi: 10.1007/s00277-007-0360-0. [DOI] [PubMed] [Google Scholar]
- 4.Jantunen E, Kuittinen T, Nousiainen T. BEAC or BEAM for high-dose therapy in patients with non-Hodgkin's lymphoma? A single centre analysis on toxicity and efficacy[J] Leuk Lymphoma. 2003;44(7):1151–1158. doi: 10.1080/1042819031000083028. [DOI] [PubMed] [Google Scholar]
- 5.Cheson BD, Pfistner B, Juweid ME, et al. Revised response criteria for malignant lymphoma[J] J Clin Oncol. 2007;25(5):579–586. doi: 10.1200/JCO.2006.09.2403. [DOI] [PubMed] [Google Scholar]
- 6.National Institutes of Health, National Cancer Institute. Common Terminology Criteria for Adverse Events (CTCAE) Version 4.03[Z] Washington, DC: US Department of Health and Human Services; 2010-6-14. [Google Scholar]
- 7.Reece DE, Barnett MJ, Connors JM, et al. Intensive chemotherapy with cyclophosphamide, carmustine, and etoposide followed by autologous bone marrow transplantation for relapsed Hodgkin's disease[J] J Clin Oncol. 1991;9(10):1871–1879. doi: 10.1200/JCO.1991.9.10.1871. [DOI] [PubMed] [Google Scholar]
- 8.Patti C, Majolino I, Scimè R, et al. High-dose cyclophosphamide, etoposide and BCNU (CVB) with autologous stem cell rescue in malignant lymphomas[J] Eur J Haematol. 1993;51(1):18–24. doi: 10.1111/j.1600-0609.1993.tb00599.x. [DOI] [PubMed] [Google Scholar]
- 9.Alessandrino EP, Bernasconi P, Colombo A, et al. Pulmonary toxicity following carmustine-based preparative regimens and autologous peripheral blood progenitor cell transplantation in hematological malignancies[J] Bone Marrow Transplant. 2000;25(3):309–313. doi: 10.1038/sj.bmt.1702154. [DOI] [PubMed] [Google Scholar]
- 10.Puig N, de la Rubia J, Remigia MJ, et al. Morbidity and transplant-related mortality of CBV and BEAM preparative regimens for patients with lymphoid malignancies undergoing autologous stem-cell transplantation[J] Leuk Lymphoma. 2006;47(8):1488–1494. doi: 10.1080/10428190500527769. [DOI] [PubMed] [Google Scholar]
- 11.Kim JW, Lee HJ, Yi HG, et al. Mitoxantrone, etoposide, cytarabine, and melphalan (NEAM) followed by autologous stem cell transplantation for patients with chemosensitive aggressive non-Hodgkin lymphoma[J] Am J Hematol. 2012;87(5):479–483. doi: 10.1002/ajh.23150. [DOI] [PubMed] [Google Scholar]
- 12.Visani G, Malerba L, Stefani PM, et al. BeEAM (bendamustine, etoposide, cytarabine, melphalan) before autologous stem cell transplantation is safe and effective for resistant/relapsed lymphoma patients[J] Blood. 2011;118(12):3419–3425. doi: 10.1182/blood-2011-04-351924. [DOI] [PubMed] [Google Scholar]
- 13.Visani G, Stefani PM, Capria S, et al. Bendamustine, etoposide, cytarabine, melphalan, and autologous stem cell rescue produce a 72% 3-year PFS in resistant lymphoma[J] Blood. 2014;124(19):3029–3031. doi: 10.1182/blood-2014-08-596668. [DOI] [PubMed] [Google Scholar]
- 14.Musso M, Scalone R, Marcacci G, et al. Fotemustine plus etoposide, cytarabine and melphalan (FEAM) as a new conditioning regimen for lymphoma patients undergoing auto-SCT: a multicenter feasibility study[J] Bone Marrow Transplant. 2010;45(7):1147–1153. doi: 10.1038/bmt.2009.318. [DOI] [PubMed] [Google Scholar]


