Abstract
目的
研究WT1基因作为微小残留病(MRD)监测指标在急性髓系白血病(AML)预后中的应用,并探索WT1 mRNA预测复发的阈值。
方法
回顾性分析121例诱导缓解并行巩固治疗的AML患者(非急性早幼粒细胞白血病)WT1 mRNA的动态表达水平。比较巩固治疗后不同转归组患者的WT1 mRNA表达水平,依据受试者工作特征(ROC)曲线确定可预测临床复发的WT1 mRNA阈值。WT1 mRNA水平采用实时定量聚合酶链反应(RQ-PCR)法检测。
结果
确立WT1 mRNA>2.98%提示高风险复发。为了临床应用方便,将提示复发的WT1 mRNA阈值设为3.00%。41例患者初诊时检测了WT1 mRNA水平,剔除3例初诊WT1 mRNA低于3.00%的患者,余下38例患者初诊WT1 mRNA中位值为44.09%(7.19%~188.06%)。缓解期351份标本WT1 mRNA检测值中位为0.48%(0~8.41%)。初诊WT1 mRNA水平高于缓解期水平。除外初诊WT1 mRNA水平低于3.00%的3例患者,巩固治疗开始后WT1阳性组(>3.00%)和阴性组(≤3.00%)复发率分别为70.0%(14/20)和12.2%(12/98)(P<0.001)。WT1 mRNA升高达阈值后到复发的中位时间为58 d。
结论
WT1基因可以作为AML患者巩固治疗开始后的MRD监测指标,WT1 mRNA>3.00%提示存在复发风险。
Keywords: WT1基因, 白血病,髓样,急性, 复发
Abstract
Objective
To probe the potential utility of Wilms tumor 1 (WT1) as a marker of minimal residual disease (MRD) in acute myeloid leukemia (AML) to estimate the relapse-predicting cut-off value.
Methods
Quantitative assessment of bone marrow WT1 mRNA level was preformed using real-time quantitative reverse transcription polymerase chain reaction (RQ-RT-PCR) assay. The expression levels of WT1 dynamically measured with RQ-RT-PCR were retrospectively analyzed in 121 AML cases (not including acute promyelocytic leukemia) achieving complete remission (CR) after induction therapy followed by consolidation therapy. By comparing WT1 levels of patients with different post-therapy outcomes, the investigators used the receiver operating characteristic (ROC) curve to determine WT1 threshold so as to predict their clinical relapses. Then prognoses and the significance of intervention were analyzed between WT1 positive and negative patients according to the cut-off value of WT1.
Results
According to ROC curve, WT1 level higher than 2.98% predicted the possibility of relapse. For simplicity and clinical application, 3.00% was used as the cut-off value of WT1 level for relapse. WT1 levels in 41 patients at diagnosis were detected, meanwhile 3 patients whose WT1 levels at diagnosis below 3.00% were excluded, then the median WT1 level of the rest 38 patients at diagnosis was 44.09% (range 7.19%–188.06%). The median WT1 level in remission was 0.48% (352 samples, range 0–8.41%). The median WT1 level at diagnosis was higher than that in remission. Excluding the 3 patients with WT1 level at diagnosis under 3.00%, the relapse rate of WT1 positive group (>3.00% during consolidation phase and follow-up) and WT1 negative group (≤3.00%) was 70.0% (14/20) and 12.2% (12/98) respectively (P<0.001). The median time from WT1 positivity to clinical relapse was 58 days.
Conclusion
WT1 expression level above 3.00% was associated with markedly high risk of relapse, which could be as a useful marker for monitoring MRD following consolidation therapy.
Keywords: Wilms'tumor gene 1; Leukemia, myeloid, acute; Relapse
尽管急性髓系白血病(AML)患者经过标准诱导方案化疗可以获得70%~80%的完全缓解(CR)率,但仅50%患者能被治愈[1]。形态学CR时,可通过监测微小残留病(MRD)预测早期复发[2]。重现性染色体异常导致的特异性转录拷贝是MRD监测的有效指标,包括融合基因PML-RARA、RUNX1-RUNX1T1、CBFβ-MYH11以及克隆性重现性基因突变NPM1等。但是,只有不到50%的患者存在着这些异常[2]–[3]。因此,非常有必要寻找一个属于白血病细胞的泛表达标志。而WT1基因就符合这一特征。80%~90%的初诊AML患者骨髓和外周血中高表达WT1基因,而正常人体内表达水平很低[3]。
WT1基因位于染色体11p13,编码4个锌指结构域的DNA结合蛋白[4]。其已被视为AML患者MRD监测指标之一[3]–[6]。但是WT1基因在缓解期AML患者骨髓中也有表达,所以有必要寻找到提示复发的WT1阈值,早期预测血液学复发。在本研究中我们通过受试者工作特征(ROC)曲线获得预测AML复发的骨髓WT1 mRNA表达水平的阈值,并分析了WT1 mRNA表达水平升高到血液学复发的时间,从而为临床应用WT1基因进行AML治疗后MRD的监测提供依据。
病例与方法
1.研究对象:收集2013年8月至2016年1月我院白血病诊疗中心收治的诱导化疗后获得CR且巩固治疗开始后行WT1基因监测至少2次的121例AML患者(非急性早幼粒细胞白血病)的临床资料。患者均根据骨髓细胞形态学、免疫组化、细胞遗传学及分子生物学确诊为AML[7]。
2.治疗方法:诱导方案为包含蒽环类、阿糖胞苷和(或)高三尖杉酯碱的联合化疗。CR后,根据患者的遗传学危险度予造血干细胞移植或巩固治疗(包含中大剂量阿糖胞苷)。
3.复发标准:CR后外周血重新出现白血病细胞或骨髓原始细胞大于0.050或髓外出现白血病细胞浸润。
4.WT1 mRNA表达水平的检测:提取RNA、逆转录合成cDNA、实时定量聚合酶链反应(RQ-PCR)及标准曲线的制作、标本相应的WT1 mRNA表达水平的计算参考文献[8]的方法。WT1 mRNA水平(%)=(WT1拷贝数/ABL拷贝数)×100%。
5.统计学处理:采用SPSS22.0及EXCEL处理数据、作图。计量资料比较采用Mann-Whitney U检验。制作ROC曲线确定预测复发的WT1阈值。计数资料比较采用卡方检验。P<0.05为差异有统计学意义。
结果
1.患者基本资料:121例患者纳入研究,其中男56例,女65例。中位年龄37(15~61)岁。按照2016 WHO标准[7]分型:AML伴t(8;21)(q22;q22)/RUNX1-RUNX1T1 25例;AML伴inv(16)(p13.1q22)或t(16;16)(p13.1;q22)/CBFβ-MYH11 9例;AML伴NPM1突变14例;AML伴CEBPA双突变8例;非特殊类型AML 65型(M1 3例;M2 19例;M4 9例,M5 32例,M6 2例)。按美国国立癌症综合网络(NCCN)AML指南危险分层标准分组,低危组56例,中危组55例,高危组10例。
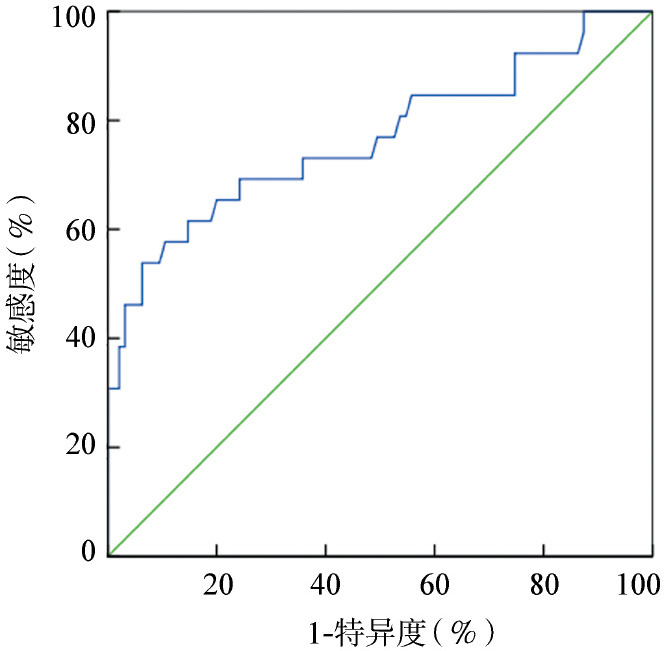
2.确定可预测临床复发的WT1阈值:选取巩固治疗开始后、复发前所检测到的WT1 mRNA水平最高值以及复发或缓解两种转归情况作为制作ROC曲线的数据。如图1所示,当WT1 mRNA表达水平超过2.98%时,预测患者复发与未复发的曲线下面积最大,为0.766,95%CI为0.647~0.885,标准误为0.061,P=0.000。敏感度53.8%,特异度93.7%。换言之,当WT1 mRNA水平>2.98%时,提示患者发生临床复发的概率为93.7%,但使用2.98%作为阈值,仅能发现复发患者中的53.8%。将阈值设为3.00%时,敏感度为53.8%,特异度为93.7%,并不改变敏感度及特异度。为了临床应用方便,将提示复发的WT1 mRNA阈值设为3.00%。
图1. WT1 mRNA水平检测的受试者工作特征曲线.
3.初诊时及缓解期WT1 mRNA表达水平:在121例患者中,41例患者初诊时进行了WT1 mRNA水平检测。其中,有3例患者初诊WT1 mRNA水平低于3.00%。初诊低于3.00%的患者,其缓解期WT1 mRNA水平理论上都是低于3.00%的,采用WT1作为其复发的预测指标无意义,故在接下来的研究中,我们剔除该3例患者。38例患者初诊WT1 mRNA水平平均值为63.85%(P2517.24%,P50 44.09%,P75 105.5%,范围7.19%~188.06%)。
我们将患者巩固治疗开始后,距离末次WT1检测时间>60 d仍未复发的多个缓解时间点的值视为缓解期WT1 mRNA水平。共有351份缓解期标本进行了WT1 mRNA水平检测。缓解期WT1 mRNA水平平均值为0.71%(P25 0.26%,P50 0.48%,P75 0.88%,范围0~8.41%)。
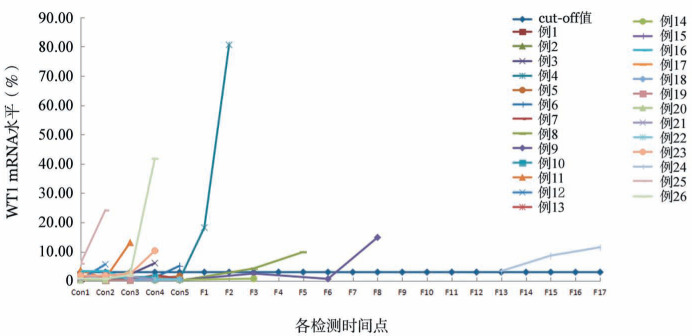
4.巩固治疗开始后WT1 mRNA阳性对预后的影响:118例患者中有92例巩固治疗期间及随诊时仍CR,26例出现复发。按照提示复发的WT1阈值3.00%的标准,92例CR组患者,有6例患者WT1 mRNA水平超过了该阈值(图2)。26例复发的患者中,有14例超过了该阈值(图3)。将WT1 mRNA水平>3.00%设定为阳性组,≤3.00%设定为阴性组。其中,WT1阳性组复发率为70.0%(14/20),WT1阴性组患者复发率为12.2%(12/98),WT1阳性组复发率明显高于WT1阴性组(P<0.001)。这也证实了采取3.00%作为提示复发的阈值是有临床意义的。
图2. 6例WT1阳性的缓解期患者各时间点WT1基因表达情况.
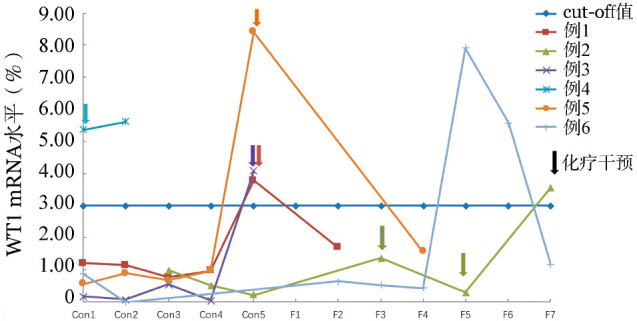
箭头代表予以化疗。Con1~Con5分别为巩固治疗1~5个疗程后;F1~F7分别为随诊1~7个月时
图3. 26例复发患者各时间点WT1基因表达情况.
Con1~Con5分别为巩固治疗1~5个疗程后;F1~F17分别为随诊1~17个月时。26例复发患者有14例复发前WT1 mRNA表达水平超过阈值
5.实施化疗干预对巩固治疗开始后WT1阳性患者复发情况的影响:按照是否采取干预措施,我们将20例WT1阳性的患者进行分组。干预组15例,采取干预措施如下:米托蒽醌+阿糖胞苷方案6例、柔红霉素+阿糖胞苷方案3例、阿克拉霉素+阿糖胞苷方案2例、大剂量阿糖胞苷方案2例、高三尖杉酯碱+阿糖胞苷方案1例、地西他滨方案1例。未干预组5例。干预组复发率为73.3%(11/15),未干预组复发率为60.0%(3/5),两组复发率相近。由于病例数少未行统计学比较。20例WT1阳性患者中有14例复发,其中1例患者未采取干预措施,且具体复发时间不详。其余13例患者从WT1首次升高达阳性水平到复发的中位时间为58(32~300)d,平均88 d。采取干预措施的11例患者WT1升高达阳性水平到复发的平均时间为89 d(P25 48 d,P50 56 d,P75 90 d,范围43~300 d)。此11例患者中,有8例患者巩固治疗期间WT1升高达阳性水平,继续按计划予1个疗程巩固治疗后即复发。未采取干预的2例复发患者从WT1阳性到复发的时间分别为32和62 d,平均47 d。
如图2,持续处于CR期的6例WT1 mRNA阳性患者中,例2和例3 WT1升高大于3.00%后,尚未到下次随诊时间。其中,例2在巩固治疗结束第3个月随诊时尽管形态学仍处于缓解,予2个疗程化疗干预,WT1 mRNA水平继续升高并达阳性水平。例4在第2疗程巩固治疗前WT1 mRNA升高达阳性水平,按计划予第2疗程化疗后WT1 mRNA继续升高。例1和例5在第6疗程巩固治疗前WT1 mRNA升高达阳性水平,按计划继续予1个疗程巩固治疗,分别于2、4个月后复查WT1 mRNA下降,仍处于缓解状态。例6的WT1 mRNA升高后未予干预,下次复查时WT1 mRNA水平再次低于3.00%。
讨论
由于WT1基因在CD34+造血干细胞亦表达,且检测外周血WT1 mRNA水平创伤更小、更方便,故近年来逐渐采用外周血进行WT1研究[4]–[5],[9]–[10]。但是文献报道检测骨髓WT1 mRNA水平比外周血更易发现复发,骨髓WT1 mRNA水平升高到血液学复发窗口期更长[10]–[11]。此外,监测骨髓WT1 mRNA水平可以和监测骨髓其他提示MRD的检测指标(流式细胞术检测白血病相关免疫表型、其他特异性融合基因、特异突变等)同时进行,可以更好地评估疾病状态[12]。故我们认为采用骨髓检测WT1 mRNA水平,灵敏度更高,且较早、更精确地提示复发风险,并可为下一步治疗方案的制定赢得准备时间。所以本研究以骨髓WT1 mRNA表达情况为研究对象。
本研究中我们借助ROC曲线来寻找提示高风险复发的WT1阈值。从ROC曲线来看2.98%时曲线下面积最大,此时特异度为93.7%,敏感度为53.8%。若提高敏感度,如将WT1阈值设为0.99%时,敏感度为73.1%,特异度为54.7%,误诊率太高。所以我们建议采用2.98%,高特异性说明WT1增高超过此阈值时复发风险高。当然,敏感度低势必会造成一定的漏诊率,且WT1并非白血病的特异性指标,所以我们建议当WT1低于阈值但高于0.99%时,要提高警惕,同时结合流式细胞术来评估白血病残留,指导治疗。按照ROC曲线结果,并结合临床需要,我们将3.00%定为提示复发高风险的阈值,设为3.00%并未影响WT1的特异度及敏感性。我们得到的WT1阈值较文献报道的偏高,考虑原因如下:既往文献报道多是以外周血WT1 mRNA表达水平监测AML的MRD,且确定阈值时针对的是所有AML患者,而本文剔除了急性早幼粒细胞白血病患者。剔除3例初诊WT1 mRNA表达水平低于3.00%的患者后,对WT1阴性组、阳性组的复发率进行比较,差异有统计学意义,这一点也反过来证实了该阈值对MRD监测有意义。文献也报道了检测巩固治疗后骨髓WT1 mRNA水平对AML患者预后有意义[4]。然而本组大部分患者初诊WT1水平未知,其中可能有低表达WT1的患者不适合采用WT1动态监测MRD,且部分患者观察时间短,尚未出现临床复发。这些因素可能会导致所得到的阈值判断效能下降。
文献报道骨髓WT1 mRNA升高到出现复发的中位时间长短不等(67 d[10]、37 d[11]),报道的外周血WT1 mRNA升高到复发的时间接近(1.8个月[5]、44 d[10])。但按我们所选取的骨髓WT1阈值,WT1阳性到复发的中位时间为56 d。由此可见,无论采用骨髓还是外周血监测WT1 mRNA,升高到复发的中位时间为1~2个月。缓解期的6例WT1阳性患者中,2例患者最后一次监测WT1 mRNA升高大于3.00%后,尚未到随诊时间(每3个月复诊)。有可能随着观察时间延长亦会复发。结合WT1升高到复发的中位时间,我们建议WT1升高的患者,随诊时间不能按既往的3个月复查一次,而应缩短随诊时间,以便早期预测复发。
在26例复发患者中,3例初诊时检测了WT1 mRNA水平,且初诊WT1水平均较高。在这3例患者中,有2例患者复发前WT1 mRNA高于3.00%,有1例复发前WT1 mRNA为1.69%,但是复发时上升至5.31%。其余23例患者,有12例患者复发前WT1 mRNA超过了3.00%。另外11例患者,有2例复发时未查WT1 mRNA,4例复发时WT1 mRNA明显增高,大于3.00%,其余5例复发时WT1 mRNA仍低于3.00%。尽管在研究开始我们已剔除了初诊WT1 mRNA小于3.00%的患者,但对于此5例患者其初诊WT1表达情况尚不清楚。所以,初诊WT1低表达的患者可能不适合采用WT1基因监测MRD。
越来越多的学者建议AML患者诱导缓解后治疗方案的选择参考MRD结果,如有文献报道大多数流式细胞术检出的MRD阳性患者采用传统的化疗方案MRD很难转阴[13],而采取异基因造血干细胞移植后复发率更低,无复发生存期更长[14]。也有文献报道融合基因定量监测可作为预测血液学复发的可靠指标,且针对分子水平复发的患者及时给予干预是有意义的[15]。
我们发现给予化疗干预的WT1阳性患者复发率与未干预组相近。15例予以干预的患者,8例化疗干预后即复发。1例予化疗后WT1 mRNA继续升高,1例未到随诊时间,有可能在不久的将来会出现血液学复发。由于本研究病例少、观察时间短、可能存在初诊WT1低表达的患者,尚难以明确化疗干预对WT1升高的患者预后是否有影响,但我们建议对于WT1阳性的患者应该采取高强度化疗或者造血干细胞移植。
综上,WT1 mRNA表达水平可作为AML缓解期MRD监测指标,WT1 mRNA水平>3.00%预示临床复发。
Funding Statement
基金项目:国家自然科学基金重点项目(81430004);天津市血液病临床医学研究中心建设(15ZXLCSY00010)
Fund program: National Natural Science Foundation of China(81430004); Tianjin Clinical Research Center for Blood Diseases(15ZXLCSY00010)
References
- 1.Burnett A, Wetzler M, Lowenberg B. Therapeutic advances in acute myeloid leukemia[J] J Clin Oncol. 2011;29(5):487–494. doi: 10.1200/JCO.2010.30.1820. [DOI] [PubMed] [Google Scholar]
- 2.Kayser S, Walter RB, Stock W, et al. Minimal residual disease in acute myeloid leukemia—current status and future perspectives[J] Curr Hematol Malig Rep. 2015;10(2):132–144. doi: 10.1007/s11899-015-0260-7. [DOI] [PubMed] [Google Scholar]
- 3.Rossi G, Minervini MM, Carella AM, et al. Wilms'tumor gene (WT1) expression and minimal residual disease in acute myeloid leukemia. In: van den Heuvel-Eibrink MM, editor. Wilms Tumor[M] Brisbane (AU): Codon Publications; 2016. pp. 273–280. [DOI] [PubMed] [Google Scholar]
- 4.Gray JX, McMillen L, Mollee P, et al. WT1 expression as a marker of minimal residual disease predicts outcome in acute myeloid leukemia when measured post-consolidation[J] Leuk Res. 2012;36(4):453–458. doi: 10.1016/j.leukres.2011.09.005. [DOI] [PubMed] [Google Scholar]
- 5.Polák J, Hájková H, Maalaufová-Soukupová J, et al. Estimation of molecular upper remission limit for monitoring minimal residual disease in peripheral blood of acute myeloid leukemia patients by WT1 expression[J] Exp Ther Med. 2012;3(1):129–133. doi: 10.3892/etm.2011.363. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.许 晶, 李 莉, 李 娟, et al. WT1基因rs16754多态性与急性髓系白血病患者临床特征及预后关系的研究[J] 中华血液学杂志. 2016;37(10):898–902. doi: 10.3760/cma.j.issn.0253-2727.2016.10.017. [DOI] [Google Scholar]
- 7.Arber DA, Orazi A, Hasserjian R, et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia[J] Blood. 2016;127(20):2391–2405. doi: 10.1182/blood-2016-03-643544. [DOI] [PubMed] [Google Scholar]
- 8.Cilloni D, Renneville A, Hermitte F, et al. Real-time quantitative polymerase chain reaction detection of minimal residual disease by standardized WT1 assay to enhance risk stratification in acute myeloid leukemia: a European LeukemiaNet study[J] J Clin Oncol. 2009;27(31):5195–5201. doi: 10.1200/JCO.2009.22.4865. [DOI] [PubMed] [Google Scholar]
- 9.Cilloni D, Messa F, Arruga F, et al. Early prediction of treatment outcome in acute myeloid leukemia by measurement of WT1 transcript levels in peripheral blood samples collected after chemotherapy[J] Haematologica. 2008;93(6):921–924. doi: 10.3324/haematol.12165. [DOI] [PubMed] [Google Scholar]
- 10.Ommen HB, Nyvold CG, Braendstrup K, et al. Relapse prediction in acute myeloid leukaemia patients in complete remission using WT1 as a molecular marker: development of a mathematical model to predict time from molecular to clinical relapse and define optimal sampling intervals[J] Br J Haematol. 2008;141(6):782–791. doi: 10.1111/j.1365-2141.2008.07132.x. [DOI] [PubMed] [Google Scholar]
- 11.Weisser M, Kern W, Rauhut S, et al. Prognostic impact of RT-PCR-based quantification of WT1 gene expression during MRD monitoring of acute myeloid leukemia[J] Leukemia. 2005;19(8):1416–1423. doi: 10.1038/sj.leu.2403809. [DOI] [PubMed] [Google Scholar]
- 12.Kitamura K, Nishiyama T, Ishiyama K, et al. Clinical usefulness of WT1 mRNA expression in bone marrow detected by a new WT1 mRNA assay kit for monitoring acute myeloid leukemia: a comparison with expression of WT1 mRNA in peripheral blood[J] Int J Hematol. 2016;103(1):53–62. doi: 10.1007/s12185-015-1882-1. [DOI] [PubMed] [Google Scholar]
- 13.Inoue D, Maruoka H, Takahashi T. Clinical analysis and optimization of postremission therapy for acute myeloid leukemia patients with minimal residual disease as determined by flow cytometry[J] Mediterr J Hematol Infect Dis. 2010;2(2):e2010020. doi: 10.4084/MJHID.2010.020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Maurillo L, Buccisano F, Del PM, et al. Toward optimization of postremission therapy for residual disease-positive patients with acute myeloid leukemia[J] J Clin Oncol. 2008;26(30):4944–4951. doi: 10.1200/JCO.2007.15.9814. [DOI] [PubMed] [Google Scholar]
- 15.Doubek M, Palasek I, Pospisil Z, et al. Detection and treatment of molecular relapse in acute myeloid leukemia with RUNX1 (AML1), CBFB, or MLL gene translocations: frequent quantitative monitoring of molecular markers in different compartments and correlation with WT1 gene expression[J] Exp Hematol. 2009;37(6):659–672. doi: 10.1016/j.exphem.2009.03.004. [DOI] [PubMed] [Google Scholar]