Abstract
目的
探讨非血缘脐血移植(UCBT)治疗急性髓系白血病(AML)的疗效及影响疗效的相关因素。
方法
回顾性分析接受UCBT治疗58例AML患者的临床资料。中位年龄14.5(3~36)岁,中位体重45(12~90) kg。FAB分型:M0 1例、M1 1例、M2 35例(包括骨髓增生异常综合征转AML 1例)、M4 3例、M5 14例、M6 3例、混合细胞白血病1例。移植时处于第1次完全缓解期(CR1)36例,第2次完全缓解期(CR2)14例,未缓解(NR) 8例,其中高危难治患者43例(74.1%)。单份UCBT 49例(84.5%),双份UCBT 9例(15.5%)。所有患者均采用强化清髓预处理方案,采用环孢素联合霉酚酸酯预防移植物抗宿主病(GVHD)。
结果
全部58例患者中56例(96.6%)获得造血重建,中性粒细胞植入、血小板植入的中位时间分别为17(12~37) d、33(17~140) d。24例(42.9%)患者发生急性GVHD,其中Ⅱ~Ⅳ度急性GVHD的发生率为30.4%(17/56)。在可评估的49例患者中,7例(14.3%)出现慢性GVHD(均为局限型)。预期3年累积总体生存(OS)率和无病生存(DFS)率分别为(60.3±6.4)%和(60.1±6.5)%。3年非复发死亡率为33.3%,复发率为9.1%。UCBT时疾病为CR患者(50例)的3年OS率高于NR患者(8例)[(66.0±6.7)%对(25.0±15.3)%,P=0.013]。
结论
UCBT治疗AML安全有效,慢性GVHD发生率和复发率较低。
Keywords: 脐血移植, 白血病,髓样,急性, 非血缘关系捐赠者, 存活率分析
Abstract
Objective
To evaluate the therapeutic efficacy and related risk factors of acute myelogenous leukemia (AML) patients treated with unrelated cord blood transplantation (UCBT).
Methods
A retrospective analysis was performed on the clinical data of 58 AML patients that consisted of 1 case of M0, 1 case M1, 35 cases M2, 3 cases M4, 14 cases M5, 3 cases M6, and 1 case acute mixed leukemia, respectively. Of them, 1 case AML secondary to myelodysplastic syndrome, and 36 in first complete remission (CR1), 14 in second complele remission (CR2), 8 in non-remission (NR), 43 cases were refractory or high-risk patients (70.1%). The median age was 14.5 years with the median weight of 45 kg, 49 patients received sUCBT and 9 dUCBT. All the patients conditioned with intensified myeloablative regimen and received a combination of Cyclosporine A (CsA) and mycophenolate mofetil (MMF) to prevent graft-versus-host disease (GVHD).
Results
56 out of 58 patients achieved engraftment with implantation rate 96.6%. The median time of ANC≥0.5×109/L was 17 (12–37) days, and that of PLT≥20×109/L 33 (17–140) days respectively. 24 cases developed acute GVHD (aGVHD), the incidence rate of grade Ⅱ to Ⅳ aGVHD was 30.4%. The chronic GVHD (cGVHD) was occured in 7 patients of the 49 evaluable patients, all were limited. The estimated 3-year overall survival (OS) and disease-free survival (DFS) were (60.3±6.4)% and (60.1±6.5)% respectively. And the cumulative incidences of 3-year non-relapse mortality (NRM) and relapse were 33.3% and 9.1% respectively. The 3-year OS rates of AML patients were (66.0±6.7)% for CR and (25.0±15.3)% for NR, differences were statistical significance.
Conclusion
For AML patients, UCBT was conducive to improve outcome with lower incidences of cGVHD and relapse, the patients after transplantation could obtain high quality of life.
Keywords: Cord blood transplantation; Leukemia, myeloid, acute; Unrelated donors; Survival analysis
急性髓系白血病(AML)是一组起源于髓系干、祖细胞的高度异质性恶性血液病。脐血由于来源丰富、采集过程无伤害、易于保存且能耐受HLA 1~2/6个位点不合的移植等独特优势,已成为除骨髓和外周血造血干细胞之外(特别是缺乏HLA相合同胞供者)的重要造血干细胞来源[1]–[2]。目前,脐血移植(umbilical cord blood trans plantation, UCBT)治疗恶性血液病在世界范围内得到了广泛应用[3]。自2006年9月至2013年11月,我中心对58例AML患者进行了强化清髓的UCBT,报道如下。
病例和方法
1.病例资料:2006年9月至2013年11月在安徽医科大学附属省立医院血液科接受UCBT治疗的58例AML患者纳入本研究。全部58例患者中,男36例,女22例,中位年龄14.5(3~36)岁,中位体重45(12~90) kg; FAB分型:M0 1例,M1 1例,M2 35例(含骨髓增生异常综合征转AML 1例),M4 3例,M5 14例,M6 3例,混合细胞白血病1例;49例(84.5%)为单份UCBT (sUCBT),9例(15.5%)为双份UCBT(dUCBT);50例(86.2%)为HLA 1~2/6个位点不合UCBT;第1次完全缓解期(CR1)36例,第二次完全缓解期(CR2)14例,未缓解(NR)8例,其中高危难治患者共43例(74.1%)。
2.脐血的选择:根据冻存前有核细胞数(TNC)、CD34+细胞数及HLA相合程度选择脐血。sUCBT要求:TNC>3.0×107/kg(受者体重)且CD34+细胞数≥1.2×105/kg(受者体重);低于以上标准者选择dUCBT,双份脐血中主份脐血TNC≥2.5×107/kg(受者体重)。供受者间HLA≥4/6个位点(HLA-A、B、DRB1位点血清学配型)相合。
3.预处理方案:全部58例患者均采用强化清髓预处理方案:①分次全身照射(sTBI)+阿糖胞苷(Ara-C)+环磷酰胺(Cy)方案(31例):sTBI 3 Gy每日2次×2 d, Ara-C 2 g/m2每日2次(间隔12 h)×2 d,Cy 60 mg·kg−1·d−1×2 d;②Ara-C或氟达拉滨(Flu)+白消安(Bu)+Cy方案(27例):Ara-C同前,Flu 30 mg·m−2·d−1×4 d, Bu 0.8 mg/kg每6 h 1次×4 d, Cy 60mg·kg−1·d−1×2 d。合并中枢神经系统白血病(CNSL)或具有CNSL高危因素的患者加用1次卡莫司汀(BCNU) 250 mg/m2。
4.移植物抗宿主病(GVHD)预防方案:全部患者均采用CsA+短程霉酚酸酯(MMF)预防GVHD。发生Ⅱ级及以上GVHD的患者加用甲泼尼龙(静脉给药)及其他免疫抑制剂治疗。
5.支持对症治疗:①预防肝静脉闭塞症(HVOD):预处理开始至移植后30 d持续应用低剂量肝素钠(PLT<20×109/L时停用)和前列腺素E1;②阿昔洛韦预防单纯疱疹病毒感染;③口服伊曲康唑预防真菌感染,有真菌感染既往史者改用伏立康唑口服;④口服复方磺胺甲恶唑预防卡氏肺囊虫感染;⑤采用实时定量聚合酶链反应(PCR)技术监测外周血巨细胞病毒(CMV)DNA拷贝数,当CMV-DNA≥103拷贝数/ml时加用更昔洛韦或膦甲酸钠联合静脉丙种球蛋白抢先治疗。移植后第6天开始使用重组人粒细胞集落刺激因子(rhG-CSF) 5 µg·kg−1·d−1静脉滴注,至白细胞计数恢复正常2 d停用。所有患者输入的血制品均经25 Gy X线照射,维持HGB≥80 g/L、PLT≥20×109/L。
6.疗效评定及随访:采集每例患者UCBT后第7、14、21天外周血标本和第30天骨髓标本,应用DNA短串联重复序列聚合酶链反应方法检测供、受者嵌合体变化。完全供者嵌合体(FDC)指嵌合体中供者成分>95%,混合嵌合体(MC)指嵌合体中供者成分占5%~95%。原发性植入失败定义为至移植后28 d中性粒细胞绝对值(ANC)<0.5×109/L且至少2次骨髓未检出供者成分。UCBT后连续3 d ANC≥0.5×109/L的第1天定义为中性粒细胞植入时间;脱离血小板输注7 d后,PLT连续3 d≥20×109/L的第1天定义为血小板植入时间。UCBT后骨髓象及嵌合体监测:前4个月每月检测1次,第6个月至2年每3个月检测1次,第3至5年每6个月检测1次。急性GVHD (aGVHD)、慢性GVHD (cGVHD)的诊断和分级采用西雅图标准。采用门诊或电话联系对所有患者进行随访。随访终点为2015年2月28日,存活患者中位随访时间为37.4(15.4~92.0)个月。
7.统计学处理:应用SPSS 17.0进行数据分析。应用Kaplan-Meier生存曲线进行生存分析,Log-rank检验进行生存率的比较,P<0.05为差异有统计学意义。
结果
1.移植的细胞数:①sUCBT:49例,中位年龄13(3~36)岁,中位体重为42(12~73)kg;受者输入复苏后脐血TNC中位数为3.76 (0.44~9.60)×107/kg,CD34+细胞中位数为1.98 (0.90~6.88)×105/kg。②dUCBT:9例,中位年龄24(19~36)岁,中位体重65(47~90)kg,受者输入复苏后脐血TNC中位数为4.93 (2.00~6.80)×107/kg,CD34+细胞中位数为2.11(1.45~3.42)×105/kg。
2.造血重建:49例sUCBT患者中47例获得造血重建,中性粒细胞植入、血小板植入的中位时间分别为17(12~37)、32.5(17~140) d。9例dUCBT患者全部获得造血重建,中性粒细胞植入、血小板植入中位时间为19(13~29)、42(24~112) d。患者移植后第21天和第30天外周血STR-PCR检测结果均为100%供者型,9例dUCBT患者最终均为1份脐血的完全嵌合。
3.植入前综合征(PES):58例患者中45例(77.6%)出现PES, 4例延续至重度GVHD。
4.GVHD发生情况:56例获得造血重建的患者中24例(42.9%)发生aGVHD,其中Ⅱ~Ⅳ度17例,Ⅲ~Ⅳ度10例。8例Ⅳ度aGVHD患者中7例治疗无效死亡(肠道aGVHD 5例、肠道合并肝脏aGVHD 2例),仅1例得到控制。所有患者应用甲泼尼龙2 mg·kg−1·d−1治疗均未得到控制,4例患者应用抗CD25单抗及甲氨蝶呤(MTX)治疗并输注脐血间充质干细胞,仅1例得到控制;2例患者加用英夫利昔单抗及MTX治疗,疗效亦不理想;1例患者应用抗CD25单抗3次,腹泻未控制,给予间充质干细胞治疗2次,效果仍不佳;另1例应用抗CD25单抗4次,腹泻及皮疹未控制,再次加用英夫利昔单抗1次,皮疹消退但腹泻仍未控制。
49例存活期>100 d的患者中,7例(14.3%)发生cGVHD(均为局限性),其中累及皮肤4例,累及胃肠道2例,自身免疫性溶血1例。所有发生cGVHD的患者经甲泼尼龙或CsA治疗后均得到控制。
5.其他并发症:20例患者于粒细胞缺乏期出现血流感染:大肠埃希菌11例,屎肠球菌3例,草绿色链球菌2例,肺炎克雷伯杆菌、小肠耶氏菌、铜绿假单胞菌和表皮葡萄球菌各1例,20例患者经抗菌药物治疗后均得到控制。2例患者在移植后100 d内发生肺真菌感染。13例患者在移植后30~120 d出现血CMV-DNA>103拷贝数/ml,无CMV病发生。4例出现出血性膀胱炎,经治疗均好转。未发生HVOD和间质性肺炎。
6.复发及转归:成功植入的56例患者中5例复发,其中2例合并髓外复发(睾丸、皮肤各1例),中位复发时间为97(55~233) d, 3年累积复发率为9.1%。骨髓复发的患者给予停用免疫抑制剂并加用乌苯美司治疗,1例患者治疗7 d后出现皮疹,复查骨髓原始细胞比例从0.090降至正常,至随访终点已无病生存367 d,余4例均放弃治疗死亡。
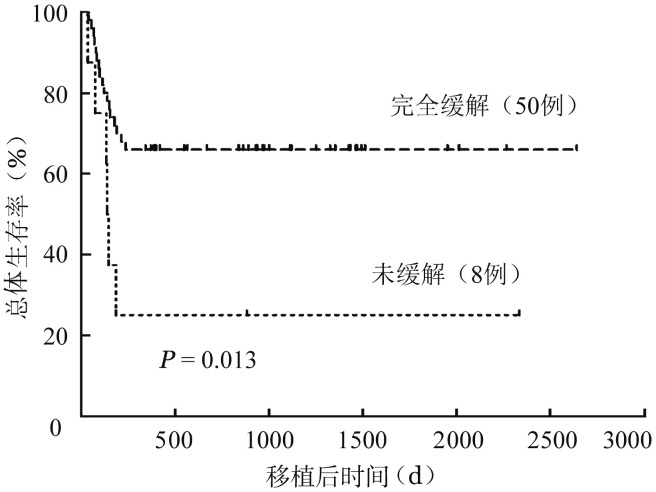
7.随访和生存情况:至随访终点,58例患者中35例(60.34%)存活,23例(39.66%)死亡。死亡原因:重度感染12例(肺感染9例、肠道感染2例、血流感染1例),原发病复发4例,重度aGVHD合并感染7例。23例患者死亡的中位时间为移植后122(36~238) d,其中移植后100 d内死亡9例(15.5%),180 d内死亡19例(32.8%)。预期3年累积总体生存(OS)率和无病生存(DFS)率分别为(60.3±6.4)%和(60.1±6.5)%。UCBT时处于CR患者(CR1 36例、CR2 14例)的3年预期OS率高于NR患者(8例) [(66.0±6.7)%对(25.0±15.3)%,P=0.013](图1)。
图1. 脐血移植前不同疾病状态急性髓系白血病患者的生存比较.
讨论
脐血作为一种替代供者,已逐渐成为HSCT重要的干细胞来源。在过去25年,已有超过30 000例患者接受了UCBT[4]。UCBT可获得与其他类型HSCT相似的生存率[5]–[6]。
本组UCBT患者获得了较高植入率。与其他移植中心研究结果[7]–[9]相比,本组患者的造血恢复亦较快。分析其原因:①我们采用强化清髓预处理方案,最大限度地清除了肿瘤细胞,促进了植入。②我们采用DNA短串联重复序列聚合酶链反应方法监测患者供、受者嵌合体变化,有利于早期发现原发性植入失败患者,及时进行二次挽救治疗,进一步提高了移植成功率。本研究58例AML患者2例原发性植入失败,其中1例患者在移植后1个月行单倍体移植挽救治疗,存活至今。
本组58例患者仅复发5例,累积3年复发率为9.1%。研究表明,UCBT不仅通过移植前大剂量的放化疗等清髓预处理杀伤白血病细胞,还可通过其强大的移植物抗白血病(GVL)效应清除残存的白血病细胞,远期疗效较好[10]。我中心采用强化清髓预处理方案,而且采用不含抗人胸腺细胞球蛋白(ATG)的预防GVHD方案,不仅保护了移植物中有限的T淋巴细胞,加速了移植后免疫重建,有利于早期GVL效应的发挥,而且避免了ATG引起的病毒感染[11]。
临床研究发现,尽管大多数UCBT受者与供者存在1~2个位点的HLA不匹配,但是与骨髓移植(BMT)和外周血造血干细胞移植(PBSCT)相比,UCBT后aGVHD的发病率显著降低。来自国际骨髓移植登记处(IBMTR)的数据表明,与1个位点不合的无关供者骨髓移植(URD)相比,4/6~6/6 HLA相合UCBT患者长期生存率相当、aGVHD发生率更低[12]。Ruggeri等[13]报道,567例UCBT成人AML患者Ⅱ~Ⅳ度aGVHD的发生率为26%。本组患者aGVHD的发生率较高(42.9%,24/56),Ⅳ度aGVHD的发生率达14.3%(8/56),分析其原因:8例Ⅳ度aGVHD患者中4例患者为2012年以前移植患者,当时对重度PES认识不足,没有PES危险度的分层标准,所以由PES延续为重度GVHD,最终治疗无效死亡;另4例患者中,1例系预防GVHD过程中患者自行停用MMF所致,其余3例Ⅳ度aGVHD患者中1例治疗后控制,存活至今,2例治疗无效死亡。7例患者死亡的主要原因均为重度aGVHD合并肠道感染和(或)肺感染所致多脏器功能衰竭。
PES亦称植入前免疫反应(pre-engraftment immune reactions,PIR)。PES为非血缘UCBT的特征性现象,出现于中性粒细胞植入前,是脐血植入时机体的一种免疫反应,主要临床表现为发热、皮疹、腹泻和(或)黄疸等症状[14],发生机制目前尚不明确。本治疗中心采用强化清髓性预处理方案体系患者PES发生率整体偏高,具体机制需进一步研究。重度PES会增加患者移植相关死亡率,需进行及时干预治疗。
cGVHD是影响移植后患者生存质量的重要因素。我中心以往研究发现,与同胞相合的BMT和PBSCT相比,UCBT造血恢复延迟,但两者中性粒细胞植入率差异无统计学意义(97.1%对100%,P=0.080),3年DFS率差异无统计学意义(55%对60%,P=0.105),UCBT患者cGVHD和广泛性cGVHD的发生率较低,能获得更好的生活质量[15]。本研究可评估的49例患者中仅7例(14.3%)发生cGVHD,且均为局限型,患者生活质量较高。
严重的感染可明显增加移植患者非复发死亡率,是UCBT失败的主要原因之一[16]。本组23例死亡患者中12例(52.17%)死于严重感染,因此,移植后特别是合并GVHD需增强免疫抑制治疗的患者,积极加强感染防治及促进免疫重建恢复十分必要。
本研究结果表明,强化清髓的UCBT治疗AML安全有效,患者移植后cGVHD发生率和复发率较低,可获得较高的生存质量。
Funding Statement
基金项目:安徽省“十二五”科技攻关项目(11010402164)
References
- 1.Hwang WY, Samuel M, Tan D, et al. A meta-analysis of unrelated donor umbilical cord blood transplantation versus unrelated donor bone marrow transplantation in adult and pediatric patients[J] Biol Blood Marrow Transplant. 2007;13(4):444–453. doi: 10.1016/j.bbmt.2006.11.005. [DOI] [PubMed] [Google Scholar]
- 2.Rocha V, Locatelli F. Searching for alternative hematopoietic stem cell donors for pediatric patients[J] Bone Marrow Transplant. 2008;41(2):207–214. doi: 10.1038/sj.bmt.1705963. [DOI] [PubMed] [Google Scholar]
- 3.孙 自敏. 脐血造血干细胞移植现状及展望[J] 国际输血及血液学杂志. 2011;34(2):97–99. [Google Scholar]
- 4.Gluckman E. Milestones in umbilical cord blood transplantation[J] Blood Rev. 2011;25(6):255–259. doi: 10.1016/j.blre.2011.06.003. [DOI] [PubMed] [Google Scholar]
- 5.Rocha V, Labopin M, Sanz G, et al. Transplants of umbilicalcord blood or bone marrow from unrelated donors in adults with acute leukemia[J] N Engl J Med. 2004;351(22):2276–2285. doi: 10.1056/NEJMoa041469. [DOI] [PubMed] [Google Scholar]
- 6.Eapen M, Rubinstein P, Zhang MJ, et al. Outcomes of transplantation of unrelated donor umbilical cord blood and bone marrow in children with acute leukaemia: a comparison study[J] Lancet. 2007;369(9577):1947–1954. doi: 10.1016/S0140-6736(07)60915-5. [DOI] [PubMed] [Google Scholar]
- 7.Barker JN, Weisdorf DJ, DeFor TE, et al. Transplantation of 2 partially HLA-matched umbilical cord blood units to enhance engraftment in adults with hematologic malignancy[J] Blood. 2005;105(3):1343–1347. doi: 10.1182/blood-2004-07-2717. [DOI] [PubMed] [Google Scholar]
- 8.Sanz J, Jaramillo FJ, Planelles D, et al. Impact on outcomes of human leukocyte antigen matching by allele-level typing in adults with acute myeloid leukemia undergoing umbilical cord blood transplantation[J] Biol Blood Marrow Transplant. 2014;20(1):106–110. [PubMed] [Google Scholar]
- 9.Sanz J, Sanz MA, Saavedra S, et al. Cord blood transplantation from unrelated donors in adults with high-risk acute myeloid leukemia[J] Biol Blood Marrow Transplant. 2010;16(1):86–94. doi: 10.1016/j.bbmt.2009.09.001. [DOI] [PubMed] [Google Scholar]
- 10.Verneris MR, Brunstein CG, Barker J, et al. Relapse risk after umbilical cord blood transplantation: enhanced graft-versusleukemia effect in recipients of 2 units[J] Blood. 2009;114(19):4293–4299. doi: 10.1182/blood-2009-05-220525. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.孙 自敏, 刘 会兰, 耿 良权, et al. TBI为主的不含ATG的清髓性预处理方案在非血缘脐血移植治疗成人恶性血液病中的应用[J] 中华医学杂志. 2012;92(24):1660–1665. [Google Scholar]
- 12.Laughlin MJ, Eapen M, Rubinstein P, et al. Outcomes after transplantation of cord blood or bone marrow from unrelated donors in adults with leukemia[J] N Engl J Med. 2004;351(22):2265–2275. doi: 10.1056/NEJMoa041276. [DOI] [PubMed] [Google Scholar]
- 13.Ruggeri A, Ciceri F, Gluckman E, et al. Alternative donors hematopoietic stem cells transplantation for adults with acute myeloid leukemia: Umbilical cord blood or haploidentical donors?[J] Best Pract Res Clin Haematol. 2010;23(2):207–216. doi: 10.1016/j.beha.2010.06.002. [DOI] [PubMed] [Google Scholar]
- 14.Wang X, Liu H, Li L, et al. Pre-engraftment syndrome after unrelated donor umbilical cord blood transplantation in patients with hematologic malignancies[J] Eur J Haematol. 2012;88(1):39–45. doi: 10.1111/j.1600-0609.2011.01709.x. [DOI] [PubMed] [Google Scholar]
- 15.Liu HL, Sun ZM, Geng LQ, et al. Similar survival, but better quality of life after myeloablative transplantation using unrelated cord blood vs matched sibling donors in adults with hematologic malignancies[J] Bone Marrow Transplant. 2014;49(8):1063–1069. doi: 10.1038/bmt.2014.102. [DOI] [PubMed] [Google Scholar]
- 16.Sauter C, Abboud M, Jia X, et al. Serious infection risk and immune recovery after double-unit cord blood transplantation without antithymocyte globulin[J] Biol Blood Marrow Transplant. 2011;17(10):1460–1471. doi: 10.1016/j.bbmt.2011.02.001. [DOI] [PMC free article] [PubMed] [Google Scholar]