Abstract
目的
分析T细胞淋巴瘤白血病患者A20基因非编码区(UTR)突变情况,了解A20基因调控改变特点。
方法
利用PCR和核苷酸序列分析方法检测52例T细胞白血病患者和99名健康对照者外周血单个核细胞中A20基因启动子区和3′UTR基因突变。
结果
在1例T细胞淋巴瘤白血病患者中,发现其A20基因启动子区存在错义突变(c.−672T>G),该突变在基因库中已作为单核苷酸多态性登记(rs139054966),同时发现在A20基因3′UTR mRNA的3916位点存在核苷酸替换(C>G),而在其他T细胞白血病样本和健康对照组中均未发现这两种改变。
结论
首次发现T细胞肿瘤中存在A20基因的rs139054966(c.−672T>G)和3916(C>G)改变,前者位于转录因子P53的结合区域,其具体意义有待进一步明确。
Keywords: A20基因, 3′非编码区, 启动子, T细胞淋巴瘤白血病, 多态性,单核苷酸
Abstract
Objective
To clarify the characteristics of the A20 regulatory changes by analyzing mutations in the non-coding region of the A20 gene in patients with T-cell lymphoma leukemia (T-LCL).
Methods
PCR and nucleotide sequence analysis were used to detect mutations in the non-coding region of the A20 gene, and DNA samples from PBMCs of 52 cases of T-LCL and 99 healthy controls.
Results
A missense mutation (c.−672T>G) was detected in the A20 gene promoter from one T-LCL patient, which has been registered as a SNP (rs139054966) in gene bank. Meanwhile, a new mutation was detected in the 3′ UTR mRNA (3916 (C>G)). These two mutations were absent in other T-LCL samples and controls.
Conclusion
The rs139054966 (c.−672T>G) and 3916 (C>G) mutations in the A20 gene were detected in T-LCL patients for the first time. There was also rs139054966 located on the binding region of the transcription factor P53, and its significance remained to be further clarified.
Keywords: A20 gene; 3′UTR; Promoter; T cell lymphoma cell leukemia; Polymorphism, single nucleotide
T细胞白血病/淋巴瘤(T cell leukemia/lymphoma)是一类预后较差的血液肿瘤,T细胞淋巴瘤白血病(T cell lymphoma cell leukemia,T-LCL)是淋巴瘤白血病期,具有高度侵袭性,预后差[1]–[2],这与其发病机制复杂和肿瘤异质性相关。涉及T细胞白血病发生的分子多数与T细胞活化信号通路相关,如Notch1等[3]。近年来,有研究显示NF-κB的负调控因子A20(又称肿瘤坏死因子α诱导蛋白,TNFAIP3)的异常表达和功能缺失与淋巴细胞肿瘤密切相关[4]–[5]。也有研究显示A20基因的单核苷酸多态性(SNP)与一些自身免疫性疾病相关[6]。我们在前期研究中也发现T细胞肿瘤中存在A20基因的突变或SNP[7],但有关A20基因非编码区(UTR)的SNP等改变并不清楚,后者涉及到A20的表观遗传调控。故本研究对A20基因启动子区和3′UTR核苷酸序列进行检测,并对1例T-LCL患者的A20基因进行突变检测,发现2个尚未报道的新突变,现报道如下。
病例与方法
1.临床资料:患者,男,19岁,因颈部多发肿物就诊于外院,血常规示:WBC 4.64 ×109/L,HGB 129 g/L,PLT 207×109/L;淋巴结活检病理示:T淋巴细胞型淋巴瘤;免疫组化示:CD68(−),TdT(灶+),CD20(−),CD3(灶+),Ki-67 50%,CD21(−),CD10(灶+)。10 d后就诊于本院。查胸部CT示:右肺上叶前段少许炎症;双侧腋窝及纵隔内多发淋巴结肿大;前纵隔类圆形软组织密度影。脾脏体积增大。B超显示:左肾小结石;颈部双侧血管鞘、耳前、耳后、颌下见肿大淋巴结。骨髓细胞形态学检测显示淋巴瘤白血病可能性大(图1A、B)。骨髓免疫分型示:病态细胞组群占62.15%,呈CD45弱阳性,SSC较小。细胞表型:CD34(+),CD38(+),CD7(++),CD10(部分+),CD3(dim+),CD33(+),CD45RA(+),cTdT(+),cCD3(+)。骨髓FISH示:未见异常杂交信号。确诊T淋巴母细胞淋巴瘤Ⅳ期A。先后予Hyper-CVAD A+左旋门冬酰胺酶(L-Asp)、Hyper-CVAD B、VDCLP、EPOCH+培门冬酶(PEG-Asp)化疗方案后,骨髓细胞形态学显示T淋巴母细胞白血病完全缓解(CR),幼稚淋巴细胞占0.020(图1C、D)。开始予2个疗程EPOCH+PEG-Asp化疗,进行无关供者异基因造血干细胞移植。患者移植后+12 d粒系重建,+14 d巨核系重建。本研究的对照组包括51例T细胞急性淋巴细胞白血病(T-ALL)和99名健康人的外周血单个核细胞样本。
图1. T细胞淋巴瘤白血病患者骨髓形态学结果(瑞氏-吉姆萨染色,×100).

A、B:初诊时骨髓细胞形态学;C、D:移植时骨髓细胞形态学
2.实验方法:收集患者和健康人EDTA抗凝外周血2 ml,按常规方法分离外周血单个核细胞和提取DNA,用于PCR检测。根据基因库所登记的A20基因的序列信息(NM_006290.3)确定A20基因启动子和3′UTR的位置和序列,利用Primer premier5.0软件设计7对引物,引物由上海英潍捷基生物有限公司合成(表1)[8]。本研究使用Invitrogen公司的Platinum® Taq DNA聚合酶试剂盒,反应体系为20 µl:基因组DNA1 µl、Taq聚合酶0.2 µl、5×缓冲液4 µl、dNTP 2 µl、Mg2+ 2 µl、上下游引物各1 µl,以及超纯水8.8 µl;扩增条件:首先94 °C 5 min、94 °C 1 min、57 °C 1 min、72 °C 1 min循环30次,最后72 °C 10 min。扩增产物用15 g/L琼脂糖凝胶电泳。挑取阳性PCR扩增产物送Invitrogen公司测序。
表1. 用于PCR检测A20基因序列的引物.
| 名称 | 序列(5′→3′) | 功能 | 产物大小(bp) |
| A20-P1-F | TTTACAAAGGAGCACCAGCAGGAGA | A20启动子 | 754 |
| A20-P1-R | ATTACATTTAAGAATACTTGTCAGG | ||
| A20-P2-F | AAGTGCCACCCTCCATCC | A20启动子 | 681 |
| A20-P2-R | AGCGGTGACAGCCTTTGG | ||
| A20-P3-F | GGTGAGTGTTGTTCTGATTC | A20启动子 | 634 |
| A20-P3-R | TCACGTGACTCTCTGGGTCG | ||
| A20-UTR1-F | CAACGGATACTGCAACGAAT | A20 3′UTR | 512 |
| A20-UTR1-R | CTCGCTGCCATGAGGATCT | ||
| A20-UTR2-F | GAGAAGCCAGAGCCATTCCACCT | A20 3′UTR | 516 |
| A20-UTR2-R | GCTCATGCCCCAACAACAACCA | ||
| A20-UTR3-F | GCTGCCCTAGAAGTACAATA | A20 3′UTR | 650 |
| A20-UTR3-R | GACAGCAACCACAAAGCACAC | ||
| A20-UTR4-F | CCCAGAGATAAAGGCTGCCAT | A20 3′UTR | 450 |
| A20-UTR4-R | GGAAGCACAGTCTTAATATC |
注:P:启动子;F:上游引物;R:下游引物;UTR:非编码区
结果
1.A20基因启动子及3′UTR特点分析和扩增结果:根据GeneBank数据库(http://www.ncbi.nlm.gov)中所登记的A20基因的序列信息,在A20翻译起始位点上游2 kb为启动子序列,设计3段引物扩增A20基因启动子;而A20 3′UTR全长共1 995 bp,设计4段引物扩增3′UTR。所扩增的PCR产物经琼脂糖凝胶电泳分析,均可见扩增出相应大小的DNA片段的阳性产物,各片段大小分别见表1。
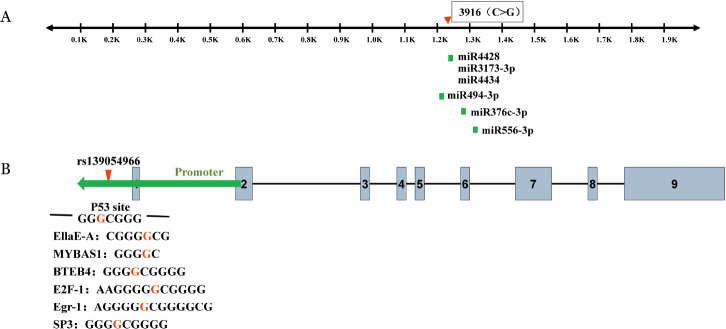
2.1例T-LCL患者A20基因启动子和3′UTR测序结果:对各PCR产物进行核苷酸序列分析,结果显示该患者A20基因启动子区存在错义突变c.−672T>G,经检索,该位点为基因库登记的SNP改变,编号为rs139054966(图2A),同时发现在3′UTR mRNA的3916位点发现核苷酸替换(C>G)(图2A),这两个突变在其他51例T-ALL患者和99名对照者中未发现。本研究所发现的T-LCL患者中A20基因座上突变/多态性位置如图2B。
图2. T细胞淋巴瘤白血病患者中A20基因单核苷酸多态性(SNP)和突变情况.

A:A20基因启动子SNP(rs139054966)和3′UTR 3916位点核苷酸替换(C>G);B:A20基因结构和突变位点示意图
3.靶突变位点功能预测及分析:通过TargetScan、miRBase等软件预测能与A20 3′UTR区域结合的miRNA,发现3916 C>G位于miRNA4428、miRNA3173-3p和miRNA4434与A20 3′UTR结合区域内(图3A)。通过PROMO、GENECARDS等数据库查找A20基因的转录因子,发现A20基因启动子检出的错义突变rs139054966(c.−672T>G)位于P53、SP3、Egr-1和E2F等转录因子结合位点上(图3B)。
图3. A20基因3916(C>G)(A)和rs139054966突变位点(B)功能预测示意图.
讨论
T-LCL为淋巴瘤细胞播散入血液及侵犯骨髓阶段,其肿瘤克隆的特点可能与T细胞白血病细胞有所差异,这些差异可能体现在遗传学和表观遗传学上的改变。基于A20在淋巴瘤尤其是B细胞淋巴瘤中的改变及其可能在肿瘤发生中的作用[9],我们在前期研究中也发现了T-ALL和一例皮肤性T细胞淋巴瘤(Sezary综合征)患者的A20基因突变和SNP改变特点有所不同[7],[10]。本研究进一步比较分析了T-LCL的A20改变特点。结果发现其启动子和3′UTR检出的SNP是在其他T-ALL中未发现的改变。这些突变的意义还有待进一步通过功能验证进行明确。
对A20启动子特征分析发现其主要含有识别NF-κB转录因子的κB元件,这是A20主要调控NF-κB的依据。通过PROMO、GENECARDS等数据库查找A20基因的转录因子,发现本研究检出的A20启动子部位c.−672T>G(rs139054966)位于P53、SP3、Egr-1、E2F等转录因子结合位点上,这些转录因子尤其是P53在DNA修复和细胞凋亡等都具有重要作用。因此,该样本中所出现的A20 c.−672T>G可能涉及的影响值得我们进一步研究。
在miRNA靶基因结合位点上的基因突变,可以影响miRNA与靶基因mRNA的亲和力,miRNA与靶mRNA不完全互补,则在蛋白质翻译水平上抑制其表达。在A20基因的3′UTR中包含有4个“ATTTA”序列,“ATTTA”序列经常被发现于免疫应答炎症相关介质的3′UTR中,可以控制A20表达的瞬时性特性。通过TargetScan和miRBase等软件预测显示,本研究中所发现的A20 3916C>G位于与miRNA4428、miRNA3173-3p、miRNA4434的结合靶点,故该突变也可能通过影响这些miRNA与A20 3′UTR结合形成的空间构象而导致A20基因的异常表达[11]–[12],还有待进一步通过克隆和转导突变型3′UTR来验证其功能。
综上所述,本研究通过核苷酸序列分析的方法检测一例T-LCL患者的A20基因的3′UTR和启动子区域,发现新突变3916(C>G)和SNP rs139054966,该研究补充了A20基因突变的数据,也丰富了T-LCL细胞分子遗传学改变的资料,为进一步分析疾病关联的A20基因3′UTR和启动子突变或多态性提供基本资料。
Funding Statement
基金项目:广东省科技计划项目(2016A020215123、2015A050502029);国家自然科学基金(91129720)
Fund program: Guangdong Provincial Science and Technology Plan Project(2016A020215123, 2015A050502029); National Natural Science Foundation of China(91129720)
References
- 1.张 景航, 杨 晓煜, 李 敏, et al. MicroRNA-191在T淋巴母细胞性白血病/淋巴瘤中的表达及其作用机制研究[J] 中华血液学杂志. 2016;37(4):273–277. doi: 10.3760/cma.j.issn.0253-2727.2016.04.003. [DOI] [Google Scholar]
- 2.归 微, 赵 志强, 张 宗, et al. 淋巴瘤白血病的病理类型与临床特征分析[J] 中华血液学杂志. 2009;30(10):662–666. doi: 10.3760/cma.j.issn.0253-2727.2009.10.005. [DOI] [PubMed] [Google Scholar]
- 3.Valliyammai N, Nancy NK, Sagar TG, et al. Study of NOTCH1 and FBXW7 mutations and its prognostic significance in South Indian T-cell acute lymphoblastic leukemia[J] J Pediatr Hematol Oncol. 2018;40(1):e1–e8. doi: 10.1097/MPH.0000000000001006. [DOI] [PubMed] [Google Scholar]
- 4.Kato M, Sanada M, Kato I, et al. Frequent inactivation of A20 in B-cell lymphomas[J] Nature. 2009;459(7247):712–716. doi: 10.1038/nature07969. [DOI] [PubMed] [Google Scholar]
- 5.Braun FC, Grabarczyk P, Möbs M, et al. Tumor suppressor TNFAIP3 (A20) is frequently deleted in Sézary syndrome[J] Leukemia. 2011;25(9):1494–1501. doi: 10.1038/leu.2011.101. [DOI] [PubMed] [Google Scholar]
- 6.Zhu L, Wang L, Wang X, et al. Characteristics of A20 gene polymorphisms and clinical significance in patients with rheumatoid arthritis[J] J Transl Med. 2015;13:215. doi: 10.1186/s12967-015-0566-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Zhu L, Zhang F, Shen Q, et al. Characteristics of A20 gene polymorphisms in T-cell acute lymphocytic leukemia[J] Hematology. 2014;19(8):448–454. doi: 10.1179/1607845414Y.0000000160. [DOI] [PubMed] [Google Scholar]
- 8.周 玲玲, 朱 丽花, 陆 帅, et al. 健康人外周血中A20基因3′UTR突变与多态性分析[J] 暨南大学学报:自然科学与医学版. 2016;37(1):7–11. doi: 10.11778/j.jdxb.2016.01.002. [DOI] [Google Scholar]
- 9.Honma K, Tsuzuki S, Nakagawa M, et al. TNFAIP3/A20 functions as a novel tumor suppressor gene in several subtypes of non-Hodgkin lymphomas[J] Blood. 2009;114(12):2467–2475. doi: 10.1182/blood-2008-12-194852. [DOI] [PubMed] [Google Scholar]
- 10.Zhou L, Zheng H, Huang X, et al. Different genetic alteration of A20 in a Sézary syndrome case with Vα2-Jα22 T cell clone[J] Asia Pac J Clin Oncol. 2018;14(2):e116–e123. doi: 10.1111/ajco.12672. [DOI] [PubMed] [Google Scholar]
- 11.Bittel DC, Kibiryeva N, Marshall JA, et al. MicroRNA-421 dysregulation is associated with tetralogy of fallot[J] Cells. 2014;3(3):713–723. doi: 10.3390/cells3030713. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Hammer S, Toenjes M, Lange M, et al. Characterization of TBX20 in human hearts and its regulation by TFAP2[J] J Cell Biochem. 2008;104(3):1022–1033. doi: 10.1002/jcb.21686. [DOI] [PubMed] [Google Scholar]