Abstract
目的
观察自体外周血造血干细胞移植(APBSCT)对于急性髓系白血病(AML)完全缓解期(CR)患者的疗效,并探讨影响APBSCT疗效的危险因素。
方法
对接受APBSCT治疗的全部55例AML患者的临床资料进行了回顾性研究,计算总生存(OS)率、无病生存(DFS)率、复发率,并对影响预后的各因素进行统计学分析。
结果
全部55例患者中,男35例,女20例,移植时中位年龄28(12~51)岁。移植后中位随访时间为1 091(20~3 024) d, 3年OS率、DFS率分别为77.1%(95% CI 71.2%~83.8%)、73.7%(95% CI 67.2%~80.3%)。移植后微小残留病(MRD)转阴<200 d组(27例)的DFS率高于≥200 d转阴组(8例)(88.9%对46.9%,P=0.042);移植前MRD持续阴性患者3年DFS率为90.0%,MRD非持续阴性组为61.1%,但差异无统计学意义(P=0.090)。从确诊到MRD转阴时间为影响AML患者CR期行APBSCT预后的独立因素[RR=0.022(95% CI 0.001~0.604),P=0.024]。
结论
APBSCT是CR期AML患者的有效治疗方法。移植前监测MRD水平有助于判断APBSCT预后。
Keywords: 白血病,髓样,急性, 造血干细胞移植, 无病生存, 微小残留病
Abstract
Objective
To evaluate the outcome of patients with acute myeloid leukemia (AML) received autologous hematopoietic stem cell transplantation (APBSCT) in complete remission (CR), and to study the prognostic factors.
Methods
55 cases of AML who underwent APBSCT in CR between 2008 and 2014 were retrospectively investigated. Major end points of study included overall survival (OS), disease free survival (DFS), relapse rate and transplantation related mortality.
Results
The median follow-up time was 1 091(20–3 024) days after transplantation. The 3-year OS and DFS rates were 77.1% (95%CI 71.2%–83.8%), 73.7% (95%CI 67.2%–80.3%), respectively. 3-year DFS for patients needed less than 200 days to attain minimal residual disease (MRD) ≤0.03% was significantly higher than that of patients required 200 days or more (88.9% vs 46.9%, P=0.042). 3-year DFS for patients with constant MRD negative 90.0% was greater than that of the remaining group 61.1%, but the difference was insignificant (P=0.090). A multivariate analysis of risk factors for relapse identified days from diagnosis to MRD negative was the only independent factor [RR=0.022 (95% CI 0.001–0.604), P=0.024].
Conclusion
The results suggested that most AML patients in CR obtained long-term DFS after APBSCT, and continuous monitoring minimal residual disease could be used to evaluate whether adult AML patients should receive APBSCT or not.
Keywords: Leukemia, myeloid, acute; Peripheral blood stem cell transplantation; Disease-free survival; Minimal residual disease
自体外周血造血干细胞移植(APBSCT)起初是作为治疗没有合适供者行异基因造血干细胞移植(allo-HSCT)的急性髓系白血病(AML)患者的替代治疗方案。清髓性预处理后进行APBSCT,可以有比化疗更高的抗肿瘤效应,并且不会出现包括移植物抗宿主病(GVHD)等allo-HSCT相关并发症,减少移植相关死亡[1]–[3]。AML是一组起源于造血干细胞的异质性疾病,患者疗效差异很大[4]–[7]。Walter等[8]报道移植前应用流式细胞术检测微小残留病(MRD)水平可以预测AML患者allo-HSCT后复发,但AML患者移植前MRD水平与APBSCT预后的相关性鲜有报道。我们对2008年1月至2014年1月55例完全缓解(CR)期接受APBSCT治疗AML患者的临床资料进行了回顾性分析,观察疗效并探讨预后影响因素。
病例与方法
1.病例:本研究纳入2008年1月至2014年1月在我院移植中心进行APBSCT的55例CR期AML患者。男35例,女20例,移植时中位年龄28(12~51)岁。所有患者均因无合适供者行allo-HSCT或患者意愿强烈而行APBSCT。
2.移植前治疗方案:55例患者中48例(87.3%)采用高三尖杉酯碱、蒽环类药物和阿糖胞苷(Ara-C)三药联合方案诱导缓解治疗,5例采用蒽环类药物和Ara-C联合方案诱导缓解治疗,2例外院转诊患者诱导治疗方案不明。获得第1次CR(CR1)后行多个疗程包含蒽环类药物联合标准剂量/中剂量/大剂量Ara-C方案的强化巩固治疗。中枢神经系统白血病的预防采用甲氨蝶呤、地塞米松、Ara-C鞘内注射。所有患者移植前骨髓原始细胞比例均< 0.005,均达到CR标准。
3.自体干细胞采集与回输:外周血干细胞(PBSC)动员均采用由蒽环类药物+中剂量Ara-C+重组人粒细胞集落刺激因子方案,当WBC升至5.0×109/L后,单采自身外周血单个核细胞(MNC)后冻存于液氮(−80 °C)中。回输MNC、CD34+细胞中位数分别为6.8(1.0~13.6)× 108/kg、2.4(0.3~7.8)× 106/kg。细胞采集后均在6个月内回输。
4.预处理方案:所有患者均接受白消安(Bu)+环磷酰胺(Cy)+氟达拉滨(Flu)+ Ara-C的改良清髓性预处理方案[1]:Bu 3.2 mg·kg−1·d−1×3~4 d,Cy 50 mg·m−2 ·d−1×2 d,Flu 30 mg·m−2 ·d−1×3 d,Ara-C2 g·m−2·d−1×3 d。
5.MRD检测:于诱导及巩固化疗结束后、PBSC采集前、移植前等多个时间点采集患者骨髓标本,应用免疫荧光标记法和多色流式细胞术进行MRD检测(美国BD公司FACS CantoⅡ型流式细胞仪),每管至少收集50万个细胞,采用FACSDiva™软件(美国BD公司产品)进行分析。目前确切的MRD定量水平与AML预后的关系尚未确定[9]–[12],我们选取0.03%作为判定MRD的阈值。
6.随访:随访方式包括门诊、电话及电子邮件。随访截至2015年12月31日或患者死亡。移植后中位随访时间为1 091(20~3 024) d。观察指标包括总生存(OS)、无病生存(DFS)、复发率及非复发相关死亡(NRM)。OS:确诊至患者死亡或随访终点。DFS:患者获得CR至复发、死亡或随访终点。NRM:移植后与移植相关的死亡事件。
7.统计学处理:应用SPSS21.0软件及R软件完成数据分析。应用ROC曲线计算出连续变量对观察指标造成影响的阈值。OS率及DFS率的分析应用Kaplan-Meier生存分析,组间比较应用Log-rank检验。复发率及NRM的估计应用累积发生率函数,以复发和NRM作为竞争风险。危险因素分析应用时间依赖的Cox比例风险回归模型,单因素分析P值<0.10的危险因素纳入多因素分析。统计学检验水准为双侧P值<0.05。
结果
1.一般资料:病种分布:M1 1例(1.8%),M2 27例(49.1%),M4 6例(10.9%),M5 21例(38.2%)。初诊时WBC中位数为12.7(0.8~180.0)×109/L。确诊时流式细胞术检测骨髓原始细胞比例中位数为66.7%(16.4%~99.6%)。根据2015年NCCN指南对46例患者进行细胞遗传学和分子生物学分级:预后良好组15例(27.3%),预后中等组26例(47.3%),预后不良组5例(9.1%)。诱导化疗疗程中位数为1(1~3)个,1个疗程44例(70.0%),≥2个11例(20.0%)。缓解后疗程中位数为4(1~6)个,<5个40例(72.7%),≥5个15例(27.%)。移植前流式细胞术检测骨髓流式原始细胞比例中位数为0(0~1.07%)。回输单个核细胞(MNC)中位数为6.8(1.0~13.6)× 108/kg,CD34+细胞中位数为2.4(0.3~7.8)×106/kg。35例患者移植前监测MRD,其中20例(36.4%)为持续阴性,确诊至MRD转阴中位时间为92(32~262) d,其中<200 d、≥200 d分别为27例(49.1%)、8例(14.5%)。
2.造血重建:所有患者均获得造血重建,中性粒细胞重建[外周血中性粒细胞绝对值(ANC)> 0.5×109/L持续3 d以上]的中位时间为15(10~62) d,血小板重建(脱离血小板输注、PLT>20×109/L持续7 d以上)的中位时间为40(9~200) d。
3.生存分析:截至2015年12月31日,共有43例患者存活。3年OS率和DFS率分别为77.1%(95% CI 71.2%~83.8%)、73.7%(95% CI 67.2%~80.3%)。13例患者死亡,其中NRM 2例(心肾衰竭、双肺感染呼吸衰竭各1例),均发生于移植后1年内。复发13例,均为骨髓复发,中位复发时间为移植后220(89~965) d,其中10例死亡,3年累积复发率为23.6%(95% CI 13.3%~35.6%)。
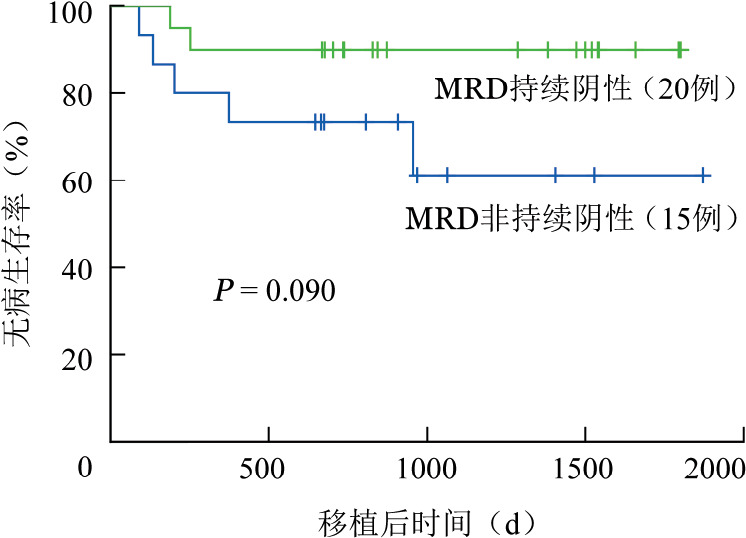
4.MRD对预后的影响:应用ROC曲线计算从确诊至MRD转阴所需时间的截点为200 d。MRD转阴≥200 d组8例,其中4例复发并死亡;MRD转阴<200 d组27例,其中3例复发,2例死亡。MRD转阴<200 d组的3年DFS率高于MRD转阴≥200 d组(88.9%对46.9%,P=0.042)(图1)。移植前MRD持续阴性的20例患者中仅2例复发,3年DFS率与移植前MRD非持续阴性组比较差异无统计学意义(90.0%对61.1 %,P=0.090)(图2)。
图1. 确诊到微小残留病(MRD)转阴时间<200 d与≥200 d组患者的无病生存曲线.

图2. 移植前微小残留病(MRD)持续阴性对急性髓系白血病自体外周血造血干细胞移植患者生存的影响.
5.细胞遗传学和分子生物学异常对预后的影响:预后中等组(26例)5例复发,3年DFS率为78.1%,仅较预后良好组(15例)患者的80.0%下降约2%;预后不良组(5例)DFS率均显著低于其余两组(图3)。预后中等组中19例患者具有可分析MRD资料,移植前MRD持续阴性的11例患者均无病生存,而MRD非持续阴性的8例患者3年DFS率仅为37.5%(P=0.018)(图4)。
图3. 细胞遗传学及分子遗传学分级对急性髓系白血病自体外周血造血干细胞移植患者无病生存率的影响(预后良好组与预后不良组比较,P=0.075;预后中等组与预后不良组比较,P=0.027).

图4. 预后中等组移植前微小残留病(MRD)持续阴性与非持续阴性患者的无病生存曲线.

6.其他移植前危险因素分析:患者性别、移植时年龄、FAB分型、发病时WBC、确诊时骨髓流式原始细胞比例、诱导及巩固化疗疗程数目、移植前流式细胞术检测MRD水平、采集物来源、回输MNC数及CD34+细胞数对患者DFS均无显著影响。
7.影响DFS率的多因素分析:将所有单因素分析中P值<0.1的指标纳入多因素分析,发现确诊至MRD转阴时间为影响CR期AML患者APBSCT预后的独立因素[P=0.024, RR=0.022(95% CI 0.001~0.604)](表1)。
表1. 55例急性髓系白血病患者自体外周血造血干细胞移植无病生存率的影响因素.
| 因素 | 单因素分析 |
多因素分析 |
||
| RR(95% CI) | P值 | RR(95% CI) | P值 | |
| 危险度分层a | ||||
| 预后良好组 | 0.233(0.047~1.161) | 0.075b | 1.553(0.061~39.569) | 0.790 |
| 预后中等组 | 0.197(0.046~0.831) | 0.027c | 0.135(0.007~2.701) | 0.190 |
| 预后不良组 | 1 | 1 | ||
| 确诊到MRD转阴时间d | ||||
| <200 d | 0.210(0.047~0.942) | 0.042 | 0.022(0.001~0.604) | 0.024 |
| ≥200 d | 1 | 1 | ||
| 移植前MRD持续阴性d | ||||
| 是 | 0.267(0.052~1.376) | 0.090 | 0.257(0.026~2.516) | 0.243 |
| 否 | 1 | 1 | ||
注:a:多因素分析中可分析病例数为46例;b:预后良好组与预后不良组比较;c:预后中等组与预后不良组比较;d:多因素分析中可分析病例数为35例。MRD:微小残留病
讨论
年轻初诊AML患者的CR率可达80%,但若不进行巩固治疗,大部分会在几个月内复发[16]。目前,CR期AML患者的强化治疗包括大剂量化疗、APBSCT和allo-HSCT,但最佳个体化治疗方案尚未明确(尤其是没有合适供者行allo-HSCT的患者)[13]–[14],[16]–[18]。为了明确MRD动态水平与APBSCT预后的相关性,我们连续观察移植前MRD水平,结果显示,移植前患者MRD若能够持续阴性,3年DFS率高达90%,MRD转阴后在化疗过程中再次转阳患者的DFS率则为61.1%,故AML患者达到MRD阴性后,若有自体移植意愿或必须移植而没有合适供者时,应尽可能维持其骨髓MRD水平持续阴性。此外,MRD转阴所需时间较短的患者DFS率较高。Kayser等[19]的研究结果显示,MRD转阴所需时间的长短反映肿瘤细胞对化疗药物的敏感性,即对化疗越敏感所需时间就越短,患者的预后也较好。
目前AML的治疗主要根据细胞遗传学和分子生物学特征进行危险度分层治疗,预后中等组患者CR1后的治疗一直存在争议[16]。本研究中,预后中等组患者能够获得与预后良好组相近的DFS率(78.1%对80.0%)。值得注意的是,预后中等组中移植前MRD持续阴性患者的DFS率高于MRD非持续阴性组(100.0%对37.5%),这表明持续监测MRD对预后中等组AML患者治疗方案的选择更具意义,诱导化疗获得CR且MRD持续阴性的预后中等组患者强烈推荐行APBSCT。
本研究结果表明,大部分CR期AML患者通过APBSCT可以获得长期无病生存,诊断至MRD转阴较短、移植前MRD持续阴性的患者可获得良好的长期生存;在移植前MRD持续阴性的预后中等组AML患者可更多地获益于APBSCT。上述结论还需要多中心、大样本量临床研究加以验证。
References
- 1.Burnett AK, Goldstone AH, Stevens RM, et al. Randomised comparison of addition of autologous bone-marrow transplantation to intensive chemotherapy for acute myeloid leukaemia in first remission: results of MRC AML 10 trial[J] Lancet. 1998;351(9104):700–708. doi: 10.1016/S0140-6736(97)09214-3. [DOI] [PubMed] [Google Scholar]
- 2.Vellenga E, van Putten W, Ossenkoppele GJ, et al. Autologous peripheral blood stem cell transplantation for acute myeloid leukemia[J] Blood. 2011;118(23):6037–6042. doi: 10.1182/blood-2011-07-370247. [DOI] [PubMed] [Google Scholar]
- 3.Wetzel D, Mueller BU, Mansouri Taleghani B, et al. Delayed Haematological recovery after autologous stem cell transplantation is associated with favourable outcome in acute myeloid leu-kaemia[J] Br J Haematol. 2015;168(2):268–273. doi: 10.1111/bjh.13118. [DOI] [PubMed] [Google Scholar]
- 4.Grimwade D, Hills RK. Independent prognostic factors for AML outcome[J] Hematology Am Soc Hematol Educ Program. 2009:385–395. doi: 10.1182/asheducation-2009.1.385. [DOI] [PubMed] [Google Scholar]
- 5.Wang Y, Liu DH, Liu KY, et al. Impact of pretransplantation risk factors on post transplantation outcome of patients with acute myeloid leukemia in remission after haploidentical hematopoietic stem cell transplantation[J] Biol Blood Marrow Transplant. 2013;19(2):283–290. doi: 10.1016/j.bbmt.2012.10.002. [DOI] [PubMed] [Google Scholar]
- 6.Wetzel D, Mueller BU, Mansouri TB, et al. Delayed Haematological recovery after autologous stem cell transplantation is associated with favourable outcome in acute myeloid leukaemia[J] Br J Haematol. 2015;168(2):268–273. doi: 10.1111/bjh.13118. [DOI] [PubMed] [Google Scholar]
- 7.Kumar CC. Genetic abnormalities and challenges in the treatment of acute myeloid leukemia[J] Genes Cancer. 2011;2(2):95–107. doi: 10.1177/1947601911408076. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Walter RB, Buckley SA, Pagel JM, et al. Significance of minimal residual disease before myeloablative allogeneic hematopoietic cell transplantation for AML in first and second complete remission[J] Blood. 2013;122(10):1813–1821. doi: 10.1182/blood-2013-06-506725. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.San Miguel JF, Martínez A, Macedo A, et al. Immunophenotyping investigation of minimal residual disease is a useful approach for predicting relapse in acute myeloid leukemia patients[J] Blood. 1997;90(6):2465–2470. [PubMed] [Google Scholar]
- 10.Buccisano F, Maurillo L, Spagnoli A, et al. Cytogenetic and molecular diagnostic characterization combined to postconsolidation minimal residual disease assessment by flow cytometry improves risk stratification in adult acute myeloid leukemia[J] Blood. 2010;116(13):2295–2303. doi: 10.1182/blood-2009-12-258178. [DOI] [PubMed] [Google Scholar]
- 11.Buccisano F, Maurillo L, Del PMI, et al. Prognostic and therapeutic implications of minimal residual disease detection in acute myeloid leukemia[J] Blood. 2012;119(2):332–341. doi: 10.1182/blood-2011-08-363291. [DOI] [PubMed] [Google Scholar]
- 12.Buckley SA, Appelbaum FR, Walter RB. Prognostic and therapeutic implications of minimal residual disease at the time of transplantation in acute leukemia[J] Bone Marrow Transplant. 2013;48(5):630–641. doi: 10.1038/bmt.2012.139. [DOI] [PubMed] [Google Scholar]
- 13.Döhner H, Estey EH, Amadori S, et al. Diagnosis and management of acute myeloid leukemia in adults: recommendations from an international expert panel, on behalf of the European LeukemiaNet[J] Blood. 2010;115(3):453–474. doi: 10.1182/blood-2009-07-235358. [DOI] [PubMed] [Google Scholar]
- 14.Creutzig U, Kaspers GJ. Revised recommendations of the International Working Group for diagnosis, standardization of response criteria, treatment outcomes, and reporting standards for therapeutic trials in acute myeloid leukemia[J] J Clin Oncol. 2004;22(16):3432–3433. doi: 10.1200/JCO.2004.99.116. [DOI] [PubMed] [Google Scholar]
- 15.Oudin C, Chevallier P, Furst S, et al. Reduced-toxicity conditioning prior to allogeneic stem cell transplantation improves outcome in patients with myeloid malignancies[J] Haematologica. 2014;99(11):1762–1768. doi: 10.3324/haematol.2014.105981. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Burnett AK. Acute myeloid leukemia: treatment of adults under 60 years[J] Rev Clin Exp Hematol. 2002;6(1):26–45. doi: 10.1046/j.1468-0734.2002.00058.x. [DOI] [PubMed] [Google Scholar]
- 17.中华医学会血液学分会. 成人急性髓系白血病(非急性早幼粒细胞白血病)中国诊疗指南(2011年版)[J] 中华血液学杂志. 2011;32(11):804–807. doi: 10.3760/cma.j.issn.0253-2727.2011.11.021. [DOI] [Google Scholar]
- 18.Burnett AK, Russell NH, Hills RK, et al. Optimization of chemotherapy for younger patients with acute myeloid leukemia: results of the medical research council AML15 trial[J] J Clin Oncol. 2013;31(27):3360–3368. doi: 10.1200/JCO.2012.47.4874. [DOI] [PubMed] [Google Scholar]
- 19.Kayser S, Schlenk RF, Grimwade D, et al. Minimal residual disease-directed therapy in acute myeloid leukemia[J] Blood. 2015;125(15):2331–2335. doi: 10.1182/blood-2014-11-578815. [DOI] [PubMed] [Google Scholar]


