真性红细胞增多症(polycythemia vera, PV)是一种慢性造血干细胞克隆性骨髓增殖性疾病,常伴白细胞及血小板增多[1]。97%~99%的PV患者有JAK2V617F或JAK2第12外显子突变[2]。衰竭期可有粒细胞减少和(或)血小板减少。Good综合征(胸腺瘤合并免疫缺陷)是一种少见的成年发病的综合征,在胸腺瘤中的发病率约为5%[3]。我们收治1例PV合并Good综合征及粒细胞缺乏症患者,报告如下并进行文献复习。
病例资料
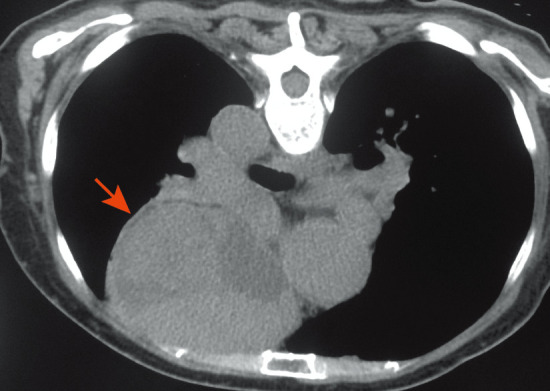
患者,女,77岁。主因“发热、咳嗽、咳痰20 d”于2014年12月30日入院。患者2年前因“头晕、四肢麻木”而就诊,血常规示WBC 5.2×109/L,中性粒细胞(N)2.3×109/L,HGB 220 g/L,PLT 270×109/L,骨髓象:增生活跃,红系占0.380,粒系占0.320,成熟受阻。骨髓活检:增生大致正常,粒系各阶段细胞均可见(散在或小簇分布),红系增生(以中晚红为主),巨核细胞计数正常范围,可见胞体大、多分叶巨核细胞。JAK2V617F阳性,BCR-ABL阴性。胸部CT:前上纵隔囊实性占位病灶。诊断:PV,胸腺瘤?先后给予羟基脲(0.5 g,每日3次,共1周)、重组人干扰素α-1b(300万U,每周3次,共2周)治疗,均出现粒细胞缺乏。后间断给予放血治疗。考虑手术风险(胸腺瘤侵犯主动脉壁),未行手术治疗。既往史:高血压病3级(极高危)8年,长期服用硝苯地平缓释片治疗,血压控制可。入院时查体:体温38.1 °C,血压120/74 mmHg(1 mmHg=0.133 kPa),颜面潮红,球结膜充血,口腔黏膜见多发溃疡(无白膜覆盖),浅表淋巴结未触及肿大,胸骨无压痛,双肺呼吸音清晰,未闻及干湿性啰音,心脏听诊正常,肝、脾肋缘下未及,双下肢无水肿。实验室检查:血常规:WBC 2.2×109/L,N 0.40×109/L,RBC 7.22×1012/L,HGB 178 g/L,红细胞比容(HCT) 0.548, PLT 281.8×109/L;尿常规、肝肾功、电解质、红细胞沉降率正常;腺病毒、呼吸道合胞病毒、甲型流感病毒、乙型流感病毒、副流感病毒、EB病毒、巨细胞病毒检测均阴性;降钙素原<0.05 µg/L;血培养、尿培养均阴性;抗中性粒细胞胞质抗体谱阴性;淋巴细胞亚群:CD3+细胞96.7%(正常参考值65.0%~79.0%),CD4+细胞18.3%(正常参考值34.0%~52.0%),CD8+细胞72.3%(正常参考值21.0%~39.0%),CD4+/CD8+细胞比值为0.25(正常参考值1.00~2.00),NK细胞2.6%(正常参考值10.0%~19.8%),B细胞0.1%(正常参考值9.0%~14.1%)。骨髄象:增生减低,粒系占0.110,红系占0.560(以中、晚幼红为主,成熟红细胞大小不等,可见嗜多染),淋巴细胞占0.265,全片见10个巨核细胞,血小板成堆(图1)。骨髄活检:增生较活跃,脂肪细胞略少,粒系各阶段均可见,散在或小簇分布,易见嗜酸粒细胞;红系比例增高,以中晚红为主,散在或成簇分布,可见双核、分裂相、类巨变表现;巨核细胞计数正常范围,以分叶核为主;铁染色(−),银染色(+);融合基因:JAK2 V617F阳性,BCR-ABL阴性。染色体核型正常。胸部CT(图2):两肺慢性炎症改变,左肺下叶胸膜下多发小结节影,考虑炎性结节;两肺多发微小结节影,两肺下叶充气不均,考虑小气道病变;前上纵隔占位(胸腺瘤?)。心电图未见异常。腹部B超声示:脾大,肋间厚14 cm,长径13 cm,回声均匀。临床诊断:PV,肺炎,粒细胞缺乏症,胸腺瘤,高血压病3级。
图1. 骨髄活检病理结果(HE染色,×400).
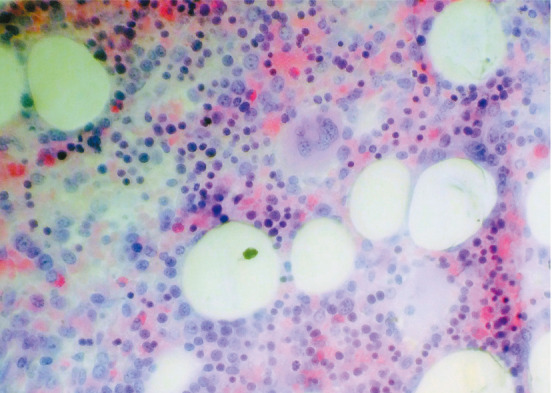
图2. 胸部CT示前上纵隔占位病变(箭头所示).
患者入院先后给予亚胺培南/西司他汀钠、万古霉素抗感染治疗,给予G-CSF 300 µg/d及低分子肝素、阿司匹林肠溶片治疗。治疗第5天体温降至正常,咳嗽、咯痰明显减轻,血常规:WBC 1.6 × 109/L,N 0.11 × 109/L,RBC 6.84×1012/L,HGB 166.5 g/L,PLT 299.2×109/L,HCT 0.515。治疗第10天血常规:WBC 2.0×109/L,N 0.07×109/L,RBC 6.36×1012/L,HGB 156 g/L,PLT 201.3×109/L,HCT 0.487;停用亚胺培南/西司他汀钠,改为哌拉西林/他唑巴坦,并给予氟康唑预防真菌感染。治疗第15天患者再次出现发热,体温最高38.0 °C(可自行下降),血常规:WBC 1.6×109/L,N 0.1×109/L,痰涂片未见抗酸杆菌;半乳甘露聚糖(GM)试验阴性;胸部CT:两肺慢性支气管炎,右肺下叶尖段陈旧病灶,左肺下叶胸膜下小结节,右肺下叶内基底段结节影。治疗调整为G-CSF联合GM-CSF治疗,停用万古霉素,改为左氧氟沙星抗感染治疗。治疗第20天患者仍有低热,血常规:WBC 1.6×109/L,N 0.07 × 109/L;免疫球蛋白:IgA 0.13 g/L,IgG 3.39 g/L,IgM 0.04 g/L。给予静脉丙种球蛋白输注(400 mg·kg−1·d−1×4d)。治疗第21天血常规:WBC 1.5×109/L,N 0.42×109/L。治疗23 d体温正常,血常规:WBC 2.7×109/L, N 1.93×109/L,RBC 6.78×1012/L,HGB 167.8 g/L, PLT 177.3×109/L。因年龄及手术风险(胸腺瘤侵及主动脉)未行手术治疗。出院后,患者于当地医院继续治疗(间断放血及输注静脉丙种球蛋白),随访至2015年8月,先后因呼吸道感染2次入院,抗炎治疗后治愈,期间查中性粒细胞偏低(具体不详)。
讨论及文献复习
Good综合征免疫异常主要以低丙种球蛋白血症、外周血B淋巴细胞减少或缺如、CD4+/CD8+细胞比值倒置、CD4+T细胞减少或T淋巴细胞对丝裂原刺激的增殖反应减弱为特征[4]。淋巴细胞减少的机制尚未阐明,T细胞抑制骨髓中前B细胞分化可能是其机制之一[4]。由于免疫功能缺陷,患者易合并感染。最多见的感染部位为鼻窦肺部感染,其次为慢性腹泻[5]。感染也是患者死亡的主要原因。国外报道5年生存率约为70%[5],国内报道的10例Good综合征患者的5年生存率为40%[6]。
Good综合征常合并血液系统疾病,以纯红再生障碍性贫血多见[5],罕见合并粒细胞缺乏[7]–[8]。从患者分离的淋巴细胞或血清抑制物可抑制骨髓粒细胞集落形成[5],[9],表明粒细胞缺乏与免疫机制相关。本例患者骨髓粒系缺如,经静脉丙种球蛋白输注治疗后粒细胞恢复正常,提示为免疫性粒细胞缺乏症。
Good综合征合并粒细胞缺乏的预后与感染发生的频率和严重程度有关。治疗上,虽然胸腺瘤本身对生存影响不大,但考虑其局部扩散及在自身免疫病中的作用,目前仍提倡手术治疗,但手术切除并不能改善骨髓造血功能[10]。胸腺瘤切除术后也可出现粒细胞缺乏。环孢素A、类固醇激素、抗CD52单抗(Campath-1H)等免疫抑制剂有效[11]–[13]。也有使用血小板受体激动剂艾曲波帕治疗Good综合症合并全血细胞减少有效的报道[14]。对于重度粒细胞缺乏的患者,血浆置换可一过性移除血浆抑制物使粒细胞部分甚至全部恢复正常[15]。
需要注意的是,本例患者2年前诊断PV时同时确诊胸腺瘤,以羟基脲、重组人干扰素α-1b治疗,但均因出现粒细胞缺乏而中断治疗。而治疗前骨髓象显示为粒细胞成熟受阻,说明当时可能已经存在免疫介导的粒细胞受损。
References
- 1.白 洁, 邵 宗鸿, 井 丽萍, et al. 185例真性红细胞增多症的临床分析[J] 中华血液学杂志. 2002;23(11):578–580. doi: 10.3760/j:issn:0253-2727.2002.11.005. [DOI] [Google Scholar]
- 2.肖 志坚. 骨髓增殖性肿瘤和骨髓增生异常综合征/骨髓增殖性肿瘤:开启分子诊断新时代[J] 中华血液学杂志. 2014;35(5):385–386. doi: 10.3760/cma.j.issn.0253-2727.2014.05.001. [DOI] [Google Scholar]
- 3.Tarr PE, Sneller MC, Mechanic LJ, et al. Infections in patients with immunodeficiency with thymoma (Good syndrome). Report of 5 cases and review of the literature[J] Medicine (Baltimore) 2001;80(2):123–133. doi: 10.1097/00005792-200103000-00005. [DOI] [PubMed] [Google Scholar]
- 4.Kelleher P, Misbah SA. What is Good's syndrome? Immunological abnormalities in patients with thymoma[J] J Clin Pathol. 2003;56(1):12–16. doi: 10.1136/jcp.56.1.12. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Kelesidis T, Yang O. Good's syndrome remains a mystery after 55 years: a systematic review of the scientific evidence[J] Clin Immunol. 2010;135(3):347–363. doi: 10.1016/j.clim.2010.01.006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.王 艳侠, 田 新平, 张 垣, et al. Good综合征10例临床分析[J] 中华医学杂志. 2011;91(21):1490–1492. doi: 10.3760/cma.j.issn.0376-2491.2011.21.014. [DOI] [PubMed] [Google Scholar]
- 7.Akinosoglou K, Melachrinou M, Siagris D, et al. Good's syndrome and pure white cell aplasia complicated by cryptococcus infection: A case report and review of the literature[J] J Clin Immunol. 2014;34(3):283–288. doi: 10.1007/s10875-014-0014-7. [DOI] [PubMed] [Google Scholar]
- 8.李 晓燕, 庄 少侠. Good综合征并白细胞减少一例[J] 中华血液学杂志. 2010;31(8):544. doi: 10.3760/cma.j.issn.0253-2727.2010.08.011. [DOI] [Google Scholar]
- 9.Joven MH, Palalay MP, Sonido CY. Case report and literature review on Good's syndrome, a form of acquired immunodeficiency associated with thymomas[J] Hawaii J Med Public Health. 2013;72(2):56–62. [PMC free article] [PubMed] [Google Scholar]
- 10.Shelly S, Agmon-Levin N, Altman A, et al. Thymoma and autoimmunity[J] Cell Mol Immunol. 2011;8(3):199–202. doi: 10.1038/cmi.2010.74. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.El-Galaly TC, Gregersen H, Bukh A. Good's syndrome with lymphopenia and neutropenia[J] Ugeskr Laeger. 2011;173(4):280–281. [PubMed] [Google Scholar]
- 12.Di Renzo M, Pasqui AL, Voltolini L, et al. Myelodysplasia and Good syndrome. A case report[J] Clin Exp Med. 2008;8(3):171–173. doi: 10.1007/s10238-008-0175-x. [DOI] [PubMed] [Google Scholar]
- 13.Alvares CL, Svasti-Salee D, Rowley M, et al. Remission induced by Campath-1H for thymoma-associated agranulocytosis[J] Ann Hematol. 2004;83(6):398–400. doi: 10.1007/s00277-003-0834-7. [DOI] [PubMed] [Google Scholar]
- 14.Kristiansen HA, Spetalen S, Fløisand Y, et al. Eltrombopag in Good's Syndrome[J] Case Rep Hematol. 2014;2014:172139. doi: 10.1155/2014/172139. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Postiglione K, Ferris R, Jaffe JP, et al. Immune mediated agranulocytosis and anemia associated with thymoma[J] Am J Hematol. 1995;49(4):336–340. doi: 10.1002/ajh.2830490412. [DOI] [PubMed] [Google Scholar]


