Abstract
目的
探讨丙戊酸钠对多发性骨髓瘤(MM)细胞株RPMI8226和U266细胞自噬的影响。
方法
丙戊酸钠处理RPMI8226和U266细胞,吖啶橙染色后采用荧光显微镜观察细胞自噬形态学变化,MTT法检测细胞增殖抑制的变化,流式细胞术检测细胞凋亡,实时定量PCR(RT-PCR)和Western Blot法检测细胞自噬相关因子LC3、Beclin1的变化。
结果
荧光显微镜观察到RPMI8226及U266细胞存在基础水平的自噬现象,丙戊酸钠作用后能够诱导细胞自噬增多;MTT法检测结果显示丙戊酸钠对细胞增殖抑制具有时间及浓度依赖性,作用24 h后半数抑制浓度分别为(12.03±0.23)mmol/L和(10.16±0.37) mmol/L。8 mmol/L丙戊酸钠作用24 h后,RPMI8226、U266细胞LC3 mRNA表达水平(22.45±0.07、0.06±0.02)、Beclin1 mRNA表达水平(283.09±17.3、1.53±0.01)与空白对照组(1.00± 0.00、1.00±0.00)比较,差异均有统计学意义(P值均<0.05)。随着丙戊酸钠浓度增加和作用时间延长,LC3、Beclin1蛋白表达水平逐渐增加,LC3Ⅰ向LC3Ⅱ的转化率逐渐升高。
结论
RPMI8226和U266细胞中存在基础水平的自噬现象,丙戊酸钠对MM细胞的自噬有激活作用,这可能是丙戊酸钠治疗MM的机制之一。
Keywords: 多发性骨髓瘤, 丙戊酸, 自噬, LC3, Beclin1
Abstract
Objective
To investigate the effects of valproic acid (VPA) on autophagy in multiple myeloma (MM) cell lines RPMI8226 and U266.
Methods
The method of dye acridine orange (AO) was used for observing morphological changes of autophagy under fluorescence microscope; The cell proliferation inhibition was measured by MTT assay; Cells apoptosis was evaluated by flow cytometry; Autophagy-related factors LC3, Beclin1 expressions changes were detected by real-time quantitative PCR (Real-time PCR) and western blot assay.
Results
AO stainings as dispersively brownish red vesicles were observed both in the control and chloroquine groups, while a lot of brownish red acidic vesicles in clusters were seen in rapamycin and VPA groups. The growths of RPMI8226 and U266 cells were suppressed by VPA treatment in a dose-and time-dependent manner, after treatment with VPA for 24 h, the IC50 were (12.03 ± 0.23) mmol/L for RPMI8226 cells and (10.16 ± 0.37) mmol/L for U266 cells respectively; Poptotie cells of RPMI8226 and U266 increased in a time-dependent manner after exposure to VPA. Real-time PCR and Western blot results of RPMI8226 and U266 cells showed that gradually increased LC3, Beclin1 mRNA and protein expressions with LC3Ⅰ to LC3Ⅱ conversion rate after increasing the concentration of VPA and prolonging duration of action of VPA.
Conclusion
The results reveal disclosed the basal level of autophagy in MM cells, VPA as a autophagy activator may be one of its actions on the treatment of MM.
Keywords: Multiple myeloma, Valproic acid, Autophagy, LC3, Beclin1
细胞自噬是细胞利用溶酶体内水解酶对细胞内受损、变性的蛋白质及衰老的细胞器进行消化降解的过程,从而获得细胞代谢所需的能量和某些细胞器的更新,以部分细胞质和细胞器被双层膜结构包裹后形成的自噬体为特点。自噬与肿瘤的发生、转移、耐药、死亡等息息相关[1]–[2],自噬与血液系统多种肿瘤的发生、耐药及复发的关系密切[3]。丙戊酸钠是口服方便耐受性好的抗癫痫药物,越来越多的研究表明其具有抗肿瘤活性[4]–[6]。近年来将其作为一种分子学工具用于肿瘤的研究。在本研究中我们采用丙戊酸钠作用于多发性骨髓瘤(multiple myeloma, MM)细胞株RPMI8226及U266细胞,以探讨MM细胞的自噬现象以及丙戊酸钠对其自噬的影响。
材料与方法
1.材料和试剂:RPMI8226及U266细胞购自上海中美合资博慧斯生物医药科技有限公司。丙戊酸钠(规格每瓶25 g,批号P4543)及兔抗人LC3、Beclin1单克隆抗体购自美国Sigma公司。TRIzol试剂购自天津福德士科技有限公司;反转录试剂盒及引物均为美国Invitrogen公司产品。凋亡试剂盒为美国BD公司产品。β-actin单克隆抗体与羊抗兔二抗为美国KPL公司产品。实时定量PCR仪为美国Roche公司产品。DYY-6C电泳仪为北京六一生物科技有限公司产品。
2.细胞培养:RPMI8226及U266细胞培养于含青霉素(100 U/ml)、链霉素(100 g/ml)的10%胎牛血清的RPMI1640培养基中,置于饱和湿度、37 °C、5% CO2培养箱中常规传代培养,取对数生长期细胞用于后续实验。
3.吖啶橙染色荧光显微镜下观察细胞自噬现象:取对数生长期细胞,以8×104个/ml密度接种于24孔板内。根据预实验结果,实验分为4组:空白对照组,8 µg/ml氯喹组(阴性对照组),250 nmol/L雷帕霉素组(阳性对照组),8 mmol/L丙戊酸钠组。孵育24 h后,弃培养液,加入2 mg/ml吖啶橙室温避光孵育2 min,置于荧光显微镜下观察、摄片。
4.MTT法检测丙戊酸钠对细胞增殖的影响:取对数生长期细胞,以每孔8×103个细胞接种于96孔板内,实验分为空白对照组及2、4、8 mmol/L丙戊酸钠处理组,置于37 °C培养箱培养相应时间后,每孔加入5 mg/ml的MTT溶液,培养4 h后每孔加入三联裂解液(100 g/L SDS+ 50 g/L异丁醇+10 mol/LHCL)100 µl, 37 °C孵育过夜,在酶标仪上测定490 nm处吸光度(A)值,按下列公式计算细胞抑制率(CIR)。
5.流式细胞术检测细胞凋亡:取对数生长期细胞,以每孔8×104个细胞接种于24孔板,实验分组同MTT法,培养6、12、24 h后收集细胞,冷PBS洗涤2次,用1×结合液调节细胞密度为1×106个/ml,取100 µl细胞悬液于5 ml流式细胞管中,加入FITC Annexin Ⅴ5 µl,孵育30 min后加入碘化丙锭染液5 µl, 15 min后加入1×结合液400 µl,1 h内上流式细胞仪检测,采用Cellquest 1.2分析软件分析结果。
6.实时定量PCR法检测LC3、Beclin1 mRNA的表达水平:实验分组同MTT法,培养24 h后收集细胞;并以8 mmol/L丙戊酸钠分别处理3、6、12、24 h后收集细胞。用TRIzol提取液提取总RNA,按照反转录试剂盒说明书合成cDNA。LC3引物序列:上游:5′-CTGTTGGTGAACGGACACAG-3′,下游:5′-ACAATTTCATCCCGAACGTCT-3′;Beclin1引物序列:上游:5′-TGAGGGATGGAAGGGTCTAA-3′,下游:5′-CCTGGGCTGTGGTAAGTAATG-3′;β-actin引物序列:上游:5′-CATGTACGTTGCTATCCAGGC-3′,下游:5′-CTCCTTAATGTCACGCACGAT-3′。以cDNA为模板,分别用目的基因LC3、Beclin1引物和内参基因β-actin引物对目的片段进行扩增,经预变性、变性、退火及延伸等步骤,绘制熔解曲线,读取CT值。以2−ΔΔCT计算实验结果。
7.Western blot法检测LC3、Beclin1蛋白的表达:实验分组同MTT法。收集各组细胞,用组织快速裂解液裂解细胞后提取总蛋白质,用二喹啉甲酸(BCA)法测定蛋白浓度。取50 µg蛋白行120 g/L、50 g/L SDS-聚丙烯酰胺凝胶电泳,电转移至PVDF膜上,用50 g/L脱脂奶粉溶液室温封闭2 h后,加入兔抗人LC3、Beclin1、β-actin一抗(4 °C摇床过夜),室温下洗膜3次,加入辣根过氧化物酶标记的羊抗兔二抗孵育2 h,室温下洗膜,电化学发光超敏发光液显影,暗室曝光。采用成像系统进行蛋白表达检测,以LC3、Beclin1与β-actin条带的吸光度比值表示LC3、Beclin1蛋白相对表达水平。
8.统计学处理:每组设3个复孔(MTT法设5个复孔),每个实验重复3次。数据以x±s表示,采用SPSS 19.0软件进行统计学分析。多组间比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
结果
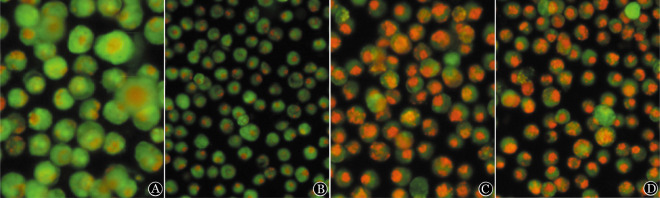
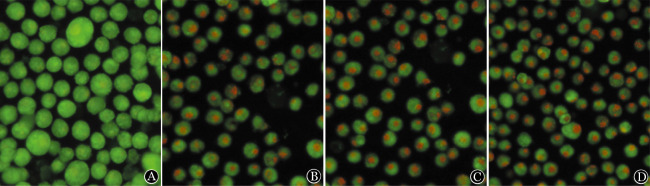
1.丙戊酸钠对细胞自噬的影响:不同药物处理RPMI8226及U266细胞24 h后,荧光显微镜下观察显示:空白对照组细胞内均可见呈弥散分布的嗜酸性棕红色囊泡;氯喹组可见散在分布的嗜酸性棕红色囊泡;雷帕霉素组和丙戊酸钠组细胞内均可见大量成簇分布的嗜酸性棕红色囊泡。结果表明MM细胞存在基础水平的自噬现象,丙戊酸钠能够诱导MM细胞自噬的增多,是一种自噬激活剂(图1、2)。
图1. 荧光显微镜下观察不同药物作用RPMI8226细胞24 h后细胞中自噬体的变化(吖啶橙染色,自噬体呈棕红色囊泡).
A:空白对照组;B:氯喹组;C:雷帕霉素组;D:丙戊酸钠组
图2. 荧光显微镜下观察不同药物作用U266细胞24 h后细胞中自噬体的变化(吖啶橙染色,自噬体呈棕红色囊泡).
A:空白对照组;B:氯喹组;C:雷帕霉素组;D:丙戊酸钠组
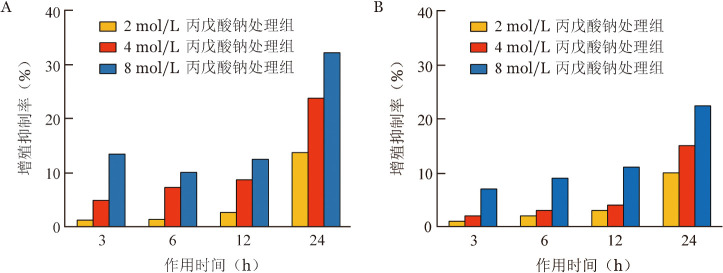
2.MTT法检测丙戊酸钠对细胞增殖的影响:与对照组相比,同一时间点,不同浓度丙戊酸钠处理RPMI8226、U266细胞,细胞增殖均受到抑制(P值均<0.05),且随着丙戊酸钠处理浓度的增加,细胞增殖抑制率逐渐升高,差异有统计学意义(P值均< 0.05)。同一浓度作用下,处理时间的不同,细胞增殖抑制率变化不明显,但随着处理时间延长至24 h,细胞增殖抑制率增加,差异有统计学意义(P< 0.05)。丙戊酸钠处理RPMI8226和U266细胞的半数抑制浓度(IC50)值分别为(12.03±0.23)mmol/L和(10.16±0.37) mmol/L(图3)。
图3. MTT法检测不同浓度丙戊酸钠处理不同时间对RPMI8226细胞(A)和U266细胞(B)增殖的影响(每组设5个复孔,每个实验重复3次).
A:RPMI8226细胞;B:U266细胞
3.流式细胞术检测丙戊酸钠对细胞凋亡的影响:结果显示8 mmol/L丙戊酸钠作用3、6、12、24 h后,RPMI8226细胞的凋亡率分别为2.4%、7.3%、9.9%和15.7%,U266细胞的凋亡率分别为3.3%、5.7%、13.6%和25.5%。
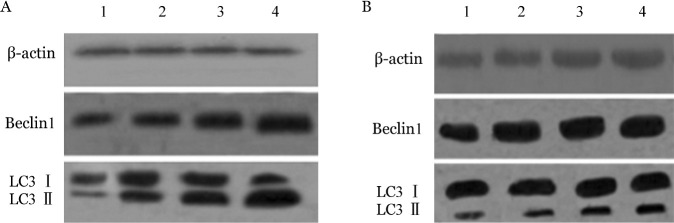
4.实时定量PCR及Western blot法检测丙戊酸钠对细胞LC3及Beclin1表达的影响:不同浓度丙戊酸钠处理RPMI8226细胞24 h,结果显示随着丙戊酸钠浓度的增加,LC3、Beclin1 mRNA和蛋白的表达水平逐渐增加,差异均有统计学意义(P值均< 0.05)(表1),且LC3Ⅰ向LC3Ⅱ的转化增加(图4A)。
表1. 实时定量PCR法检测不同浓度丙戊酸钠处理24 h对RPMI8226、U266细胞自噬相关因子表达的影响(x±s).
| 组别 | RPMI8226细胞 |
U266细胞 |
||||||
| Beclin1 |
LC3 |
Beclin1 |
LC3 |
|||||
| mRNA表达 | 蛋白表达 | mRNA表达 | 蛋白表达 | mRNA表达 | 蛋白表达 | mRNA表达 | 蛋白表达 | |
| 对照组 | 1.00±0.00 | 2.29±0.02 | 1.00±0.00 | 0.55±0.01 | 1.00±0.00 | 1.42±0.01 | 1.00±0.00 | 0.29±0.01 |
| 丙戊酸钠处理组 | ||||||||
| 2 mmol/L | 23.08±1.96a | 3.60±0.03a | 5.38±0.21a | 2.36±0.02a | 0.60±0.01a | 2.44±0.01a | 0.07±0.01a | 0.45±0.01a |
| 4 mmol/L | 174.34±3.80ab | 4.99±0.12ab | 13.86±0.12ab | 4.95±0.06ab | 1.24±0.01ab | 2.64±0.03ab | 0.17±0.01ab | 0.84±0.02ab |
| 8 mmol/L | 283.09±17.3abc | 7.73±0.18abc | 22.45±0.07abc | 9.96±0.11abc | 1.53±0.01abc | 2.97±0.02abc | 0.60±0.02abc | 1.17±0.06abc |
注:a:与对照组比较,P<0.05; b:与2 mmol/L丙戊酸钠处理组比较,P<0.05;c:与4 mmol/L丙戊酸钠处理组比较,P<0.05;每组设3个复孔,每个实验重复3次
图4. Western blot法检测不同浓度丙戊酸钠处理24 h对RPMI8226细胞(A)和U266细胞(B)蛋白表达的影响.
1:空白对照组;2:2 mmol/L丙戊酸钠处理组;3:4 mmol/L丙戊酸钠处理组;4:8 mmol/L丙戊酸钠处理组
不同浓度丙戊酸钠处理U266细胞24 h,结果显示随着丙戊酸钠浓度的增加,LC3、Beclin1 mRNA和蛋白的表达水平逐渐增加,差异有统计学意义(P值均<0.05)(表1),且LC3Ⅰ向LC3Ⅱ的转化增加(图4B)。随着处理时间延长,LC3、Beclin1 mRNA及蛋白的表达量呈现先增加后减少的变化,处理12 h时表达量最高,差异有统计学意义(P值均< 0.05)(表2)。
表2. 实时定量PCR法检测8 mmol/L丙戊酸钠处理不同时间对RPMI8226、U266细胞自噬相关因子表达的影响(x±s).
| 组别 | RPMI8226细胞 |
U266细胞 |
||||||
| Beclin1 |
LC3 |
Beclin1 |
LC3 |
|||||
| mRNA表达 | 蛋白表达 | mRNA表达 | 蛋白表达 | mRNA表达 | 蛋白表达 | mRNA表达 | 蛋白表达 | |
| 对照组 | 1.00±0.00 | 0.21±0.01 | 1.00±0.00 | 0.33±0.01 | 1.00±0.00 | 0.39±0.01 | 1.00±0.00 | 0.03±0.00 |
| 丙戊酸钠处理组 | ||||||||
| 3h | 1.68±0.22a | 0.40±0.01a | 2.36±0.18a | 0.44±0.02a | 0.01±0.00ab | 0.51±0.02ab | 0.01±0.00ab | 0.08±0.01ab |
| 6h | 2.79±0.20a | 0.59±0.03a | 2.46±0.12a | 0.70±0.02a | 0.57±0.03ab | 0.62±0.01ab | 0.13±0.01ab | 0.17±0.01ab |
| 12 h | 5.77±0.21a | 1.12±0.02a | 2.62+0.27a | 1.08±0.04a | 1.88±0.08a | 1.26±0.02a | 0.86±0.08a | 0.47±0.02a |
| 24 h | 283.09±17.30a | 1.63±0.06a | 22.45±0.07a | 1.48±0.03a | 1.53±0.01ab | 0.71±0.03ab | 0.60±0.02ab | 0.20±0.01ab |
注:a:与对照组比较,P<0.05; b:与12 h处理组比较,P<0.05;每组设3个复孔,每个实验重复3次
讨论
近年来随着对MM发病机制研究的深入,发现细胞自噬有可能参与MM的发生,但其具体的机制仍不清楚[7]。细胞自噬是通过溶酶体对细胞内成分进行分解代谢的过程,低水平的自噬,易在细胞饥饿及DNA、细胞器受损的状态时被激活,通过降解过多的或受损的细胞内成分而对细胞起保护性作用,高水平的自噬会引起细胞自噬性死亡[8]–[9]。近十年来关于自噬的研究成为热点,研究过程中发现自噬与肿瘤的关系十分密切,自噬与MM关系的研究亦受到人们的关注。
丙戊酸钠是一种耐受性良好的抗癫痫药,越来越多的研究发现其具有抗肿瘤活性,主要通过促进分化、诱导凋亡、使细胞周期阻滞、抑制血管新生及对自噬活性的调节等发挥作用[4]–[6]。在本研究中我们首先通过荧光显微镜观察到吖啶橙染色的MM细胞中存在弥散分布的嗜酸性棕红色囊泡,证实MM细胞内存在基础水平的自噬,Yang等[10]也发现MM细胞自噬水平高于正常浆细胞;丙戊酸钠处理后MM细胞内可见大量嗜酸性棕红色囊泡且成簇分布,与雷帕霉素处理后相似,表明丙戊酸钠和雷帕霉素一样可以激活细胞的自噬,是一种自噬激活剂,这与Hoang等[11]的报道一致。我们前期的研究结果显示丙戊酸钠处理MM细胞24 h至72 h时,细胞增殖抑制作用具有时间及浓度依赖性[12]。
在本研究中我们的结果显示12 h内丙戊酸钠对RPMI8266和U266细胞增殖抑制作用不明显,可能有两方面原因:一是药物作用时间短,药物发挥疗效需要时间;二是药物对MM细胞刺激,诱导了MM细胞基础水平自噬的增强,通过清除受损或老化的细胞器,使长寿命蛋白和蛋白复合体得到重复利用,保护细胞适应不利环境得以存活。同时我们的实验结果显示24 h时细胞增殖抑制作用明显增强,其可能因素包括:①自噬过度引起了自噬性细胞死亡,低水平自噬可降解多余或受损的细胞器,起着保护性作用,但高水平的自噬能够引起细胞死亡。何时以及如何引起自噬的转化引起自噬功能的转化是现如今研究的热点[13]–[14];②丙戊酸钠激活了MM凋亡,自噬与凋亡同属于程序性细胞死亡,两者之间的关系错综复杂,有文献报道丙戊酸钠可通过激活凋亡途径促进肿瘤细胞的死亡[15]。随着浓度的增加,丙戊酸钠对MM细胞增殖抑制作用逐渐增强,差异有统计学意义(P<0.05)。Kaiser等[16]的研究结果也显示丙戊酸钠能够抑制MM细胞增殖并呈剂量依赖性。
细胞自噬以自噬体的形成为特点,自噬相关因子Beclin1和LC3在自噬体的形成及成熟阶段发挥着重要的调控作用,自噬激活时,Beclin1表达通常是增加的,LC3有两种形式即LC3Ⅰ和LC3Ⅱ[17]–[18],LC3的相互转化特性被用来检测自噬活性[19],其中LC3Ⅱ是自噬体的特征性标志。我们采用实时定量PCR及Western blot法分别从mRNA和蛋白水平对RPMI8226、U266细胞中自噬相关因子LC3、Beclin1的表达进行了检测,结果显示在RPMI8226细胞中随着丙戊酸钠浓度的增加和处理时间的延长,自噬相关因子Beclin1及LC3 mRNA及蛋白表达水平呈时间和浓度依赖性;在U266细胞中随着丙戊酸钠浓度的增加,LC3、Beclin1 mRNA和蛋白的表达水平逐渐增加,随着处理时间延长,LC3、Beclin1 mRNA及蛋白的表达水平呈现先增加后减少的变化,处理12 h时表达量最高。Dong等[20]报道丙戊酸钠能够诱导伯基特淋巴瘤白血病期细胞的自噬。Xu等[6]发现丙戊酸钠能够激活甲状腺癌细胞的自噬,且具有浓度依赖性。与我们的结果报道相似。而自噬在两种细胞株出现的时间不同,分析原因可能有两方面:一是细胞株本身存在差异导致自噬水平不一样,但关于这方面未见文献报道,还有待进一步研究;二是检测的时间短,在短时间内药物在两细胞株中的作用未能达成一致。
自噬是一把双刃剑,它可以保护肿瘤细胞抵抗缺血、缺氧及放化疗的杀伤作用,又可以导致肿瘤细胞发生自噬性细胞死亡,丙戊酸钠能够激活MM细胞的自噬,为MM的治疗提供了新思路。
Funding Statement
基金项目:河北省自然科学基金(H2013406112)
Fund program: Hebei Province Natural Science Foundation of China(H2013406112)
References
- 1.Pavlides S, Tsirigos A, Migneco G, et al. The autophagic tumor stroma model of cancer: Role of oxidative stress and ketone production in fueling tumor cell metabolism[J] Cell Cycle. 2010;9(17):3485–3505. doi: 10.4161/cc.9.17.12721. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Levy JM, Thorburn A. Targeting autophagy during cancer therapy to improve clinical outcomes[J] Pharmacol Ther. 2011;131(1):130–141. doi: 10.1016/j.pharmthera.2011.03.009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Puissant A, Robert G, Auberger P. Targeting autophagy to fight hematopoietic malignancies[J] Cell Cycle. 2010;9(17):3470–3478. doi: 10.4161/cc.9.17.13048. [DOI] [PubMed] [Google Scholar]
- 4.Kostrouchová M, Kostrouch Z, Kostrouchová M. Valproic acid, a molecular lead to multiple regulatory pathways[J] Folia Biol (Praha) 2007;53(2):37–49. [PubMed] [Google Scholar]
- 5.Chang CY, Li JR, Wu CC, et al. Valproic acid sensitizes human glioma cells to gefitinib-induced autophagy[J] IUBMB Life. 2015;67(11):869–879. doi: 10.1002/iub.1445. [DOI] [PubMed] [Google Scholar]
- 6.Xu Y, Xu D, Zhu SJ, et al. Induction of apoptosis and autophagy in metastatic thyroid cancer cells by valproic acid (VPA)[J] Int J Clin Exp Pathol. 2015;8(7):8291–8297. [PMC free article] [PubMed] [Google Scholar]
- 7.Oliva L, Cenci S. Autophagy in plasma cell pathophysiology[J] Front Immunol. 2014;5:103. doi: 10.3389/fimmu.2014.00103. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.廖 爱军, 胡 荣, 李 迎春, et al. FTY720诱导多发性骨髓瘤细胞株U266自噬与凋亡的研究[J] 中华血液学杂志. 2011;32(10):664–667. doi: 10.3760/cma.j.issn.0253-2727.2011.10.005. [DOI] [PubMed] [Google Scholar]
- 9.Cea M, Cagnetta A, Fulciniti M, et al. Targeting NAD+ salvage pathway induces autophagy in multiple myeloma cells via mTORC1 and extracellular signal-regulated kinase (ERK1/2) inhibition[J] Blood. 2012;120(17):3519–3529. doi: 10.1182/blood-2012-03-416776. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Yang LJ, Chen Y, He J, et al. Betulinic acid inhibits autophagic flux and induces apoptosis in human multiple myeloma cells in vitro[J] Acta Pharmacol Sin. 2012;33(12):1542–1548. doi: 10.1038/aps.2012.102. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Hoang B, Benavides A, Shi Y, et al. Effect of autophagy on multiple myeloma cell viability[J] Mol Cancer Ther. 2009;8(7):1974–1984. doi: 10.1158/1535-7163.MCT-08-1177. [DOI] [PubMed] [Google Scholar]
- 12.乔 莲, 张 志华, 王 陶然, et al. 丙戊酸钠对RPMI8226细胞增殖的影响[J] 承德医学院学报. 2013;(5):363–364. doi: 10.3969/j.issn.1004-6879.2013.05.001. [DOI] [Google Scholar]
- 13.Shimizu S, Yoshida T, Tsujioka M, et al. Autophagic cell death and cancer[J] Int J Mol Sci. 2014;15(2):3145–3153. doi: 10.3390/ijms15023145. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Lindqvist LM, Simon AK, Baehrecke EH. Current questions and possible controversies in autophagy[J] Cell Death Discov. 2015;pii:15036. doi: 10.1038/cddiscovery.2015.36. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Xie C, Edwards H, Xu X, et al. Mechanisms of synergistic antileukemic interactions between valproic acid and cytarabine in pediatric acute myeloid leukemia[J] Clin Cancer Res. 2010;16(22):5499–5510. doi: 10.1158/1078-0432.CCR-10-1707. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Kaiser M, Zavrski I, Sterz J, et al. The effects of the histone deacetylase inhibitor valproic acid on cell cycle, growth suppression and apoptosis in multiple myeloma[J] Haematologica. 2006;91(2):248–251. [PubMed] [Google Scholar]
- 17.Kanno H, Ozawa H, Sekiguchi A, et al. Spinal cord injury induces upregulation of Beclin 1 and promotes autophagic cell death[J] Neurobiol Dis. 2009;33(2):143–148. doi: 10.1016/j.nbd.2008.09.009. [DOI] [PubMed] [Google Scholar]
- 18.Fujita N, Itoh T, Omori H, et al. The Atg16L complex specifies the site of LC3 lipidation for membrane biogenesis in autophagy[J] Mol Biol Cell. 2008;19(5):2092–2100. doi: 10.1091/mbc.E07-12-1257. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Tsukahara T, Matsuda Y, Haniu H. The role of autophagy as a mechanism of toxicity induced by multi-walled carbon nanotubes in human lung cells[J] Int J Mol Sci. 2015;16(1):40–48. doi: 10.3390/ijms16010040. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Dong LH, Cheng S, Zheng Z, et al. Histone deacetylase inhibitor potentiated the ability of MTOR inhibitor to induce autophagic cell death in Burkitt leukemia/lymphoma[J] J Hematol Oncol. 2013;6:53. doi: 10.1186/1756-8722-6-53. [DOI] [PMC free article] [PubMed] [Google Scholar]