Abstract
目的
探讨TP53、Bcl-2、Bcl-6、Myc蛋白表达对弥漫大B细胞淋巴瘤(DLBCL)患者预后的影响。
方法
回顾性分析223例DLBCL患者的临床资料,对有完整病理资料患者的石蜡标本采用免疫组化法进行TP53、Bcl-2、Bcl-6、Myc蛋白表达检查,并结合临床资料进行预后影响因素分析。
结果
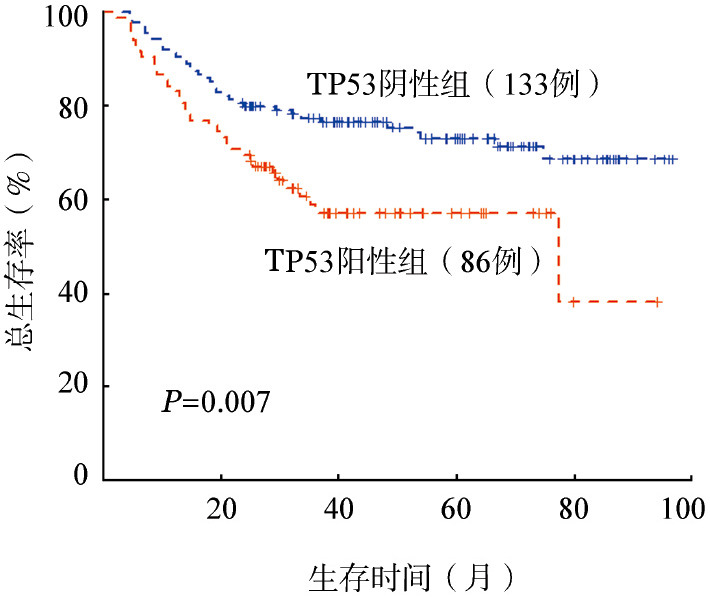
①223例患者中男133例,女90例,中位发病年龄为56(15~83)岁。所有患者均进行TP53、Myc、Bcl-2、Bcl-6蛋白检测,阳性率分别为39.0%、38.6%、69.1%、56.5%,Myc/Bcl-2双表达22.7%(64/223);按照Hans分型分类,生发中心起源B细胞亚型(GCB型)占27.4%,non-GCB占72.6%。②进一步分析发现TP53蛋白表达组non-GCB亚型居多(81.6%对66.9%,P=0.021),且与Myc表达存在显著正相关(P<0.001)。③219例患者获得完整随访资料,中位随访时间为38(2~97)个月,3、5年总生存(OS)率分别为70%、66%。单因素分析结果显示Bcl-6蛋白表达为预后良好因素(P=0.034),TP53高表达(P=0.007)、Myc/Bcl-2双表达(P=0.012)为预后不良因素。多因素分析结果显示TP53高表达(HR=1.848,95%CI 1.025~2.968,P=0.010)及Myc/Bcl-2双表达(HR=1.124,95%CI 1.134~2.256,P=0.032)为独立预后不良因素。④TP53阳性与阴性组患者3年OS率分别为59%和77%,5年OS率分别为57%和71%,差异均有统计学意义(P值均<0.05)。
结论
免疫组化法检测Myc/Bcl-2双表达及TP53高表达能够预测DLBCL患者的预后,Myc/Bcl-2双表达及TP53高表达是DLBCL患者的独立预后不良因素。
Keywords: 淋巴瘤,大B细胞,弥漫性, 肿瘤抑制蛋白质p53, 原癌基因蛋白质c-myc, 原癌基因蛋白质c-bcl-2, 预后
Abstract
Objective
To analyze the prognostic significance of TP53, Bcl-2, Bcl-6, Myc proteins expression by immunohistochemical method (IHC) in diffuse large B cell Lymphoma (DLBCL).
Methods
Clinical and pathologic data of 223 patients with DLBCL hospitalized in Zhejiang First Hospital from March 2009 to June 2015 were retrospectively analyzed.
Results
The 223 cases, a median age of 56 years old with a male predominance, had shown a 39.0% of TP53 positive expression, 38.6% of Myc, 69.1% of Bcl-2, 56.5% of Bcl-6, and 22.7% of Myc/Bcl-2 double expression. According to Hans' classification, 27.4% were GCB and 72.6% were non-GCB. With a median follow-up of 38 (2–97) months, the 3 and 5 years survival rates were 70% and 66%, respectively. By multivariate analysis, TP53 over-expression and Myc/Bcl-2 double expression were independently associated with poor outcomes. 3-year and 5-year overall survival were 59% and 57% for patients with TP53 positive, 77% and 71% for patients with TP53 negative expression. Patients with non-GCB subtype receiving chemotherapy combined with rituximab had a higher OS than those without rituximab. But rituximab did not improve the prognosis of patients with TP53 positive.
Conclusion
Myc/Bcl-2 double expression and TP53 over-expression are poor prognosis for DLBCL patients. Patients with Myc/Bcl-2 double expression have shorter OS. Patients with non-GCB subtype who received chemotherapy combined with rituximab have a better OS than those without rituximab. But rituximab does not improve the prognosis of patients with TP53 positive.
Keywords: Lymphoma, large B cell, diffuse; Tumor suppressor protein p53; Proto-oncogene proteins c-myc; Proto-oncogene proteins c-bcl-2; Prognosis
弥漫大B细胞淋巴瘤(diffuse large B cell lymphoma, DLBCL)是成熟B细胞淋巴瘤中最常见的一种亚型,利妥昔单抗联合蒽环类为基础的化疗方案可使多数患者获得很好的疗效,然而,仍然有三分之一的患者会发生复发及难治[1]。因此在现有的预后评分指标的基础上,有必要寻找适合中国现状的分子病理预后指标,从而指导个体化治疗,改善DLBCL患者的预后。我们对近6年来有完整病理资料的223例DLBCL患者进行回顾性分析,总结其临床特征,分析免疫组化方法检测相关蛋白表达对预后的意义,为DLBCL患者寻找经济且易于检测的预后指标。
病例与方法
1.病例:以2009年3月1日至2015年6月30日在本院诊治的223例初发DLBCL患者为研究对象,诊断均经我院病理系病理检查证实,病理诊断符合2008年WHO造血淋巴组织肿瘤分类诊断标准,临床分期按Ann Arbor分期标准,并已除外HIV、HCV感染及既往接受过免疫抑制治疗病史。
2.方法:收集患者年龄、性别、生化检测、病理组织学特征、免疫组化检查、影像学检查、骨髓检查等资料。采用石蜡切片进行TP53(美国Labvision公司产品)、Myc(美国Abcam公司产品)、Bcl-2(美国Invitrogen公司产品)、Bcl-6(德国Leica公司产品)等免疫组化染色。DLBCL亚型分类根据Hans模型进行CD10(美国Novocastra公司产品)、Bcl-6和MUM-1(美国Invitrogen公司产品)的免疫组化检测,分为生发中心型(GCB型)和非生发中心型(non-GCB型)。对以前未检测患者的组织标本重新进行免疫组化检测及分类。定义肿瘤细胞中TP53表达≥30%、Myc表达≥40%、Bcl-2表达≥50%为阳性。
3.治疗:223例患者均有完整的治疗资料,其中CHOP(环磷酰胺、阿霉素或表阿霉素、长春新碱、泼尼松)方案诱导化疗75例,利妥昔单抗(R)-CHOP方案诱导化疗148例。一线化疗方案主要采用联合或不联合利妥昔单抗的CHOP或CHOP样方案。二线化疗方案主要采用DHAP(顺铂、阿糖胞苷、地塞米松)、ICE(异环磷酰胺、卡铂、依托泊苷、表阿霉素)、GDP(吉西他滨、地塞米松、顺铂)方案等。
4.疗效标准:疗效评估按WHO标准分为完全缓解(CR)、部分缓解(PR)、病情稳定(SD)和疾病进展(PD)。总生存(OS)期为明确诊断之日至任何原因所致死亡或末次随访的时间。
5.随访:223例患者中,4例患者不规范化疗、诱导治疗后仅接受支持疗法,219例患者有完整随访资料。根据门诊或住院资料,并通过电话或短信回访方式随访。随访截止时间为2017年5月14日,中位随访时间为38(2~97)个月。
6.统计学处理:采用SPSS 17.0软件进行统计学分析。非正态分布计量资料用中位数表示;单因素分析采用秩和检验和χ2检验,样本例数较少时采用Fisher确切概率法;单因素分析采用Kaplan-Meier法;多因素分析采用Cox回归模型;生存率比较采用Log-rank检验,生存曲线采用Kaplan-Meier方法。P<0.05为差异有统计学意义。
结果
1.病例特征:223例患者中位发病年龄为56(15~86)岁。常见结外受累脏器为肠道24例(10.8%),胃19例(8.5%),睾丸6例(2.7%),肾5例(2.2%),肝4例(1.8%),乳腺3例(1.3%),卵巢3例(1.3%),胰腺3例(1.3%),肺3例(1.3%),椎体1例(0.4%);其他部位14例(6.3%),骨髓受累7例(3.1%)。一般临床特征见表1。
表1. 223例弥漫大B细胞淋巴瘤患者的一般临床特征.
| 临床特征 | 例数(%) |
| 性别 | |
| 男 | 133(59.6) |
| 女 | 90(40.4) |
| 发病年龄 | |
| <40岁 | 32(14.3) |
| 40~60岁 | 119(53.3) |
| >60岁 | 72(32.4) |
| 合并B症状 | 72(32.3) |
| 原发部位 | |
| 结内 | 131(58.7) |
| 结外 | 57(25.6) |
| 结内外同时累及 | 35(15.7) |
| LDH水平 | |
| 正常 | 111(49.8) |
| 升高 | 112(50.2) |
| Ann Arbor分期 | |
| Ⅰ、Ⅱ期 | 72(32.3) |
| Ⅲ、Ⅳ期 | 151(67.7) |
| ECOG评分 | |
| <2分 | 147(65.9) |
| ≥2分 | 76(34.1) |
| IPI评分 | |
| 低危组(0~1分) | 76(34.1) |
| 低中危组(2分) | 49(21.9) |
| 中高危组(3分) | 52(23.4) |
| 高危组(4~5分) | 46(20.6) |
| Hans法分型 | |
| non-GCB型 | 162(72.6) |
| GCB型 | 61(27.4) |
注:B症状:发热、盗汗、体重减轻;LDH正常值范围:91~250 U/L;ECOG:美国东部肿瘤协作组;IPI:国际预后指数;GCB:生发中心;non-GCB:非生发中心
2.TP53、Myc、Bcl-2、Bcl-6蛋白表达:所有患者均进行TP53、Myc、Bcl-2、Bcl-6蛋白检测,阳性率分别为39.0%、38.6%、69.1%、56.5%。Myc/Bcl-2双表达阳性者64例(22.7%),其中GCB亚型13(21.3%)例,non-GCB亚型51(31.5%)例。177例可评估患者中Ki-67阳性率>80%者78例。
我们还特别关注了TP53表达与其他指标间的关系,发现non-GCB亚型患者在TP53表达阳性组中所占比例为81.6%(71/87),在阴性组中所占比例为66.9%(91/136),差异有统计学意义(P=0.021);Myc表达阳性患者在TP53阳性组中所占比例为77.0%(67/87),在阴性组中所占比例为12.5%(17/136)(P<0.001)(表2)。
表2. TP53表达与其他临床特征间的关系.
| 临床特征 | TP53阴性组(136例) | TP53阳性组(87例) | 统计量 | P值 |
| 中位年龄[岁,M(P25~P75)] | 56.5(48.0~62.0) | 56.0(49.0~64.5) | 0.617 | 0.537 |
| 年龄>60岁[例(%)] | 40(29.4) | 31(35.6) | 0.946 | 0.377 |
| 男性[例(%)] | 82(60.3) | 51(58.6) | 0.062 | 0.889 |
| ECOG≥2分[例(%)] | 43(31.6) | 33(37.9) | 0.941 | 0.385 |
| 结外受累部位≥2个[例(%)] | 44(32.4) | 34(39.1) | 1.056 | 0.317 |
| Ann Arbor分期Ⅲ/Ⅳ期[例(%)] | 94(69.1) | 57(65.5) | 0.315 | 0.660 |
| LDH升高[例(%)] | 63(49.6) | 49(58.3) | 1.546 | 0.260 |
| non-GCB型[例(%)] | 91(66.9) | 71(81.6) | 5.768 | 0.021 |
| IPI≥3分[例(%)] | 54(39.7) | 44(50.6) | 2.544 | 0.129 |
| Bcl-2阳性[例(%)] | 87(64.0) | 67(77.0) | 4.223 | 0.053 |
| Bcl-6阳性[例(%)] | 75(55.1) | 51(58.6) | 0.260 | 0.678 |
| Myc阳性[例(%)] | 17(12.5) | 67(77.0) | 94.047 | <0.001 |
注:ECOG:美国东部肿瘤协作组;LDH正常值范围:91~250 U/L;non-GCB:非生发中心;IPI:国际预后指数
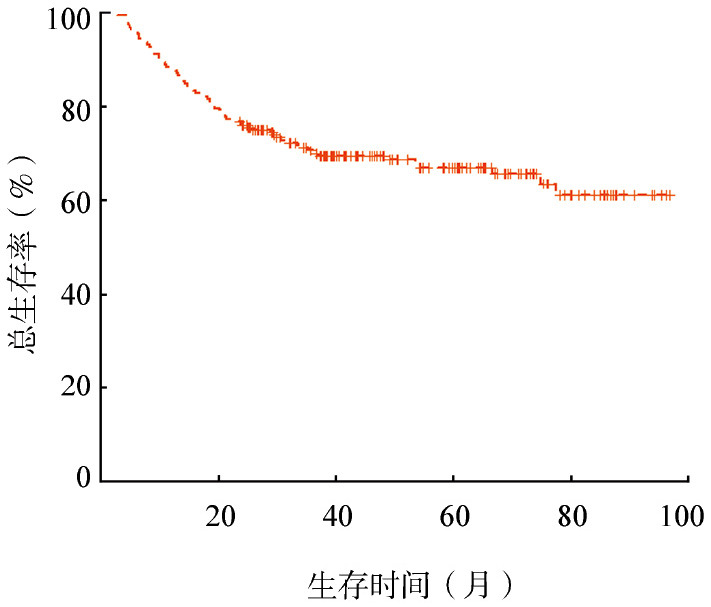
3.疗效及预后:223例患者中,未进行规范化治疗的4例患者全部死于PD。219例患者CR率65.7%,PR率21.7%,总有效率87.4%,无一例死于治疗早期相关并发症。经过系统抗肿瘤治疗的219例患者,中位随访38(2~97)个月,172例(78.5%)存活,76例(21.5%)死亡。76例死亡患者中67例(89%)死于PD:对化疗不敏感(原发PD)20例,经治疗达PR后出现PD 26例,治疗获CR后病情复发21例[中位复发时间为17(7~30)个月]。3年、5年OS率分别为70%和66%(图1)。
图1. 219例弥漫大B细胞淋巴瘤患者的总生存曲线.
4.生存分析:单因素分析结果显示Bcl-6蛋白表达(P=0.034)为预后良好因素;ECOG评分≥2分(P=0.028)、国际预后指数(IPI)危险分级≥3分(P=0.024)、TP53表达(P=0.007)、Myc/Bcl-2双表达(P=0.012)为预后不良因素(表3)。多因素分析结果显示TP53高表达(HR=1.848,95%CI 1.025~2.968,P=0.010)及Myc/Bcl-2蛋白双表达(HR=1.124,95%CI 1.134~2.256,P=0.032)为独立预后不良因素。TP53阳性与阴性组患者3年OS率分别为59%和77%,5年的OS率分别为57%和71%,差异均有统计学意义(P值均<0.05)(图2)。
表3. 影响弥漫大B细胞淋巴瘤患者总生存的单因素分析.
| 临床特征 | HR | 95%CI | P值 |
| 年龄>60岁 | 1.196 | 0.787~1.807 | 0.090 |
| 男性 | 0.976 | 0.567~1.822 | 0.710 |
| ECOG≥2分 | 1.811 | 1.396~2.436 | 0.028 |
| 结外受累部位≥2个 | 1.098 | 0.658~1.794 | 0.350 |
| LDH升高 | 1.199 | 0.806~1.812 | 0.080 |
| non-GCB型 | 1.089 | 0.625~1.899 | 0.390 |
| IPI≥3分 | 1.830 | 1.426~2.439 | 0.024 |
| Bcl-2阳性 | 1.066 | 0.664~1.947 | 0.600 |
| Bcl-6阳性 | 0.545 | 0.292~0.983 | 0.034 |
| Myc阳性 | 0.903 | 0.518~1.789 | 0.900 |
| Myc/Bcl-2双阳性 | 1.970 | 1.635~2.843 | 0.012 |
| TP53阳性 | 2.026 | 1.883~2.917 | 0.007 |
注:ECOG:美国东部肿瘤协作组;LDH正常值:91~250 U/L;IPI:国际预后指数;non-GCB型:非生发中心型
图2. TP53阳性表达对弥漫大B细胞淋巴瘤患者总生存的影响.
在CHOP方案治疗组Hans法区分的GCB及non-GCB患者OS率差异有统计学意义(5年OS率,66%对48%,χ2=5.43,P=0.040),但在R-CHOP治疗组OS率差异无统计学意义(5年OS率,68%对65%,χ2=1.80,P=0.310)。
讨论
本组DLBCL病例,中位年龄56岁,男性发病率多于女性,男女比例1.48∶1,发病部位最常见为肠道,其次是胃、睾丸、肾、肝脏,与文菁菁等[2]报道的一致。原发部位结内多于结外,15.7%的患者同时累及结内及结外,进展期比例高,IPI评分中、高危不少见。病理non-GCB来源比例明显高于国外文献报道[3]。化疗患者3年及5年OS率分别为70%和66%,稍高于国内外相关报道。
DLBCL在病理及临床方面呈高度异质性,患者对治疗的反应及预后也相差很大。随着分子病理及靶向治疗的发展,使DLBCL的预后评估有了很大进展。尽管IPI被证实是一种非常有用的预后预测工具,广泛地用于患者的危险分层[4],但它仅基于临床参数,并未涵盖疾病的生物学异质性,不能有效指导疾病的靶向治疗。随着分子预后新指标的不断出现,临床评估系统的预后作用已逐渐减弱。新的分子预后因素包括GCB、non-GCB亚型、C-Myc、Bcl-2、p53等[5]–[6]。
基因表达谱分析(GEP),将DLBCL分为3种亚型:GCB DLBCL、活化B细胞样(ABC)DLBCL,以及不能分类型(约10%),相比较于ABC及不能分类DLBCL,GCB DLBCL患者具有更好的预后[7]–[8],新药包括伊布替尼或者免疫调节剂如来那度胺在ABC及non-GCB DLBCL患者显示了非常好的疗效[9]。但GEP方法操作复杂,结合价格原因,不能在一般的医疗单位常规开展,国内常用Hans法代替GEP法,文献报道两者能够保持较高的一致性,但事实上临床工作中并未被普遍采纳,尤其在利妥昔单抗时代更是如此。本组病例分析结果显示Hans法区分的GCB及non-GCB在CHOP方案治疗组OS率差异有统计学意义(P=0.040),但在利妥昔单抗联合治疗组并未显示生存差异(P=0.310),与Staiger等[3]的研究结果一致。我们认为利妥昔单抗的使用改善了non-GCB DLBCL患者的预后,减小了两组亚型的预后差距。虽然根据患者的分子学特征将DLBCL分为ABC及GCB亚型具有非常重要的生物学意义,并且有助于更好地选择靶向治疗,然而我们的研究认为新药时代Hans法COO分型的预后价值还有待商榷。
我们在本研究中发现Bcl-6表达是预后良好因素,同时肯定了Myc/Bcl-2双表达在DLBCL的不良预后意义[10]–[11],单纯Myc或Bcl-2的表达并不影响患者的OS,然而Myc和Bcl-2双表达却是OS的预后不良因素,这似乎可以用肿瘤的双打击理论来解释。我们的研究发现Myc/Bcl-2双表达在GCB亚型较non-GCB亚型的预后意义更为显著,这与Scott等[12]的报道相一致。同时我们发现排除Myc/Bcl-2双表达病例,GCB和non-GCB亚型间的预后差异趋势变得明显,因此我们认为Myc/Bcl-2双表达是影响Hans分型GCB亚组患者预后的主要因素之一。
TP53在细胞周期及细胞增殖的调节中起着非常重要的作用,由于它能够诱导DNA损伤细胞的凋亡,从而扮演肿瘤抑制子的角色。而TP53突变则导致基因不稳定,从而诱发肿瘤细胞非控制性增殖。TP53突变在侵袭性B细胞淋巴瘤有比较高的发生率,如Burkitt淋巴瘤为33%,DLBCL为21%~23%,转化的滤泡细胞淋巴瘤为29%~80%[13]–[14]。众多研究均证实了TP53基因的突变或缺失对于预后的重要意义[15]–[16]。
然而TP53的突变测序以及FISH检测同样面临费用昂贵、对样本要求高、难以常规开展的问题,而TP53突变往往与TP53的表达相关。本研究采用免疫组化方法检测DLBCL患者的TP53蛋白水平,发现其阳性率为39.0%,TP53阳性和阴性组患者初诊断时的临床特征并无差异,但TP53阳性表达患者中non-GCB亚型比例明显高于GCB亚型,同时与Myc表达呈正相关。单因素及多因素分析结果显示TP53表达是一个独立预后不良因素,TP53表达阳性患者的预后明显劣于阴性患者。因此我们认为免疫组化法检测TP53表达可以作为不良预后的预测指标。治疗方面,利妥昔单抗的使用并不能改善TP53阳性患者的预后。
综上,我们的研究结果显示免疫组化检测的TP53蛋白表达、Myc/Bcl-2双表达可以用于DLBCL不良预后的预测。
Funding Statement
基金项目:国家自然科学基金(81670124、81370643、81470305);国家中医临床研究基地业务建设第二批科研专项(JDZX2015115)
Fund program: National Natural Science Foundation of China(81670124, 81370643, 81470305); National Chinese Medicine Clinical Research Base Business Special Construction of The Second Batch of Scientific Research(JDZX2015115)
References
- 1.Sehn LH. Paramount prognostic factors that guide therapeutic strategies in diffuse large B-cell lymphoma[J] Hematology Am Soc Hematol Educ Program. 2012;2012:402–409. doi: 10.1182/asheducation-2012.1.402. [DOI] [PubMed] [Google Scholar]
- 2.文 菁菁, 刘 志彬, 徐 娟, et al. 681例弥漫大B细胞淋巴瘤患者的临床特征分析[J] 中华血液学杂志. 2012;33(12):1004–1009. doi: 10.3760/cma.j.issn.0253-2727.2012.12.005. [DOI] [PubMed] [Google Scholar]
- 3.Staiger AM, Ziepert M, Horn H, et al. Clinical Impact of the Cell-of-Origin Classification and the MYC/ BCL2 Dual Expresser Status in Diffuse Large B-Cell Lymphoma Treated Within Prospective Clinical Trials of the German High-Grade Non-Hodgkin's Lymphoma Study Group[J] J Clin Oncol. 2017:JCO2016703660. doi: 10.1200/JCO.2016.70.3660. [DOI] [PubMed] [Google Scholar]
- 4.Ziepert M, Hasenclever D, Kuhnt E, et al. Standard International prognostic index remains a valid predictor of outcome for patients with aggressive CD20 + B-cell lymphoma in the rituximab era[J] J Clin Oncol. 2010;28(14):2373–2380. doi: 10.1200/JCO.2009.26.2493. [DOI] [PubMed] [Google Scholar]
- 5.杨 海燕, 尹 文娟, 吴 美娟, et al. BCL-2、MYC基因异常对弥漫大B细胞淋巴瘤患者预后的影响[J] 中华血液学杂志. 2015;36(8):656–661. doi: 10.3760/cma.j.issn.0253-2727.2015.08.006. [DOI] [Google Scholar]
- 6.Zou D, Yi S, Cui R, et al. BCL-2 and MYC gain/amplification is correlated with central nervous system involvement in diffuse large B cell lymphoma at leukemic phase[J] BMC Med Genet. 2017;18(1):16. doi: 10.1186/s12881-017-0381-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Alizadeh AA, Eisen MB, Davis RE, et al. Distinct types of diffuse large B-cell lymphoma identified by gene expression profiling[J] Nature. 2000;403(6769):503–511. doi: 10.1038/35000501. [DOI] [PubMed] [Google Scholar]
- 8.Rosenwald A, Wright G, Chan WC, et al. The use of molecular profiling to predict survival after chemotherapy for diffuse large-B-cell lymphoma[J] N Engl J Med. 2002;346(25):1937–1947. doi: 10.1056/NEJMoa012914. [DOI] [PubMed] [Google Scholar]
- 9.Nowakowski GS, LaPlant B, Macon WR, et al. Lenalidomide combined with R-CHOP overcomes negative prognostic impact of non-germinal center B-cell phenotype in newly diagnosed diffuse large B-Cell lymphoma: a phase II study[J] J Clin Oncol. 2015;33(3):251–257. doi: 10.1200/JCO.2014.55.5714. [DOI] [PubMed] [Google Scholar]
- 10.Hu S, Xu-Monette ZY, Tzankov A, et al. MYC/BCL2 protein coexpression contributes to the inferior survival of activated B-cell subtype of diffuse large B-cell lymphoma and demonstrates high-risk gene expression signatures: a report from The International DLBCL Rituximab-CHOP Consortium Program[J] Blood. 2013;121(20):4021–4031; quiz 4250. doi: 10.1182/blood-2012-10-460063. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Johnson NA, Slack GW, Savage KJ, et al. Concurrent expression of MYC and BCL2 in diffuse large B-cell lymphoma treated with rituximab plus cyclophosphamide, doxorubicin, vincristine, and prednisone[J] J Clin Oncol. 2012;30(28):3452–3459. doi: 10.1200/JCO.2011.41.0985. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Scott DW, Mottok A, Ennishi D, et al. Prognostic Significance of Diffuse Large B-Cell Lymphoma Cell of Origin Determined by Digital Gene Expression in Formalin-Fixed Paraffin-Embedded Tissue Biopsies[J] J Clin Oncol. 2015;33(26):2848–2856. doi: 10.1200/JCO.2014.60.2383. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Cheung KJ, Horsman DE, Gascoyne RD. The significance of TP53 in lymphoid malignancies: mutation prevalence, regulation, prognostic impact and potential as a therapeutic target[J] Br J Haematol. 2009;146(3):257–269. doi: 10.1111/j.1365-2141.2009.07739.x. [DOI] [PubMed] [Google Scholar]
- 14.Young KH, Leroy K, Møller MB, et al. Structural profiles of TP53 gene mutations predict clinical outcome in diffuse large B-cell lymphoma: an international collaborative study[J] Blood. 2008;112(8):3088–3098. doi: 10.1182/blood-2008-01-129783. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Fiskvik I, Beiske K, Delabie J, et al. Combining MYC, BCL2 and TP53 gene and protein expression alterations improves risk stratification in diffuse large B-cell lymphoma[J] Leuk Lymphoma. 2015;56(6):1742–1749. doi: 10.3109/10428194.2014.970550. [DOI] [PubMed] [Google Scholar]
- 16.Pillai RK, Sathanoori M, Van Oss SB, et al. Double-hit B-cell lymphomas with BCL6 and MYC translocations are aggressive, frequently extranodal lymphomas distinct from BCL2 double-hit B-cell lymphomas[J] Am J Surg Pathol. 2013;37(3):323–332. doi: 10.1097/PAS.0b013e31826cebad. [DOI] [PubMed] [Google Scholar]


