Abstract
目的
探讨多发性骨髓瘤(MM)6种常见细胞遗传学异常对预后的影响。
方法
对532例初诊MM患者通过CD138免疫磁珠富集骨髓瘤细胞,采用间期荧光原位杂交(FISH)技术对13q−、17p−、1q+、t(4;14)、t(11;14)和t(14;16)等MM常见遗传学异常进行检测,比较不同遗传学异常对预后的影响。
结果
532例患者中,细胞遗传学异常检出率为78.20%(416/532),其中13q−的检出率为42.29%(225/532),17p−为16.35%(87/532),1q+为53.38%(284/532),t(4;14)为25.94%(138/532),t(11;14)为21.62%(115/532),t(14;16)为2.07%(11/532)。将6种细胞遗传学异常进行相关性分析,得出13q−与17p−、1q+、t(4;14)、t(14;16)的发生均相关(P值均<0.05)。单因素分析结果显示,13q−、1q+、t(4;14)和t(14;16)对患者无进展生存(PFS)有明显影响,13q−、17p−、t(4;14)和t(14;16)对患者总生存(OS)有明显影响。多因素分析结果显示,1q+、t(4;14)和t(14;16)是影响患者PFS的独立预后不良因素,17p−、t(4;14)和t(14;16)是影响患者OS的独立预后不良因素。将患者根据所伴有的独立预后不良因素的数量进行分组,伴有0、1、2、3个独立预后不良因素的患者中位PFS时间分别为30.9、28.4、18.7、17.6个月(P=0.035),中位OS分别为54.4、46.1、38.0、21.2个月(P=0.004)。
结论
1q+、17p−、t(4;14)和t(14;16)是影响MM患者生存的独立预后不良因素;13q−的发生常伴随着17p−、1q+和(或)t(4;14),单纯13q−不是独立预后因素;伴有的独立预后不良因素数量越多,患者预后越差。
Keywords: 多发性骨髓瘤, 细胞遗传学, 荧光原位杂交, 预后
Abstract
Objective
To explore the effect of 6 common cytogenetic abnormalities on the prognosis of multiple myeloma (MM).
Methods
Myeloma cells from a cohort of 532 newly-diagnosed MM patients enrolled were enriched by CD138 immunomagnetic beads, then detected 13q−, 17p−, 1q+, t(4;14), t(11;14) and t(14;16) and other common genetic abnormalities in MM by using interphase fluorescence in situ hybridization (FISH) technique to compare the influence of different genetic abnormalities on their prognoses.
Results
The rate of cytogenetic abnormalities was 78.20% (416/532) in 532 patients, of which 13q− accounted for 42.29% (225/532), 17p− 16.35% (87/532), 1q+ 53.38% (284/532), t(4;14) 25.94% (138/532), t(11;14) 21.62% (115/532), t(14;16) 2.07% (11/532). Six kinds of cytogenetic abnormalities were analyzed, 13q− and 17p−, 1q+, t (4; 14), t(14;16) were all correlated (P <0.05). The univariate analysis indicated that 13q−, 1q+, t(4;14) and t(14;16) had a significant effect on progression-free survival (PFS), 13q−, 17p−, t(4;14) and t(14;16) had a marked influence on overall survival (OS). The multivariate analysis showed that 1q+, t(4;14) and t(14;16) were independent adverse factors of PFS, 17p−, t(4;14) and t(14;16) were independent unfavorable factors of OS. According to the independent prognosis factors number-based groups, the median PFS with 0, 1, 2, 3 independent prognosis factors of patients were 30.9, 28.4, 18.7 and 17.6 months (P =0.035) respectively, and the median OS were 54.4, 46.1, 38.0 and 21.2 months (P =0.004) respectively.
Conclusion
1q+, 17p−, t(4;14) and t(14;16) were independent prognostic factors affecting the survival of MM patients. 13q− is often accompanied by 17p−, 1q + and (or) t(4;14), simply 13q− was not an independent prognostic factor; the more number of independent prognostic factors, the worse the prognosis of patients.
Keywords: Multiple, myeloma; Cytogenetics; Fluorescence in situ hybridization; Prognosis
多发性骨髓瘤(MM)以骨髓中克隆性浆细胞恶性增殖和异常积聚为特征,异常浆细胞浸润骨骼和软组织,产生过量M蛋白,引起骨骼破坏伴贫血、肾功能损坏和免疫功能异常。其临床经过及预后差异很大,疾病呈现明显的异质性。MM的遗传学改变多为同时包含数量和结构改变的复杂核型异常,所有46条染色体均可能受累[1]。已有研究表明MM部分核型异常是非随机分布的。我们采用磁珠分选系统(MACS)结合荧光原位杂交(FISH)技术对532例MM患者13q−、17p−、1q+、t(4;14)、t(11;14)和t(14;16)等MM常见遗传学异常进行了检测,并对其相关性及对预后的影响进行了分析。
病例与方法
1.病例资料:532例患者均来自上海长征医院2013年6月至2015年12月收治的初诊MM患者,诊断均符合2015年修订的《中国多发性骨髓瘤诊治指南》[2]诊断标准,其中男319例,女213例,中位年龄59(35~78)岁。532例患者中524例患者接受以硼替佐米为基础的化疗,5例患者接受以沙利度胺为基础的化疗,3例患者接受传统化疗,所有患者均接受至少2个疗程的诱导化疗。
2.间期FISH技术检测常见遗传学异常:每例初发MM患者抽取15~20 ml骨髓标本,肝素抗凝,密度梯度离心法分离骨髓单个核细胞,MACS法分选纯化浆细胞。用MACS缓冲液制备细胞悬液,每5×l06个细胞加80 µl缓冲液及10 µl CD138磁珠混匀,4 °C孵育15 min以上。过柱分离CD138阳性细胞,将纯化的浆细胞低渗固定处理后收获细胞,−20 °C冻存。探针购自英国CYTOCELL公司。严格按照试剂说明书进行操作。Ther-moBrite原位杂交仪购自美国自然基因有限公司。结果判断标准:用OPI YMPUS BX51荧光显微镜在DAPI/FITC/RED三色滤光镜激发下观察,每个样本每个探针分别观察200个间期细胞荧光杂交信号,用FISH分析软件(美国VideoTest公司产品)进行图像分析。阈值:参考值按照欧洲骨髓瘤工作组设定标准,13q−、17p−和1q+的阈值均设置为20%。
3.随访:所有患者均随访至2016年6月,中位随访时间为15.2(3.2~61.8)个月,采用住院病历查询及电话联系方式进行随访,观察无进展生存(PFS)时间和总生存(OS)时间。PFS期定义为从开始治疗至疾病进展或复发的时间;OS期定义为从开始治疗至死亡的时间,末次随访仍无以上事件发生则计算至末次随访日[3]。患者中位PFS时间27.3个月,中位OS时间47.7个月。
4.统计学处理:采用SPSS21.0软件进行统计学分析,相关性分析用线性相关分析法,Kaplan-Meier法进行单因素分析,Cox回归模型进行多因素分析,率的比较采用χ2检验,P<0.05为差异有统计学意义。
结果
1.细胞遗传学异常检出率:532例多发性骨髓瘤患者中,细胞遗传学异常检出率为78.20%(416/532),13q−的检出率为42.29%(225/532),17p−的检出率为16.35%(87/532),1q +的检出率为53.38%(284/532),t(4;14)的检出率为25.94%(138/532),t(11;14)的检出率为21.62%(115/532),t(14;16)的检出率为2.07%(11/532)。
2.6种常见细胞遗传学异常之间的相关性分析:结果见表1。13q−与17p−、1q+、t(4;14)、t(14;16)发生相关(P值均<0.05);1q +与t(4;14)发生相关;t(14;16)例数太少,结果不做分析。
表1. 多发性髓瘤患者6种常见细胞遗传学异常之间相关性分析.
| 细胞遗传学异常 | 13q− |
17p− |
1q + |
t(4;14) |
t(11;14) |
t(14;16) |
||||||
| r值 | P值 | r值 | P值 | r值 | P值 | r值 | P值 | r值 | P值 | r值 | P值 | |
| 13q− | 0.14 | <0.01 | 0.15 | <0.01 | 0.43 | <0.01 | −0.19 | 0.21 | 0.11 | <0.05 | ||
| 17p− | 0.14 | <0.01 | −0.08 | 0.11 | 0.00 | 0.97 | −0.07 | 0.19 | 0.10 | <0.05 | ||
| 1q + | 0.15 | <0.01 | −0.08 | 0.11 | 0.15 | <0.01 | −0.07 | 0.15 | 0.02 | 0.77 | ||
| t(4;14) | 0.43 | <0.01 | 0.00 | 0.97 | 0.15 | <0.01 | −0.24 | <0.01 | −0.08 | 0.13 | ||
| t(11;14) | −0.19 | 0.21 | −0.07 | 0.19 | −0.07 | 0.15 | −0.24 | <0.01 | −0.07 | 0.20 | ||
| t(14;16) | 0.11 | <0.05 | 0.11 | <0.05 | 0.02 | 0.77 | −0.08 | 0.13 | −0.07 | 0.20 | ||
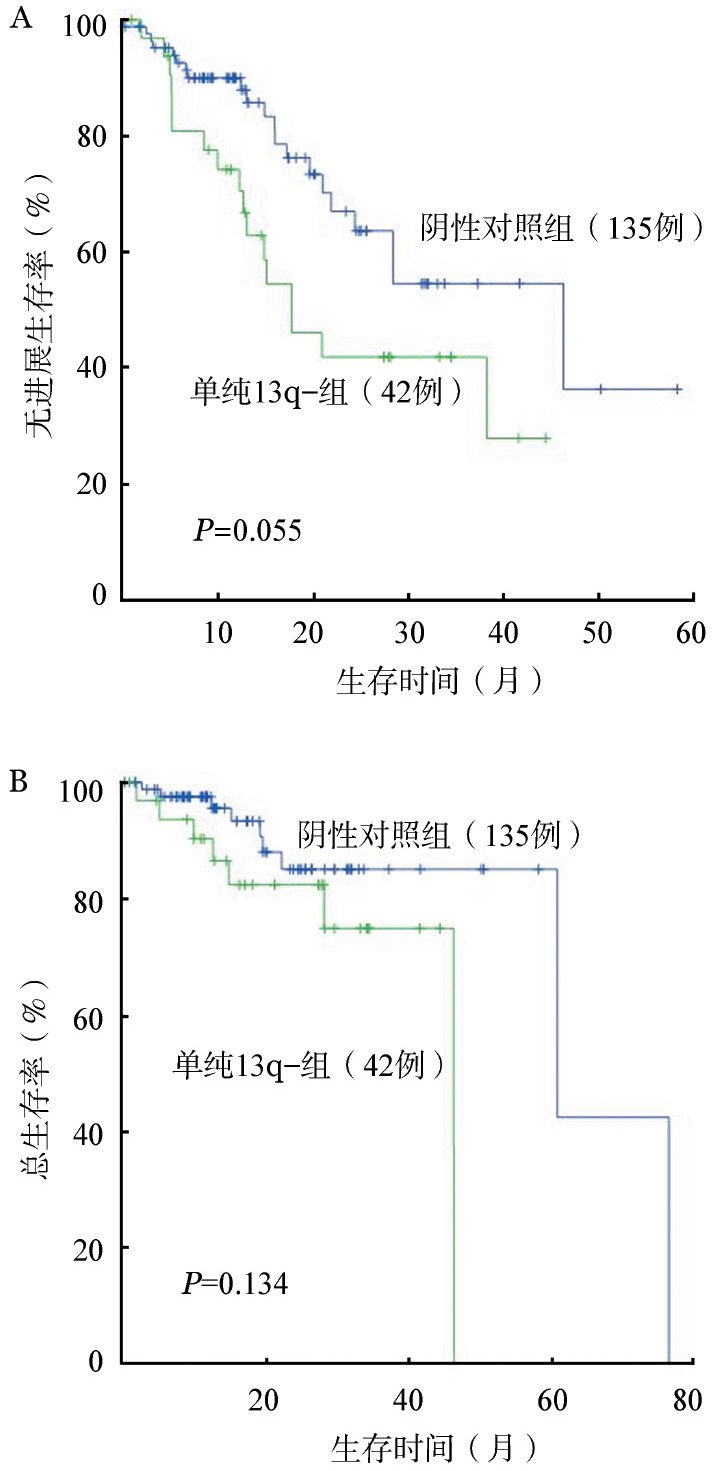
3.预后单因素分析:单因素分析13q−、17p−、1q+、t(4;14)、t(14;16)、t(11;14)6种细胞遗传学异常对PFS、OS的影响,结果见表2。对PFS有显著影响的是13q−、1q +、t(4;14)和t(14;16)(P值分别为0.025、0.008、0.041和0.027),对OS有显著影响的是13q−、17p−、t(4;14)和t(14;16)(P值分别为0.005、0.025、0.007和0.009)。相关性分析得出13q−的发生往往伴随着17p−、1q +和(或)t(4;14)等遗传学异常,故排除其他因素的影响,将单纯13q−的患者与阴性对照组(无细胞遗传学异常)进行生存比较。结果两组PFS和OS差异均无统计学意义(P值分别为0.055、0.134)(图1)。
表2. 影响多发性骨髓瘤患者无进展生存(PFS)和总生存(OS)的单因素分析.
| 细胞遗传学异常 | 例数 | PFS |
OS |
||||
| PFS期(月) | HR | P值 | OS期(月) | HR | P值 | ||
| 13q− | 1.459 | 0.025 | 2.088 | 0.005 | |||
| ≥ 20% | 255 | 35.5 | 37.2 | ||||
| <20% | 277 | 40.2 | 40.6 | ||||
| 17p− | 0.923 | 0.812 | 1.573 | 0.025 | |||
| ≥ 20% | 70 | 24.1 | 26.3 | ||||
| <20% | 462 | 38.2 | 39.5 | ||||
| 1q+ | 1.692 | 0.008 | 1.021 | 0.416 | |||
| ≥ 20% | 303 | 27.2 | 30.3 | ||||
| <20% | 229 | 46.3 | 46.4 | ||||
| t(4;14) | 1.590 | 0.041 | 2.198 | 0.007 | |||
| 阳性 | 106 | 29.9 | 31.3 | ||||
| 阴性 | 426 | 37.2 | 40.6 | ||||
| t(14;16) | 1.566 | 0.027 | 1.655 | 0.009 | |||
| 阳性 | 10 | 18.6 | 31.3 | ||||
| 阴性 | 522 | 40.1 | 40.6 | ||||
| t(11;14) | 0.701 | 0.497 | 0.891 | 0.091 | |||
| 阳性 | 90 | 24.4 | 25.5 | ||||
| 阴性 | 442 | 38.2 | 40.6 | ||||
图1. 单纯13q−和阴性对照组无进展生存(A)和总生存(B)的比较.
4.预后多因素分析:将单因素分析筛选出的5项预后相关因素纳入多因素分析,结果显示1q+、t(4;14)和t(14;16)是影响患者PFS的独立预后不良因素,17p−、t(4;14)和t(14;16)是影响患者OS的独立预后不良因素(表3、4)。
表3. 影响多发性骨髓瘤患者无进展生存的Cox多因素分析.
| 因素 | B | 标准误 | Wald | P值 | HR(95%CI) |
| 13q− | 0.120 | 0.175 | 0.474 | 0.491 | 1.128(0.801~1.588) |
| 17p− | 0.249 | 0.209 | 1.418 | 0.234 | 1.283(0.851~1.932) |
| 1q + | 0.602 | 0.179 | 11.287 | 0.001 | 1.825(1.285~2.593) |
| t(4;14) | 0.064 | 0.222 | 0.083 | 0.043 | 1.457(1.032~1.872) |
| t(14;16) | 0.798 | 0.513 | 2.416 | 0.020 | 1.955(1.521~2.303) |
表4. 影响多发性骨髓瘤患者总生存的Cox多因素分析.
| 因素 | B | 标准误 | Wald | P值 | HR(95%CI) |
| 13q− | 0.113 | 0.152 | 0.550 | 0.458 | 1.120(0.831~1.510) |
| 17p− | 0.553 | 0.171 | 10.521 | 0.001 | 1.739(1.245~2.429) |
| 1q+ | 0.314 | 0.154 | 4.155 | 0.062 | 1.369(0.792~1.851) |
| t(4;14) | −0.068 | 0.196 | 0.120 | 0.029 | 1.433(1.221~1.700) |
| t(14;16) | −0.064 | 0.587 | 0.012 | 0.013 | 1.528(1.301~1.814) |
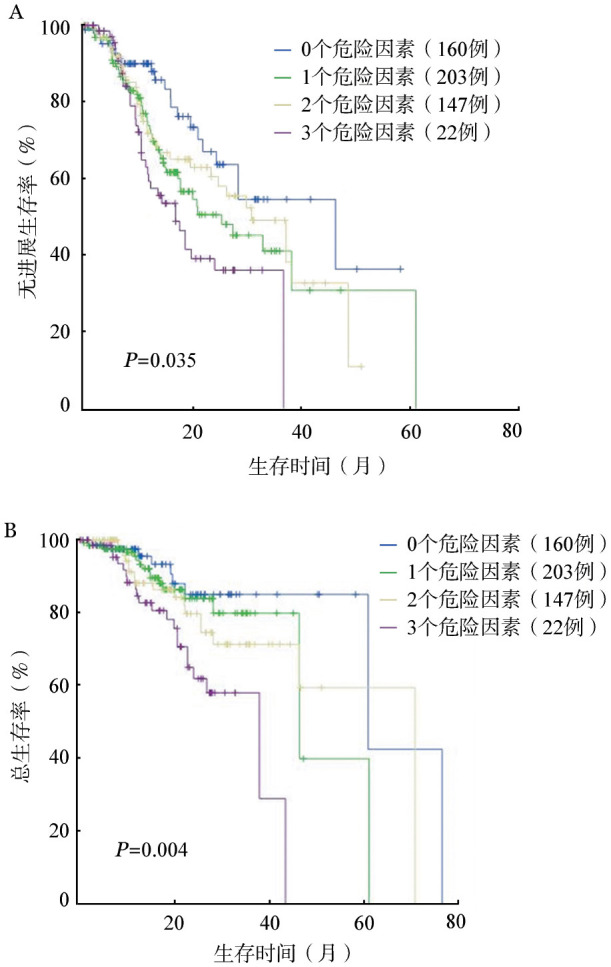
5.伴有独立预后不良因素的数量对预后的影响:按患者所伴有的17p−、1q+、t(4;14)和t(14;16)四个独立预后因素的数量,将患者分为0、1、2和3个预后不良因素组,四组患者的中位PFS期分别为30.9、28.4、18.7、17.6个月,中位OS期分别为54.4、46.1、38.0、21.2个月,差异均有统计学意义(P值分别为0.035、0.004)(图2)。患者伴有的预后不良因素数量越多,中位PFS和OS期均越短,即预后越差。
图2. 伴有不同数量预后不良因素患者无进展生存(A)和总生存(B)的比较.
讨论
13q14染色体缺失是MM最常见的染色体异常之一,主要涉及D13S319至D13S25的较大片段丢失,具体定位在13q14.3。早期有研究者认为13q−是MM患者独立的不良预后因素[4],但近年国外学者发现13q−并非独立的预后因素,其预后差主要与合并17p−、t(4;14)和t(14;16)等其他不良预后因素有关[5]。本研究我们将13q−与其他所有常见遗传学异常进行了相关性分析,发现13q−的预后差与此前国内外文献报道的三种不良预后因素相关,同时发现13q−还与1q+有高度相关性。当13q−单独出现时,不会缩短患者的PFS和OS期,但大多数情况下13q−的出现往往伴随着17p−、1q+和(或)t(4;14),所以13q−的预后不良与17p−、1q+和(或)t(4;14)发生相关。
在MM中涉及17号染色体异常主要发生在p53基因,p53基因是疾病进展期的继发性改变,疾病进展患者的检出率明显高于初诊患者[6]。本研究结果提示17p−对OS有显著不良影响,是OS的独立预后不良因素。另有研究表明17p−累及的细胞比例越高,预后越差[7]。MM中1q异常最初在传统细胞遗传学检测中被发现,包括1q12~q23正向和反向重复、1q等臂染色体、1q跳跃性易位[8],MM中我们重点讨论1q21区域的基因。本研究结果提示1q+对PFS有显著不良影响,是影响患者PFS的独立预后不良因素。国外文献报道初治MM患者1q21扩增检出率为35%~45%[9]–[10],本中心研究结果为53.38%,高于文献报道。1q21拷贝数的变异对MM患者的预后影响仍有待研究。国外有研究认为3个以上的1q21拷贝数和3个拷贝数的患者预后无差别[10],但也有文献报道3个以上拷贝数的患者预后更差[11]。MM中IgH易位最常累及的5个伙伴基因分别为11q13(cyclinD1)、6p21(cyclinD)、16q23(MAF)、20q12(MAFB)和4p16(FGFR3以及MMSET)。其中最常见的易位是t(4;14)(p16;q32),本研究检出率为25.94%,多因素分析结果提示t(4;14)是影响患者PFS和OS的独立预后不良因素。检出率列第2位的是t(11;14)(q13;q32),检出率为21.62%,预后单因素分析结果显示对PFS和OS均无显著影响,与国内外文献报道一致。临床上很重要但出现频率非常低的易位是t(14;16)(q32;q23),本研究检出率为2.07%,多因素分析同样显示为影响患者PFS和OS的独立预后不良因素。
对于伴有细胞遗传学异常数量的多少对MM患者预后的影响方面的研究,国内外文献都鲜有报道,本研究在相关分析后得出17p−、1q +、t(4;14)或t(14;16)是MM独立的预后不良因素,且患者伴随的这4个遗传学异常的数量越多、预后越差,从而为临床对患者危险度评估提供了有力的依据。
随着遗传学检查技术的深入研究,FISH检测用于评估患者预后以及进行疾病危险度分层变得尤为重要,由于不同学者应用不同检测手段得到的研究结果可能不同,导致遗传学异常对预后的意义存在一定的差异,希望通过以后更深入的研究,在细胞遗传学对MM预后的影响方面达成共识来指导临床治疗。
Funding Statement
基金项目:国家自然科学基金(81670193)
Fund program: National Natural Science Foundation of China(81670193)
References
- 1.陈 丽娟, 李 建勇, 朱 雨, et al. 多发性骨髓瘤1q染色体异常与13q缺失的相关性研究[J] 中华医学遗传学杂志. 2009;26(1):102–105. [Google Scholar]
- 2.中国医师协会血液科医师分会, 中华医学会血液学分会, 中国医师协会多发性骨髓瘤专业委员会. 中国多发性骨髓瘤诊治指南(2015年修订)[J] 中华内科杂志. 2015;54(12):1066–1070. doi: 10.3760/cma.j.issn.0578-1426.2015.12.020. [DOI] [Google Scholar]
- 3.杨 强, 侯 健, 陈 文明, et al. 双克隆免疫球蛋白多发性骨髓瘤六例报告并文献复习[J] 中华血液学杂志. 2016;37(7):614–616. doi: 10.3760/cma.j.issn.0253-2727.2016.07.015. [DOI] [Google Scholar]
- 4.Fonseca R, Harrington D, Oken MM, et al. Biological and prognostic significance of interphase fluorescence in situ hybridization detection of chromosome 13 abnormalities (delta13) in multiple myeloma: an eastern cooperative oncology group study[J] Cancer Res. 2002;62(3):715–720. [PubMed] [Google Scholar]
- 5.Avet-Loiseau H, Attal M, Campion L, et al. Long-term analysis of the IFM 99 trials for myeloma: cytogenetic abnormalities [t(4;14), del(17p), 1q gains] play a major role in defining long-term survival[J] J Clin Oncol. 2012;30(16):1949–1952. doi: 10.1200/JCO.2011.36.5726. [DOI] [PubMed] [Google Scholar]
- 6.Tiedemann RE, Gonzalez-Paz N, Kyle RA, et al. Genetic aberrations and survival in plasma cell leukemia[J] Leukemia. 2008;22(5):1044–1052. doi: 10.1038/leu.2008.4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Painuly U, Rajkumar V, Ketterling RP, et al. 17p deleted multiple myeloma: clinical outcomes and predictive factors for acquisition of 17p deletion[J] Blood (ASH Annual Meeting Abstracts) 2013;122:1846. [Google Scholar]
- 8.Sawyer JR, Tricot G, Lukacs JL, et al. Genomic instability in multiple myeloma: evidence for jumping segmental duplications of chromosome arm 1q[J] Genes Chromosomes Cancer. 2005;42(1):95–106. doi: 10.1002/gcc.20109. [DOI] [PubMed] [Google Scholar]
- 9.Hanamura I, Stewart JP, Huang Y, et al. Frequent gain of chromosome band 1q21 in plasma-cell dyscrasias detected by fluorescence in situ hybridization: incidence increases from MGUS to relapsed myeloma and is related to prognosis and disease progression following tandem stem-cell transplantation[J] Blood. 2006;108(5):1724–1732. doi: 10.1182/blood-2006-03-009910. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Bahmanyar M, Qi X, Chang H. Genomic aberrations in anaplastic multiple myeloma: high frequency of 1q21(CKS1B) amplifications[J] Leuk Res. 2013;37(12):1726–1728. doi: 10.1016/j.leukres.2013.09.025. [DOI] [PubMed] [Google Scholar]
- 11.Neben K, Lokhorst HM, Jauch A, et al. Administration of bortezomib before and after autologous stem cell transplantation improves outcome in multiple myeloma patients with deletion 17p[J] Blood. 2012;119(4):940–948. doi: 10.1182/blood-2011-09-379164. [DOI] [PubMed] [Google Scholar]


