Abstract
目的
明确美国国家综合癌症网络国际预后指数(NCCN-IPI)对外周T细胞淋巴瘤(PTCL)患者化疗后的预后评估价值。
方法
回顾性分析2003年1月至2013年5月接受CHOP或CHOP样方案化疗的162例初治PTCL患者的临床资料,采用国际预后指数(IPI)和NCCN-IPI进行危险分层和预后评估。
结果
①162例患者预期5年总生存(OS)和无进展生存(PFS)率分别为33%和20%,中位OS和PFS时间分别为17.0和9.2个月。②多因素分析提示美国东部肿瘤协作组体能状态评分(ECOG评分)≥2分(PFS:HR=2.418,95%CI 1.535~3.809,P<0.001;OS:HR=2.347,95%CI 1.435~3.839,P=0.001)和存在特定的结外病变部位(PFS:HR=1.800,95%CI 1.216~2.665,P=0.003;OS:HR=1.608,95%CI 1.054~2.454,P=0.027)是影响患者PFS和OS的独立危险因素;ALK+是影响间变性大细胞淋巴瘤患者PFS(HR=0.424,95%CI 0.184~0.975,P=0.043)及OS(HR=0.276,95%CI 0.087~0.877,P=0.029)的独立预后良好因素。③NCCN-IPI低危组患者的生存率显著高于IPI低危组患者(5年OS率74%对54%,χ2=5.041,P=0.025;5年PFS率50%对38%,χ2=5.295,P=0.021),差异均有统计学意义。
结论
NCCN-IPI较IPI对低危PTCL患者具有更好的预后判断意义,可作为PTCL患者有效的预后分层工具。
Keywords: 淋巴瘤,T细胞,外周, 预后, 国际预后指数, 美国国家综合癌症网络国际预后指数
Abstract
Objective
To validate the prognostic value of NCCN-International Prognostic Index (NCCN-IPI) for patients with peripheral T-cell lymphoma (PTCL) treated with CHOP-based chemotherapy.
Methods
A retrospective analysis in 162 PTCL patients who were initially diagnosed and treated in Rui Jin Hospital from January 2003 to May 2013 was conducted. Baseline characteristics were collected, and survival analysis was performed according to the IPI and NCCN-IPI model.
Results
The estimated 5-year overall survival (OS) rate and progression free survival (PFS) rate were 33% and 20%, with median OS and PFS of 17.0 months and 9.2 months, respectively. Multivariate analysis indicated ECOG score (PFS: HR=2.418, 95%CI 1.535–3.809, P<0.001; OS: HR=2.347, 95%CI 1.435–3.839, P= 0.001), specific extra-nodal sites (PFS: HR=1.800, 95%CI 1.216–2.665, P=0.003; OS: HR=1.608, 95% CI 1.054–2.454, P=0.027) and pathology type (PFS: HR=0.424, 95% CI 0.184–0.975, P=0.043; OS: HR=0.276, 95% CI 0.087–0.877, P=0.029) were independent prognostic factors of OS and PFS for the patients with PTCL. The survival rates of low risk patients based on NCCI-IPI were remarkably higher than the counterparts based on IPI (5-year OS 74% vs 54%, χ2=5.041, P=0.025, 5-year PFS 50% vs 38%, χ2= 5.295, P=0.021). NCCN-IPI was outstanding to identify the subgroup of low risk patients with PTCL, who may benefit from conventional chemotherapy such as CHOP or CHOP-like regimen.
Conclusion
NCCN-IPI is more powerful for low risk PTCL patients and a strong supplement for IPI.
Keywords: Lymphoma, T-cell, peripheral; Prognosis; International prognostic index; National comprehensive cancer network international prognostic index
外周T细胞淋巴瘤(peripheral T-cell lymphoma,PTCL)起源于胸腺后或成熟T淋巴细胞或自然杀伤细胞,是一组具有高度异质性的恶性肿瘤[1],在临床上可表现为皮肤、脾脏、骨髓等多发结外器官受累[2]。目前PTCL尚缺乏非常有效的治疗方法,临床上多采用CHOP(环磷酰胺、多柔比星、长春新碱、泼尼松)方案或CHOP样方案进行全身化疗,但仅有少数患者经上述化疗后获得良好生存,大部分PTCL患者仍然预后不佳,5年总体生存(OS)率仅30%~40%[3]–[4]。由于PTCL异质性较强,在临床实践中需要根据患者不同的预后分层制订和调整治疗策略。因此,如何对PTCL进行精确的预后分层显得至关重要。
国际预后指数(IPI)在多种非霍奇金淋巴瘤(NHL)中均被证实有效[5]–[6]。2014年构建的美国国家综合癌症网络IPI(NCCN-IPI)在弥漫大B细胞淋巴瘤(diffused large B cell lymphoma,DLBCL)中较IPI具有更强的预后评估效应[7]。迄今为止,NCCN-IPI对于PTCL患者的预后评估价值还鲜有研究报道。在本研究中我们采用NCCN-IPI评价体系回顾性分析了在我院接受治疗的PTCL患者的生存状况,并将其与IPI预后分层进行对比,探讨NCCN-IPI在PTCL患者中的应用价值。
病例与方法
1.病例:收集2003年1月至2013年5月在我院确诊的162例初诊PTCL患者资料,所有患者均经活检或手术病理确诊并符合世界卫生组织(WHO)2008年关于淋巴组织肿瘤分类标准。分别采用IPI、NCCN-IPI评分进行预后评估。
2.治疗与疗效评估:所有患者均接受标准剂量CHOP方案或CHOP样方案化疗,中位疗程数为6(1~12)个,达到最佳疗效后有6例(3.7%)患者后续接受自体造血干细胞移植,其余患者结束治疗定期接受随访。疗效评价采用全身PET-CT或增强CT,并按照2007年国际工作组标准评价疗效[1]。
3.随访及预后:随访方式主要为查阅住院及门诊病历或者电话随访,末次随访时间为2016年7月1日。无进展生存(PFS)期定义为明确诊断至疾病进展、复发或死亡时间。OS期定义为明确诊断至任何原因导致死亡或末次随访时间。
4.统计学处理:采用SPSS 23.0软件进行统计学分析,采用Kaplan-Meier法描绘生存曲线,采用Log-rank检验进行单因素分析,各分类变量间采用χ2检验,采用Cox回归模型进行多因素分析。以双侧P<0.05表示差异有统计学意义。
结果
1.一般资料:162例患者中位年龄55(13~81)岁,男性患者101例(62.3%)。Ann Arbor分期Ⅲ~Ⅳ期患者122例(75.3%),美国东部肿瘤协作组(ECOG)体力状态评分≥2分者40例(24.7%)。有B症状(发热、盗汗、体重减轻)者108例(66.7%)。存在特定结外病变部位[骨髓、中枢神经系统(CNS)、肝脏/胃肠道或肺部]者77例(47.5%),骨髓受累者43例(26.5%)、胃肠道受累者28例(17.3%)和皮肤受累者16例(9.9%),累及≥2个结外器官者37例(22.8%)。LDH水平升高(LDH>192 U/L)者92例(56.8%)。临床病理结果显示,PTCL-非特指型(PTCL-NOS)98例(60.5%),血管免疫母细胞性T细胞淋巴瘤(AITL)20例(12.3%),间变性大细胞淋巴瘤,ALK阳性(ALCL,ALK+)13例(8.0%),ALCL,ALK阴性(ALCL,ALK−)17例(10.5%),肠病相关T细胞淋巴瘤(EATL)11例(6.8%),肝脾T细胞淋巴瘤3例(1.9%)(表1)。
表1. 162例外周T细胞淋巴瘤(PTCL)患者的临床特征及预后单因素分析.
| 影响因素 | 例数(%) | 总生存 |
无进展生存 |
||||
| 中位时间(月) | χ2值 | P值 | 中位时间(月) | χ2值 | P值 | ||
| 性别 | 0.030 | 0.862 | 0.003 | 0.952 | |||
| 男 | 101(62.3) | 18.0 | 10.0 | ||||
| 女 | 61(37.7) | 12.0 | 9.0 | ||||
| 年龄(岁) | 6.479 | 0.097 | 3.670 | 0.299 | |||
| ≤40 | 37(22.8) | 19.3 | 10.0 | ||||
| >40~60 | 62(38.3) | 18.0 | 9.0 | ||||
| >60~75 | 58(35.8) | 12.0 | 9.1 | ||||
| >75 | 5(3.1) | 3.0 | 3.0 | ||||
| 临床分期 | 4.781 | 0.029 | 6.399 | 0.012 | |||
| Ⅰ~Ⅱ期 | 40(24.7) | 46.0 | 24.0 | ||||
| Ⅲ~Ⅳ期 | 122(75.3) | 12.0 | 9.0 | ||||
| ECOG评分 | 20.193 | <0.001 | 15.916 | <0.001 | |||
| 0~1分 | 122(75.3) | 24.0 | 12.0 | ||||
| ≥2分 | 40(24.7) | 4.0 | 3.0 | ||||
| B症状 | 11.494 | 0.001 | 3.158 | 0.077 | |||
| 无 | 54(33.3) | 46.6 | 13.0 | ||||
| 有 | 108(66.7) | 12.0 | 9.0 | ||||
| 结外累及部位数 | 14.264 | <0.001 | 11.138 | 0.001 | |||
| 0~1处 | 125(77.2) | 20.1 | 10.0 | ||||
| ≥2处 | 37(22.8) | 6.0 | 5.0 | ||||
| 特定的结外病变部位 | 23.310 | <0.001 | 21.674 | <0.001 | |||
| 无 | 85(52.5) | 46.6 | 16.2 | ||||
| 有 | 77(47.5) | 9.1 | 6.2 | ||||
| LDH水平 | 24.655 | <0.001 | 14.448 | 0.001 | |||
| 正常 | 70(43.2) | 36.0 | 13.0 | ||||
| >1至≤3倍 | 78(48.1) | 14.0 | 10.0 | ||||
| >3倍 | 14(8.7) | 2.0 | 2.0 | ||||
| 病理类型 | 25.498 | <0.001 | 13.908 | 0.016 | |||
| PTCL-NOS | 98(60.5) | 18.0 | 9.0 | ||||
| AITL | 20(12.3) | 12.0 | 10.0 | ||||
| ALCL,ALK+ | 13(8.0) | 90.0 | 60.0 | ||||
| ALCL,ALK− | 17(10.5) | 17.5 | 12.0 | ||||
| EATL | 11(6.8) | 6.0 | 5.0 | ||||
| 肝脾T细胞淋巴瘤 | 3(1.9) | 未达到 | 未达到 | ||||
注:ECOG评分:美国东部肿瘤协作组体力状态评分;B症状:发热、盗汗、体重减轻;特定的结外病变部位:骨髓、中枢神经系统、肝脏/胃肠道或肺;LDH:正常值上限为192 U/L;PTCL-NOS:PTCL-非特指型;AITL:血管免疫母细胞性T细胞淋巴瘤;ALCL,ALK+:间变性大细胞淋巴瘤,ALK阳性;ALCL,ALK−:ALCL,ALK阴性;EATL:肠病相关T细胞淋巴瘤
2.IPI和NCCN-IPI评分分组与疗效的关系分析:162例患者中58例(35.8%)获得完全缓解(CR),35例(21.6%)获得部分缓解(PR),总有效率为57.4%,达到CR的中位化疗疗程数为6(4~8)疗程。IPI和NCCN-IPI评分分组各组患者的CR率差异均有统计学意义(P值均<0.001)(表2)。
表2. IPI和NCCN-IPI评分分组患者的疗效和生存分析.
| 组别 | 例数(%) | 完全缓解 |
5年总生存 |
5年无进展生存 |
||||||
| 率(%) | χ2值 | P值 | 率(%) | χ2值 | P值 | 率(%) | χ2值 | P值 | ||
| IPI评分分组 | 20.531 | <0.001 | 51.248 | <0.001 | 37.067 | <0.001 | ||||
| 低危组 | 43(26.6) | 58.1 | 54 | 38 | ||||||
| 低中危组 | 57(35.2) | 35.1 | 38 | 17 | ||||||
| 中高危组 | 37(22.8) | 32.4 | 23 | 14 | ||||||
| 高危组 | 25(15.4) | 25.0 | 4 | 4 | ||||||
| NCCN-IPI评分分组 | 20.748 | <0.001 | 38.642 | <0.001 | 29.853 | <0.001 | ||||
| 低危组 | 19(11.7) | 73.7 | 74 | 50 | ||||||
| 低中危组 | 76(46.9) | 39.5 | 45 | 27 | ||||||
| 中高危组 | 51(31.5) | 25.5 | 16 | 7 | ||||||
| 高危组 | 16(9.9) | 6.2 | 0 | 0 | ||||||
注:IPI:国际预后指数,低危(0~1分)、低中危(2分)、中高危(3分)、高危(4~5分);NCCN-IPI:美国国家综合癌症网络国际预后指数,低危(0~1分)、低中危(2~3分)、中高危(4~5分)、高危(6~8分)
3.生存情况:中位随访时间为12.5(1.0~162.0)个月。1年OS率和PFS率分别47%和33%;5年OS率和PFS率分别为33%和20%。中位OS和PFS时间分别为17.0和9.2个月。就病理类型而言,ALCL,ALK+患者的5年OS率为75%,显著优于ALCL,ALK−(27%)、PTCL-NOS(32%)、AITL(30%)和EATL(21%),差异有统计学意义(P< 0.001)(图1)。3例肝脾T细胞淋巴瘤患者均在2年内死亡。
图1. 不同病理类型外周T细胞淋巴瘤(PTCL)患者的生存曲线比较.
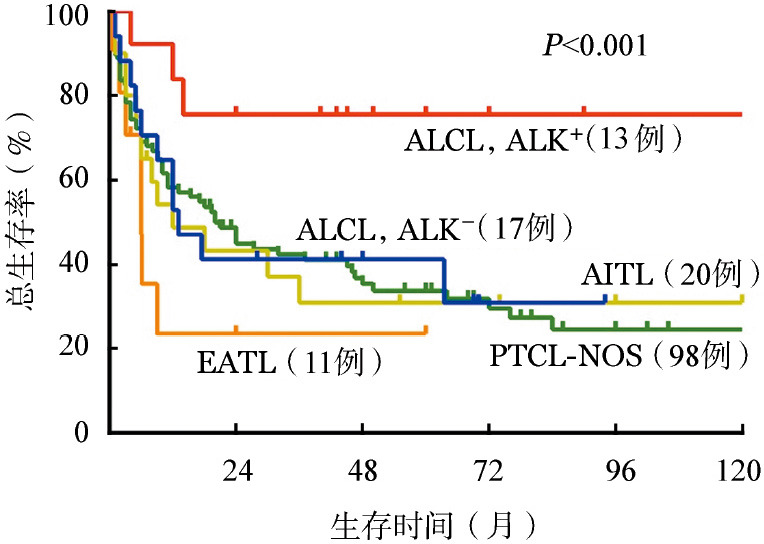
PTCL-NOS:PTCL-非特指型;AITL:血管免疫母细胞性T 细胞淋巴瘤;ALCL,ALK+:间变性大细胞淋巴瘤,ALK阳性;ALCL,ALK−:ALCL,ALK阴性;EATL:肠病相关T细胞淋巴瘤
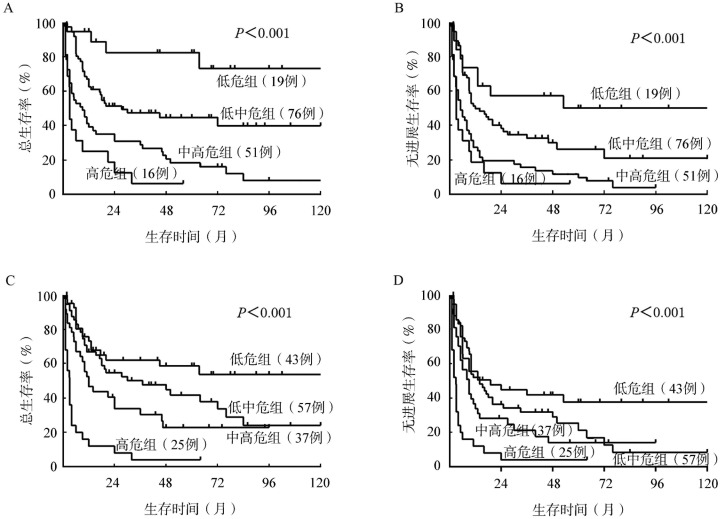
IPI和NCCN-IPI评分分组各组间患者的5年OS、PFS率差异均有统计学意义(P值均<0.001);无论是在IPI还是NCCN-IPI评分系统中,中高危和高危患者的5年OS、PFS率均低于低中危和低危组患者,差异均有统计学意义(P值均<0.001)(表2、图2)。NCCN-IPI低危组患者的生存率显著高于IPI低危组患者(5年OS率74%对54%,χ2=5.041,P=0.025;5年PFS率50%对38%,χ2=5.295,P=0.021),差异均有统计学意义。
图2. NCCN-IPI(A、B)及IPI(C、D)不同分层外周T细胞淋巴瘤(PTCL)患者的总生存和无进展生存曲线.
4.影响患者生存的预后因素分析:单因素分析结果显示,Ann Arbor Ⅲ~Ⅳ期、ECOG评分≥2分、结外受累部位数≥2处、存在特定的结外病变部位、LDH升高是影响患者PFS及OS率的不良预后因素,ALK+与ALCL患者获得更佳的PFS及OS有关(P值均<0.05)(表1)。将上述6项因素纳入Cox比例风险模型进行多因素分析,ECOG≥2分和存在特定的结外病变部位是降低患者PFS及OS率的独立危险因素,ALCL,ALK+是提高患者PFS及OS率的独立预后因素(P值均<0.05)(表3)。
表3. 162例外周T细胞淋巴瘤(PTCL)患者影响预后的多因素分析.
| 影响因素 | 总体生存 |
无进展生存 |
||||
| HR | 95%CI | P值 | HR | 95%CI | P值 | |
| 临床分期Ⅲ~Ⅳ期 | 0.962 | 0.582~1.674 | 0.936 | 1.807 | 1.161~2.810 | 0.445 |
| ECOG评分≥2分 | 2.347 | 1.435~3.839 | 0.001 | 2.418 | 1.535~3.809 | <0.001 |
| 结外累及部位≥2处 | 1.479 | 0.940~2.327 | 0.088 | 1.363 | 0.879~2.111 | 0.157 |
| 存在特定的结外病变部位 | 1.608 | 1.054~2.454 | 0.027 | 1.800 | 1.216~2.665 | 0.003 |
| LDH水平>1至≤3倍 | 1.439 | 0.955~2.168 | 0.082 | 1.201 | 0.810~1.782 | 0.642 |
| LDH水平>3倍 | 2.292 | 1.162~4.519 | 0.017 | 1.697 | 0.879~3.276 | 0.164 |
| 病理类型为ALCL,ALK+ | 0.276 | 0.087~0.877 | 0.029 | 0.424 | 0.184~0.975 | 0.043 |
注:ECOG评分:美国东部肿瘤协作组体力状态评分;特定的结外病变部位:骨髓、中枢神经系统、肝脏/胃肠道或肺;LDH:正常值上限为192 U/L;ALCL,ALK+:间变性大细胞淋巴瘤,ALK阳性
讨论
在欧美国家中PTCL约占NHL的10%,而在亚洲国家这一比例达到了20%~35%[3],[9]。与B细胞淋巴瘤相比而言,PTCL在病理形态、免疫表型和基因标志物方面异质性更强。传统化疗对PTCL的疗效有限,患者的整体预后不佳。即使在利妥昔单抗前时代,其预后也较B细胞淋巴瘤患者更差[2],[10]。
IPI评分自1993年建立以来一直是NHL,尤其是DLBCL公认的预后评价标准,用于指导临床进行分层治疗。然而在临床实践中发现,相同IPI评分的淋巴瘤患者其生存状态也不尽相同。对于异质性更强的PTCL患者更是迫切需要一个优化的预后评价体系用于指导临床的治疗策略。过去十年间,不断发现一些新的临床指标可以被加入预后评价体系并由此诞生了多个针对PTCL的预后模型。如以体能状态、血清LDH水平、骨髓浸润为分层因素的PTCL-NOS预后指数(PIT)[11];以年龄、体能状态和血小板计数为危险因素的国际PTCL项目预后模型(IPTCLP)以及将骨髓浸润改为肿瘤增殖指数Ki-67的修正的PTCL-NOS预后指数(m-PIT)[12],后者也是目前唯一包含生物学指标的PTCL预后模型。Gutiérrez-García等[13]在一组PTCL患者中对IPI、PIT、m-PIT、IPTCLP的预后评估作用进行了比较,结果显示PIT对于预测患者的PFS最佳,而IPTCLP对于预测OS最佳。上述4个预后模型在临床实践中较容易开展,能明显区分不同危险因素的患者。本中心2015年也对105例PTCL-NOS患者进行了类似的比较分析,结果显示IPI的Log-rank值最高,对于不同危险度患者的区分能力更强。但由于病例数相对有限,对于IPI是否优于其他3个预后模型仍待进一步证实[14]。由此可见,PTCL预后评价体系仍需要进一步优化。
NCCN-IPI创建于2014年,并首先在DLBCL中得到验证。研究显示,NCCN-IPI较IPI在DLBCL患者中体现出更好的预后判断价值[7],[15]–[16]。Zhou等[7]报道,患者年龄对生存的影响呈线性相关,以年龄≤40岁为参照,每隔15~20岁为一增幅提供了更优化的拟合模型。LDH对患者生存的影响呈非线性相关,在与正常值上限比值为3时达到平台。骨髓、CNS、胃肠道/肝脏或肺等重要器官的累及比单纯统计结外累及数目>1处对患者的生存更具有预测价值。上述任何单一的结外部位受累对患者PFS和OS产生的影响差异均有统计学意义,因而是影响患者PFS和OS的独立危险因素,而脾、骨骼和泌尿生殖系受累对患者生存的影响差异则未见有统计学意义。
本研究中,我们按照NCCN-IPI评分进行分组,尽管四组不同年龄阶段的患者两两之间PFS时间差异无统计学意义(P>0.05),但患者OS率呈现随年龄增加而下降的趋势,年龄超过75岁的患者OS率明显低于年龄在40~60岁之间的患者(P=0.046)。根据NCCN-IPI标准,不同LDH水平的三组患者的PFS和OS时间差异有统计学意义(P<0.001),LDH水平越高者其生存状态相对更差,提示肿瘤负荷与患者预后具有相关性。对于结外病变与预后的关系,我们发现,NCCN-IPI定义的无特定结外部位累及与IPI危险因素中≤1处结外部位累及相比,前者的中位OS(46.6对20.1个月)与中位PFS(16.2对10.0个月)均明显延长。多因素分析结果显示,骨髓、CNS、胃肠道/肝脏或肺等特定结外部位累及是PTCL患者的独立不良预后因素。
此外,在本研究中我们将患者按照IPI评分进行分层,低危组患者的比例为26.5%,5年OS和PFS率分别为54%和38%,而按照NCCN-IPI评分进行分层,低危组患者的比例仅为11.7%,5年OS和PFS率则分别达到74%和50%,这表明IPI评分分层中的低危组患者实际包含了一部分NCCN-IPI评分分层中的中危患者,故而使得其生存率有所降低。由此可以看出,NCCN-IPI预后模型对筛选真正的低危患者更具有价值,这部分患者从传统的CHOP或CHOP样治疗方案中即可获得较为理想的长期生存,或许并不一定需要更高强度的化疗或自体造血干细胞移植。此外,NCCN-IPI低中危和中高危患者的OS和PFS时间差异均有统计学意义(P值均<0.001),而在IPI分层中相对应的两组患者的OS和PFS时间差异并无统计学意义(OS:P=0.091;PFS:P=0.124),再次表明了NCCN-IPI预后模型可能较IPI更能区分不同预后的PTCL患者。
综上,NCCN-IPI较IPI细化了年龄和LDH两个变量的预后作用,着重强调了特定的结外部位受累对患者预后的影响,可以作为PTCL患者重要的预后评价工具,特别对于低危患者的预后判断和治疗决策具有重要的指导意义。未来需要在更大样本量的患者中进一步评价NCCN-IPI评分体系的作用,包括对接受自体造血干细胞移植患者的评价,进一步优化现有的预后评价参数,以实现更精确的危险分层和预后判断,指导临床的治疗策略。
References
- 1.Foss FM, Zinzani PL, Vose JM, et al. Peripheral T-cell lymphoma[J] Blood. 2011;117(25):6756–6767. doi: 10.1182/blood-2010-05-231548. [DOI] [PubMed] [Google Scholar]
- 2.Escalón MP, Liu NS, Yang Y, et al. Prognostic factors and treatment of patients with T-cell non-Hodgkin lymphoma: the M. D. Anderson Cancer Center experience[J] Cancer. 2005;103(10):2091–2098. doi: 10.1002/cncr.20999. [DOI] [PubMed] [Google Scholar]
- 3.Vose J, Armitage J, Weisenburger D. International peripheral T-cell and natural killer/T-cell lymphoma study: pathology findings and clinical outcomes[J] J Clin Oncol. 2008;26(25):4124–4130. doi: 10.1200/JCO.2008.16.4558. [DOI] [PubMed] [Google Scholar]
- 4.Savage KJ. Peripheral T-cell lymphomas[J] Blood Rev. 2007;21(4):201–216. doi: 10.1016/j.blre.2007.03.001. [DOI] [PubMed] [Google Scholar]
- 5.A predictive model for aggressive non-Hodgkin's lymphoma[J] N Engl J Med. 1993;329(14):987–994. doi: 10.1056/NEJM199309303291402. [DOI] [PubMed] [Google Scholar]
- 6.Gisselbrecht C, Gaulard P, Lepage E, et al. Prognostic significance of T-cell phenotype in aggressive non-Hodgkin's lymphomas. Groupe d'Etudes des Lymphomes de l'Adulte (GELA)[J] Blood. 1998;92(1):76–82. [PubMed] [Google Scholar]
- 7.Zhou Z, Sehn LH, Rademaker AW, et al. An enhanced International Prognostic Index (NCCN-IPI) for patients with diffuse large B-cell lymphoma treated in the rituximab era[J] Blood. 2014;123(6):837–842. doi: 10.1182/blood-2013-09-524108. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Cheson BD, Pfistner B, Juweid ME, et al. Revised response criteria for malignant lymphoma[J] J Clin Oncol. 2007;25(5):579–586. doi: 10.1200/JCO.2006.09.2403. [DOI] [PubMed] [Google Scholar]
- 9.Au WY, Ma SY, Chim CS, et al. Clinicopathologic features and treatment outcome of mature T-cell and natural killer-cell lymphomas diagnosed according to the World Health Organization classification scheme: a single center experience of 10 years[J] Ann Oncol. 2005;16(2):206–214. doi: 10.1093/annonc/mdi037. [DOI] [PubMed] [Google Scholar]
- 10.Savage KJ, Chhanabhai M, Gascoyne RD, et al. Characterization of peripheral T-cell lymphomas in a single North American institution by the WHO classification[J] Ann Oncol. 2004;15(10):1467–1475. doi: 10.1093/annonc/mdh392. [DOI] [PubMed] [Google Scholar]
- 11.Gallamini A, Stelitano C, Calvi R, et al. Peripheral T-cell lymphoma unspecified (PTCL-U): a new prognostic model from a retrospective multicentric clinical study[J] Blood. 2004;103(7):2474–2479. doi: 10.1182/blood-2003-09-3080. [DOI] [PubMed] [Google Scholar]
- 12.Went P, Agostinelli C, Gallamini A, et al. Marker expression in peripheral T-cell lymphoma: a proposed clinical-pathologic prognostic score[J] J Clin Oncol. 2006;24(16):2472–2479. doi: 10.1200/JCO.2005.03.6327. [DOI] [PubMed] [Google Scholar]
- 13.Gutiérrez-García G, García-Herrera A, Cardesa T, et al. Comparison of four prognostic scores in peripheral T-cell lymphoma[J] Ann Oncol. 2011;22(2):397–404. doi: 10.1093/annonc/mdq359. [DOI] [PubMed] [Google Scholar]
- 14.Xu P, Yu D, Wang L, et al. Analysis of prognostic factors and comparison of prognostic scores in peripheral T cell lymphoma, not otherwise specified: a single-institution study of 105 Chinese patients[J] Ann Hematol. 2015;94(2):239–247. doi: 10.1007/s00277-014-2188-8. [DOI] [PubMed] [Google Scholar]
- 15.Huang CE, Chen YY, Lu CH, et al. Validation of an enhanced International Prognostic Index (NCCN-IPI) in an Asian cohort of patients with diffuse large B cell lymphoma[J] Ann Hematol. 2015;94(6):1063–1065. doi: 10.1007/s00277-014-2293-8. [DOI] [PubMed] [Google Scholar]
- 16.Melchardt T, Troppan K, Weiss L, et al. A modified scoring of the NCCN-IPI is more accurate in the elderly and is improved by albumin and β2-microglobulin[J] Br J Haematol. 2015;168(2):239–245. doi: 10.1111/bjh.13116. [DOI] [PubMed] [Google Scholar]