Abstract
目的
观察程序性死亡受体1/及其配体(PD-1/PD-L1)共刺激分子在慢性淋巴细胞白血病(CLL)患者中的表达水平,并探讨其可能的临床意义。
方法
以57例CLL患者为研究对象,以20名健康体检者为对照,采用流式细胞术分别检测其外周血CD8+、CD4+T细胞和CD19+B细胞中PD-1的表达水平,以及树突细胞(DC)中PD-L1的表达水平;同时分析PD-1/PD-L1表达与疾病分期、CD38表达、ZAP-70表达、染色体核型异常、β2微球蛋白(β2-MG)表达水平的相关性。
结果
①CLL患者组中男39例,女18例,平均年龄(63.7±10.7)岁。与对照组比较,年龄、性别差异无统计学意义(P值均>0.05);CLL患者组外周血中PD-1、PD-L1的表达均高于对照组(P值均<0.05)。②在Rai分期低、中、高危组中,随着危险度的增高PD-1、PD-L1的表达水平亦增高(P值均<0.05)。③PD-1表达在CD8+CD38+组(11例)高于CD8+CD38−组(46例)(P=0.004),在CD8+预后不良染色体组(14例)高于CD8+预后良好染色体组(28例)(P=0.004)。④PD-L1表达在CD38+组(11例)高于CD38−组(46例)(P=0.002),在ZAP-70+组(11例)高于ZAP-70−组(28例)(P<0.001),在预后不良染色体组(14例)高于预后良好染色体组(28例)(P=0.023)。PD-1、PD-L1表达与β2-MG表达无相关性(P值均>0.05)。
结论
PD-1、PD-L1在CLL患者体内存在高表达,其表达水平与疾病分期、CD38表达、ZAP-70表达、染色体核型等预后指标存在一定的相关性,与β2-MG表达无相关性,提示其有可能作为评估CLL患者预后的指标。
Keywords: 白血病,淋巴细胞,慢性,B细胞, 程序性细胞死亡受体1, 抗原,CD274
Abstract
Objective
To observe the expression levels of PD-1/PD-L1 costimulatory molecules and explore the clinical significance in patients with chronic lymphocytic leukemia (CLL).
Methods
The expression of PD-1/PD-L1 in peripheral blood CD8+ T cells, CD4+T cells, CD19+B, and dendrites cells (DC) was detected by flow cytometry in 57 CLL patients and 20 healthy controls. The correlations of PD-1/PD-L1 expression with disease stage, CD38 expression, ZAP-70 expression, chromosome karyotype abnormality and β2-MG expression were analyzed.
Results
①Compared with control, CLL patients, including 39 males and 18 females with the median age of (63.7±10.7) years, had no statistically significant difference in age and gender (P>0.05). CLL patients had the higher PD-1/PD-L1 expression than healthy controls (P<0.05). ②In Rai staging, the later the stage, the higher expression of PD-1/PD-L1 (P<0.05). ③PD-1 expression in CD8+CD38+ group (11 cases) was higher than that in CD8+CD38−group (46 cases) (P=0.004), and CD8+ poor prognosis chromosome group (14 cases) also had significant higher PD-1 expression than CD8+good prognosis chromosome group (28 cases) (P=0.004). ④The expression of PD-L1 was higher in CD38+group, ZAP-70+group, and poor prognosis group, as compared to that in CD38−group (P=0.002), in ZAP-70−group (P<0.001), in good prognosis group (P=0.023). There was no correlation between the expression of PD-1/PD-L1 and β2-MG (P>0.05).
Conclusion
This data reveals that PD-1/PD-L1 was highly expressed in CLL patients. Its expression levels were correlated with Rai stage, CD38, ZAP-70, chromosome karyotype, but not with β2-MG. PD-1/PD-L1 may be a prognostic factor in patients with CLL.
Keywords: Leukemia, lymphocytic, chronic, B- cell; Programmed cell death 1 receptor; Antigens, CD274
慢性淋巴细胞白血病(chronic lymphocytic leukemia,CLL)是一种多发生于中老年人群的低度恶性的成熟B淋巴细胞克隆增殖性肿瘤,以单克隆性淋巴细胞在外周血、骨髓、脾脏和淋巴结聚集为特征[1]–[4]。而程序性死亡受体(programmed cell death 1,PD-1,CD279)/及其配体(PD-L1,CD274)参与肿瘤免疫逃逸及利用PD-L1进行免疫治疗的相关研究己成为目前国内外肿瘤学研究的最新焦点,PD-1与PD-L1结合后,诱导T细胞凋亡或失活,从而抑制机体抗肿瘤作用,同时肿瘤细胞获得免疫逃逸[5]–[7]。有研究者报道PD-1、PD-L1在CLL患者体内高表达,但其与疾病分期及临床参数的相关性尚无定论[8]–[9]。在本研究中我们采用流式细胞术检测CLL患者及健康对照者外周血PD-1、PD-L1的表达,同时分析其与CLL预后指标的相关性,以探讨其可能的临床意义。
病例与方法
1.病例:所选病例为2015年1月至2016年6月就诊于我院的57例初治CLL患者,其中男39例(68.4%),女18例(31.6%),平均年龄(63.7±10.7)岁,所选病例的诊断、分期均根据文献[10]标准。根据Rai分期法将患者分为:低危组(0期)5例,中危组(Ⅰ~Ⅱ期)34例,高危组(Ⅲ~Ⅳ期)18例。以我院20名体检健康者为对照,其中男14名,女6名,平均年龄(60.3±5.2)岁。两组受试者年龄及性别差异无统计学意义(P值均>0.05)(表1)。本研究获得我院伦理委员会批准,且所有受试者均签署知情同意书。
表1. 慢性淋巴细胞白血病(CLL)患者组及对照组一般资料比较.
| 组别 | 例数 | 男性患者[例(%)] | 年龄(岁,x±s) | WBC(×109/L,x±s) | 淋巴细胞绝对数(×109/L,x±s) | 淋巴细胞百分比(%,x±s) | HGB(g/L,x±s) | PLT(×109/L,x±s) |
| 对照组 | 20 | 14(70.0) | 60.3±5.2 | 5.06±0.33 | 1.97±0.14 | 30.18±1.99 | 135.00±3.87 | 245.00±15.82 |
| CLL组 | 57 | 39(68.4) | 63.7±10.7 | 51.63±26.87 | 41.22±24.35 | 76.99±13.49 | 123.40±24.17 | 160.74±69.26 |
| t值 | 0.017 | 1.377 | 13.083 | 12.170 | 25.412 | −3.511 | −8.591 | |
| P值 | 0.896 | 0.172 | <0.001 | <0.001 | <0.001 | 0.001 | <0.001 | |
2.主要试剂和仪器:所用荧光单克隆抗体(FITC标记的CD8、Lin-1,PE标记的PD-1、PD-L1,Percp标记的CD4、CD11c,APC标记的CD19,PE-cy7标记的HLA-DR)均购自美国BD公司。流式细胞仪为德国美天旎生物技术有限公司产品。
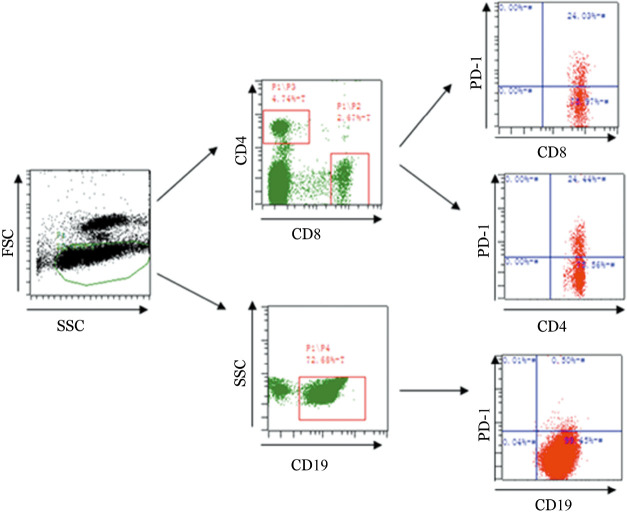
3.方法及指标检测:取受试者肝素抗凝的新鲜(6 h内)外周血。在T细胞流式管分别加入FITC标记的CD8、PE标记的PD-1、Percp标记的CD4、APC标记的CD19单克隆抗体各10 µl,之后再加入外周血100 µl充分混匀,在树突细胞(DC)流式管分别加入FITC标记的Lin-1、PE标记的PD-L1、Percp标记的CD11c、PE-cy7标记的HLA-DR单克隆抗体各10 µl,之后再加入外周血100 µl充分混匀,避光作用15 min后加红细胞裂解液500 µl,室温作用10 min;加入PBS终止裂解,1 000 r/min(离心半径17 cm)离心5 min,弃上清液;用PBS洗涤2次,PBS重悬细胞,调整细胞密度为1×106/ml。上机检测至少10 000个细胞,采用FSC/SSC双参数设门,分析PD-1;用SSC和Lin-1设门选择Lin-1阴性细胞,再以HLA-DR/CD11c设门,选定HLA-DR+CD11c−细胞即为DC,进一步分析DC表面PD-L1表达情况。逐级设门示意图见图1。
图1. 逐级设门图(PD-1:程序性死亡受体1).
4.统计学处理:采用SPSS 21.0软件进行统计学处理,计量资料以x±s表示(均符合正态分布),两组间的比较采用t检验,三组间比较采用方差分析,组间两两比较采用LSD法,若方差不齐,则组间比较运用秩和检验。P<0.05为差异有统计学意义。
结果
1.PD-1、PD-L1的表达:结果显示与对照组相比,PD-1在CLL患者CD8+T细胞、CD4+T细胞和CD19+B细胞表面的表达均明显增高(P值均<0.001);PD-L1在CLL组的表达明显高于对照组(P<0.001)(表2)。
表2. 慢性淋巴细胞白血病(CLL)患者及对照组程序性死亡受体1/及其配体(PD-1/PD-L1)的表达(%,x±s).
| 组别 | 例数 | PD-1 |
PD-L1 |
||
| CD8+T细胞 | CD4+T细胞 | CD19+B细胞 | 树突细胞 | ||
| 对照组 | 20 | 13.17±4.03 | 13.75±5.34 | 1.98±0.90 | 2.09±0.79 |
| CLL组 | 57 | 30.46±14.06 | 33.10±10.47 | 11.52±6.83 | 19.36±13.48 |
| t值 | 8.360 | 10.572 | 10.296 | 9.625 | |
| P值 | <0.001 | <0.001 | <0.001 | <0.001 | |
2.CLL组不同Rai分期患者的PD-1、PD-L1表达:低、中、高危三组CLL患者PD-1、PD-L1的表达水平见表3。CD8+T细胞、CD4+T细胞和CD19+B细胞表面PD-1的表达在三组患者中的差异均有统计学意义(P值均<0.01);DC表面PD-L1的表达在三组患者中的差异有统计学意义(P=0.001)。随着危险度的增高PD-1、PD-L1的表达水平亦增高(P值均<0.05)。
表3. 不同Rai分期慢性淋巴细胞白血病患者程序性死亡受体1/及其配体(PD-1/PD-L1)的表达(x±s).
| 组别 | 例数 | 年龄(岁) | PD-1(%) |
PD-L1(%) |
||
| CD8+T细胞 | CD4+T细胞 | CD19+B细胞 | 树突细胞 | |||
| 低危组 | 5 | 72.60±7.57 | 13.89±3.81 | 21.45±3.51 | 4.37±1.46 | 4.92±3.48 |
| 中危组 | 34 | 62.88±10.30 | 28.64±12.18 | 31.46±7.99 | 10.22±3.79 | 17.25±10.38 |
| 高危组 | 18 | 62.89±11.46 | 38.51±14.27 | 39.44±12.10 | 15.95±9.28 | 27.37±15.76 |
| F值 | 1.950 | 8.511 | 8.686 | 9.238 | 8.101 | |
| P值 | 0.152 | 0.001 | 0.001 | <0.001 | 0.001 | |
3.患者PD-1、PD-L1表达与临床特征的相关性分析:57例患者均进行了CD38检测,根据结果将患者分为CD38+组(CD38≥20%,11例)及CD38−组(CD38<20%,46例),CD8+ T细胞表面PD-1的表达在CD38+组高于CD38−组,差异有统计学意义(P=0.004);CD4+T细胞、CD19+ B细胞表面PD-1的表达在两组患者中的差异无统计学意义(P值均>0.05)。DC表面PD-L1的表达在CD38+组高于CD38−组,差异有统计学意义(P=0.002)(表4)。
表4. CD38表达对慢性淋巴细胞白血病患者程序性死亡受体1/及其配体(PD-1/PD-L1)表达的影响(x±s).
| 组别 | 例数 | 年龄(岁) | PD-1(%) |
PD-L1(%) |
||
| CD8+T细胞 | CD4+T细胞 | CD19+B细胞 | 树突细胞 | |||
| 阳性组 | 11 | 67.27±9.62 | 41.19±13.88 | 37.23±9.89 | 11.95±8.25 | 30.18±16.03 |
| 阴性组 | 46 | 62.89±10.85 | 27.90±12.97 | 32.11±10.47 | 11.42±6.55 | 16.78±11.56 |
| t值 | 1.227 | 3.014 | 1.471 | 0.230 | 3.198 | |
| P值 | 0.225 | 0.004 | 0.147 | 0.819 | 0.002 | |
注:CD38+组:阳性率≥20%;CD38−组:阳性率<20%
57例患者中39例进行了ZAP-70检测,根据结果将患者分为ZAP-70+组(ZAP-70≥20%,11例)及ZAP-70−组(ZAP-70<20%,28例)。CD8+ T细胞、CD4+ T细胞、CD19+ B细胞表面PD-1的表达在两组患者中的差异均无统计学意义(P值均>0.05)。DC表面PD-L1的表达在ZAP-70+组中表达高于ZAP-70−组,差异有统计学意义(P<0.001)(表5)。
表5. ZAP-70表达对不同分组慢性淋巴细胞白血病患者程序性死亡受体1/及其配体(PD-1/PD-L1)表达的影响(x±s).
| 组别 | 例数 | 年龄(岁) | PD-1(%) |
PD-L1(%) |
||
| CD8+T细胞 | CD4+T细胞 | CD19+B细胞 | 树突细胞 | |||
| 阳性组 | 11 | 65.27±13.74 | 37.32±14.19 | 37.12±12.52 | 16.76±10.28 | 32.36±14.44 |
| 阴性组 | 28 | 62.29±9.12 | 27.69±13.28 | 32.62±9.62 | 10.56±5.96 | 15.23±11.58 |
| t值 | 0.666 | 1.999 | 1.207 | 1.879 | 3.876 | |
| P值 | 0.517 | 0.053 | 0.235 | 0.083 | <0.001 | |
注:CD38+组:阳性率≥20%;CD38−组:阳性率<20%;ZAP-70+组:阳性率≥20%;ZAP-70−组:阳性率<20%
57例患者中42例进行了FISH染色体核型检测,将正常核型(20例)及13q−(8例)的CLL患者定义为预后良好染色体组(28例),将单纯+12(6例)、单纯11q−(3例)、单纯17p−(2例)及复杂异常核型(13q−合并17p−1例,11q−合并13q−2例,共3例)的CLL患者定义为预后不良染色体组(14例)。CD8+T细胞表面PD-1的表达在预后不良染色体组中高于预后良好染色体组(P=0.004);CD4+T细胞、CD19+B细胞表面PD-1的表达在两组患者中的差异无统计学意义(P值均>0.05)。DC表面PD-L1的表达在预后不良染色体组中高于预后良好染色体组,差异有统计学意义(P=0.023)(表6)。
表6. 不同染色体核型分组慢性淋巴细胞白血病患者程序性死亡受体1/及其配体(PD-1/PD-L1)表达的影响(x±s).
| 组别 | 例数 | 年龄(岁) | PD-1(%) |
PD-L1(%) |
||
| CD8+T细胞 | CD4+T细胞 | CD19+B细胞 | 树突细胞 | |||
| 预后不良染色体组 | 14 | 62.93±18.61 | 39.94±14.88 | 35.28±11.13 | 11.11±9.91 | 27.80±15.97 |
| 预后良好染色体组 | 28 | 62.96±10.62 | 25.99±13.18 | 29.95±8.94 | 11.09±5.20 | 16.08±11.03 |
| t值 | −0.008 | 3.099 | 1.681 | 0.010 | 2.468 | |
| P值 | 0.994 | 0.004 | 0.101 | 0.992 | 0.023 | |
57例患者中41例进行了β2微球蛋白(β2-MG)检测,其中≥3.5 mg/L者13例,<3.5 mg/L者28例。结果见表7。PD-1、PD-L1在两组患者中的表达差异均无统计学意义(P值均>0.05)。
表7. β2微球蛋白表达对慢性淋巴细胞白血病患者程序性死亡受体1/及其配体(PD-1/PD-L1)表达的影响(x±s).
| 组别 | 例数 | 年龄(岁) | PD-1(%) |
PD-L1(%) |
||
| CD8+T细胞 | CD4+T细胞 | CD19+B细胞 | 树突细胞 | |||
| ≥3.5 mg/L组 | 13 | 67.85±10.46 | 30.31±12.39 | 36.18±14.50 | 13.67±9.54 | 23.52±15.75 |
| <3.5 mg/L组 | 28 | 62.04±10.41 | 32.02±14.50 | 30.87±8.33 | 10.54±5.82 | 19.60±14.38 |
| t值 | 1.661 | −0.368 | 1.231 | 1.094 | 0.790 | |
| P值 | 0.105 | 0.715 | 0.236 | 0.290 | 0.434 | |
讨论
PD-l是CD28/CTLA-4家族共刺激分子中的一员,位于染色体的2q37.35。通常PD-1只在活化的T细胞中表达,而静息的细胞尚未发现存在PD-1蛋白分子[11]。PD-L1为PD-1的配体,是CD28/B7家族中第4个成员,人PD-L1基因定位于染色体9p24,正常组织在许多情况下经诱导才表达PD-L1,并且随着这些细胞的活化表达会上调[12]。PD-1与PD-L1结合后在肿瘤细胞免疫应答中发挥负性调控作用,从而导致免疫逃逸。免疫编辑是肿瘤细胞通过改变自身表型逃避免疫系统攻击的现象,免疫编辑有三个阶段:免疫清除、免疫均衡及免疫逃逸。尽管免疫编辑在肿瘤早期效果佳,但有证据表明在肿瘤进展过程中肿瘤细胞仍会采用各种破坏性反应维持自身生存[13],在实体瘤中,这样的过程依赖于表面分子PD-L1过度表达,PD-L1与PD-1结合后,可抑制T细胞免疫反应,从而使肿瘤进展并扩散[14]–[15]。通过特定的抗体抑制PD-1/PD-L1在肿瘤中的免疫抑制反应,已用于治疗各种不同器官的实体瘤[16]–[17]。
本研究中我们的结果显示在CLL患者CD8+T细胞、CD4+ T细胞、CD19+B细胞PD-1的表达均高于健康对照组,Brusa等[9]也报道了类似的研究结果。McClanahan等[18]在CLL小鼠模型中观察到PD-1的表达高于健康对照鼠。因PD-L1分布广泛,在T细胞、B细胞、抗原提呈细胞等细胞表面均有表达,而DC为专职抗原提呈细胞,国外有研究者报道PD-L1在CD19+B细胞表面高表达[9]。目前尚无在CLL患者DC表达的相关研究。我们在本研究中检测了PD-L1在DC表面的表达,结果显示DC表面PD-L1的表达较健康对照组明显增加,差异有统计学意义。DC可激活初始T细胞,在免疫应答的启动、调控及维持环节发挥作用,DC表面PD-L1的高表达提示PD-1/PD-L1通路可能通过干扰DC的抗原提呈作用而抑制T细胞免疫应答。
在本研究中我们对CLL患者以Rai分期进行危险度分组,发现疾病越倾向中晚期,PD-1在CD8+T细胞、CD4+T细胞、CD19+B细胞表面的表达均越高,PD-L1在DC表面的表达也越高。Rusak等[19]仅报道了PD-1在CD4+ T细胞表面的表达与Rai分期呈正相关。而Grzywnowicz等[20]则对CLL患者以Binet分期进行危险度分组,三组患者PD-1、PD-L1的表达差异无统计学意义,这可能与病例数、种族及地域差异有关,这种差异有待进一步验证。
CD38为CLL重要的预后指标。我们在本研究中发现只有CD8+T细胞表面PD-1的表达水平在CD38+组显著高于CD38−组,差异有统计学意义,而CD4+ T细胞、CD19+B细胞表面PD-1的表达差异在两组的差异无统计学意义,DC表面PD-L1的表达水平在CD38+组显著高于CD38−组。CD38+CLL患者较CD38−者预后差[21],故PD-1、PD-L1可能与CLL患者的预后相关。
ZAP-70是一种蛋白酪氨酸激酶,在正常机体的B细胞中低表达,而在CLL患者的B细胞中则呈高表达,其表达水平越高提示预后越差[22]。我们在本研究中发现DC表面PD-L1的表达在ZAP-70+组中表达显著高于ZAP-70−组,差异有统计学意义,与文献[23]的研究结果一致。
CLL患者的染色体常见异常核型有13q−、+12、11q−、17p−,Dewald等[24]研究认为,正常核型及13q−者预后良好,而+12、11q−、17p−及复杂核型者预后不良。我们根据上述结论将CLL患者分为预后良好染色体组和预后不良染色体组。研究结果显示预后不良染色体组患者CD8+T细胞表面PD-1表达、DC表面PD-L1表达均高于预后良好染色体组,差异均有统计学意义。提示CLL患者外周血中PD-1、PD-L1高表达可能与患者预后相关。
β2-MG是细胞表面人白细胞抗原(HLA)的β链,在CLL患者的尿液及血液中β2-MG可升高,其表达水平与CLL负荷、临床分期密切相关。本研究57例CLL患者中41例进行了β2-MG检测,以3.5 mg/L为界将患者分为两组,结果显示PD-1、PD-L1在两组中的表达差异无统计学意义。
综上,在本研究中我们发现PD-1、PD-L1在CLL患者呈高表达,其表达水平在CD38+组、预后不良染色体组及Rai分期高危组患者中均存在高表达,提示其可能与CLL预后相关,随着疾病进展,病情越倾向中晚期PD-1、PD-L1的表达水平越高,故PD-1、PD-L1可能作为CLL的预后指标对患者进行综合评估并及时指导治疗,同时PD-1/PD-L1信号通路有望成为CLL新的免疫治疗靶点。关于PD-1、PD-L1在CLL中的详细作用机制需继续完善相关实验,从分子水平等不同层面进行探讨。
Funding Statement
基金项目:新疆维吾尔自治区自然科学基金(2013211A100)
Fund program: Natural Science Foundation of Xinjiang Uygur Autonomous Region(2013211A100)
References
- 1.Bianco M, Gasparri A, Generoso L, et al. Inhibition of chronic lymphocytic leukemia progression by full-length chromogranin A and its N-terminal fragment in mouse models[J] Oncotarget. 2016;7(27):41725–41736. doi: 10.18632/oncotarget.9407. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Sall A, Touré AO, Sall FB, et al. Characteristics of chronic lymphocytic leukemia in Senegal[J] BMC Hematol. 2016;16:10. doi: 10.1186/s12878-016-0051-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Hallek M. Pathogenesis, Diagnosis and Treatment of Chronic Lymphocytic Leukemia: Exciting Times[J] Oncol Res Treat. 2016;39(1-2):8. doi: 10.1159/000443821. [DOI] [PubMed] [Google Scholar]
- 4.Lutfallah AA, Kourie HR, Eid R, et al. Watch and Wait in Lebanese Chronic Lymphocytic Leukemia Patients: How Relevant is it?[J] Asian Pac J Cancer Prev. 2016;17(1):215–217. doi: 10.7314/apjcp.2016.17.1.215. [DOI] [PubMed] [Google Scholar]
- 5.Darb-Esfahani S, Kunze CA, Kulbe H, et al. Prognostic impact of programmed cell death-1(PD-1) and PD-ligand 1(PD-L1) expression in cancer cells and tumor-infiltrating lymphocytes in ovarian high grade serous carcinoma[J] Oncotarget. 2015;7(2):1486–1499. doi: 10.18632/oncotarget.6429. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Lin AY, Lin E. Programmed death 1 blockade, an Achilles heel for MMR-deficient tumors?[J] J Hematol Oncol. 2015;8:124. doi: 10.1186/s13045-015-0222-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Sui X, Ma J, Han W, et al. The anticancer immune response of anti-PD-1/PD-L1 and the genetic determinants of response to anti-PD-1/PD-L1 antibodies in cancer patients[J] Oncotarget. 2015;6(23):19393–19404. doi: 10.18632/oncotarget.5107. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Ramsay AG, Clear AJ, Fatah R, et al. Multiple inhibitory ligands induce impaired T-cell immunologic synapse function in chronic lymphocytic leukemia that can be blocked with lenalidomide: establishing a reversible immune evasion mechanism in human cancer[J] Blood. 2012;120(7):1412–1421. doi: 10.1182/blood-2012-02-411678. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Brusa D, Serra S, Coscia M, et al. The PD-1/PD-L1 axis contrib-utes to T-cell dysfunction in chronic lymphocytic leukemia[J] Haematologica. 2013;98(6):953–963. doi: 10.3324/haematol.2012.077537. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.中华医学会血液学分会;中国抗癌协会血液肿瘤专业委员会. 中国慢性淋巴细胞白血病/小淋巴细胞淋巴瘤的诊断与治疗指南(2015年版)[J] 中华血液学杂志. 2015;(10):809–813. doi: 10.3760/cma.j.issn.0253-2727.2015.10.001. [DOI] [Google Scholar]
- 11.王 宝英, 宋 爱华, 李 涛, et al. PD-1/PD-L1通路在免疫调节作用中的研究进展[J] 现代检验医学杂志. 2014;29(3):124–127. [Google Scholar]
- 12.Xing K, Gu B, Zhang P, et al. Dexamethasone enhances programmed cell death 1(PD-1) expression during T cell activation: an insight into the optimum application of glucocorticoids in anti-cancer therapy[J] BMC Immunol. 2015;16:39. doi: 10.1186/s12865-015-0103-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Schreiber RD, Old LJ, Smyth MJ. Cancer immunoediting: integrating immunity's roles in cancer suppression and promotion[J] Science. 2011;331(6024):1565–1570. doi: 10.1126/science.1203486. [DOI] [PubMed] [Google Scholar]
- 14.Flies DB, Sandler BJ, Sznol M, et al. Blockade of the B7-H1/PD-1 pathway for cancer immunotherapy[J] Yale J Biol Med. 2011;84(4):409–421. [PMC free article] [PubMed] [Google Scholar]
- 15.Wang S, Chen L. Immunobiology of cancer therapies targeting CD137 and B7-H1/PD-1 cosignal pathways[J] Curr Top Microbiol Immunol. 2011;344:245–267. doi: 10.1007/82_2010_81. [DOI] [PubMed] [Google Scholar]
- 16.Brahmer JR, Tykodi SS, Chow LQ, et al. Safety and activity of anti-PD-L1 antibody in patients with advanced cancer[J] N Engl J Med. 2012;366(26):2455–2465. doi: 10.1056/NEJMoa1200694. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Topalian SL, Hodi FS, Brahmer JR, et al. Safety, activity, and immune correlates of anti-PD-1 antibody in cancer[J] N Engl J Med. 2012;366(26):2443–2454. doi: 10.1056/NEJMoa1200690. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.McClanahan F, Riches JC, Miller S, et al. Mechanisms of PD-L1/PD-1-mediated CD8 T-cell dysfunction in the context of aging-related immune defects in the Eµ-TCL1 CLL mouse model[J] Blood. 2015;126(2):212–221. doi: 10.1182/blood-2015-02-626754. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Rusak M, Eljaszewicz A, Bołkun Ł, et al. Prognostic significance of PD-1 expression on peripheral blood CD4+ T cells in patients with newly diagnosed chronic lymphocytic leukemia[J] Pol Arch Med Wewn. 2015;125(7-8):553–559. doi: 10.20452/pamw.2967. [DOI] [PubMed] [Google Scholar]
- 20.Grzywnowicz M, Karczmarczyk A, Skorka K, et al. Expression of Programmed Death 1 Ligand in Different Compartments of Chronic Lymphocytic Leukemia[J] Acta Haematol. 2015;134(4):255–262. doi: 10.1159/000430980. [DOI] [PubMed] [Google Scholar]
- 21.Thompson PA, Tam CS. CD38 expression in CLL: a dynamic marker of prognosis[J] Leukemia & Lymphoma. 2014;55(1):1–2. doi: 10.3109/10428194.2013.789510. [DOI] [PubMed] [Google Scholar]
- 22.王 晓娜, 张 正昊, 刘 洋, et al. 慢性淋巴细胞白血病患者骨髓中CD200表达及预后的关系[J] 细胞与分子免疫学杂志. 2014;30(1):75–78. [PubMed] [Google Scholar]
- 23.Grzywnowicz M, Zaleska J, Mertens D, et al. Programmed death-1 and its ligand are novel immunotolerant molecules expre-ssed on leukemic B cells in chronic lymphocytic leukemia[J] PLoS One. 2012;7(4):e35178. doi: 10.1371/journal.pone.0035178. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Dewald GW, Brockman SR, Paternoster SF, et al. Chromosome anomalies detected by interphase fluorescence in situ hybridization: correlation with significant biological features of B-cell chronic lymphocytic leukaemia[J] Br J Haematol. 2003;121(2):287–295. doi: 10.1046/j.1365-2141.2003.04265.x. [DOI] [PubMed] [Google Scholar]