Abstract
目的
探讨慢性中性粒细胞白血病(CNL)患者的临床表现、细胞遗传学和基因突变等实验室特征及预后因素。
方法
对符合2016年WHO诊断分型标准的16例CNL患者进行资料采集,随访患者并进行预后分析。利用直接测序法检测CSF3R、ASXL1、SETBP1、CALR、MPL基因突变状态,对有突变的样本进行克隆后测序鉴定,采用等位基因特异性聚合酶链反应(AS-PCR)检测JAK2 V617F突变。
结果
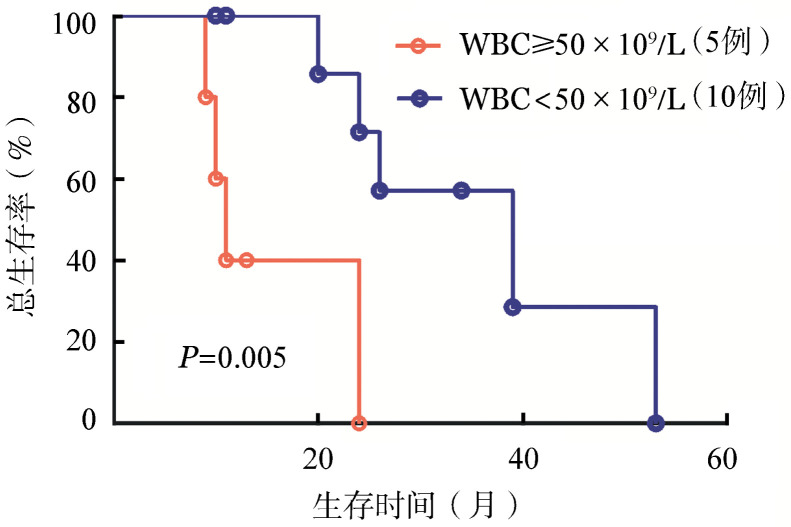
16例CNL患者中位发病年龄为64(43~80)岁,男性占75%(12/16),确诊时中位HGB水平为114(81~154)g/L,中位WBC为41.20(26.05~167.70)×109/L,中位PLT为238(91~394)×109/L。中位骨髓纤维化水平为1(0~3)级。除1例t(1;7)(p32;q11)、1例+21克隆异常及1例14ps+外,余患者均为正常核型。16例CNL患者中,CSF3R T618I突变检出率为100%(16/16),ASXL1突变检出率为81%(13/16),SETBP1突变检出率为63%(10/16),1例患者携带CALR K385fs*47突变,所有患者均无JAK2 V617F突变及MPL突变。CNL患者中位生存期为24(95%CI 18~30)个月。初诊WBC≥50×109/L者中位生存期较<50×109/L者短(11个月对39个月,P=0.005)。
结论
CSF3R T618I突变是CNL的特异性突变。CNL患者中位生存期24个月,确诊时WBC≥50×109/L是不良预后因素。
Keywords: 白血病,中性粒细胞,慢性, 染色体核型, 基因,CSF3R, 预后
Abstract
Objective
To investigate the clinical manifestation, cytogenetics, gene mutations and prognostic factors of chronic neutrophilic leukemia (CNL).
Methods
16 CNL cases, according to WHO (2016) -definition, were reviewed retrospectively. Identifications of the CSF3R, ASXL1, SETBP1, CALR and MPL mutations were performed by direct sequencing. JAK2 V617F mutation was detected by AS-PCR.
Results
Of the 16 CNL patients, the median age was 64 (43–80) years with a male predominance of 75% (12/16). The median hemoglobin was 114 (81–154) g/L, with median WBC of 41.20 (26.05–167.70) (109/L and median PLT of 238 (91–394) ×109/L.The median level of marrow fibrosis (MF) was 1 (0–3) degree. There was no other cytogenetic abnormalities except t(1;7) (p32;q11), +21 and 14ps+ for each. All the 16 CNL patients harbored CSF3R T618I mutation. ASXL1 mutations were identified in 81% (13/16), while SETBP1 mutations were confirmed in 63% (10/16). The CALR K385fs*47 mutation was found. There was no mutation in JAK2 V617F or MPL in the above 16 patients. The median overall survival (OS) of patients presented with WBC≥50×109/L at diagnosis (11 months) was significantly shorter than of WBC<50×109/L (39 months, P=0.005).
Conclusion
CSF3R T618I mutation was specific for CNL. The median OS of CNL patients was 24 months, and WBC≥50×109/L at diagnosis was an unfavorable prognostic factor.
Keywords: Leukemia, neutrophilic, chronic; Karyotypes; Gene, CSF3R; Prognosis
1920年Tuohy首次报道了慢性中性粒细胞白血病(CNL),2001年WHO造血和淋巴组织肿瘤分型将其归于一种罕见的BCR-ABL阴性的骨髓增殖性肿瘤(MPN)[1]–[2]。此前,CNL的诊断多为排除性诊断,且确诊病例数较少[3]–[4]。2013年Maxson等[5]通过对1 862个基因进行深度测序发现CNL患者中存在CSF3R T618I突变,随后的研究证实CSF3R T618I是CNL特异性突变,并且发现ASXL1基因与SETBP1基因在CNL患者也有较高的突变频率[6]–[7]。JAK2 V617F及CALR作为BCR-ABL阴性MPN患者常见的基因突变,在CNL患者也有报道[7]–[9]。迄今CNL大宗病例研究较少,我们对16例符合WHO 2016诊断标准的CNL患者进行了临床和实验室特征及预后因素回顾性分析,现报道如下。
病例与方法
1.病例选择:2006年9月至2015年7月中国医学科学院血液病医院和北京大学人民医院收治的16例CNL患者纳入研究,其中6例为既往已报道的病例[7]。依据WHO(2016)CNL诊断分型标准[10]进行回顾性诊断并进行病例资料采集。
2.染色体核型分析:短期培养法常规制备染色体标本,采用R显带法分析核型,并按照《人类细胞遗传学国际命名体制(ISCN2009)》进行核型描述。
3.基因突变分析:用血液基因组DNA提取试剂盒(爱思进生物技术有限公司产品)提取骨髓细胞基因组DNA。CSF3R基因(第14~17外显子)、ASXL1基因(第12外显子)、SETBP1基因(第4外显子)、CALR基因(第9外显子)、MPL基因(第10外显子)PCR扩增引物设计参照文献[6],[11]–[12]。PCR体系包括DNA 50~100 ng,2×Taq PCR Master Mix[天根生化科技(北京)有限公司产品]15 µl,正反向引物各0.5 µl,加去离子水补足体系至30 µl。反应条件:94 °C预变性5 min,94 °C变性30 s,59 °C退火30 s,72 °C延伸30 s,共35个循环,72 °C延伸7 min。PCR扩增产物经回收、纯化后用ABI 3700测序仪(美国Agencourt Bioscience公司产品)以末端标记双脱氧法进行双向测序,采用Mutation Surveyor软件分析测序结果。根据分析结果对突变的基因采用克隆后测序,从而确定患者的突变类型。采用等位基因特异性聚合酶链反应(AS-PCR)检测JAK2 V617F突变,具体方法参见文献[13]。
4.随访:所有患者随访至2016年4月1日,随访资料来源于住院和门诊病历。对随访期间死亡的患者,依病历记录或电话联系患者家属加以确认。总生存期为确诊至患者死亡的时间或确诊至2016年4月1日。随访资料完整者16例,中位随访时间20(9~53)个月。
5.统计学处理:计量资料以中位数表示,偏态分布的计量资料比较采用非参数Mann-Whitney U检验,计数资料比较采用列联表卡方检验,相关性分析采用Spearman等级相关分析法,生存分析采用Kaplan-Meier方法,绘制Kaplan-Meier生存曲线,各组生存曲线比较应用Log-rank检验。P<0.05为差异有统计学意义。所有数据采用SPSS 18.0软件包进行统计处理。采用GraphPad Prism 5.0进行绘图。
结果
1.临床及实验室特征:16例CNL患者中位发病年龄为64(43~80)岁,男性占75%(12/16)。确诊时中位HGB水平为114(81~154)g/L,中位WBC为41.20(26.05~167.70)×109/L,中位PLT为238(91~394)×109/L。外周血不成熟粒细胞比例为0.020(0~0.090),外周血原始细胞比例为0(0~0.005),骨髓原始细胞比例为0.010(0~0.045)。中位骨髓纤维化水平为1(0~3)级。除1例t(1;7)(p32;q11)、1例+21克隆异常及1例14ps+外,余患者均为正常核型。2例患者接受地西他滨治疗血常规指标恢复正常(未复查骨髓),其中1例3个月后复发,应用第2次地西他滨治疗期间死于化疗抑制期肺部感染,另外1例血常规指标正常维持4个月后复发,接受非亲缘异基因造血干细胞移植(allo-HSCT)(HLA 8/10相合),目前血常规及骨髓象正常。余患者均接受羟基脲和(或)干扰素治疗,根据WBC调整剂量。
2.CSF3R、ASXL1、SETBP1、JAK2 V617F、CALR及MPL基因突变分析:16例CNL患者中,CSF3R T618I突变检出率为100%(16/16),其中1例合并CSF3R W791X突变;ASXL1突变检出率为81%(13/16),依据检出频率依次为G646WfsX12(8例)、Y591X(2例)、S871SfsX4(1例)、R404X(1例)及Q976X(1例)。SETBP1突变检出率为63%(10/16),依据检出频率依次为D868N(4例)、I871T(3例)、G870S(1例)、G870D(1例)及D874N(1例)。同时有CSF3R T618I、ASXL1及SETBP1突变的患者为9例,同时有CSF3R T618I及ASXL1突变且不伴有SETBP1突变的患者为4例,同时有CSF3R T618I及SETBP1突变且不伴有ASXL1突变的患者为1例,仅有CSF3R T618I突变的患者2例。通过直接测序检测到1例患者合并CALR K385fs*47突变,该患者ASXL1及SETBP1基因均未见突变。所有患者均无JAK2 V617F突变及MPL突变。除SETBP1基因发现1例G870S及1例I871T纯合突变外,余基因突变均为杂合突变。
ASXL1基因突变的患者与野生型患者比较:性别比例(P=1.000)、年龄分布(P=0.141)、HGB水平(P=0.455)、WBC(P=0.296)、PLT(P=0.521)、骨髓纤维化是否≥1级(P=0.312)各项指标差异均无统计学意义。SETBP1突变的患者与野生型患者比较:性别比例(P=0.604)、年龄分布(P=0.443)、HGB水平(P=0.654)、WBC(P=0.635)、PLT(P=0.635)、骨髓纤维化是否≥1级(P=0.256)各项指标差异均无统计学意义。ASXL1突变与SETBP1突变无相关性(r=0.289,P=0.277)。
3.总体生存预后因素分析:去除1例接受allo-HSCT患者生存数据后,15例CNL患者中位总生存期为24(95%CI 18~30)个月(图1)。单因素分析结果显示初诊WBC≥50×109/L者生存期较<50×109/L者短(11个月对39个月,P=0.005)(图2);而性别(P=0.349)、年龄是否≥60岁(P=0.705)、初诊是否有贫血(贫血标准以男性HGB<120 g/L,女性HGB<110 g/L计算,P=0.063)、是否有ASXL1突变(P=0.986)、是否有SETBP1突变(P=0.694)、是否同时合并ASXL1及SETBP1突变(P=0.694)、外周血是否有幼稚粒细胞(P=0.465)、骨髓原始细胞比例是否≥0.020(P=0.257)、骨髓纤维化是否≥1级(P=0.751)对患者总生存均无明显影响。
图1. 15例慢性中性粒细胞白血病患者总生存曲线.
图2. 初治白细胞计数对慢性中性粒细胞白血病患者生存的影响.
讨论
由于发病率低、缺乏特异性诊断标志,迄今文献报道的CNL不超过200例[4],[8],[14]–[15]。2013年Maxson等[5]通过对1 862个基因的编码区深度测序发现89%(8/9例)的CNL患者有CSF3R基因突变,而在AML患者中其突变频率仅为1%,提出CSF3R基因突变为CNL的分子克隆性标志。随后,Pardanani等[6]对疑诊CNL或不典型慢性髓性白血病(aCML)的患者进行了CSF3R外显子测序分析,发现检测出的10个CSF3R T618I突变仅见于WHO(2008)标准确诊的CNL患者,而在aCML患者未能检测到CSF3R T618I突变,由此确认CSF3R T618I突变是CNL一个高度特异而敏感的分子诊断标志。本研究组在前期研究中也发现全部6例CNL患者均携带CSF3R T618I的突变,而意义未明的单克隆免疫球蛋白病(MGUS)伴有成熟中性粒细胞增多表现的2例患者均未检测到CSF3R基因突变[7]。在最新颁布的“2016修订的WHO髓系肿瘤及急性白血病分型”中,对CNL的诊断标准修订如下:外周血WBC≥25×109/L、中性杆状+分叶核粒细胞≥80%、不成熟粒细胞<10%、原始粒细胞罕见、单核细胞<1×109/L、无粒系发育异常;骨髓增殖表现:中性粒细胞比例及绝对值增高、原始粒细胞<5%、中性粒细胞成熟正常;不符合WHO标准中CML、真性红细胞增多症、原发性血小板增多症或原发性骨髓纤维化的诊断;无PDGFRA、PDGFRB、FGFR1或PCM1-JAK2重排;存在CSF3R T618I或其他活化CSF3R突变(如果无CSF3R突变,需3个月以上持续中性粒细胞增加、脾大,并除外感染、肿瘤、浆细胞疾病等因素,如存在,则需用细胞遗传学或分子生物学证实髓系细胞的克隆性)[10]。本研究中的16例患者严格符合WHO(2016)CNL的诊断及排除标准,并且全部检测到CSF3R T618I突变,进一步证实了CSF3R突变在诊断CNL时提供克隆性证据、提高诊断准确性的重要作用。
ASXL1是染色体修饰与调节相关的基因[16],ASXL1的突变特点是范围广、移码突变为主(本研究共发现11例移码突变及2例点突变),这些突变均导致了终止密码子的提前。我们在国际上率先报道了CNL中ASXL1突变的存在[7],此次扩大样本后证实ASXL1突变的频率达到了75%,高于Elliott等[15]报道的57%。本研究同时发现SETBP1的突变频率达到了63%,与Gotlib等[8]报道的56%基本一致,显著高于Pardanani等[6]报道的33%,此差异的具体原因尚不清楚。我们发现的1例同时合并CSF3R T618I和CALR移码突变的患者既往已有报道[7],在新报道的10例患者中未发现新的JAK2 V617F或CALR突变的病例。尽管JAK2 V617F及CALR突变是BCR-ABL阴性的MPN患者常见的突变,但是根据现有的文献报道,两种基因突变在CNL患者中发生的频率不高[8]–[9]。
多数CNL患者在就诊时无明显症状,仅表现为外周血白细胞计数增高。本组16例CNL患者中,确诊时中位白细胞计数为41.20×109/L,伴轻度贫血(中位HGB 114 g/L),血小板计数表现为先正常或轻度增高,随着病情演进出现下降趋势,最后血常规表现为显著白细胞计数增高及血红蛋白水平和血小板计数降低,与文献[4]报道相似。随着病程进展,患者最常表现出乏力,此外还有体重减轻、骨痛以及夜间盗汗,但这些症状并没有特异性。国外文献报道CNL患者在疾病晚期外周血检查发现慢性粒-单核细胞白血病(CMML)样改变[15],因此在进行疾病诊断的时候需要仔细询问病史、完善CSF3R等基因检查,以与真正的CMML鉴别。本研究因为患者随诊中骨髓检查受限,未发现急性白血病转变患者,但是国外文献报道CNL具有一定的转急性白血病比例[15]。本研究结果显示初诊WBC≥50×109/L是不良预后因素。Elliott等[15]报道ASXL1突变及血小板减少为独立不良预后因素,本研究并未发现这样的趋势,分析其原因可能为:尽管本研究组的病例数相对较多,但是CNL作为罕见病总体病例数仍较少(如纳入最后生存分析的ASXL1突变型和野生型患者分别为13例和2例),有待今后通过与其他研究组合作、扩大样本数来加以进一步分析。
羟基脲是最常用CNL传统治疗药物,疾病早期应用可控制白细胞及脾脏肿大症状,但是疾病进展期应用疗效不佳,更换其他药物如阿糖胞苷、沙利度胺及芦可替尼后疗效也较为短暂[4],[15]。干扰素也是CNL传统治疗选择之一,可在羟基脲不耐受或无效的CNL患者中取得一定的疗效,但在疾病进展期应用无效[15]。在治疗进展期及白血病期的CNL患者应用诱导化疗(蒽环类和阿糖胞苷)至今尚无取得完全缓解的报道,仅有1例患者恢复到了慢性期[17],而大部分患者对诱导化疗不敏感或在诱导化疗期间死亡。
allo-HSCT是目前唯一能治愈CNL的手段,由于CNL是罕见疾病且多为老年患者,目前接受allo-HSCT患者不超过10例[4],[17]–[21]。本研究1例43岁男性患者接受了非亲缘外周血allo-HSCT(HLA 8/10相合)治疗,目前移植后6个月,血常规及骨髓象正常。对于有合适供者、符合移植条件的患者,建议尽早行allo-HSCT治疗。
研究表明近跨膜区突变和截短型突变可分别激活JAK-STAT和SRC家族-TNK2激酶,并推论近跨膜区的突变患者应用JAK酶抑制剂如芦可替尼可能有效,而截短型CSF3R突变患者可能对SRC酶抑制剂如达沙替尼敏感[5]。另有研究报道,1例伴CSF3R T618I和SETBP1突变CNL患者,原代细胞体外培养发现可被JAK2抑制剂fedratinib抑制,但该患者使用ruxolitinib治疗无效[22]。本研究中2例患者接受1个疗程地西他滨治疗,均获外周血完全缓解且疗效维持3~4个月,虽然目前尚无连续使用地西他滨治疗CNL的经验,但地西他滨治疗CNL的分子机制及临床疗效值得进一步探索。
综上,本研究进一步证实CSF3R T618I突变为CNL的特异性基因诊断标志,羟基脲和干扰素等CNL传统治疗药物并不能改变CNL的自然病程,本组患者的中位生存期为24(95%CI 18~30)个月,初诊WBC≥50×109/L是不良预后因素。有合适供者且符合移植条件的患者,建议尽早行allo-HSCT治疗。
Funding Statement
基金项目:国家自然科学基金(81530008、81370611、81270585、81470297);北京协和学者创新研究团队
Fund program: National Natural Science Foundation of China(81530008, 81370611, 81270585, 81470297); Program for Peking Union Medical College Scholars and Innovative Research Team
References
- 1.Li B, Gale R, Xiao Z. Molecular genetics of chronic neutrophilic leukemia, chronic myelomonocytic leukemia and atypical chronic myeloid leukemia[J] J Hematol Oncol. 2014;7:93. doi: 10.1186/s13045-014-0093-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Vardiman JW, Brunning RD, Harris NL. WHO histological classification of chronic myeloproliferative disease. In: Jaffe ES HN, Stein H, Vardiman JW, editors. World Health Organization classification of tumours: pathology and genetics of tumours and lymphoid tissue[M] Lyon: IARC Press; 2001. pp. 17–44. [Google Scholar]
- 3.Bain BJ, Brunning RD, Vardiman JW, et al. Chronic neutrophilic leukemia. In: Swerdlow SH, Campo E, Lee Harris N, et al., editors. WHO classification of tumors of hematopoietic and lymphoid tissues[M] Lyon: IARC Press; 2008. pp. 38–39. [Google Scholar]
- 4.Elliott MA, Hanson CA, Dewald GW, et al. WHO-defined chronic neutrophilic leukemia: a long-term analysis of 12 cases and a critical review of the literature[J] Leukemia. 2005;19(2):313–317. doi: 10.1038/sj.leu.2403562. [DOI] [PubMed] [Google Scholar]
- 5.Maxson JE, Gotlib J, Pollyea DA, et al. Oncogenic CSF3R mutations in chronic neutrophilic leukemia and atypical CML[J] N Engl J Med. 2013;368(19):1781–1790. doi: 10.1056/NEJMoa1214514. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Pardanani A, Lasho TL, Laborde RR, et al. CSF3R T618I is a highly prevalent and specific mutation in chronic neutrophilic leukemia[J] Leukemia. 2013;27(9):1870–1873. doi: 10.1038/leu.2013.122. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.崔 亚娟, 李 冰, 江 倩, et al. 慢性中性粒细胞白血病CSF3R、ASXL1、SETBP1、JAK2 V617F和CALR基因突变研究[J] 中华血液学杂志. 2014;35(12):1069–1073. doi: 10.3760/cma.j.issn.0253-2727.2014.12.005. [DOI] [PubMed] [Google Scholar]
- 8.Gotlib J, Maxson JE, George TI, et al. The new genetics of chronic neutrophilic leukemia and atypical CML: implications for diagnosis and treatment[J] Blood. 2013;122(10):1707–1711. doi: 10.1182/blood-2013-05-500959. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Lasho TL, Elliott MA, Pardanani A, et al. CALR mutation studies in chronic neutrophilic leukemia[J] Am J Hematol. 2014;89(4):450. doi: 10.1002/ajh.23665. [DOI] [PubMed] [Google Scholar]
- 10.Arber DA, Orazi A, Hasserjian R, et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia[J] Blood. 2016;127(20):2391–2405. doi: 10.1182/blood-2016-03-643544. [DOI] [PubMed] [Google Scholar]
- 11.Li B, Xu J, Wang J, et al. Calreticulin mutations in Chinese with primary myelofibrosis[J] Haematologica. 2014;99(11):1697–1700. doi: 10.3324/haematol.2014.109249. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.傅 建非, 薄 兰君, 熊 红, et al. 慢性骨髓增殖性肿瘤患者MPL基因突变研究[J] 中华血液学杂志. 2009;30(9):634–637. doi: 10.3760/cma.j.issn.0253-2727.2009.09.016. [DOI] [Google Scholar]
- 13.王 婕妤, 艾 晓菲, 徐 俊卿, et al. Ph染色体阴性骨髓增殖性肿瘤患者JAK2基因第12外显子突变研究[J] 中华血液学杂志. 2012;33(9):705–709. doi: 10.3760/cma.j.issn.0253-2727.2012.09.004. [DOI] [PubMed] [Google Scholar]
- 14.Böhm J, Kock S, Schaefer HE, et al. Evidence of clonality in chronic neutrophilic leukaemia[J] J Clin Pathol. 2003;56(4):292–295. doi: 10.1136/jcp.56.4.292. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Elliott MA, Pardanani A, Hanson CA, et al. ASXL1 mutations are frequent and prognostically detrimental in CSF3R-mutated chronic neutrophilic leukemia[J] Am J Hematol. 2015;90(7):653–656. doi: 10.1002/ajh.24031. [DOI] [PubMed] [Google Scholar]
- 16.Sauvageau M, Sauvageau G. Polycomb group proteins: multi-faceted regulators of somatic stem cells and cancer[J] Cell Stem Cell. 2010;7(3):299–313. doi: 10.1016/j.stem.2010.08.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Hasle H, Olesen G, Kerndrup G, et al. Chronic neutrophil leukaemia in adolescence and young adulthood[J] Br J Haematol. 1996;94(4):628–630. doi: 10.1046/j.1365-2141.1996.7082329.x. [DOI] [PubMed] [Google Scholar]
- 18.Böhm J, Schaefer HE. Chronic neutrophilic leukaemia: 14 new cases of an uncommon myeloproliferative disease[J] J Clin Pathol. 2002;55(11):862–864. doi: 10.1136/jcp.55.11.862. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Piliotis E, Kutas G, Lipton JH. Allogeneic bone marrow transplantation in the management of chronic neutrophilic leukemia[J] Leuk Lymphoma. 2002;43(10):2051–2054. doi: 10.1080/1042819021000016087. [DOI] [PubMed] [Google Scholar]
- 20.Kako S, Kanda Y, Sato T, et al. Early relapse of JAK2 V617F-positive chronic neutrophilic leukemia with central nervous system infiltration after unrelated bone marrow transplantation[J] Am J Hematol. 2007;82(5):386–390. doi: 10.1002/ajh.20805. [DOI] [PubMed] [Google Scholar]
- 21.Goto H, Hara T, Tsurumi H, et al. Chronic neutrophilic leukemia with congenital Robertsonian translocation successfully treated with allogeneic bone marrow transplantation in a young man[J] Intern Med. 2009;48(7):563–567. doi: 10.2169/internalmedicine.48.1334. [DOI] [PubMed] [Google Scholar]
- 22.Lasho TL, Mims A, Elliott MA, et al. Chronic neutrophilic leukemia with concurrent CSF3R and SETBP1 mutations: single colony clonality studies, in vitro sensitivity to JAK inhibitors and lack of treatment response to ruxolitinib[J] Leukemia. 2014;28(6):1363–1365. doi: 10.1038/leu.2014.39. [DOI] [PubMed] [Google Scholar]