Abstract
目的
研究经典霍奇金淋巴瘤(CHL)中肿瘤坏死因子α诱导蛋白3(TNFAIP3)基因及其编码的A20蛋白表达情况,并分析其与Epstein-Barr病毒(EBV)感染的相关性。
方法
收集54例CHL患者的病理标本及临床资料,选取肿瘤细胞丰富区制作组织芯片。应用免疫组织化学染色法检测EBV编码的潜伏膜蛋白1(LMP-1),原位杂交法检测EBV编码的RNA(EBER1/2)以明确EBV感染状态。使用位点特异性间期荧光原位杂交(FISH)法检测TNFAIP3基因表达,免疫组织化学染色法检测A20蛋白表达。使用SPSS17.0统计学软件包进行数据分析。
结果
LMP-1、EBER1/2阳性率均为25.9%(14/54),两者符合率为100%。27.8%(15/54)的标本存在A20表达丢失,20.4%(10/49)的标本存在TNFAIP3杂合或纯合缺失。两种方法的检测结果显示存在明显不一致,TNFAIP3缺失伴A20丢失仅有1例。此外,EBV感染阴性与A20丢失及TNFAIP3缺失无相关性(P>0.05)。
结论
EBV阳性和阴性CHL病例均存在TNFAIP3基因和(或)A20蛋白表达丢失。FISH和免疫组织化学染色两种方法结果不一致,可能与技术因素有关。
Keywords: 霍奇金病; 基因,TNFAIP3; EB病毒感染; 原位杂交, 荧光; 免疫组织化学
Abstract
Objective
To investigate the TNFAIP3/A20 abnormalities and its association with Epstein-Barr virus (EBV) in classical Hodgkin lymphoma (CHL).
Methods
Formalin-fixed, paraffinembedded tissue blocks of 54 CHL patients were collected and subjected to the construction of tissue microarray (TMA) for further analyses. EBV status was evaluated by in situ hybridization (ISH) for EBER1/2 and immunohistochemistry (IHC) with anti-LMP-1 antibody. Fluorescence in situ hybridization (FISH) and IHC were performed to determine the copy number alterations of TNFAIP3 and A20 protein expression respectively.
Results
The concordance rate of IHC for LMP-1 and ISH for EBER1/2 was100%, and 25.9% (14/54) cases were identified with EBV infection. Immunohistochemistry analysis demonstrated 27.8% (15/54) cases with A20 expression deficiency. Of the 54 cases tested for A20 expression, 49 cases were simultaneously analyzed by FISH, which showed 10 (20.4%) cases harboring TNFAIP3 deletion. However, discrepancy was observed between the results of A20 by IHC and TNFAIP3 deletion by FISH. Only 1 case with TNFAIP3 deletion demonstrated complete loss of A20 immunoreactivity. In addition, comparison of the frequency of either A20 expression loss or TNFAIP3 deletion between EBV-positive and-negative cases did not reveal any significance (P>0.05).
Conclusion
TNFAIP3 deletion could be observed in both EBV-positive and -negative CHL cases. A20 expression by IHC could not confirm TNFAIP3 deletion by FISH, which might be related to the technical issues.
Keywords: Hodgkin disease; Genes, TNFAIP3; Epstein-Barr virus infections; In situ hybridization, fluorescence; Immunohistochemistry
经典霍奇金淋巴瘤(classical Hodgkin lymphoma, CHL)是一类来源于生发中心B细胞、具有独特临床病理学特征的恶性肿瘤[1]–[3]。目前,CHL的病因及发病机制尚未完全阐明,多种环境及遗传易感因素参与其发病,其中Epstein-Barr病毒(EBV)感染与CHL发生的相关性已被广泛认可[3]。核转录因子NF-κB通路的持续活化被认为是多种B细胞淋巴瘤(包括CHL)的标志性改变并对其发生起关键作用[4]。基因组学研究显示,CHL肿瘤细胞(HRS细胞)中存在与NF-κB信号通路相关的多个基因异常,从而使其过度激活[4]。EBV编码的潜伏膜蛋白1(LMP-1)可通过模仿活化的CD40受体诱导NF-κB持续激活,但对于EBV阴性CHL,NF-κB信号通路的异常活化可能与其负调控因子失活有关[5],其中之一便是由肿瘤坏死因子α诱导蛋白3(TNFAIP3)基因编码的A20。A20具有泛素化酶和去泛素化酶双重功能,生理情况下作用于NF-κB激酶抑制蛋白(IKK)复合物的上游。已知IKK复合物可以被上游泛素化的肿瘤坏死因子受体相关因子(TRAF)/受体相互作用蛋白(RIP)激活,而A20可通过使RIP/TRAF去泛素化并添加Lys-48–连接泛素分子,促使其被蛋白酶水解而无法向下继续激活IKK复合物。因而A20是NF-κB通路重要的负调节因子,其失活可导致NF-κB通路的异常激活。Küppers等[4]发现霍奇金淋巴瘤中TNFAIP3基因失活突变或缺失的总检出率约40%,但在EBV阴性CHL中此比率为60%。Nomoto等[6]也发现TNFAIP3失活突变与EBV感染呈负相关,提示A20失活对EBV阴性CHL的发生可能具重要意义。本研究中,我们分别采用位点特异性间期荧光原位杂交法(FISH)、免疫组化染色法检测54例CHL患者肿瘤细胞TNFAIP3基因拷贝数、A20蛋白表达情况,并分析其与EBV感染的相关性。
材料与方法
1.标本来源:对2006年11月至2014年9月北京大学基础医学院病理学系血液病理研究室会诊及北京肿瘤医院病理科存档的CHL病理标本进行回顾性研究,经2名以上血液病理学专家依据2008版WHO淋巴造血系统肿瘤分类标准[7]核实诊断,54例CHL存档石蜡包埋组织标本纳入本研究。本研究获得北京大学生物医学伦理委员会审查通过。
2.组织芯片制作:全部54例标本经10%甲醛固定,常规脱水后石蜡包埋、切片(厚度5 µm),常规HE染色,光镜观察形态学特点。使用组织芯片仪(法国Alphelys公司产品)依照光镜观察选取的HRS细胞丰富区域制作石蜡包埋组织芯片(TMA),每例均包含2个直径1 mm的组织条,使用芯片仪自带程序标记其对应坐标位置[8]。
3.免疫组织化学染色:对TMA切片进行二氨基联苯胺(DAB)免疫组化染色,应用美国Roche公司的BENCHMARK-XT免疫组织化学自动染色机完成。抗LMP-1抗体为北京中杉金桥生物技术有限公司产品,以已知阳性CHL病例为阳性对照(阳性信号位于肿瘤细胞胞膜及胞质)。A20抗体购自英国Abcam公司,以睾丸组织为阳性对照(阳性信号位于曲细精管的支持细胞和生精细胞胞质)。所有阴性对照均以抗体稀释液代替一抗进行染色。A20染色判读标准:肿瘤细胞广泛均匀着色为阳性,>10%肿瘤细胞出现定位准确但不均匀(或浅棕色)着色为弱阳性,不符合以上两条者为阴性(丢失)。
4.原位杂交法检测EBV编码的RNA(EBER1/2):EBER1/2原位杂交试剂盒购自北京中杉金桥生物技术有限公司。按照说明书进行操作。阳性对照为已知EBER1/2阳性CHL肿瘤组织(阳性着色部位为肿瘤细胞核)。
5.FISH检测TNFAIP3基因表达:TNFAIP3/A20双色分离探针购自北京博朗生科技有限公司,用Spectrum Red(红色)和Spectrum Green(绿色)分别标记TNFAIP3(6q23)和6号染色体着丝粒(CEP6)。正常间期细胞中可以看到两个红色及两个绿色信号。如果肿瘤细胞发生TNAIP3杂合性缺失或纯合性缺失,则表现为0或1个红色信号伴有2个绿色信号。按文献[9]–[10]方法进行FISH检测,由两名经验丰富的研究人员判读结果。判读标准:由于HRS细胞基因高度不稳定,故计算每例CHL肿瘤细胞内的红色信号数目之和(R总)及绿色信号数目之和(G总),然后计算R总/G总的比值(RRG)。将RRG<1.0、>2.0、1.0~2.0分别判读为TNFAIP3缺失、扩增、不确定。由于观察HRS细胞数相对较少,对于不确定的病例,根据该病例中各HRS细胞的红色信号与绿色信号比值,进一步明确是否存在TNFAIP3缺失。
6.统计学处理:应用SPSS17.0软件进行统计学分析。计量资料两独立样本均数比较采用t检验;计数资料多样本率的比较采用确切概率法,两影响因素关联性比较应用χ2检验(Pearson法)。以P<0.05为差异有统计学意义。
结果
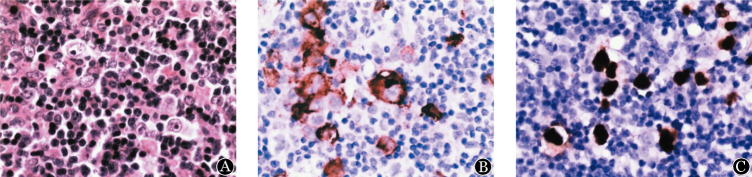
1.一般临床病理学特征:54例CHL患者中男34例,女20例,中位发病年龄45.5(22.0~68.0)岁,发病高峰位于31~35岁(12例)及56~60岁(8例)。所有病例均为淋巴结内原发。依据WHO2008版淋巴瘤分类标准进行分型,54例CHL中结节硬化型(NS型)32例(59.3%)、混合细胞型(MC型)21例(38.9%)、淋巴细胞丰富型(LR型)1例(1.9%)。制作完成的TMA经HE染色观察均见HRS细胞(图1A)。全部54例CHL标本均同时进行LMP1免疫组织化学和EBER1/2原位杂交检测,2种方法的检测结果完全一致。54例CHL标本中14例(25.9%)LMP1(图1B)和EBER1/2检测结果均为阳性(图1C)。不同性别、年龄及组织学亚型中EBV感染情况见表1。MC型患者EBV阳性率为52.4%(11/21),NS型患者为9.4%(3/32),1例LR患者EBV检测为阴性,MC型EBV阳性率高于其他组织学亚型(χ2=12.523,P<0.001);年龄≥60岁组EBV的检出率高于年龄<60岁组[(55.6%(5/9)对20.0%(9/45),χ2=4.937,P=0.041];男性与女性患者EBV检出率差异无统计学意义[76.5%(26/34)对70.0%(14/20),χ2=0.275,P=0.600]。
图1. 经典霍奇金淋巴瘤形态及Epstein-Barr病毒(EBV)检测(×400).
A:典型的HRS细胞(HE染色);B:免疫组织化学染色法检测EBV编码的潜伏膜蛋白1(LMP-1)(棕黄色阳性信号定位于胞质,二氨基联苯胺显色);C:原位杂交法检测EBV编码的RNA(EBER1/2)(棕黄色阳性信号位于HRS细胞核,二氨基联苯胺显色)
表1. 54例经典霍奇金淋巴瘤(CHL)患者Epstein-Barr病毒(EBV)感染与年龄、性别及组织学亚型的相关性[例(%)].
| 因素 | EBV阳性 | EBV阴性 | χ2值 | P值 |
| 年龄 | 4.937 | 0.041 | ||
| <60岁 | 9(20.0) | 36(80.0) | ||
| ≥60岁 | 5(55.6) | 4(44.4) | ||
| 性别 | 0.275 | 0.600 | ||
| 男 | 8(23.5) | 26(76.5) | ||
| 女 | 6(30.0) | 14(70.0) | ||
| CHL亚型 | 12.523 | <0.001 | ||
| 混合细胞型 | 11(52.4) | 10(47.6) | ||
| 结节硬化型 | 3(9.4) | 29(90.6) | ||
| 淋巴细胞丰富型 | 0 | 1(100.0) |
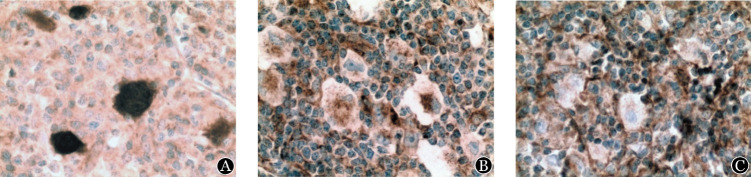
2.A20蛋白表达检测结果:54例CHL患者中,20例(37.0%)A20阳性(图2A),19例(35.2%)弱阳性(图2B),15例(27.8%)阴性(图2C)。
图2. 经典霍奇金淋巴瘤A20蛋白表达情况(二氨基联苯胺显色,×400).
A:HRS细胞A20蛋白阳性(信号位于胞核和胞质);B:A20染色弱阳性;C:A20染色阴性/丢失
3.FISH检测TNFAIP3基因拷贝数结果:以内对照背景细胞可见2个红色(R)和2个绿色(G)信号为标准,54例CHL标本中49例成功进行了FISH-TNFAIP3检测:19例(38.8%)观察到5个HRS细胞,11例(22.4%)观察到4个HRS细胞,7例(14.3%)观察到3个HRS细胞,8例(16.3%)观察到2个HRS细胞,其余4例(8.2%)仅观察到1个HRS细胞。在观察的HRS细胞中,红色信号0~13个,绿色信号1~13个。CHL病例的R信号均值(每例CHL所有观察HRS细胞的R信号总数与观察HRS细胞总数比值)中位数为3.8(1.5~7.5),提示CHL病例中肿瘤细胞TNFAIP3拷贝数具有高度变异性。
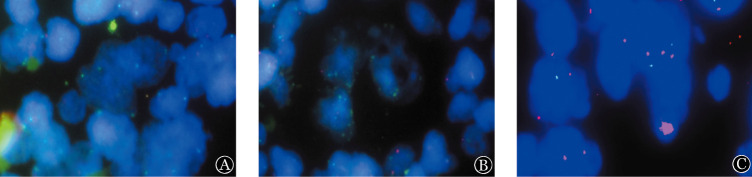
FISH检测TNFAIP3的RRG为0.8~2.3, 7例(14.3%)RRG <1.0, 39例(79.6%)RRG 1.0~2.0, 3例(6.1%)RRG>2.0。由于RRG 1.0~2.0的CHL标本中发现3例存在1个以上的可观察HRS细胞内红色信号/绿色信号比值<1.0,最终亦判为TNFAIP3缺失。故而最终有10例(20.4%)标本被判定为肿瘤细胞存在TNFAIP3纯合性或杂合性缺失(图3A、B),3例(6.1%)肿瘤细胞存在TNFAIP3扩增(图3C),其余36例(73.5%)为不确定。
图3. 位点特异性间期荧光原位杂交法检测经典霍奇金淋巴瘤肿瘤坏死因子α诱导蛋白3(TNFAIP3)基因拷贝数.
A:HRS细胞TNFAIP3纯合型缺失,红色信号(TNFAIP3)缺如,仅见2个绿色信号(CEP6);B:TNFAIP3杂合缺失,仅见1个红色信号,绿色信号(CEP6)拷贝数明显增多(>10个);C:TNFAIP3扩增,可见5个红色信号和2个绿色信号
4.A20表达与TNFAIP3基因拷贝数检测结果的比较:FISH检测存在TNFAIP3缺失的10例标本中,A20表达阴性1例,弱阳性6例,阳性3例。A20表达阴性的12例标本中TNFAIP3缺失1例,不确定9例,扩增2例。两者不具显著相关性(χ2=1.426,P=0.414)。
5.TNFAIP3基因缺失及A20表达丢失与EBV、年龄、性别及组织学分型的相关性:TNFAIP3缺失的病例中,60.0%(6/10)检测EBER1 /2阴性;EBER1/2检测阴性的病例中,TNFAIP3检测表现为缺失仅占16.7%(6/36)。同样A20免疫组织化学染色丢失病例中,EBV检测阴性率为83.3%(10/12)。而EBV检测阴性的病例中,A20免疫组织化学染色27.8%(10/36)为丢失。经相关性分析EBV感染阴性与A20丢失及TNFAIP3缺失未见显著相关性(P>0.05)(表2)。此外,将本组病例按照性别(男/女)、年龄(≥60岁/<60岁)及组织类型(MC/NS)进行分组并与A20及TNFAIP3检测结果进行相关性分析,均未显示出相关性(P>0.05)(表2)。
表2. 49例经典霍奇金淋巴瘤(CHL)患者TNFAIP3(位点特异性间期染色体原位杂交法)及A20(免疫组织化学染色法)检测结果与EBV感染(EBER1/2原位杂交法)等因素的相关性[例(%)].
| 因素 | A20表达(49例) |
TNFAIP3状态(49例) |
||||||||
| 丢失(阴性) | 无丢失 | χ2值 | P值 | 缺失 | 无缺失 | χ2值 | P值 | |||
| 弱阳性 | 阳性 | 不确定 | 扩增 | |||||||
| EBV | 0.793 | 0.474 | 1.169 | 0.422 | ||||||
| 阴性 | 10(27.8) | 11(30.6) | 15(41.7) | 6(16.7) | 27(75.0) | 3(8.3) | ||||
| 阳性 | 2(15.4) | 8(61.5) | 3(23.1) | 4(30.8) | 9(69.2) | 0 | ||||
| 性别 | 0.079 | 1.000 | 0.245 | 0.726 | ||||||
| 男 | 8(25.8) | 10(32.3) | 13(41.9) | 7(22.6) | 21(67.7) | 3(9.7) | ||||
| 女 | 4(22.2) | 9(50.0) | 5(27.8) | 3(16.7) | 15(83.3) | 0 | ||||
| 年龄 | 0.031 | 1.000 | 1.134 | 0.364 | ||||||
| <60岁 | 10(25.0) | 16(40.0) | 14(35.0) | 7(17.5) | 30(75.0) | 3(7.5) | ||||
| ≥60岁 | 2(22.2) | 3(33.3) | 4(44.4) | 3(33.3) | 6(66.7) | 0 | ||||
| 亚型 | 0.013 | 1.000 | 1.299 | 0.285 | ||||||
| 混合细胞型 | 4(23.5) | 10(58.8) | 3(17.6) | 5(29.4) | 11(64.7) | 1(5.9) | ||||
| 结节硬化型 | 8(25.0) | 9(28.1) | 15(46.9) | 5(15.6) | 25(78.1) | 2(6.3) | ||||
注:TNFAIP3:肿瘤坏死因子α诱导蛋白3; EBER: EBV编码的RNA
讨论
本组病例发病年龄具有“双峰”特征,与文献[11]–[12]结果一致;其次,男性多于女性,与文献[7],[12]–[14]结果一致。本组CHL患者的EBV感染率为25.9%(14/54),低于文献[11]–[12],[15]的结果,可能与本组样本数较少和人种差异有关。
本组CHL病例中,FISH检测结果提示20.4%(10/49)的病例存在TNFAIP3缺失,略低于文献[16]的结果。此外,本组10例存在TNFAIP3缺失的CHL患者中,EBV阴性6例,多于EBV阳性病例(4例),但其占全部EBV阴性CHL的不足1/3,低于Schimtz等[5]和Nemoto等[6]所报道的EBV阴性CHL中70%和43%的TNFAIP3缺失率。以上与既往研究结果不一致可能与样本量的差异有关,且本组病例TNFAIP3拷贝数计数是基于暗视野下寻找“鹤立鸡群”的HRS细胞,敏感度可能不如文献中所使用的免疫荧光联合染色体原位杂交(FICTION)技术,因此75.0%(27/36)的EBV阴性病例TNFAIP3状态判读为不确定。
A20是NF-κB通路的负调节因子,NF-κB通路异常活化可反馈性诱导A20表达水平升高[5]。因此在存在NF-κB持续活化的肿瘤(包括CHL)中常可检测到A20阳性或弱阳性表达。本组病例中高达72.2%(39/54)的病例存在A20表达。Hirsch等[18]研究结果显示A20表达阴性病例均为EBV阴性。本研究中A20表达阴性的CHL病例中,80%(12/15)为EBV阴性,3例(20%)为EBV阳性,分析可能与样本选择差异及所用抗体不同有关。Hirsch等[18]通过对比免疫组织化学A20表达与TNFAIP3突变检测结果,提出A20的表达情况在一定程度上可反映TNFAIP3基因改变情况:存在基因突变者A20表达完全丢失,而A20弱阳性提示TNFAIP3为野生型。上述结论并未在本组病例中得到验证。本组12例A20表达丢失的病例中,仅1例FISH检测到TNFAIP3缺失。FISH技术仅能检测基因拷贝数变化,而无法确定是否存在其他异常。有研究证实在黏膜相关淋巴瘤中存在体细胞TNFAIP3基因突变或其启动子甲基化等所致A20表达丢失[17],推测在CHL肿瘤细胞可能亦会存在此类异常。此外,我们在9例A20阳性/弱阳性的病例中检出TNFAIP3缺失,可能与文献[18]所用抗体不同有关,亦可能与前述关于FISH检测TNFAIP3基因缺失技术和判读标准存在一定缺陷有关。
Acknowledgments
感谢首都医科大学病理学系宫丽平教授的悉心指导及帮助
Funding Statement
基金项目:国家自然科学基金(81201859)
Fund program: National Natural Science Foundation of China(81201859)
References
- 1.Hodgkin On some Morbid Appearances of the Absorbent Glands and Spleen[J] Med Chir Trans. 1832;17:68–114. doi: 10.1177/095952873201700106. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Küppers R, Engert A, Hansmann ML. Hodgkin lymphoma[J] J Clin Invest. 2012;122(10):3439–3447. doi: 10.1172/JCI61245. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Matsuki E, Younes A. Lymphomagenesis in Hodgkin lymphoma[J] Semin Cancer Biol. 2015;34:14–21. doi: 10.1016/j.semcancer.2015.02.002. [DOI] [PubMed] [Google Scholar]
- 4.Kuppers R. Molecular biology of Hodgkin lymphoma[J] Hematology Am Soc Hematol Educ Program. 2009:491–496. doi: 10.1182/asheducation-2009.1.491. [DOI] [PubMed] [Google Scholar]
- 5.Schmitz R, Hansmann ML, Bohle V, et al. TNFAIP3 (A20) is a tumor suppressor gene in Hodgkin lymphoma and primary mediastinal B cell lymphoma[J] J Exp Med. 2009;206(5):981–989. doi: 10.1084/jem.20090528. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Nomoto J, Hiramoto N, Kato M, et al. Deletion of the TNFAIP3/A20 gene detected by FICTION analysis in classical Hodgkin lymphoma[J] BMC Cancer. 2012;12:457. doi: 10.1186/1471-2407-12-457. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Swerdlow SH, Campo E, Lee Harris N, et al. World health organization classification of tumours of haematopoietic and lymphoid tissues[M] Lyon: IARC Press; 2008. pp. 321–334. [Google Scholar]
- 8.时 云飞, 高 子芬, 刘 翠苓, et al. COX-2、p16INK4A、p53蛋白在经典型霍奇金淋巴瘤患者中的表达及其预后相关分析[J] 中华血液学杂志. 2015;36(11):926–932. doi: 10.3760/cma.j.issn.0253-2727.2015.11.008. [DOI] [Google Scholar]
- 9.时 云飞, 刘 翠苓, 周 春菊, et al. 原发系统型间变性大细胞淋巴瘤间变性淋巴瘤激酶基因异常与其融合蛋白表达及预后分析[J] 北京大学学报(医学版) 2008;40(4):380–386. doi: 10.3321/j.issn:1671-167X.2008.04.009. [DOI] [Google Scholar]
- 10.王 桂秋, 周 英琼, 宫 丽平, et al. 用荧光原位杂交在石蜡切片上检测t(11;18)和涉及bcl-10基因染色体易位的方法[J] 中华病理学杂志. 2007;36(7):494–495. doi: 10.3760/j.issn:0529-5807.2007.07.017. [DOI] [PubMed] [Google Scholar]
- 11.Koh YW, Yoon DH, Suh C, et al. Impact of the Epstein-Barr virus positivity on Hodgkin's lymphoma in a large cohort from a single institute in Korea[J] Ann Hematol. 2012;91(9):1403–1412. doi: 10.1007/s00277-012-1464-8. [DOI] [PubMed] [Google Scholar]
- 12.时 云飞, 李 向红. 北方地区235例霍奇金淋巴瘤临床病理特征及其EB病毒感染的相关性分析[J] 中华病理学杂志. 2015;44(2):84–89. doi: 10.3760/cma.j.issn.0529-5807.2015.02.002. [DOI] [Google Scholar]
- 13.付 骞千, 纪 洪媛, 张 甜甜, et al. 136例中国北方汉族人群经典型霍奇金淋巴瘤与EB病毒感染的相关性研究[J] 中国肿瘤临床. 2014;(10):629–633. doi: 10.3969/j.issn.1000-8179.20140394. [DOI] [Google Scholar]
- 14.宋 新兰, 胡 预兵, 孙 振柱. 105例霍奇金淋巴瘤的临床病理与免疫组化分析[J] 新疆医学. 2007;37(6):5–8. doi: 10.3969/j.issn.1001-5183.2007.06.003. [DOI] [Google Scholar]
- 15.沈 丽佳, 何 滢, 蒋 会勇, et al. mic2/CD99在经典型霍奇金淋巴瘤H/RS细胞中的表达及与Eber-1/LMP-1相关性的研究[J] 中国病理生理杂志. 2006;22(4):776–780. doi: 10.3321/j.issn:1000-4718.2006.04.035. [DOI] [Google Scholar]
- 16.Kato M, Sanada M, Kato I, et al. Frequent inactivation of A20 in B-cell lymphomas[J] Nature. 2009;459(7247):712–716. doi: 10.1038/nature07969. [DOI] [PubMed] [Google Scholar]
- 17.Chanudet E, Huang Y, Ichimura K, et al. A20 is targeted by promoter methylation, deletion and inactivating mutation in MALT lymphoma[J] Leukemia. 2010;24(2):483–487. doi: 10.1038/leu.2009.234. [DOI] [PubMed] [Google Scholar]
- 18.Hirsch B, Grünbaum M, Wagner F, et al. A novel A20 (TNFAIP3) antibody (Ber-A20) can be used to detect unmutated A20 by immunohistology[J] Histopathology. 2012;60(6B):E19–27. doi: 10.1111/j.1365-2559.2012.04181.x. [DOI] [PubMed] [Google Scholar]