Abstract
目的
探索聚乙二醇脂质体阿霉素(PLD)在联合环磷酰胺、长春新碱和泼尼松组成改良CHOP方案中的最大耐受剂量(MTD)。
方法
研究纳入21例初治侵袭性非霍奇金淋巴瘤患者。患者第1个周期使用PLD,分为4个剂量水平(30、35、40、45 mg/m2第1天)按照3+3方法进行剂量递增,第2~6个周期使用阿霉素(50 mg/m2第1天)。而联合方案中环磷酰胺(750 mg/m2第1天)、长春新碱(1.4 mg/m2第1天,最大剂量不超过2 mg)和泼尼松(100 mg/d第1~5天)的剂量保持不变,仅统计第1个周期的不良反应。
结果
21例患者中男14例,女7例,中位年龄49(25~67)岁。T细胞淋巴瘤15例,B细胞淋巴瘤6例。在PLD剂量递增至45 mg/m2剂量组时,3例患者中2例出现3级口腔黏膜炎,达到剂量限制性毒性,因此剂量下调一个等级。在40 mg/m2剂量组时,12例患者中仅有1例出现肺炎伴4级中性粒细胞下降。所有剂量组中,观察到的3~4级不良反应为中性粒细胞下降(13例,61.9%)、口腔黏膜炎(2例,9.5%)、血小板下降(1例,4.8%)和肺炎(1例,4.8%),经过抗感染、口腔护理、支持治疗后症状均可缓解。
结论
在联合环磷酰胺、长春新碱和泼尼松治疗侵袭性非霍奇金淋巴瘤的治疗方案中,PLD的最大耐受剂量为40 mg/m2,不良反应经对症处理后症状可缓解。
Keywords: 淋巴瘤,非霍奇金, 聚乙二醇脂质体阿霉素, 临床试验,Ⅰ期
Abstract
Objective
To explore the maximum tolerated dose of pegylated liposomal doxorubicin (PLD) in combination with cyclophosphamide, vincristine and prednisone as a modified CHOP regimen for aggressive non-Hodgkin lymphoma.
Methods
Patients with newly diagnosed aggressive non-Hodgkin lymphoma were eligible for this trial. PLD was administered in cycle 1 and categorized into 4 dose level (30 mg/m2, 35 mg/m2, 40 mg/m2, 45 mg/m2 D1) according to a 3 + 3 approach for dose-escalation. Doxorubin was used in cycles 2–6. In this combination regimen, the doses of cyclophosphamide (750 mg/m2 D1), vincristine (1.4 mg/m2 D1, maximum dose of 2 mg) and prednisone (100 mg D1–5) were fixed. Toxicities of cycle 1 were documented.
Results
Totally, 21 patients were enrolled in this trial. Among them, 15 patients had T-cell lymphoma and 6 had B-cell lymphoma. When the dose of PLD was escalated to the level of 45 mg/m2, 2 of 3 patients developed grade 3 mucositis, which met the criteria of dose-limiting toxicity. Therefore, the dose was de-escalated for one level. At the level of 40 mg/m2, only one among 12 patients had pneumonia and grade 4 neutropenia. In all dose levels, the grade 3/4 toxicities observed were neutropenia (13 cases, 61.9%), mucositis (2 cases, 9.5%), thrombocytopenia (1 case, 4.8%) and pneumonia (1 case, 4.8%).
Conclusion
When combined with cyclophosphamide, vincristine and prednisone as a combination regimen, the maximum tolerated dose of PLD was 40 mg/m2.
Keywords: Lymphoma, non-Hodgkin; Pegylated liposomal doxorubicin; Clinical trial, phase Ⅰ
CHOP(阿霉素、环磷酰胺、长春新碱和泼尼松)方案一直是治疗侵袭性非霍奇金淋巴瘤(non-Hodgkin lymphoma, NHL)的标准化疗方案[1]。对于B细胞淋巴瘤,特别是弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma, DLBCL),在CHOP方案基础上联合抗CD20单克隆抗体(利妥昔单抗)显著改善了肿瘤缓解率和生存率[1]–[5]。而对于T细胞淋巴瘤,目前含蒽环类药物的化疗方案如CHOP和CHOP样化疗方案仍是最常用的一线方案。
在CHOP方案中,阿霉素是最为关键的药物之一,但其导致的心脏毒性是临床应用的主要障碍[6]–[8]。聚乙二醇脂质体阿霉素(pegylated liposomal doxorubicin, PLD)由于其脂质体采用了聚乙二醇进行修饰,与普通阿霉素相比,其半衰期延长10余倍,改善了药物的生物利用度,同时有可能减少药物对正常组织如骨髓、心肌细胞和皮肤毛囊组织的毒副作用[9]–[14]。目前批准的PLD适应证包括卡波西肉瘤、卵巢癌、多发性骨髓瘤和乳腺癌。在一项比较PLD(50 mg/m2,每4周重复1次)和传统阿霉素(60 mg/m2,每3周重复1次)单药治疗晚期乳腺癌的Ⅲ期随机对照研究中,接受普通阿霉素治疗的患者发生心脏毒性的风险是接受PLD患者的3.16倍(P<0.001),而两组患者在疗效上差异无统计学意义[11]。在PLD联合环磷酰胺、长春新碱和泼尼松治疗淋巴瘤的方案中,PLD的使用剂量范围为20~45 mg/m2[15]–[20],而在治疗NHL方案中最佳的使用剂量尚不明确。鉴于上述背景,我们开展一项针对PLD的Ⅰ期剂量递增试验,联合标准剂量的环磷酰胺、长春新碱和泼尼松治疗侵袭性NHL,以明确PLD在该方案中的最大耐受剂量,从而为今后的Ⅱ、Ⅲ期临床试验奠定基础。
对象与方法
1.对象:入组标准包括18~70岁的患者;PS 0~1分,组织学证实的初治侵袭性NHL,并分为B细胞淋巴瘤(无法接受利妥昔单抗治疗)和T细胞淋巴瘤(NK/T细胞淋巴瘤除外);患者均有良好的心脏、骨髓造血、肝肾功能等。排除标准为原发或继发中枢DLBCL,需要联合接受鞘内化疗,合并需要治疗的心脏疾病等。研究通过我院临床试验机构和伦理委员会的批准(批准号:IRB1403132-5),研究符合赫尔辛基宣言和GCP的标准,所有患者均签署知情同意书。
2.研究方案:PLD为石家庄制药集团有限公司产品。按照3+3原则,在4个剂量水平(30、35、40、45 mg/m2)进行PLD剂量,并在第1天使用。本次研究入组人群为有潜在治愈可能的初治侵袭性NHL,为防止低剂量组治疗强度不足,故PLD仅在第1个周期使用,后续第2~6个周期使用阿霉素50 mg/m2。在此同时,联合环磷酰胺750 mg/m2第1天,长春新碱1.4 mg/m2第1天(最大剂量2 mg)和泼尼松50 mg第1~5天治疗。每3周重复1次。
3.剂量限制性毒性(DLT)的定义:血液学毒性:出现发热性粒细胞缺乏≥3 d、4级中性粒细胞下降≥ 5 d、4级血小板下降≥3 d、PLT<10×109/L;非血液性毒性:出现任何3~4级不良反应(恶心、呕吐、脱发除外);任何毒性导致的化疗延迟超过2周。
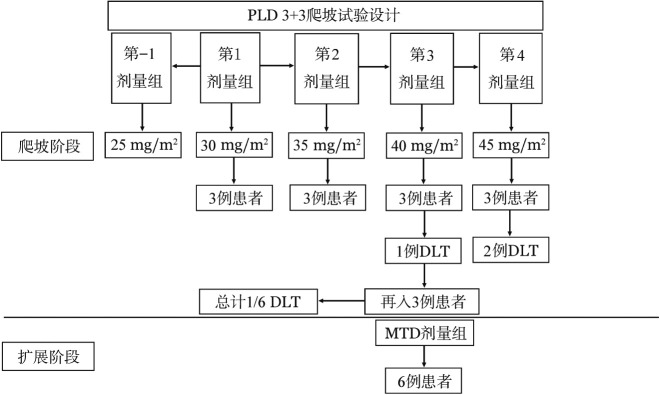
4.剂量递增方案:按照入组时间先后,在由低到高的剂量等级,每一个剂量等级治疗3例患者,并观察第1个周期的毒性。如果没有出现DLT,进行下一个剂量等级的治疗;如果出现1例DLT,则需要额外治疗3例患者,如果没有DLT发生则继续进行剂量递增,如果出现DLT则剂量递增终止;如果3例中出现1例以上DLT,则剂量递增终止。确定DLT的低一等级剂量为最大耐受剂量(MTD),如果第1等级(30 mg/m2)就确定出现DLT,则进行第-1等级(25 mg/m2)的研究。在MTD的剂量等级需要额外治疗6例患者,如果出现≤1例的DLT,则确定为最终MTD,如果出现>1例的DLT,研究者讨论决定最终MTD。如果剂量递增至第4等级仍未出现确定MTD,则该等级的剂量(45 mg/m2)确定为最终MTD(图1)。
图1. 聚乙二醇脂质体阿霉素(PLD)Ⅰ期剂量递增试验方案实施示意图.
DLT:剂量限制性毒性;MTD:最大耐受剂量
5.安全性评价:本研究的主要研究终点是在联合方案中PLD的最大耐受剂量,所有不良反应按照NCI CTCAE 4.0标准进行评价。次要研究终点为肿瘤缓解率,按照Cheson 2007版标准进行评价。
6.统计学处理:本研究为Ⅰ期剂量递增研究,采用标准3+3的入组设计,具体样本量取决于在那个等级确定MTD。疗效、不良反应采用百分率表示。考虑到本研究只使用1个周期的PLD,所有安全性数据只收集第1个周期。
结果
1.入组患者一般临床特征:从2014年4月至2015年5月,本试验共入组21例初治侵袭性NHL患者,其中T细胞淋巴瘤15例(外周T细胞淋巴瘤,非特指型12例、ALK阳性间变大细胞淋巴瘤3例),B细胞淋巴瘤6例(DLBCL 5例,滤泡淋巴瘤1例)。21例患者中男14例,女7例,中位年龄49(25~67)岁。有B症状(发热、盗汗、体重减轻)者3例;LDH>正常值上限者2例;Ann Arbor分期Ⅰ/Ⅱ者12例,Ⅲ/Ⅳ者9例;结外受累者6例;IPI评分0~1分者18例,2分者3例。
2.Ⅰ期剂量递增试验:采用了标准3+3的入组。前两个剂量等级30、35 mg/m2的6例患者未出现DLT。在第3个剂量等级(40 mg/m2),1例患者出现发热性粒细胞缺乏超过3 d被判定为DLT,此例患者最终被诊断为肺炎。后在这个剂量组扩展至6例患者,未出现其他DLT事件,故剂量递增至第4个剂量等级(45 mg/m2)。在此剂量等级有2例患者均出现3级口腔黏膜炎,被判定为DLT,故剂量递增试验终止,确定DLT的低一等级剂量即40 mg/m2为MTD。并根据方案在这个剂量等级再扩组6例患者,均未出现DLT(图1)。
3.第1个周期的不良反应:观察到的最常见3~4级不良反应为中性粒细胞下降(13例,61.9%)、口腔黏膜炎(2例,9.5%)、血小板下降(1例,4.8%)和肺炎(1例,4.8%),经过抗感染、口腔护理、支持治疗后症状均可缓解(表1)。
表1. 聚乙二醇脂质体阿霉素Ⅰ期剂量递增试验中21例初治侵袭性非霍奇金淋巴瘤患者的不良反应[例(%)].
| 不良反应 | 1级 | 2级 | 3级 | 4级 |
| 中性粒细胞减少 | 3(14.3) | 3(14.3) | 3(14.3) | 10(47.6) |
| 血红蛋白减少 | 4(19.0) | 0 | 0 | 0 |
| 血小板下降 | 0 | 0 | 1(4.8) | 0 |
| 口腔黏膜炎 | 4(19.0) | 2(9.5) | 2(9.5) | 0 |
| 输液相关反应 | 1(4.8) | 2(9.5) | 0 | 0 |
| ALT升高 | 4(19.0) | 1(4.8) | 0 | 0 |
| 肺炎 | 0 | 0 | 1(4.8) | 0 |
| 室性早搏 | 1(4.8) | 0 | 0 | 0 |
| 皮疹 | 1(4.8) | 1(4.8) | 0 | 0 |
4.发生DLT患者的治疗及转归:本次临床试验中,总共有3例患者发生DLT。在40 mg/m2剂量组中出现的1例患者为4级中性粒细胞减少,予以升白细胞及莫西沙星、注射用亚胺培南西司他丁钠、氟康唑、卡泊芬净抗感染治疗2周后症状缓解,下次化疗减量治疗后要求回当地治疗退出临床试验。在45 mg/m2剂量组中出现的2例患者均为3级口腔黏膜炎,经过抗感染、口腔护理、支持治疗后症状均缓解。其中1例患者在不良反应症状缓解后要求退出试验,更换为DICE化疗方案。
5.疗效:在完成2个周期并具有可测量病灶的19例患者中,完全缓解(CR) 14例,部分缓解(PR)4例,疾病进展(PD) 1例,总体缓解率为94.74%(18/19)。在病理分型中,5例B细胞淋巴瘤和3例ALK阳性间变大细胞淋巴瘤均获得CR,而在11例外周T细胞淋巴瘤中,6例患者获得完全缓解,4例患者获得部分缓解但疾病迅速进展进行挽救治疗,1例患者出现疾病进展并接受了挽救化疗。
讨论
本项Ⅰ期临床试验探索了PLD在联合方案中的合适剂量,我们采用了3+3的入组设计进行剂量递增研究,最初设计本次试验时,计划使用6个周期PLD替代阿霉素,但考虑入组人群为有潜在治愈可能的初治侵袭性NHL,为防止低剂量组治疗强度不足,故最终方案决定PLD仅在第1个周期使用,后续周期使用阿霉素,故只能观察使用1个周期PLD的不良反应。
在研究中,我们观察到在45 mg/m2剂量组中出现2例DLT,均为3级口腔黏膜炎,而在所有21例患者中,所有等级的口腔黏膜炎为8例(38.1%),为最常见的非血液学毒性。而在其他研究中,不同剂量的脂质体阿霉素发生口腔黏膜炎的比例高低不一。Uziely等[21]进行脂质体阿霉素的Ⅰ期临床试验,在单药80 mg/m2 3周方案中,3例患者中2例发生4级黏膜炎;在单药60 mg/m2 3周方案中,26例患者中出现1例4级和2例3级黏膜炎。而在联合方案中,其中一项针对HIV阳性B细胞NHL患者的前瞻性Ⅱ期临床试验中,PLD (40 mg/m2)被用来代替普通阿霉素组成R-CHOP方案,40例患者中5例出现1级黏膜炎[16]。另一项研究中,采用30 mg/m2的PLD为基础的CDOP(环磷酰胺、PLD、长春新碱、泼尼松)方案进行老年DLBCL治疗的Ⅱ期临床试验,3%的患者出现1级的口腔黏膜炎[17]。意大利研究者也曾采用30 mg/m2的PLD替代阿霉素进行了R-CHOP治疗,总共30例患者中仅有1例2级和1例3级口腔黏膜炎[18]。Oki等[19]以80例年龄在61~91岁的NHL患者为研究对象,进行40 mg/m2 PLD为基础的CHOP方案Ⅱ期临床试验,结果未见口腔黏膜炎的发生。在我们的研究中,口腔黏膜炎发生的比例相对较高,猜测可能与不同工艺进行脂质体包裹,导致组织中药物浓度不同有关。
在既往研究中,另一个相对常见的非血液性毒性是手足综合征,但各项研究中发生比例不等。在一项每3周PLD 60 mg/m2单药研究中指出手足综合征一般在2~3个周期用药后出现[21]。Schmitt等[20]回顾性分析了21例具有LVEF功能不全或者具有心脏毒性高危因素的NHL患者,手足综合征是导致停药的主要原因,特别是对于每周剂量强度超过15 mg/m2的患者。联合方案使用PLD剂量为40 mg/m2时,有研究指出20%的患者出现不同程度的手足综合征。Zaja等[18]在R-CHOP方案中以30 mg/m2的PLD替代阿霉素进行治疗,则未见手足综合征的发生。Oki等[19]在研究中观察到有4%的患者出现手足综合征。我们在研究中未观察到任何程度的手足综合征发生,考虑到PLD仅在第1个周期使用,其远期或累积毒性需要在接下来的Ⅱ、Ⅲ期临床试验中进一步了解。
通过研究,我们确定PLD在联合环磷酰胺、长春新碱和泼尼松方案中的最大耐受剂量为40 mg/m2,而组成的联合方案治疗侵袭性NHL的疗效也需要在今后开展的Ⅱ、Ⅲ期临床试验中进行验证。
References
- 1.Fisher RI, Gaynor ER, Dahlberg S, et al. Comparison of a standard regimen (CHOP) with three intensive chemotherapy regimens for advanced non-Hodgkin's lymphoma[J] N Engl J Med. 1993;328(14):1002–1006. doi: 10.1056/NEJM199304083281404. [DOI] [PubMed] [Google Scholar]
- 2.Coiffier B, Lepage E, Briere J, et al. CHOP chemotherapy plus rituximab compared with CHOP alone in elderly patients with diffuse large-B-cell lymphoma[J] N Engl J Med. 2002;346(4):235–242. doi: 10.1056/NEJMoa011795. [DOI] [PubMed] [Google Scholar]
- 3.Coiffier B, Thieblemont C, Van Den Neste E, et al. Long-term outcome of patients in the LNH-98.5 trial, the first randomized study comparing rituximab-CHOP to standard CHOP chemotherapy in DLBCL patients: a study by the Groupe d'Etudes des Lymphomes de l'Adulte[J] Blood. 2010;116(12):2040–2045. doi: 10.1182/blood-2010-03-276246. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Pfreundschuh M, Trümper L, Osterborg A, et al. CHOP-like chemotherapy plus rituximab versus CHOP-like chemotherapy alone in young patients with good-prognosis diffuse large-B-cell lymphoma: a randomised controlled trial by the MabThera International Trial (MInT) Group[J] Lancet Oncol. 2006;7(5):379–391. doi: 10.1016/S1470-2045(06)70664-7. [DOI] [PubMed] [Google Scholar]
- 5.Pfreundschuh M, Kuhnt E, Trümper L, et al. CHOP-like chemotherapy with or without rituximab in young patients with goodprognosis diffuse large-B-cell lymphoma: 6-year results of an open-label randomised study of the MabThera International Trial (MInT) Group[J] Lancet Oncol. 2011;12(11):1013–1022. doi: 10.1016/S1470-2045(11)70235-2. [DOI] [PubMed] [Google Scholar]
- 6.Singal PK, Deally CM, Weinberg LE. Subcellular effects of adriamycin in the heart: a concise review[J] J Mol Cell Cardiol. 1987;19(8):817–828. doi: 10.1016/s0022-2828(87)80392-9. [DOI] [PubMed] [Google Scholar]
- 7.Von Hoff DD, Layard MW, Basa P, et al. Risk factors for doxoru-bicin-induced congestive heart failure[J] Ann Intern Med. 1979;91(5):710–717. doi: 10.7326/0003-4819-91-5-710. [DOI] [PubMed] [Google Scholar]
- 8.Swain SM, Whaley FS, Ewer MS. Congestive heart failure in patients treated with doxorubicin: a retrospective analysis of three trials[J] Cancer. 2003;97(11):2869–2879. doi: 10.1002/cncr.11407. [DOI] [PubMed] [Google Scholar]
- 9.Bennett CL, Calhoun EA. Pharmacoeconomics of liposomal anthracycline therapy[J] Semin Oncol. 2004;31(6 Suppl 13):191–195. doi: 10.1053/j.seminoncol.2004.08.008. [DOI] [PubMed] [Google Scholar]
- 10.van Dalen EC, Michiels EM, Caron HN, et al. Different anthracycline derivates for reducing cardiotoxicity in cancer patients[J] Cochrane Database Syst Rev. 2006;(4):CD005006. doi: 10.1002/14651858.CD005006.pub2. [DOI] [PubMed] [Google Scholar]
- 11.O'Brien ME, Wigler N, Inbar M, et al. Reduced cardiotoxicity and comparable efficacy in a phase III trial of pegylated liposomal doxorubicin HCl (CAELYX/Doxil) versus conventional doxorubicin for first-line treatment of metastatic breast cancer[J] Ann Oncol. 2004;15(3):440–449. doi: 10.1093/annonc/mdh097. [DOI] [PubMed] [Google Scholar]
- 12.Markman M. Disease management of solid tumors and the emerging role of pegylated liposomal doxorubicin[J] Drugs. 1997;54(Suppl.4):1–35. [Google Scholar]
- 13.Alberts DS. Single agent pegylated liposomal doxorubicin in cancer: current status and future applications[J] Oncology. 1997;11(Suppl.11):9–67. [Google Scholar]
- 14.Lyass O, Uziely B, Ben-Yosef R, et al. Correlation of toxicity with pharmacokinetics of pegylated liposomal doxorubicin (Doxil) in metastatic breast carcinoma[J] Cancer. 2000;89(5):1037–1047. doi: 10.1002/1097-0142(20000901)89:5<1037::aid-cncr13>3.0.co;2-z. [DOI] [PubMed] [Google Scholar]
- 15.Swain SM, Whaley FS, Gerber MC, et al. Cardioprotection with dexrazoxane for doxorubicin-containing therapy in advanced breast cancer[J] J Clin Oncol. 1997;15(4):1318–1332. doi: 10.1200/JCO.1997.15.4.1318. [DOI] [PubMed] [Google Scholar]
- 16.Levine AM, Noy A, Lee JY, et al. Pegylated liposomal doxorubicin, rituximab, cyclophosphamide, vincristine, and prednisone in AIDS-related lymphoma: AIDS Malignancy Consortium Study 047[J] J Clin Oncol. 2013;31(1):58–64. doi: 10.1200/JCO.2012.42.4648. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Martino R, Perea G, Caballero MD, et al. Cyclophosphamide, pegylated liposomal doxorubicin (Caelyx), vincristine and prednisone (CCOP) in elderly patients with diffuse large B-cell lymphoma: results from a prospective phase II study[J] Haematologica. 2002;87(8):822–827. [PubMed] [Google Scholar]
- 18.Zaja F, Tomadini V, Zaccaria A, et al. CHOP-rituximab with pegylated liposomal doxorubicin for the treatment of elderly patients with diffuse large B-cell lymphoma[J] Leuk Lymphoma. 2006;47(10):2174–2180. doi: 10.1080/10428190600799946. [DOI] [PubMed] [Google Scholar]
- 19.Oki Y, Ewer MS, Lenihan DJ, et al. Pegylated liposomal doxoru-bicin replacing conventional doxorubicin in standard R-CHOP chemotherapy for elderly patients with diffuse large B-cell lymphoma: an open label, single arm, phase II trial[J] Clin Lymphoma Myeloma Leuk. 2015;15(3):152–158. doi: 10.1016/j.clml.2014.09.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Schmitt CJ, Dietrich S, Ho AD, et al. Replacement of conventional doxorubicin by pegylated liposomal doxorubicin is a safe and effective alternative in the treatment of non-Hodgkin's lymphoma patients with cardiac risk factors[J] Ann Hematol. 2011;91(3):391–397. doi: 10.1007/s00277-011-1308-y. [DOI] [PubMed] [Google Scholar]
- 21.Uziely B, Jeffers S, Isacson R, et al. Liposomal doxorubicin: antitumor activity and unique toxicities during two complementary phase I studies[J] J Clin Oncol. 1995;13(7):1777–1785. doi: 10.1200/JCO.1995.13.7.1777. [DOI] [PubMed] [Google Scholar]