Abstract
目的
观察白血病细胞分泌的基质金属蛋白酶(MMP)-2和MMP-9对脑微血管内皮细胞(BMVEC)紧密连接蛋白ZO-1、claudin-5、occludin表达及对血脑屏障(BBB)通透性的影响,探讨MMP-2和MMP-9在中枢神经系统白血病(CNSL)发病机制中的作用。
方法
①实时定量PCR检测SHI-1、HL-60、U937细胞MMP-2、MMP-9基因的转录水平;明胶酶谱法检测细胞培养上清中MMP-2和MMP-9蛋白表达;体外穿膜实验观察各白血病细胞株的侵袭能力。②将原代人BMVEC接种于铺有Matrigel胶和纤维黏连蛋白包被的Transwell小室系统中,建立体外BBB模型。将蛋白酶抑制剂GM6001处理或未处理的SHI-1、HL-60、U937细胞或MMP-2/MMP-9基因沉默的SHI-1细胞接种于BBB模型的Transwell小室上层与BMVEC共培养,倒置相差显微镜观察BMVEC的形态变化,激光共聚焦显微镜观察紧密连接蛋白ZO-1、claudin-5和occludin的表达,计算白血病细胞的穿膜率。
结果
①SHI-1细胞表达较高转录水平的MMP-2和MMP-9及酶活性,且侵袭能力强于HL-60、U937细胞(P< 0.01)。②与HL-60、SHI-1和U937细胞共培养后,融合致密的BMVEC之间出现间隙、细胞呈单个生长,紧密连接蛋白ZO-1、claudin-5和occludin的表达明显下调,各白血病细胞均不同程度地穿过体外BBB进入Transwell小室下层。其中SHI-1细胞对BMVEC的形态改变及3种紧密连接蛋白的下调最为明显,穿膜率最高。GM6001明显抑制白血病细胞分泌MMP-2和MMP-9,使BMVEC的形态有所恢复,同时上调ZO-1、claudin-5和occludin的表达,降低了BBB的通透性。③用siRNA分别沉默MMP-2和MMP-9基因后,SHI-1细胞分泌MMP-2和MMP-9被抑制,SHI-1细胞穿膜率较沉默前分别下降43.64%和57.30%(P<0.01),ZO-1、claudin-5和occludin表达上调。
结论
白血病细胞株分泌的MMP-2和MMP-9能通过降解BMVEC紧密连接蛋白ZO-1、claudin-5和occludin而破坏BBB。
Keywords: HL-60细胞, U937细胞, SHI-1细胞, 血脑屏障, 基质金属蛋白酶类
Abstract
Objective
To observe the effects of matrix metalloproteinases (MMP)-2 and MMP-9 secreted by leukemic cells on tight junction proteins ZO-1, claudin-5 and occluding and the permeability of the blood-brain barrier (BBB) and explore the mechanisms of MMP-2 and MMP-9 in leukemic cell infiltration of the central nervous system (CNS).
Methods
The mRNA expressions of MMP-2 and MMP-9 in leukemic cell lines SHI-1, HL-60 and U937 were detected by quantitative RT-PCR. The MMP inhibitor GM6001 was used to inhibit the secretion of MMP-2 and MMP-9. RNA interference (RNAi) was used to knock down the expression of MMP-2 and MMP-9. Zymography was used to analyze the secretion of MMP-2 and MMP-9 in the supernatant of different leukemia cell lines treated or untreated with drugs, as well as the RNAi-treated cells. An in vitro BBB model composed of human brain microvascular endothelial cells (BMVECs) was developed on a Matrigel-based insert. Cell invasion through a barrier of Matrigel-based human basement membrane and the BMVECs-based human BBB barrier was assayed to measure the invasive capacity and the capacity to breakdown the BBB of different leukemia cell lines treated or untreated with drugs, as well as the RNAi-treated cells. The morphologic changes of BMVECs after co-culture with different leukemia cell lines treated or untreated with drugs, as well as the RNAi-treated cells in vitro BBB models were observed by invert microscopy and tight junction proteins in these BMVECs were analyzed with a laser-scanning confocal microscope.
Results
①The mRNA expression in different leukemic cell lines shown a pronounced transcription of MMP-2 and -9, and the transcriptional level in SHI-1 cells was the highest among all leukemic cell lines tested (P<0.01). The data of activities of MMP-2 and -9 were consistent with the results of mRNA expression and SHI-1 displayed higher capacity of invasion (P<0.01). ②After incubation 24h with different leukemic cells, the BMVECs disrupted to loss cell-cell contacts and grew in single cell. Confocal imaging showed down-regulations of ZO-1, claudin-5 and occluding accompanied by the disruption of BBB in vitro models. SHI-1 cells had stronger alterations to BMVECs, tight junction proteins and the permeability of the BBB than HL-60 and U937 cells. However, GM6001 and the knock-down of MMP-2 and MMP-9 altered the responses of BBB. They reduced the degradation of three tight junction proteins with a decreased permeability of BBB.
Conclusion
MMP-2 and MMP-9 secreted by leukemic cells could disrupt the BBB by degrading the tight junction proteins ZO-1, claudin-5 and occluding, which contributed the infiltration of leukemic cell into CNS.
Keywords: HL-60 cells, U937 cells, SHI-1 cells, Blood-brain barrier, Matrix metalloproteinases
随着急性白血病有效化疗的迅速发展,其完全缓解率和长期生存率逐渐提高,但由于白血病细胞受到体内某些“庇护所”的保护,多数化疗药物不易进入髓外残余白血病病灶,使之成为急性白血病复发的根源[1]。血脑屏障(BBB)的存在使中枢神经系统白血病(CNSL)成为白血病复发的重要原因之一[2]–[4]。
BBB主要由脑微血管内皮细胞(BMVEC)、紧密连接、细胞外连续的基底膜、星形胶质细胞周足等构成。其中,内皮细胞之间的紧密连接使相邻细胞两层质膜“焊接”在一起,目前已阐明紧密连接是BBB最重要的结构和功能基础[5]–[7]。紧密连接由跨膜蛋白(claudin、occludin、连接黏附分子)和胞质附着蛋白(ZO)两种成分组成,其中claudin-5、occludin及ZO-1是脑血管内皮细胞通透性调节的关键靶点,对BBB通透性起着至关重要的调节作用[6]–[8]。
基质金属蛋白酶(MMP)是一组锌依赖的蛋白水解酶,具有降解多种细胞外基质(ECM)成分的功能。以往研究表明大多数白血病细胞表达或高表达MMP-2和MMP-9,且MMP-2、MMP-9是白血病、淋巴瘤等恶性血液病预后的重要影响因素[9]–[10]。在脑缺血缺氧、恶性胶质瘤等疾病中,MMP-2和MMP-9能降解BMVEC的紧密连接蛋白和基底膜蛋白,导致血管完整性受损、BBB破坏,引起脑水肿和出血[11]–[12]。本研究中,我们建立体外BBB模型,研究白血病细胞株SHI-1、HL60和U937细胞分泌的MMP-2和MMP-9在CNSL发病机制中的作用。
材料与方法
1.细胞培养和药物处理:白血病细胞株SHI-1由本所建立[13]并保存,HL60和U937细胞为本实验室保存。SHI-1、HL60和U937细胞用含10%胎牛血清(杭州四季青生物有限公司产品)的IMDM培养基(美国Gibco公司产品),在37 °C、5%CO2、饱和湿度的培养箱中培养。取对数生长期细胞进行实验。BMVEC(美国Sciencell公司)细胞接种于铺有纤维黏连蛋白(3 mg/cm,美国Gibco公司产品)的塑料培养瓶中,用内皮细胞培养基ECM(美国Sciencell公司产品)在37 °C、5%CO2、饱和湿度条件下培养,当细胞生长至90%~100%融合时用0.25%的胰蛋白酶消化传代,取第2、3代细胞进行实验。
2.实时定量PCR(qRT-PCR)检测MMP-2和MMP-9的表达水平:收集各白血病细胞5×106个,TRIzol一步法提取总RNA。取2 µg用逆转录酶MMLV将RNA反转录为cDNA。用Primer Express 2.0设计引物和探针。用MJ Research OpticonTM2荧光定量PCR仪进行PCR检测:反应体系25 µl,包括样品cDNA、引物、探针、TaqMan通用PCR Mastermix。反应条件:95 °C 10 min、95 °C 15 s、60 °C 1 min,50个循环。以甘油醛-3-磷酸脱氢酶(GAPDH)作为内参照,基因表达量(Ct值)以2−ΔCt表示,ΔCt=CtMMP-2/MMP-9−CtGAPDH。各标本每个基因检测设定3个复孔。
3.小干扰RNA(siRNA)转染SHI-1细胞:用RNAi技术特异性沉默SHI-1细胞MMP-2、MMP-9基因。针对MMP-2、MMP-9基因的siRNA序列由上海吉玛制药技术有限公司合成。用羟基荧光素(FAM)标记的siRNA(FAM-siRNA)优化转染条件。用流式细胞术检测转染效率。根据FAM的表达筛选出达到最佳转染效率的siRNA寡聚物和Lipofectamine™2000的组合为200 pmol/µl。参照文献[14]操作。
4.明胶酶谱法分析白血病细胞培养上清中MMP-2和MMP-9的活性:各种白血病细胞株和蛋白酶抑制剂GM6001 (10 µg/ml,德国Calbiochem公司产品)处理或RNA干扰处理后的细胞分别重悬于0.1 ml无血清IMDM培养基中(2.0×105个/ml),接种于96孔板,培养24 h后收集上清。取20 µl上清经100 g/L含有1 g/L明胶的SDS-PAGE电泳后,将胶放入2.5% TritonX-100中洗涤2次(每次30 min),37 °C孵育过夜。用考马斯亮蓝R-250室温下染胶1 h后,洗脱液(10%冰醋酸、30%乙醇)洗脱3次,每次20 min。明胶酶活性可通过在蓝色背景下溶解空白带显示。在凝胶成像仪上拍摄成灰色背景的白色条带。
5.体外BBB模型的建立:用IMDM培养基将Matrigel基质胶按5∶1稀释,取50 µl加入8 µm孔径的Transwell小室,无菌条件下风干过夜成胶,并用纤维黏连蛋白包被。将小室放入24孔板中,每孔外池加入0.8 ml内皮细胞培养基,将2×104个BMVEC接种在加有内皮细胞培养基的内池。待细胞生长至完全致密融合,将异硫氰酸荧光素标记的葡聚糖(FITC-Dextran)加入内室,4 h后取培养基,用流式细胞术检测外池中有无FITC-Dextran颗粒。外池中无FITC-Dextran表明BBB模型建立成功。
6.体外侵袭和穿膜实验:用IMDM将Matrigel基质胶按1∶5稀释,取50 µl加入8 µm孔径的Transwell小室无菌条件下风干过夜成胶。将小室放入24孔板中,每孔下层加入0.8 ml含10%FBS的IMDM培养基及终浓度100 ng/ml的基质细胞衍生因子1α(SDF-1α)作为趋化因子。经GM6001孵育或未孵育的各组白血病细胞或RNA干扰处理后的SHI-1细胞分别重悬于0.2 ml含10%FBS的IMDM培养基(2×105个细胞/孔)中,接种于BBB模型上层或与完全融合的BMEVC共同接种于BBB模型上层。将小室系统放入培养箱中培养24 h后,计数穿过Matrigel或Matrigel与BMEVC共同组成的BBB移行到下层培养基中的细胞总数。穿膜率(细胞侵袭率)(%)=下层的白血病细胞数/上层接种白血病细胞数×100%。实验重复3次。
7.与白血病细胞共培养后BMEVC形态变化:在BBB模型中,将加或不加GM6001孵育的各种白血病细胞株或RNA干扰处理后的SHI-1细胞与BMEVC共培养24 h,用PBS缓冲液洗去白血病细胞,在倒置相差显微镜下观察BMEVC的形态变化。
8.激光共聚焦显微镜观察BMVEC紧密连接蛋白ZO-1、claudin-5和occludin的表达:将与各白血病细胞株共培养前后的Transwell小室上层的BMVEC用4%多聚甲醛室温固定30 min,10 g/L血清白蛋白室温封闭1 h,用0.1 mol/L PBS缓冲液漂洗后,分别加入2 µg/ml抗小鼠单抗ZO-1 (FITC标记)、3 µg/ml Claudin-5(Alexa 488标记)、2.5 µg/ml occludin(Alexa 488标记),4 °C孵育过夜。以上单抗均为美国Invitrogen公司产品。DAPI染核后加入抗荧光淬灭剂、封片。Leica激光扫描共聚焦显微镜观察。同法设定阴性对照(以PBS缓冲液替代单抗)。
9.统计学处理:采用Graphpad 4.0软件进行统计学分析。数据以x±s表示,两组间比较采用独立样本的t检验。P<0.05认为差异有统计学意义。
结果
1.MMP-2和MMP-9在白血病细胞株中的表达:qRT-PCR检测SHI-1、HL-60、U937细胞的MMP-2和MMP-9的mRNA表达水平,结果示三个细胞系均表达MMP-2和MMP-9,且SHI-1细胞的表达量高于HL-60细胞和U937细胞(P<0.01)(图1)。明胶酶谱法分析白血病细胞培养上清中MMP-2和MMP-9的活性,结果显示三种细胞均分泌一定量酶原形式的MMP-2(Pro-MMP-2)和MMP-9(Pro-MMP-9),SHI-1细胞除分泌较高水平的Pro-MMP-2和MMP-9外,还分泌一部分活化的MMP-9(图2)。
图1. 实时定量PCR检测SHI-1、HL-60、U937细胞的基质金属蛋白酶2(MMP-2)(A)、MMP-9 mRNA(B)表达.
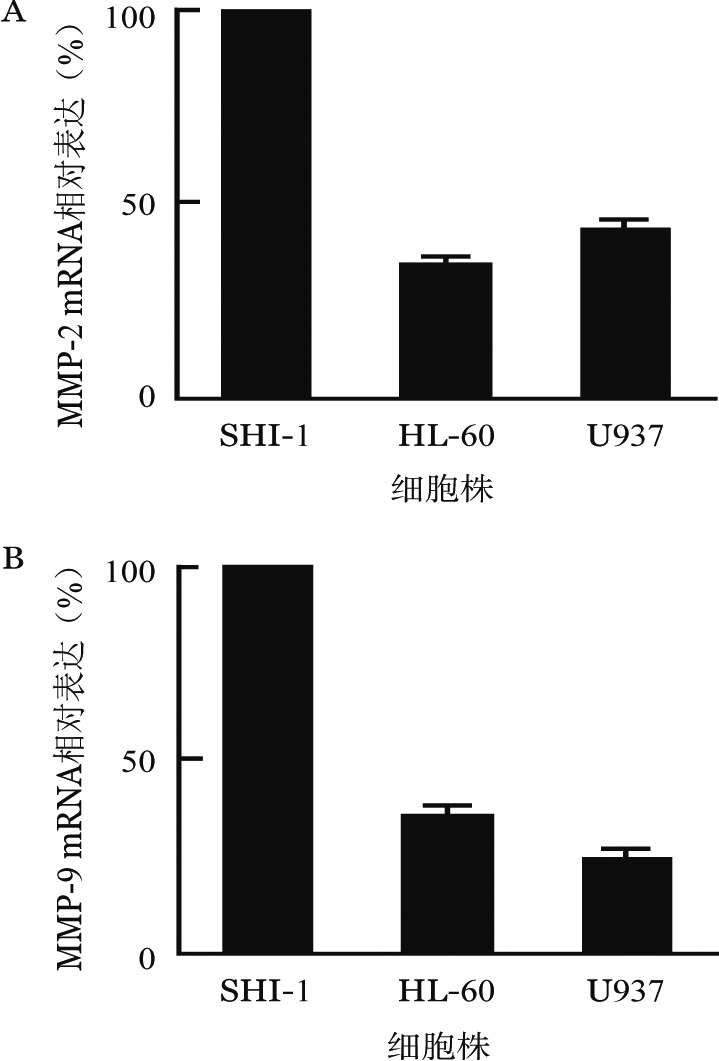
图2. 明胶酶谱法检测SHI-1、HL-60和U937细胞分泌基质金属蛋白酶2(MMP-2)和MMP-9.
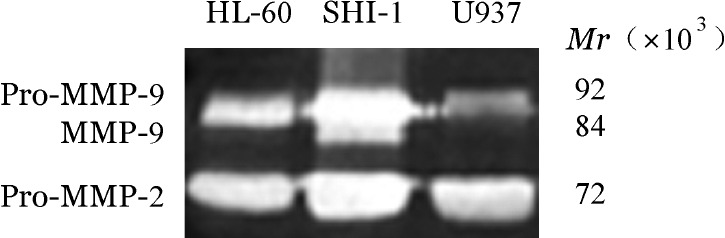
Pro-MMP-2:基质金属蛋白酶原2;Pro-MMP-9:基质金属蛋白酶原9
2.白血病细胞的侵袭力及对体外BBB通透性的影响:SHI-1、HL-60、U937细胞均能穿过人工基底膜,但穿膜数量不同,HL-60、U937的穿膜率仅为SHI-1细胞的17%~30%(图3)。
图3. 白血病细胞单独培养及GM6001处理前后与BMVEC在体外血脑屏障模型中共培养的穿膜率比较(*P< 0.01).
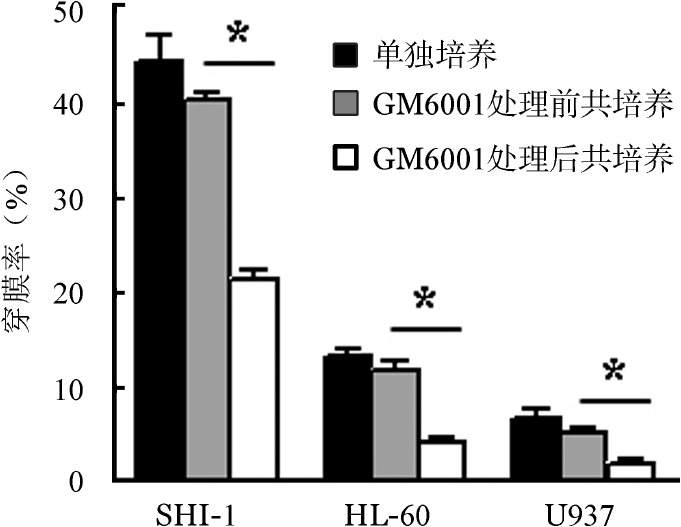
倒置相差显微镜下观察到Transwell小室上层的BMVEC生长至完全融合。流式细胞术检测小室外池中无Dextran-FITC后,将白血病细胞接种于内池中与BMVEC共培养24 h,倒置显微镜下观察到外池中出现白血病细胞,计算穿膜率。结果示均有不同数量的白血病细胞穿过BBB进入外池,SHI-1细胞的穿膜率最高(图3)。
3.蛋白酶抑制剂GM6001对白血病细胞分泌MMP-2和MMP-9及BBB模型通透性的影响:在SHI-1、HL-60和U937细胞中加入10 µg/ml蛋白酶抑制剂GM6001孵育24 h,明胶酶谱结果显示,MMP-2和MMP-9的酶活性被明显抑制(图4)。在体外BBB模型中,SHI-1、HL-60和U937细胞侵袭率即穿透BBB模型的能力较GM6001处理前明显降低(P<0.01)(图3)。
图4. 蛋白酶抑制剂GM6001处理对SHI-1(A)、HL-60(B)和U937(C)细胞分泌基质金属蛋白酶2(MMP-2)、MMP-9的影响.
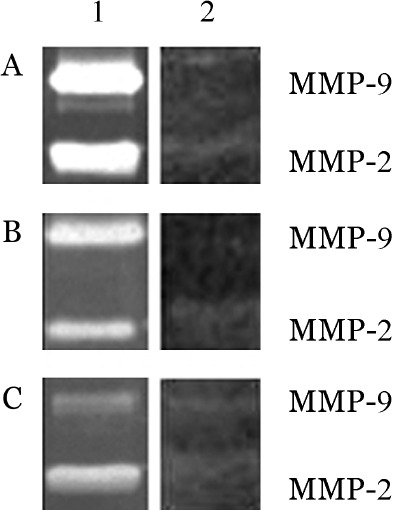
1:未经GM6001处理;2:GM6001处理
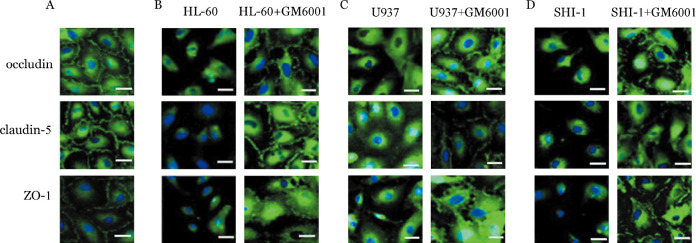
4.GM6001对BMVEC形态及紧密连接蛋白ZO-1、claudin-5和occludin表达的影响:①在BBB模型中,倒置显微镜观察到完全融合的BMVEC呈单层致密生长,细胞与细胞之间无间隙(图5A)。与白血病细胞SHI-1、HL-60、U937共培养24 h后,单层致密生长的BMVEC之间的连接被破坏,大部分细胞呈单个生长,与SHI-1细胞共培养的BMVEC均单个生长,呈不规则形态(图5B、C、D)。用蛋白酶抑制剂GM6001处理白血病细胞SHI-1、HL-60和U937后,BMVEC细胞形态变规整(细胞形状规则、细胞与细胞之间的连接大部分存在)(图6)。②激光共聚焦显微镜成像显示,单独生长的BMVEC细胞间可见连续分布的紧密连接蛋白ZO-1、claudin-5和occludin的绿色荧光(图7A);与SHI-1、HL-60和U937细胞共培养24 h后,BMVEC细胞间的ZO-1、claudin-5和occludin表达明显减少或消失。SHI-1、HL-60和U937细胞用蛋白酶抑制剂GM6001处理后,对ZO-1、claudin-5和occludin的破坏明显减轻(图7B、C、D)。
图5. SHI-1、HL-60和U937细胞对脑微血管内皮细胞(BMVEC)形态的影响.
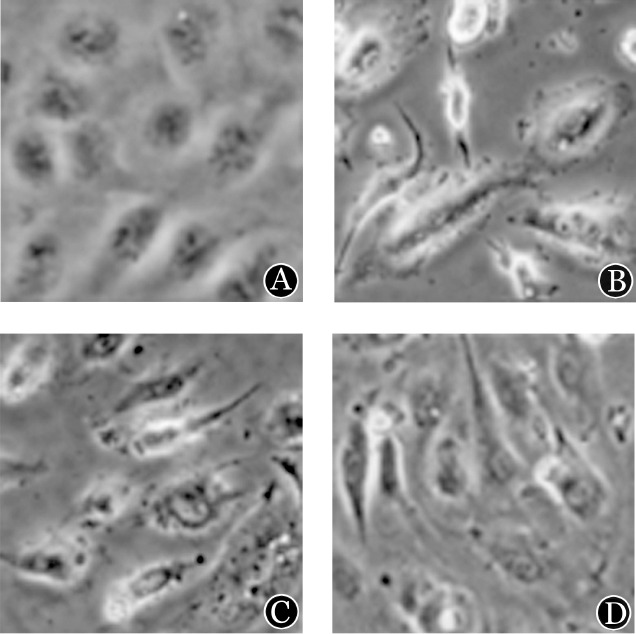
A:BMVEC呈单层致密生长,细胞与细胞之间无间隙;B:与SHI-1细胞共培养的BMVEC均单个生长,形态不规则;C:与HL-60细胞共培养的BMVEC;D:与U937细胞共培养的BMVEC
图6. 蛋白酶抑制剂GM6001减轻白血病细胞SHI-1、HL-60和U937对脑微血管内皮细胞(BMVEC)形态的影响(×560).
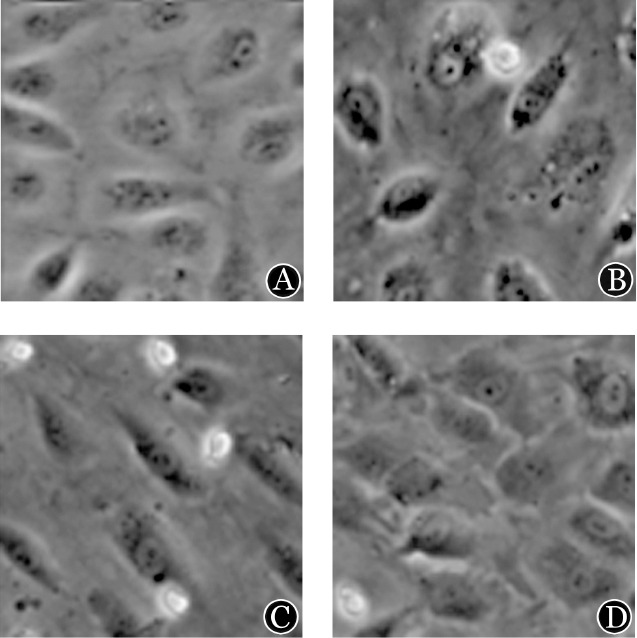
A:GM6001处理单独培养的BMVEC;B:与经GM6001处理SHI-1细胞共培养的BMVEC;C:与经GM6001处理HL-60细胞共培养的BMVEC;D:与经GM6001处理U937细胞共培养的BMVEC
图7. 激光共聚焦显微镜观察蛋白酶抑制剂GM6001减轻白血病细胞对脑微血管内皮细胞(BMVEC)紧密连接蛋白ZO-1、claudin-5和occludin的破坏.
A:未经GM6001处理正常生长的BMVEC中紧密连接蛋白ZO-1、claudin-5和occludin的表达(线性分布的绿色荧光);B、C、D分别为BMVEC与白血病细胞HL-60、U937和SHI-1共培养24 h后,细胞之间的紧密连接蛋白ZO-1、claudin-5和occludin明显破坏,细胞相互分离并出现各种不规则形态,而经GM6001处理后BMVEC之间的密连接蛋白ZO-1、claudin-5和occludin的破坏减轻,细胞形态变规整
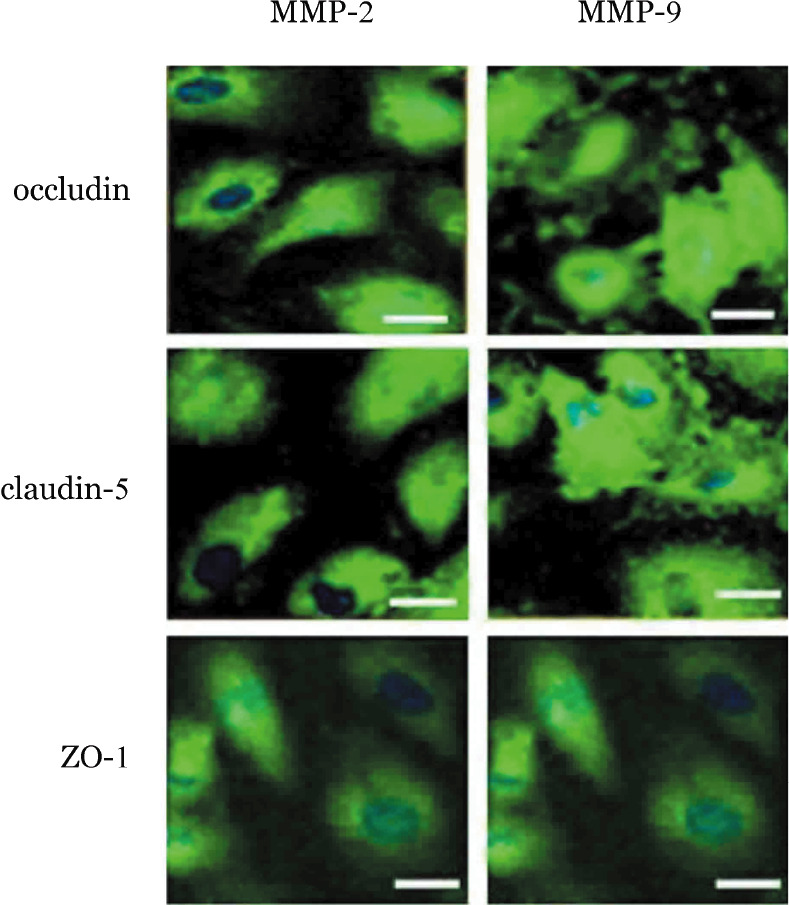
5.沉默SHI-1细胞的MMP-2和MMP-9基因对BMVEC的影响:分别沉默SHI-1细胞的MMP-2和MMP-9基因后,BMVEC的形态较前变规整(细胞形状规则、细胞与细胞之间的致密接触仅有部分破坏)。激光共聚焦显微镜成像显示,BMVEC细胞间的ZO-1、claudin-5和occludin表达较MMP-2和MMP-9沉默前明显升高(图8)。
图8. 激光共聚焦显微镜观察沉默SHI-1细胞基质金属蛋白酶2(MMP-2)、MMP-9基因对脑微血管内皮细胞(BMVEC)分泌紧密连接蛋白ZO-1、claudin-5、occludin的影响.
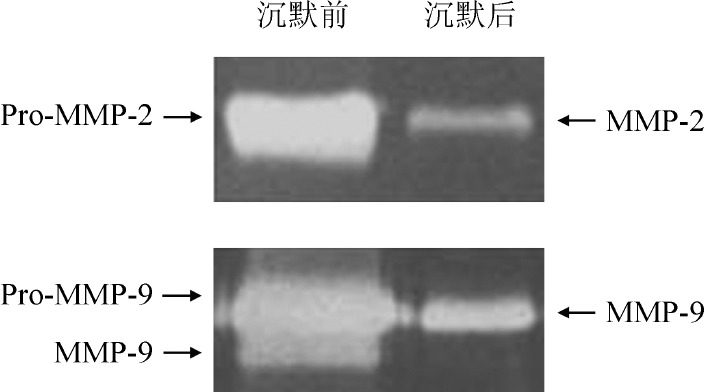
6.沉默SHI-1细胞MMP-2和MMP-9基因对BBB模型通透性的影响:我们用RNA干扰技术证实MMP-2和MMP-9的高表达在SHI-1细胞破坏BBB过程中的作用,结果表明干扰效率为60%~65%。明胶酶谱结果显示沉默MMP-2和MMP-9基因后SHI-1细胞分泌的MMP-2、MMP-9明显降低(图9)。干扰后的细胞接种于BBB模型的Transwell小室,24 h后检测其对BBB的穿膜率,结果示沉默MMP-2、MMP-9基因后SHI-1细胞穿膜率较沉默前分别下降43.64%和57.30%。
图9. 明胶酶谱法检测沉默基质金属蛋白酶2(MMP-2)、MMP-9基因后SHI-1细胞MMP-2、MMP-9的表达情况.
讨论
肿瘤细胞在侵袭、转移过程中通过分泌降解细胞外基质和某些组织屏障相关蛋白等物质(如血管生长因子、MMP等)侵入其他组织器官。其中MMP-2和MMP-9能降解细胞外胶原、层黏连蛋白、纤维连接蛋白等成分,在肿瘤血管新生中起重要作用。MMP-2和MMP-9也参与了血液肿瘤(尤其是白血病)的发展进程,其促进白血病细胞生长转移和浸润的作用亦引起重视。MMP-2和MMP-9不同水平的表达也在不同的髓系白血病细胞系中被检测到[15]。单核细胞白血病细胞表达较高的MMP-9,且与白血病细胞的体外侵袭和体内浸润密切相关[16]–[17]。本研究和本实验室以前的研究[18]–[19]也发现急性白血病细胞及多种白血病细胞株表达MMP-2和MMP-9,具有强侵袭能力的SHI-1细胞MMP-2和MMP-9的表达和分泌明显高于U937、K562和HL-60细胞[19]。
BBB是位于血液和脑组织之间的选择性通透系统。血液循环中的白血病细胞通过BMVEC及其细胞间的紧密连接后才能进入脑组织。体外BBB模型是研究BBB功能及其通透性的重要工具。体外培养的BMVEC保持了良好的紧密连接结构及功能,已成功用来建立体外BBB模型,研究药物及各种因素对BBB的通透性[20]。我们将原代培养的人BMVEC接种在铺有Matrigel胶(类似基底膜成分)的Transwell小室系统中,成功模拟BBB的屏障作用,Dextran-FITC不能通过此屏障,说明体外BBB模型建立成功。我们将白血病细胞SHI-1、HL-60和U937接种于Transwell小室上层与BMVEC共培养24 h后,原本致密接触生长的BMVEC之间出现间隙,与SHI-1共培养的BMVEC甚至出现各种不规则形态,BBB通透性增加使各白血病细胞由小室上层穿透BBB至下层,其中高表达MMP-2和MMP-9的SHI-1细胞的穿透率最高。共聚焦显微镜同时观察到经白血病细胞SHI-1、HL-60和U937作用后BMVEC细胞之间的紧密连接蛋白ZO-1、claudin-5和occludin明显下调或消失。广谱蛋白酶抑制剂GM6001能够抑制MMP-2和MMP-9的分泌,已被广泛用来研究MMP-2和MMP-9的功能[14],[21]。我们发现GM6001抑制白血病细胞SHI-1、HL-60和U937分泌的MMP-2和MMP-9后,白血病细胞对BBB模型的破坏作用明显减轻、BMVEC的形态改变较前减轻、细胞之间有更多的融合及连接,紧密连接蛋白ZO-1、claudin-5和occludin也有明显上调。以上结果表明白血病细胞分泌的MMP-2和MMP-9与BBB的破坏密切相关,MMP-2和MMP-9能够通过下调紧密连接蛋白的表达而增加BBB的通透性。
为进一步研究MMP-2和MMP-9在破坏BBB中的作用,我们用小干扰RNA沉默SHI-1细胞高表达的MMP-2和MMP-9基因,观察到SHI-1细胞沉默后MMP-2和MMP-9的分泌明显降低对BBB的破坏作用明显减轻,紧密连接蛋白ZO-1、claudin-5和occludin的表达较干扰前亦明显上调。进一步证明了MMP-2和MMP-9在CNSL中的作用。MMP-2和MMP-9除能降解基底膜外,还能通过降解紧密连接蛋白ZO-1、claudin-5和occludin而破坏BBB。
研究表明,MMP-2和MMP-9能够切割紧密连接蛋白ZO-1、claudin-5和occludin[21]–[22],但具体机制尚未阐明。有研究表明,跨膜紧密连接蛋白claudin-5和occludin的细胞外环上存在MMP-2和MMP-9的底物Ⅳ型胶原,此处可能为MMP-2和MMP-9的切割位点[20],[23]。紧密连接蛋白的破坏可致BMVEC形态的改变,有研究认为损伤的BMVEC可加重紧密连接蛋白的破坏[20]。
综上所述,本研究表明MMP-2和MMP-9与白血病细胞的CNS侵袭密切相关,MMP-2和MMP-9能够通过降解BMVEC的紧密连接蛋白ZO-1、claudin-5和occludin而增加BBB的通透性,使白血病细胞得以进入CNS,这可能是CNSL的一个重要发病机制。白血病细胞的CNS侵袭是一个复杂的动态过程,尚需要进行更深入的研究。
Funding Statement
基金项目:国家自然科学基金(30670905)
Fund program: National Natural Science Foundation of China(30670905)
References
- 1.Sunami S, Sekimizu M, Takimoto T, et al. Prognostic impact of intensified maintenance therapy on children with advanced lymphoblastic lymphoma: a report from the Japanese pediatric leukemia/lymphoma study group ALB-NHL03 study[J] Pediatr Blood Cancer. 2016;63(3):451–457. doi: 10.1002/pbc.25824. [DOI] [PubMed] [Google Scholar]
- 2.Pui CH. Central nervous system disease in acute lymphoblastic leukemia: prophylaxis and treatment[J] Hematology Am Soc Hematol Educ Program. 2006:142–146. doi: 10.1182/asheducation-2006.1.142. [DOI] [PubMed] [Google Scholar]
- 3.Montesinos P, Díaz-Mediavilla J, Debén G, et al. Central nervous system involvement at first relapse in patients with acute promyelocytic leukemia treated with all-trans retinoic acid and anthracycline monochemotherapy without intrathecal prophylaxis[J] Haematologica. 2009;94(9):1242–1249. doi: 10.3324/haematol.2009.007872. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Sakurai T, Kuroda H, Yamada M, et al. Acute promyelocytic leukemia presenting with central nervous system involvement at initial diagnosis[J] Rinsho Ketsueki. 2013;54(6):574–578. doi: 10.11406/rinketsu.54.574. [DOI] [PubMed] [Google Scholar]
- 5.Romero IA, Radewicz K, Jubin E, et al. Changes in cytoskeletal and tight junctional proteins correlate with decreased permeability induced by dexamethasone in cultured rat brain endothelial cells[J] Neurosci Lett. 2003;344(2):112–116. doi: 10.1016/S0304-3940(03)00348-3. [DOI] [PubMed] [Google Scholar]
- 6.Johnsen KB, Moos T. Revisiting nanoparticle technology for blood-brain barrier transport: Unfolding at the endothelial gate improves the fate of transferrin receptor-targeted liposomes[J] J Control Release. 2016;222:32–46. doi: 10.1016/j.jconrel.2015.11.032. [DOI] [PubMed] [Google Scholar]
- 7.Martin TA, Mansel RE, Jiang WG. Antagonistic effect of NK4 on HGF/SF induced changes in the transendothelial resistance (TER) and paracellular permeability of human vascular endothelial cells[J] J Cell Physiol. 2002;192(3):268–275. doi: 10.1002/jcp.10133. [DOI] [PubMed] [Google Scholar]
- 8.vanov AN, Puchinyan DM, Norkin IA. Vascular endothelial Barrier Function[J] Usp Fiziol Nauk. 2015;46(2):72–96. [PubMed] [Google Scholar]
- 9.Klein G, Vellenga E, Fraaije MW, et al. The possible role of matrix metalloproteinase (MMP)-2 and MMP-9 in cancer, e.g. acute leukemia[J] Crit Rev Oncol Hematol. 2004;50(2):87–100. doi: 10.1016/j.critrevonc.2003.09.001. [DOI] [PubMed] [Google Scholar]
- 10.Hatfield KJ, Reikvam H, Bruserud Ø. The crosstalk between the matrix metalloprotease system and the chemokine network in acute myeloid leukemia[J] Curr Med Chem. 2010;17(36):4448–4461. doi: 10.2174/092986710794183033. [DOI] [PubMed] [Google Scholar]
- 11.Yang Y, Estrada EY, Thompson JF, et al. Matrix metalloproteinase-mediated disruption of tight junction proteins in cerebral vessels is reversed by synthetic matrix metalloproteinase inhibitor in focal ischemia in rat[J] J Cereb Blood Flow Metab. 2007;27(4):697–709. doi: 10.1038/sj.jcbfm.9600375. [DOI] [PubMed] [Google Scholar]
- 12.Bauer AT, Bürgers HF, Rabie T, et al. Matrix metalloproteinase-9 mediates hypoxia-induced vascular leakage in the brain via tight junction rearrangement[J] J Cereb Blood Flow Metab. 2010;30(4):837–848. doi: 10.1038/jcbfm.2009.248. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Chen S, Xue Y, Zhang X, et al. A new human acute monocytic leukemia cell line SHI-1 with t(6;11) (q27;q23), p53 gene alterations and high tumorigenicity in nude mice[J] Haematologica. 2005;90(6):766–775. [PubMed] [Google Scholar]
- 14.Ries C, Egea V, Karow M, et al. MMP-2, MT1-MMP, and TIMP-2 are essential for the invasive capacity of human mesenchymal stem cells: differential regulation by inflammatory cytokines[J] Blood. 2007;109(9):4055–4063. doi: 10.1182/blood-2006-10-051060. [DOI] [PubMed] [Google Scholar]
- 15.Shibakura M, Niiya K, Kiguchi T, et al. Simultaneous induction of matrix metalloproteinase-9 and interleukin 8 by all-trans retinoic acid in human PL-21 and NB4 myeloid leukaemia cells[J] Br J Haematol. 2002;118(2):419–425. doi: 10.1046/j.1365-2141.2002.03723.x. [DOI] [PubMed] [Google Scholar]
- 16.Paupert J, Mansat-De Mas V, Demur C, et al. Cell-surface MMP-9 regulates the invasive capacity of leukemia blast cells with monocytic features[J] Cell Cycle. 2008;7(8):1047–1053. doi: 10.4161/cc.7.8.5645. [DOI] [PubMed] [Google Scholar]
- 17.Reikvam H, Hatfield KJ, Oyan AM, et al. Primary human acute myelogenous leukemia cells release matrix metalloproteases and their inhibitors: release profile and pharmacological modulation[J] Eur J Haematol. 2010;84(3):239–251. doi: 10.1111/j.1600-0609.2009.01382.x. [DOI] [PubMed] [Google Scholar]
- 18.李 晟, 陈 子兴, 王 玮, et al. 明胶酶A在急性白血病细胞中的表达及其对髓外浸润的意义[J] 苏州大学学报(医学版) 2003;23(3):321–323. doi: 10.3969/j.issn.1673-0399.2003.03.024. [DOI] [Google Scholar]
- 19.Wang C, Chen Z, Li Z, et al. The essential roles of matrix metalloproteinase-2, membrane type 1 metalloproteinase and tissue inhibitor of metalloproteinase-2 in the invasive capacity of acute monocytic leukemia SHI-1 cells[J] Leuk Res. 2010;34(8):1083–1090. doi: 10.1016/j.leukres.2010.01.016. [DOI] [PubMed] [Google Scholar]
- 20.Wang W, Dentler WL, Borchardt RT. VEGF increases BMEC monolayer permeability by affecting occludin expression and tight junction assembly[J] Am J Physiol Heart Circ Physiol. 2001;280(1):H434–440. doi: 10.1152/ajpheart.2001.280.1.H434. [DOI] [PubMed] [Google Scholar]
- 21.Haseloff RF, Dithmer S, Winkler L, et al. Transmembrane proteins of the tight junctions at the blood-brain barrier: structural and functional aspects[J] Semin Cell Dev Biol. 2015;38:16–25. doi: 10.1016/j.semcdb.2014.11.004. [DOI] [PubMed] [Google Scholar]
- 22.Fujimoto M, Takagi Y, Aoki T, et al. Tissue inhibitor of metalloproteinases protect blood-brain barrier disruption in focal cerebral ischemia[J] J Cereb Blood Flow Metab. 2008;28(10):1674–1685. doi: 10.1038/jcbfm.2008.59. [DOI] [PubMed] [Google Scholar]
- 23.Lischper M, Beuck S, Thanabalasundaram G, et al. Metalloproteinase mediated occludin cleavage in the cerebral microcapillary endothelium under pathological conditions[J] Brain Res. 2010;1326:114–127. doi: 10.1016/j.brainres.2010.02.054. [DOI] [PubMed] [Google Scholar]