Abstract
目的
提高对副肿瘤性自身免疫多器官综合征(PAMS)的诊疗水平。
方法
对1例滤泡淋巴瘤(FL)合并PAMS且肺受累患者的诊治过程进行回顾性分析,并通过文献复习总结PAMS患者的临床特征。
结果
患者,女,49岁,主要临床症状为口腔、阴道溃疡,干咳、憋气。影像学提示多发淋巴结肿大。腹股沟淋巴结活检病理学检查提示为FL。应用糖皮质激素和沙利度胺治疗后口腔、阴道溃疡好转,呼吸困难进行性加重;给予R-CHOP(利妥昔单抗、环磷酰胺、表柔比星、长春地辛、泼尼松)方案6个疗程治疗后FL部分缓解,但呼吸困难无明显改善。
结论
原因不明的口腔黏膜损害伴有与胸部影像学改变不相称的呼吸困难时,需高度怀疑PAMS,同时应积极寻找其伴发肿瘤。早期诊断并完整切除肿瘤是PAMS治疗关键。
Keywords: 天疱疮, 淋巴瘤,滤泡性, 闭塞性细支气管炎, 副肿瘤性自身免疫多器官综合征
Abstract
Objective
To broaden our knowledge of para-neoplastic autoimmune multi-organ syndrome (PAMS).
Methods
A patient with PAMS associated with follicular lymphoma and bronchiolitis obliterans treated in our hospital was retrospectively analyzed and the clinical features of PAMS were reviewed.
Results
A 49-year-old female patient suffered from painful ulcers in the oral cavity and vagina, dry cough and dyspnea. Imaging examinations suggested multiple lymph node enlargements. Inguinal lymph node biopsy revealed follicular lymphoma. Although the oral and vaginal ulcers went into remission with glucocorticoid and thalidomide therapy and follicular lymphoma gained partial remission with six cycles of R-CHOP (rituximab, cyclophosphamide, doxorubicin, vincristine, prednisolone) chemotherapy, respiratory failure still progressed.
Conclusion
PAMS should be considered in patients with unexplained oral mucosa ulcers and dyspnea, which didn't match with the chest image manifestations. Extensive work-up should be performed to find out the potential tumor after diagnosis of PAMS. Early diagnosis and complete removal of tumor were essential to PAMS treatment.
Keywords: Pemphigus; Lymphoma, follicular; Bronchiolitis obliterans; Para-neoplastic autoimmune multi-organ syndrome
副肿瘤天疱疮(paraneoplastic pemphigus,PNP)/副肿瘤性自身免疫多器官综合征(paraneoplastic autoimmune multiorgan syndrome,PAMS)是一种罕见的自身免疫性皮肤黏膜疾病,伴发于淋巴组织增殖性疾病或良恶性肿瘤[1]。体液免疫及细胞免疫均参与其发病[2]。临床上以痛性口腔黏膜炎为突出表现,伴多形皮损,少数患者发生闭塞性细支气管炎(bronchiolitis obliterans,BO)。患者皮肤及黏膜病变通过接受有效的肿瘤治疗后一般可愈合,接受糖皮质激素联合免疫抑制剂治疗亦有一定获益,但肺损伤不可逆,接受针对肿瘤手术或药物治疗均无效,肺移植是唯一有效的手段。现报告1例滤泡淋巴瘤(FL)合并PAMS且肺受累患者的临床资料,并通过文献复习总结PAMS临床特征,以提高临床医师对该病的诊疗水平。
病例资料
患者,女,49岁。因“口腔溃疡9个月,干咳、喘憋5个月”于2015年11月25日入住我院。患者2015年3月无诱因出现痛性口腔黏膜溃疡,2015年7月口腔黏膜损害加重,出现阴道痛性溃疡,伴干咳、喘憋、盗汗,无发热、眼痛、关节痛或皮疹。针刺试验阴性,红细胞沉降率41 mm/1 h,C反应蛋白8.86 mg/L,血清结核抗体阴性。在外院诊断为“白塞病”,于2015年10月4日起接受甲泼尼龙40 mg/d × 19 d(静脉滴注),泼尼松45 mg/d ×7 d(口服),泼尼松40 mg/d ×26 d(口服),同时口服沙利度胺,口腔、外阴溃疡愈合,呼吸困难进行性加重。近半年体重下降15 kg。既往史:黄疸型肝炎、2型糖尿病。
入院查体:血氧饱和度(SpO2)91%(自然状态),体表面积1.482 m2,无口腔、外阴溃疡或皮疹,双肺吸气相可闻及弥漫分布的开瓣音,未闻及干湿啰音,心、腹未见异常。血常规:WBC 4.82×109/L,中性粒细胞73.2%,HGB 95 g/L(小细胞低色素),PLT 269×109/L。血β2微球蛋白1.410 mg/L;血LDH 185 U/L;血清铁蛋白5 µg/L;抗核抗体1∶160;HLA-B5、抗BP180抗体、Dsg-3、Dsg-1、抗中性粒细胞胞质抗体(ANCA)阴性。T、B淋巴细胞亚群:B细胞绝对值为0, CD4+细胞绝对值为0.584×109/L,CD4+/CD8+细胞比值为4.58。NT-proBNP、心肌酶谱、心电图、超声心动图未见异常。血气分析(自然状态):pH 7.369,PCO2 49.0 mmHg(1 mmHg=0.133 kPa),PO2 68.0 mmHg,HCO3− 27.6 mmol/L,SpO2 91.9%,cLac 1.8 mmol/L。呼气NO浓度:21 ppb。肺功能检查:重度阻塞性通气功能障碍(FEV1 0.45/21.8%,FEV 1%,FVC 38.95%),弥散功能正常,舒张试验阴性(图1)。喉镜未见异常。肺动脉CT血管造影术检查未见异常。胸部高分辨CT+气道三维重建检查示双肺多发支气管轻度扩张(图2)。超声检查示右颈及锁骨上窝、双腋窝、双侧腹股沟多发肿大淋巴结。腹盆增强CT检查:空肠近段软组织占位(5.7 cm×5.5 cm),淋巴瘤可能。PET-CT:L2-3水平肠系膜根部代谢轻度增高团块(7.7 cm × 4.2 cm×5.5 cm, SUV值3.5);L3-5椎体前方片状软组织影,包绕血管,代谢轻度增高;肠系膜上及双侧腹股沟多组肿大淋巴结,代谢稍增高;伴骨髓弥漫代谢轻度增高及脾大,不除外血液系统恶性病变可能。脑脊液压力145 mmH2O(1 mmH2O=9.807 Pa),脑脊液常规、生化、细胞学正常。骨髓象:增生活跃,粒红比0.96∶1,淋巴细胞比例正常,部分淋巴细胞可见核畸形,可见切迹,胞质量极少。骨髓活检病理学检查:符合低级别惰性B细胞性淋巴瘤累及。右侧腹股沟淋巴结活检病理学检查(图3):符合非霍奇金淋巴瘤,滤泡型,WHOⅠ级;免疫组化:AE1/AE3(−),CD138(散在+),CD20(++),CD21(生发中心+),CD3(+),CD31(+),CD38(散在+),CD79α(+),Ki-67(指数20%),Bcl-2(+)。淋巴结活检基因重排结果:TCRβ(+)[Vβ+ Jβ1/2(−),Vβ+ Jβ2(+),Dβ+Jβ1/2(−)];TCRδ(+)[Vδ+Dδ+Jδ(+)];TCRγ(−)[Vγ1-8,Vγ10+ multiple Jγregions(−);Vγ9,Vγ11 + multiple Jγregions(−)];IgH(+)[VH-FR1+JH Consensus(+);VH-FR2+JH Consensus(+);VH-FR3 + JH Consensus(+);DH+JH Consensus(−);DH7+JH Consensus(−)];IgK(+)[Vκ+Jκ(+);Vκand intron+ Kde(+)];IgL(−)[Vλ+Jλ(−)]。诊断为FL(WHO Ⅰ级),黏膜损害考虑为PAMS可能性大,呼吸困难考虑为PAMS合并BO所致。2016年1月至7月患者共接受6个疗程R-CHOP(利妥昔单抗、环磷酰胺、表柔比星、长春地辛、泼尼松)方案化疗,期间于4月27日出现纵隔及皮下气肿,经保守治疗,3个月后气肿吸收,但仍存在憋气。化疗后患者浅表淋巴结明显缩小,增强CT检查评估病情为部分缓解,但患者呼吸困难无明显改善,末次随访为2016年7月13日,患者仍需鼻导管吸氧2 L/min, SpO2 97%。
图1. 肺功能检查示患者重度阻塞性通气功能障碍.
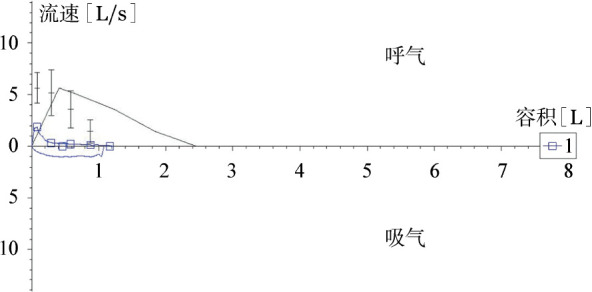
图2. 胸部高分辨CT+气道三维重建检查示患者双肺多发支气管轻度扩张.
A:胸部高分辨CT肺窗;B:胸部高分辨CT肺窗;C:气道三维重建
图3. 患者右侧腹股沟淋巴结活检组织行免疫组化染色(低倍).
A:CD20;B:Bcl-2;C:CD79a
讨论及文献复习
PNP是在1990年由Anhalt等[1]首先描述的一种罕见的与肿瘤伴发的自身免疫性皮肤黏膜疾病。其发病机制尚未完全明确,体液免疫及细胞免疫均参与其中,且后者为甚[2]。此概念提出后20年内仅450例文献报道,好发年龄为45~70岁,亦有报道发生于儿童,男性较女性多见[3]。除皮肤黏膜损害外,PNP可累及多种内脏器官。因此,近年来提出PAMS这一名词,以更全面地概括该疾病的临床表现和免疫病理学特征的异质性。
PAMS伴发肿瘤以非霍奇金淋巴瘤(NHL)、Castleman病、慢性淋巴细胞白血病(CLL)等血液系统疾病为主。Kaplan等[4]纳入163例PAMS患者进行研究,结果显示84%的PAMS与血液系统疾病相关,前3位依次为NHL(38.6%)、CLL(18.4%)、Castleman病(18.4%);Lehman等[5]纳入208例PAMS患者进行研究,结果显示前3位依次为Castleman病(38.9%)、NHL(37.5%)、CLL (14.4%)。而PAMS伴发的NHL者89%为B细胞淋巴瘤,且以惰性淋巴瘤为主。Keiko等[6]对56例NHL伴发PAMS患者进行研究,结果显示CLL占43%、FL占27%、弥漫大B细胞淋巴瘤占5%。本研究为1例FL患者,为PAMS相对多见的伴发肿瘤之一。
临床上,广泛、严重的痛性口腔黏膜糜烂或溃疡为PAMS的突出表现,且通常为首发症状。其他部位如眼结膜、外阴、扁桃体、咽喉部,甚至胃肠道黏膜亦可受累。PAMS皮损多形,可有天疱疮样、类天疱疮样、多形红斑样、移植物抗宿主样和扁平苔藓样皮损。皮损常出现在口腔黏膜损害之后,初为局限性,以后可泛发全身,以头颈部、前胸后背和肢体近端为主。
除皮肤黏膜受累之外,PAMS亦可累及其他脏器,30%的PAMS患者出现肺损伤。PAMS合并BO最常见的伴发疾病依次为Castleman病(71.2%)、淋巴瘤(18.6%)[7]。但FL同时出现PAMS和BO实属罕见。国外文献曾报道19例FL合并PAMS,其中仅4例出现BO[6],[8]–[10](表1)。其机制一方面为免疫球蛋白或补体沉积于支气管柱状上皮,另一方面,对PNP患者尸检发现其肺组织CD8+T淋巴细胞、NK细胞全层浸润,而无B细胞浸润,提示T细胞介导的细胞毒性亦在肺损伤中起重要作用[11]。以上免疫介导的损伤使气道黏膜柱状上皮脱落,阻塞小气道,从而出现BO。其临床表现为干咳、呼吸困难;血气分析可见血氧饱和度降低和二氧化碳分压增高;肺功能检查常提示阻塞性通气功能障碍;CT扫描可见双肺多发支气管扩张,有时可观察到弥漫性空气潴留征象;支气管活检提示呼吸道纤毛柱状上皮与基底细胞层剥离,黏膜下层炎症细胞浸润,进而堵塞细支气管腔[12]。BO通常发生在病程晚期,进展快,最终出现致命性呼吸衰竭,文献报道的出现BO的4例FL患者中3例在诊断BO 6~7个月后死于呼吸衰竭。
表1. 合并副肿瘤性自身免疫多器官综合征(PAMS)及闭塞性细支气管炎(BO)的4例滤泡淋巴瘤(FL)患者的主要临床特征.
| 参考文献 | 年龄(岁) | 性别 | FL分级 | PAMS诊断时间 | BO诊断时间 | 治疗 | 疗效 | 转归 |
| [6] | 65 | 女 | FLⅢ级 | 与肿瘤同时发现 | PAMS诊断5个月后 | 诊断BO前:R-CHOP→R单药→R-CVP诊断BO后:放弃治疗 | 肿瘤缩小,黏膜、皮肤损害好转,BO不详 | 不详 |
| [8] | 64 | 女 | FLⅠ级 | 与肿瘤同时发现 | PAMS诊断2个月后 | 诊断BO前:泼尼松1 mg·kg−1·d−1诊断BO后:甲泼尼龙500 mg/d ×3 d、双重滤过血浆成分分离4次,IVIG、环孢素A | 肿瘤稳定,皮肤损害好转,黏膜损害、BO无效, | 出现BO后7个月死亡 |
| [9] | 63 | 女 | FL | 发现肿瘤后10年 | 与PAMS同时诊断 | 诊断BO前:丁苯酸氮芥、长春新碱、泼尼松诊断BO后:泼尼松、硫唑嘌呤、支气管扩张剂 | BO无效 | 出现BO后6个月死亡 |
| [10] | 60 | 男 | FL | 与肿瘤同时发现 | PAMS诊断近3个月时 | 诊断BO前:R单药8个疗程诊断BO后:8次血浆置换×8、IVIG、R-CVP 1个疗程、R+苯达莫司汀2个疗程 | 肿瘤缩小,黏膜、皮肤损害好转,BO无效 | 出现BO后7个月死亡 |
注:R:利妥昔单抗;C:环磷酰胺;H:阿霉素;O:长春新碱;P:泼尼松;V:长春新碱;IVIG:静脉用丙种球蛋白
此外,也有报道肾小球、膀胱、肌肉中检测出PAMS抗体沉积,但这些患者中尚未发现与上述检测结果相关的器官功能障碍的证据[13]。
PAMS皮肤黏膜损害病理学特征包括基底细胞层上棘细胞松解、表皮内个别角质形成细胞坏死、基底细胞液化变性、真皮浅层致密以淋巴细胞为主的浸润、真皮浅层血管扩张等。其中基底细胞层上棘细胞松解及表皮内角质形成细胞坏死是诊断的重要线索。
PAMS免疫学特征是患者血清中存在能识别复层鳞状上皮、移行柱状上皮和单层上皮蛋白的自身抗体。表现为皮损直接免疫荧光(direct immunofluorescence, DIF)检查可见到IgG、C3在表皮细胞间沉积;以鳞状上皮或移行上皮切片为底物的间接免疫荧光(indirect immunofluorescence, IIF)检查可见患者血样中循环抗体与之结合;以大鼠膀胱为底物行IIF检查可见鼠膀胱上皮棘细胞间荧光,其特异性及敏感性高。免疫沉淀/免疫印迹检查可见患者血清中的自身抗体可识别桥粒黏附斑蛋白家族的多种成分,以包斑蛋白(envoplakin,相对分子质量210×103)及周斑蛋白(periplakin,相对分子质量190×103)最为特异。
结合临床表现、病理、DIF、IIF和免疫共沉淀法可对PNP/PAMS做出诊断。2011年Czernik等[3]提出的诊断标准中,主要条件为:①多形黏膜皮肤损害;②痛性、持续性口腔炎;③呼吸系统受累;④肿瘤;⑤抗桥粒黏附斑蛋白抗体(免疫沉淀或蛋白免疫印迹法):190×103的周斑蛋白、210×103的壳斑蛋白或桥粒蛋白Ⅱ。次要条件为:①皮肤棘层松解;②表皮下裂隙;③DIF检查示细胞间或基底膜染色模式;④IIF检查示患者血样与鼠的膀胱上皮细胞发生反应;⑤无与抗Dsg1或Dsg3抗体相关的皮肤黏膜病。将呼吸系统受累列入主要条件中,强调其除黏膜皮肤之外可出现多器官受累的特性,且肺损伤相对多见。
2012年Leger等[14]提出的诊断标准包括:①皮肤和(或)黏膜损害:寻常天疱疮样、多形性红斑样、大疱性类天疱疮样、扁平苔藓样;②与常合并PAMS的肿瘤或淋巴系统增殖性疾病相关;③组织病理学:棘层松解、上皮内水疱、角质形成细胞坏死和(或)真皮表皮连接处小淋巴细胞炎性浸润;④DIF:IgG和(或)C3在受累皮肤棘细胞间和(或)基底膜带的沉积处沉积;⑤以鳞状上皮或移行上皮切片为底物的IIF:患者血样中循环抗体与之结合;⑥以鼠的膀胱上皮细胞为底物的IIF:患者血样中循环抗体与之结合;⑦蛋白免疫印迹法:识别一种及以上蛋白:桥粒蛋白Ⅰ、大疱性类天疱疮抗原、壳斑蛋白、桥粒蛋白Ⅱ、周斑蛋白、α2-巨球蛋白样蛋白。要求7条中满足4条即可诊断。表明PAMS可仅出现黏膜损害或仅出现皮肤损害。
本例患者仅有黏膜损害而无典型皮损,获取病变部位组织进行病理学检查并行DIF法检查,对其诊断价值高,但较为遗憾,该患者入院时黏膜损害已愈合,入院后送检IFF查抗体阴性,可能与外院使用激素及沙利度胺相关,但患者FL诊断明确,并先后出现口腔、外阴黏膜病变及呼吸困难,且肺功能和胸部CT支持BO的诊断,从临床角度诊断考虑为PAMS。文献也有报道血清学检查阴性的PAMS[2],推测其一方面是由于诊断标准中的所有条目不可能在疾病一开始即完全展露;另一方面可能与治疗用药相关,血清抗体减少至不能检出。
治疗方面,主要包括伴发肿瘤治疗、皮肤黏膜损害治疗及受累器官并发症治疗。皮肤黏膜损害可在手术完整切除肿瘤后得到改善[15];对于不能切除的肿瘤,针对原发病的治疗通常效果不佳,大剂量激素与环孢素A、硫唑嘌呤、环磷酰胺等免疫调节剂联合应用可能改善皮肤黏膜症状[3]。亦有报道采用利妥昔单抗治愈皮肤黏膜损伤[10]。阿伦单抗(alemtuzumab)是一种CD52单抗,可同时抑制T细胞及B细胞,免疫抑制效应强,有报道显示可使PAMS患者黏膜皮肤损害愈合[3]。围手术期给予免疫球蛋白阻断循环中自身抗体可显著降低严重BO的发病风险[15]。但肺损伤一旦发生则不可逆,不仅对药物治疗无反应,即便肿瘤切除后仍会继续进展[3],肺移植是唯一可能有效的治疗方法。
PAMS预后差,病死率高,主要死因为败血症、呼吸衰竭或潜在肿瘤。合并BO预后更差,Nikolskaia等[16]总结了28例合并PAMS的Castleman病患者资料,肺受累的26例患者中22例死于由BO引发的呼吸衰竭。
原因不明的口腔黏膜损害,伴与胸部影像学所见改变不相称的呼吸困难时,需高度怀疑PAMS。即便暂时不能完全符合PAMS诊断标准,也有必要积极重复病变黏膜活检、DIF、IIF和免疫共沉淀等检查以协助明确诊断,并积极寻找其伴发肿瘤。早期诊断,并行完整肿瘤切除术对预后意义重大。
References
- 1.Anhalt GJ, Kim SC, Stanley JR, et al. Paraneoplastic pemphigus. An autoimmune mucocutaneous disease associated with neoplasia[J] N Engl J Med. 1990;323(25):1729–1735. doi: 10.1056/NEJM199012203232503. [DOI] [PubMed] [Google Scholar]
- 2.Cummins DL, Mimouni D, Tzu J, et al. Lichenoid paraneoplastic pemphigus in the absence of detectable antibodies[J] J Am Acad Dermatol. 2007;56(1):153–159. doi: 10.1016/j.jaad.2006.06.007. [DOI] [PubMed] [Google Scholar]
- 3.Czernik A, Camilleri M, Pittelkow MR, et al. Paraneoplastic autoimmune multiorgan syndrome: 20 years after[J] Int J Dermatol. 2011;50(8):905–914. doi: 10.1111/j.1365-4632.2011.04868.x. [DOI] [PubMed] [Google Scholar]
- 4.Kaplan I, Hodak E, Ackerman L, et al. Neoplasms associated with paraneoplastic pemphigus: a review with emphasis on non-hematologic malignancy and oral mucosal manifestations[J] Oral Oncol. 2004;40(6):553–562. doi: 10.1016/j.oraloncology.2003.09.020. [DOI] [PubMed] [Google Scholar]
- 5.Lehman VT, Barrick BJ, Pittelkow MR, et al. Diagnostic imaging in paraneoplastic autoimmune multiorgan syndrome: retrospective single site study and literature review of 225 patients[J] Int J Dermatol. 2015;54(4):424–437. doi: 10.1111/ijd.12603. [DOI] [PubMed] [Google Scholar]
- 6.Morikawa K, Tsuji T, Yamasaki H, et al. Paraneoplastic pemphigus occurs most commonly in indolent B cell lymphoma[J] Acta Haematol. 2014;132(1):73–74. doi: 10.1159/000357109. [DOI] [PubMed] [Google Scholar]
- 7.Lee J, Bloom R, Amber KT. A Systematic Review of Patients with Mucocutaneous and Respiratory Complications in Paraneoplastic Autoimmune Multiorgan Syndrome: Castleman's Disease is the Predominant Malignancy[J] Lung. 2015;193(4):593–596. doi: 10.1007/s00408-015-9732-8. [DOI] [PubMed] [Google Scholar]
- 8.Kanaoka M, Matsukura S, Ishikawa H, et al. Paraneoplastic pemphigus associated with fatal bronchiolitis obliterans and appearance of anti-BP180 antibodies in the late stage of the disease[J] J Dermatol. 2014;41(7):628–630. doi: 10.1111/1346-8138.12521. [DOI] [PubMed] [Google Scholar]
- 9.Gudi VS, Ormerod AD, Weir J, et al. Severe breathlessness, mouth ulcers and skin blistering in a female[J] Eur Respir J. 2004;24(5):884–887. doi: 10.1183/09031936.04.00023204. [DOI] [PubMed] [Google Scholar]
- 10.Hirano T, Higuchi Y, Yuki H, et al. Rituximab monotherapy and Rituximab-containing chemotherapy were effective for paraneoplastic pemphigus accompanying follicular lymphoma, but not for subsequent bronchiolitis obliterans[J] J Clin Exp Hematop. 2015;55(2):83–88. doi: 10.3960/jslrt.55.83. [DOI] [PubMed] [Google Scholar]
- 11.Takahashi M, Shimatsu Y, Kazama T, et al. Paraneoplastic pemphigus associated with bronchiolitis obliterans[J] Chest. 2000;117(2):603–607. doi: 10.1378/chest.117.2.603. [DOI] [PubMed] [Google Scholar]
- 12.Nousari HC, Deterding R, Wojtczack H, et al. The mechanism of respiratory failure in paraneoplastic pemphigus[J] N Engl J Med. 1999;340(18):1406–1410. doi: 10.1056/NEJM199905063401805. [DOI] [PubMed] [Google Scholar]
- 13.Nguyen VT, Ndoye A, Bassler KD, et al. Classification, clinical manifestations, and immunopathological mechanisms of the epithelial variant of paraneoplastic autoimmune multiorgan syndrome: a reappraisal of paraneoplastic pemphigus[J] Arch Dermatol. 2001;137(2):193–206. [PubMed] [Google Scholar]
- 14.Leger S, Picard D, Ingen-Housz-Oro S, et al. Prognostic factors of paraneoplastic pemphigus[J] Arch Dermatol. 2012;148(10):1165–1172. doi: 10.1001/archdermatol.2012.1830. [DOI] [PubMed] [Google Scholar]
- 15.Zhang J, Qiao QL, Chen XX, et al. Improved outcomes after complete resection of underlying tumors for patients with paraneoplastic pemphigus: a single-center experience of 22 cases[J] J Cancer Res Clin Oncol. 2011;137(2):229–234. doi: 10.1007/s00432-010-0874-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Nikolskaia OV, Nousari CH, Anhalt GJ, et al. Paraneoplastic pemphigus in association with Castleman's disease[J] Br J Dermatol. 2003;149(6):1143–1151. doi: 10.1111/j.1365-2133.2003.05659.x. [DOI] [PubMed] [Google Scholar]




