Abstract
目的
研究microRNA-202(miR-202)对多发性骨髓瘤(MM)细胞生长的影响,并初步探讨miR-202在MM细胞药物敏感性中的作用机制。
方法
荧光定量PCR检测miR-202及其靶基因B淋巴细胞刺激因子(BAFF)在MM细胞中的表达水平。将miR-202模拟物、miR-202抑制物、BAFF干扰质粒(siBAFF)及其阴性对照转染U266细胞,Western blot检测Bcl-2家族和MAPK信号通路蛋白的表达。WST-1法、流式细胞术(Annexin V-FLUOS)分别检测转染后U266细胞的增殖和凋亡情况。
结果
U266细胞、MM患者CD138+细胞中miR-202 mRNA表达(分别为0.052±0.009、0.304±0.354)均低于健康对照组(3.550±1.126)(P<0.001,P=0.009),BAFF表达水平(5.700±0.734、9.576±2.887)均高于健康对照组(1.819±0.853)(P<0.001,P=0.006)。miR-202模拟物转染组细胞增殖抑制率高于对照组[(56.04±0.02)%对(18.89±0.32)%,P=0.002]。Western blot结果显示,转染miR-202模拟物后,U266细胞Bcl-2表达下调约24%,而Bax蛋白的表达上调约1.24倍,miR-202模拟物组细胞凋亡率高于对照组[(49.60 ± 4.89)%对(26.20 ± 1.28)%,P=0.029]。硼替佐米和miR-202模拟物联合组细胞凋亡率为(51.23 ± 5.41)%,高于硼替佐米单独处理组(31.70 ± 4.40)%和硼替佐米与模拟物对照联合处理组[(51.23±5.41)%对(31.70±4.40)%,P=0.047;(51.23±5.41)%对(27.94±4.04)%,P=0.028)],而miR-202模拟物联合沙利度胺和地塞米松与miR-202模拟物对照组相比差异无统计学意义[(11.66±1.91)%对(10.63±1.74)%,P=0.700;(16.35±1.32)%对(17.43±1.95)%,P=0.400]。miR-202模拟物联合硼替佐米对U266细胞的增殖抑制率高于硼替佐米单独处理组[(36.93±5.98)%对(18.18±4.10)%,P=0.029]。miR-202模拟物及硼替佐米处理U266细胞后,p-JNK蛋白表达水平下调。
结论
miR-202模拟物和硼替佐米可协同抑制MM细胞增殖、诱导其凋亡,可能通过miR-202负向调控靶基因BAFF的表达、抑制JNK/SAPK信号通路的活化来实现的。
Keywords: 多发性骨髓瘤; 微RNAs; 抗药性, 肿瘤; 信号通路
Abstract
Objective
To explore the role of miR-202 in multiple myeloma (MM) cells, and study the regulation of miR-202 on drug sensitivity of MM cells.
Methods
miR-202 and BAFF mRNA levels were detected by real-time PCR. U266 cells were transfected with miR-202-mimics, miR-202-inhibitor, siBAFF and their negative controls. After above treatments, protein levels of Bcl-2 family and MAPK signaling pathway were detected by Western blot analysis, and the proliferation and apoptosis ability of MM cells were examined by WST-1, Annexin V-FLUOS assay, respectively.
Results
The results showed that the expression of miR-202 in CD138+ MM cells (0.304±0.354) and U266 cells (0.052± 0.009) were lower than in normal controls (3.550 ± 1.126) (P<0.001, P=0.009), whereas BAFF mRNA levels (5.700 ± 0.734, 9.576 ± 2.887) were higher than in normal controls (1.819 ± 0.853) (P<0.001, P= 0.006). The proliferation ability of U266 cells transfected with miR-202 mimics was significantly inhibited than in control group [(56.04±0.021)% vs (18.89±0.32)%, P=0.002]. The result of Western blot showed that the expression of Bcl-2 decreased by about 24%, and the expression of Bax increased by about 124% in cells transfected with miR-202 mimics. The apoptosis rate in cells transfected with miR-202 mimics was significantly more than in control group [(49.60±4.89)% vs (26.20±1.28)%, P=0.029]. The apoptosis rate in miR-202 mimics combined with Bort group (51.23±5.41)% was higher as compared with Bort treatment alone (31.70±4.40)% or miR-202 mimics control combined with Bort group (27.94±4.04)%, (P=0.047, P= 0.028), whereas the apoptosis rate in miR-202 mimics combined with Thal or Dex had no significant difference compared with miR-202 mimics control [(11.66±1.91)% vs (10.63±1.74)%, P=0.700; (16.35± 1.32)% vs (17.43 ± 1.95)%, P=0.400]. The inhibitory rate of cell growth in miR-202 mimics combined with Bort group was higher as compared with Bort treatment alone [(36.93±5.98)% vs (18.18±4.10)%, P= 0.029]. The expressions of p-JNK protein decreased in U266 cells transfected with miR-202 mimics and treated with Bort.
Conclusion
miR-202 mimics combined with Bort could inhibit proliferation and induce apoptosis of U266 cells through negative regulating target gene BAFF, which further inhibited the JNK/SAPK signaling pathway.
Keywords: Multiple myeloma; MicroRNAs; Drug resistance, neoplasm; Signaling pathway
多发性骨髓瘤(MM)是一种目前仍不可治愈的浆细胞恶性肿瘤[1]–[2]。目前研究报道MM细胞的耐药机制主要包括NF-κB、JAK/Stat3、MEK/MAPK等信号通路的活化[3]。microRNA (miRNA)是一类包含21~25个核苷酸的小非编码RNA家族。近年来是肿瘤研究领域的研究热点,主要通过部分或完全互补至靶基因mRNA的3′ UTR,抑制或降解靶基因mRNA,从而在转录后水平调节基因表达[4]。miRNA除了在正常生理过程中发挥作用,还参与许多疾病的发生发展[5]–[6]。通过基因芯片技术在MM患者样本和细胞株发现了miR-181、miR-21、miR-17-92、miR-202和miR-9等许多miRNA分子。我们前期研究发现MM患者外周血单个核细胞中表达miR-202及其靶基因B淋巴细胞刺激因子(BAFF),但是两者的功能及相互作用尚不清楚[7]–[8]。Gao等[9]研究发现miRNA能调节白血病细胞株对药物的敏感性和耐药性。本研究旨在观察miR-202联合硼替佐米、沙利度胺和地塞米松对MM细胞增殖及凋亡的影响并探讨MAPK信号通路在miR-202调节MM细胞耐药中的作用。
材料与方法
1.主要试剂:Bax、Bcl-2、β-Actin抗体购自上海碧云天生物技术有限公司南通分公司;c-Jun氨基末端激酶(JNK)、磷酸化c-Jun氨基末端激酶(p-JNK)、p38、p-p38、细胞外调节蛋白激酶(ERK)、磷酸化细胞外调节蛋白激酶(p-ERK)抗体为美国Cell Signaling公司产品;Annexin V-FLUOS Staining kit、Cell Proliferation Reagent WST-1为德国Roche公司产品;lipo2000、逆转录试剂为立陶宛Fermentas公司产品;FBS为美国Hyclone公司产品;RPMI1640培养基、Opti-MEM Reduced Serum Medium为美国Gibco公司产品;B淋巴细胞刺激因子干扰质粒(siBAFF,BAFF-homo-708)为上海吉玛制药技术有限公司产品;TRIzol、has-miR-202模拟物、has-miR-202抑制物、阴性对照、抑制物阴性对照为Invitrogen公司产品。
2.样本来源及细胞培养:骨髓标本来自2013年9月至2014年12月南通大学附属医院就诊的7例初诊MM患者[男4例,女3例,中位年龄60 (50~65)岁]和3名志愿者[男2名,女1名,中位年龄54 (48~60)岁]。本研究经南通大学附属医院伦理委员会批准,所有受试者均知情同意。人MM细胞系U266细胞购于上海拜力生物科技有限公司,悬浮生长于含10%胎牛血清、1%链霉素-青霉素、1%谷氨酰胺的RPMI 1640培养基中,置于37 °C、含5%CO2的培养箱中进行培养。
3.细胞转染:收集对数生长期细胞,按每孔(2~8)×105的密度接种于6孔板,6 h后分别将miR-202模拟物(5′-AGAGGUAUAGGGCAUGGGAA-3′、5′-CCCAUGCCCUAUACCUCUUU-3′)、阴性对照(5′-UUCUCCGAACGUGUCACGUTT-3′、5′-ACGUGACACGUUCGGAGAATT-3′)、miR-202抑制物(5′-UUCCCAUGCCCUAUACCUCU-3′)、siBAFF(5′-CAUGGCUUCUCAGCUUUAATT-3′、5′-UUAAA GCUGAGAAGCCAUGTT-3′)转染入U266细胞中,培养48~72 h后分别提取总RNA和蛋白。
4.逆转录PCR将U266细胞及MM患者CD138+浆细胞中RNA逆转录成cDNA:TRIzol法提取细胞总RNA,用紫外分光光度计测得总RNA浓度,取5 µg RNA进行逆转录。反应条件:42 °C 60 min,70 °C 5 min。逆转录产物于−20 °C保存。
5.荧光定量PCR检测U266细胞及MM患者CD138+浆细胞miR-202及BAFF mRNA的表达水平:BAFF引物序列:5′-TGTCACCGCGGGACTGAAAATCT-3′(上游引物),5′-TGTCTGCAATCAGTTGCAAGCAGT-3′(下游引物),以GAPDH和U6作为内参基因。miR-202引物购自广州锐博生物科技有限公司。反应体系:SYBR GreenⅠmix(Rox)10 µl,cDNA 3 µl,上、下游引物各0.5 µl,RNase-free水补足至20 µl。反应条件:95 °C 10 min; 95 °C 15 s, 60 °C 15 s, 72 °C 31 s, 40个循环。
6.Western blot检测U266细胞转染miR-202模拟物、抑制物、siBAFF及其对照后凋亡相关蛋白及MAPK信号通路中蛋白表达水平:用RIPA裂解液(含1%PMSF)提取细胞总蛋白,紫外分光光度计检测蛋白浓度,取400 µg总蛋白进行SDS-聚丙烯酰胺凝胶电泳(80 V 40 min, 100 V 60 min),并将蛋白从SDS-PAGE凝胶转至PVDF膜(300 mA 120 min)。50 g/L脱脂奶粉/TBST液封闭2 h。按1∶600稀释一抗(Bcl-2、Bax、JNK、p-JNK、p38、p-p38、ERK、p-ERK),按1∶1 000稀释β-actin抗体,4 °C孵育过夜。按1∶1 000稀释二抗(山羊抗兔IgG、山羊抗鼠IgG),室温孵育2 h,用增强化学发光液进行显影。
7.WST-1细胞增殖检测:收集对数生长期U266细胞,按3 000细胞/孔的密度种入96孔板,6 h后转染miR-202模拟物、miR-202抑制物、siBAFF及其对照,培养基补足至每孔100 µl,24~72 h后每孔加入10 µl WST-1试剂,继续培养2 h后,用酶标仪测量各孔450 nm(650 nm参考)的吸光度(A)值。每组设5个复孔,实验重复3次,结果取均数。按以下公式计算细胞增殖抑制率。
8.流式细胞术(Annexin V-FLUOS)检测细胞凋亡:细胞种板,6 h后转染miR-202模拟物及其对照,48 h后收集6孔板内细胞,移入2 ml EP管中,离心后1×PBS洗涤2次,按试剂盒说明书配制细胞染液,室温孵育10~15 min,混匀进行流式细胞术检测。实验重复3次,结果取均数。此外,用50 nmol/L硼替佐米、200 µmol/L沙利度胺、10 nmol/L地塞米松单药及联合50 nmol/L miR-202模拟物作用于U266细胞,采用上述方法检测细胞凋亡率。
9.统计学处理:应用SPSS 17.0软件进行分析。实验数据以x±s表示,两组比较采用Mann-Whitney U检验,P<0.05为差异有统计学意义。
结果
1.U266细胞及MM患者CD138 +浆细胞miR-202 mRNA及BAFF的表达:流式细胞术分选MM患者及健康人骨髓来源CD138+浆细胞。提取U266细胞株及CD138+浆细胞的总RNA进行逆转录及荧光定量PCR。U266细胞、MM患者CD138+浆细胞miR-202 mRNA相对表达量分别为0.052± 0.009、0.304 ± 0.354,均低于健康对照组(3.550 ± 1.126)(P<0.001,P=0.009)。通过检索microRNA. org与DIANA-miT生物信息学工具预测发现B淋巴细胞刺激因子(BAFF)是miR-202潜在的靶基因,荧光素酶报告基因进一步证实两者之间的调控关系[8]。实时荧光定量PCR检测结果显示U266细胞、MM患者CD138+浆细胞BAFF表达分别为5.700± 0.734、9.576 ± 2.887,均高于健康对照组(1.819 ± 0.853)(P<0.001,P=0.006)。
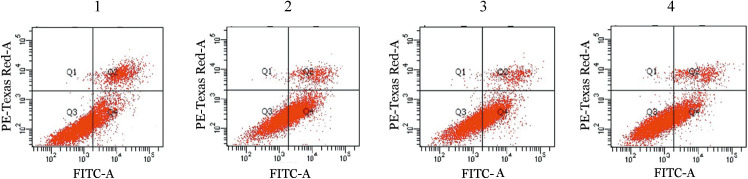
2.miR-202对U266细胞生长和凋亡的影响:U266细胞转染miR-202模拟物(mimics)、miR-202抑制物(Inhibitor)、siBAFF及其对照。WST-1实验发现miR-202模拟物转染组细胞增殖抑制率为(56.04±0.02)%,与对照组[(18.89±0.32)%]相比,差异有统计学意义(P=0.002),提示miR-202可通过靶向BAFF抑制U266细胞增殖。Western blot结果显示,转染miR-202模拟物后,Bcl-2表达下调约24%,Bax蛋白表达上调约1.24倍(图1),提示miR-202能够诱导U266细胞凋亡。此外,流式细胞术结果显示,miR-202模拟物组细胞凋亡率高于对照组[(49.60 ± 4.89)%对(26.20 ± 1.28)%,P=0.029],siBAFF组、miR-202抑制物组细胞凋亡率分别为(30.70±1.44)%、(40.40±1.34)%,与对照组相比差异无统计学意义(P值分别为0.200、0.310)(图2),提示miR-202模拟物抑制U266细胞增殖、促进细胞凋亡。
图1. Western blot法检测转染miR-202模拟物对U266细胞凋亡相关蛋白表达的影响.
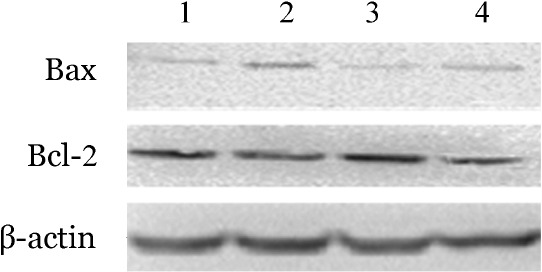
1:对照组;2:miR-202模拟物;3:miR-202抑制物;4:BAFF干扰质粒(siBAFF)
图2. 流式细胞术检测miR-202对U266细胞凋亡的影响.
1:对照组;2:miR-202模拟物;3:miR-202抑制物;4:BAFF干扰质粒(siBAFF)
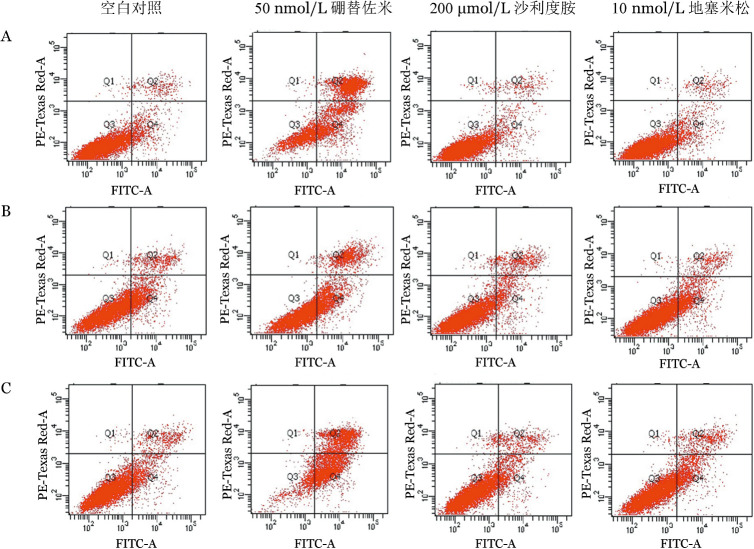
3.流式细胞术检测miR-202、硼替佐米、沙利度胺、地塞米松对U266细胞凋亡的影响:为了研究miR-202在抗骨髓瘤药物诱导的MM细胞凋亡中作用,我们单独使用miR-202模拟物或抗骨髓瘤药物以及两者联合处理U266细胞后,用流式细胞术检测细胞凋亡情况。如图3所示,硼替佐米和miR-202模拟物联合组凋亡率[(51.23±5.41)%]高于硼替佐米单独处理组[(31.70±4.40)%,P=0.047]和硼替佐米与模拟物对照联合处理组[(27.94 ± 4.04)%,P= 0.028]。然而,模拟物对照组与miR-202模拟物联合沙利度胺、地塞米松组的细胞凋亡率差异无统计学意义[(11.66±1.91)%对(10.63±1.74)%,P=0.700;(16.35 ± 1.32)%对(17.43 ± 1.95)%,P=0.400],提示miR-202模拟物增加了U266细胞对硼替佐米的敏感性,也就是说MM中miR-202的低表达与MM对硼替佐米的耐药相关。
图3. 流式细胞术分析miR-202与抗多发性骨髓瘤药物对U266细胞凋亡的影响.
A:未转染;B:转染miR-202对照;C:转染miR-202模拟物
4.miR-202模拟物对U266细胞药物敏感性的影响:硼替佐米、miR-202模拟物对U266细胞增殖抑制率分别为(18.18±4.10)%、(15.38±1.90)%,两者联合的抑制率为(36.93±5.98)%,与单独使用硼替佐米相比差异有统计学意义(P=0.029)。单独用地塞米松、miR-202模拟物对U266细胞增殖抑制率分别是(17.47±4.92)%、(15.50±2.31)%,两者联合的抑制率为(26.67±2.89)%,与单独使用地塞米松相比差异无统计学意义(P=0.100)。沙利度胺单独、联合miR-202对U266细胞增殖抑制率差异无统计学意义[(15.68±2.27)%对(20.55±4.90)%,P=0.200]。以上结果提示miR-202表达的上调使U266细胞对硼替佐米更敏感。
5.Western blot检测miR-202对MAPK信号通路的影响:U266细胞中有ERK、p38、JNK和p-JNK表达,未检测到p-ERK和p-p38表达且miR-202模拟物组p-JNK表达水平下调约20%(图4),表明JNK/SAPK信号通路参与了miR-202的表达调控。我们进一步检测了硼替佐米处理48 h后U266细胞p-JNK的表达水平。结果显示与对照组相比,miR-202模拟物组和siRNA-BAFF组的p-JNK表达水平分别下调52%、67%(图5),表明miR-202模拟物与siRNA-BAFF有类似的作用。这些结果提示miR-202能够负向调控BAFF的表达,进一步抑制JNK/SAPK信号通路的活化,从而增强了MM细胞对硼替佐米敏感性。
图4. Western blot检测miR-202对MAPK信号通路的影响.
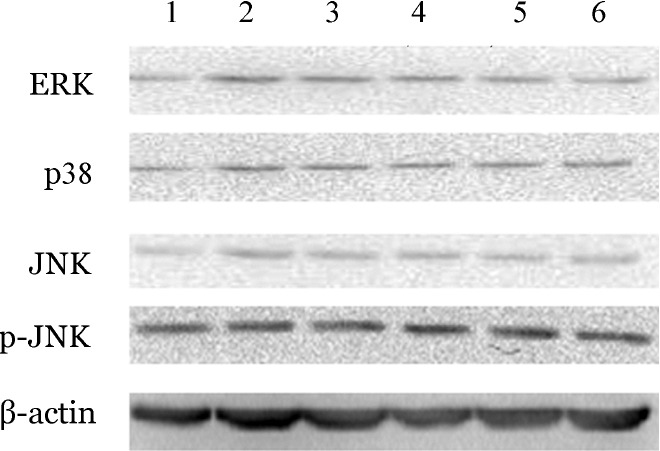
1:BAFF干扰质粒;2:抑制物;3:抑制物阴性对照;4:模拟物;5:模拟物阴性对照;6:对照组
图5. Western blot分析经硼替佐米处理48 h后U266细胞p-JNK水平.
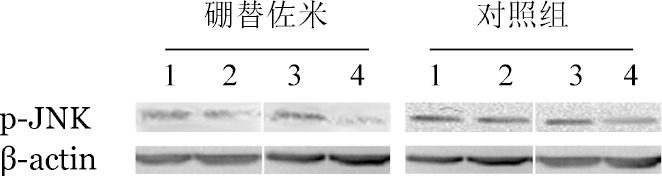
1:对照组;2:miR-202模拟物;3:BAFF干扰质粒对照;4:BAFF干扰质粒
讨论
MM是一种克隆B细胞恶性疾病,以骨髓中浆细胞异常和不可控制的增殖、骨损伤和免疫缺陷为特征。浆细胞的恶性增殖产生大量无功能的单克隆免疫球蛋白或片段,临床表现为贫血、肾损伤、骨损伤和感染。目前,MM患者由于耐药的产生而缺乏有效的治愈方案[10]。
BAFF通过连接受体B细胞成熟抗原(BCMA)、转膜蛋白复合物(TACI)和BAFF受体(BAFF-R/BR3)在调节B细胞和T细胞增殖与生存中发挥重要作用。越来越多的证据显示BAFF影响恶性B细胞的生长和生存,促进MM细胞增殖和生存,与MM发展和进程密切相关[11]。我们的前期研究表明MM患者外周血及MM细胞株中BAFF及其受体的表达显著高于正常对照组[12]–[13],提示BAFF在MM起始和进展中发挥重要作用。近来有研究表明BAFF参与MM耐药的发生[14]。然而,BAFF在MM发病机理和耐药中的生物学作用并不十分清楚。
前期研究发现MM患者血清miR-202表达水平显著升高,且与血清β2微球蛋白和κ链浓度有一定相关性[15]。本研究中MM患者CD138+细胞和U266细胞株中miR-202 mRNA低表达,与前期研究相反,可能由于骨髓基质细胞(BMSC)分泌高水平BAFF[16],具体机制仍需进一步研究。
尽管MM患者对硼替佐米最初反应总体很好,但随着时间的推移许多患者会产生耐药,MM患者对硼替佐米药物敏感性和耐药性的准确调节机制仍未阐明[17]。本研究的结果提示,miR-202模拟物使U266细胞对硼替佐米敏感且联合miR-202模拟物对MM细胞生存的抑制作用更为显著。这些结果提示miR-202表达的调节机制可能是MM治疗的一个潜在靶点。
许多研究表明不同的药物通过改变MAPK信号通路的活化发挥其抑制MM细胞增殖和生存的能力[18]–[19]。我们在前期研究中发现BAFF能激活JNK/SAPK信号通路、BAFF siRNA抑制JNK/SAPK信号通路,提示JNK/SAPK信号通路的活化程度与BAFF表达水平呈正相关[19]。本研究中我们发现U266细胞转染miR-202模拟物后MAPK信号通路中p-JNK表达下调,提示miR-202抑制JNK/SAPK信号通路,且JNK/SAPK信号通路参与miR-202对BAFF的调控。同时对硼替佐米治疗反应性的提高可能由于miR-202对BAFF介导的信号通路的抑制作用,进而阻碍JNK/SAPK信号通路的再活化,提示miR-202靶向BAFF可能为MM患者的治疗提供新的选择。
Funding Statement
基金项目:国家自然科学基金面上项目(81271920、81301498);江苏省重点研发专项(BE2015654);江苏省卫计委科研课题(H201422、H201526)
Fund program: National Natural Science Foundation of China(81301498, 81271920); Key Project of Jiangsu Province(BE2015654); Scientific Research Foundation for Jiangsu Provincial Commission of Health and Family Planning(H201422, H201526)
References
- 1.Cömert M, Güneş AE, Sahin F, et al. Quality of life and supportive care in multiple myeloma[J] Turk J Haematol. 2013;30(3):234–246. doi: 10.4274/Tjh.2012.0192. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Andrews SW, Kabrah S, May JE, et al. Multiple myeloma: the bone marrow microenvironment and its relation to treatment[J] Br J Biomed Sci. 2013;70(3):110–120. doi: 10.1080/09674845.2013.11669945. [DOI] [PubMed] [Google Scholar]
- 3.Fuchs O. Targeting of NF-kappaB signaling pathway, other signaling pathways and epigenetics in therapy of multiple myeloma[J] Cardiovasc Hematol Disord Drug Targets. 2013;13(1):16–34. doi: 10.2174/1871529X11313010003. [DOI] [PubMed] [Google Scholar]
- 4.Calin GA, Croce CM. MicroRNA signatures in human cancers[J] Nat Rev Cancer. 2006;6(11):857–866. doi: 10.1038/nrc1997. [DOI] [PubMed] [Google Scholar]
- 5.Kong YW, Ferland-McCollough D, Jackson TJ, et al. micro RNAs in cancer management[J] Lancet Oncol. 2012;13(6):e249–258. doi: 10.1016/S1470-2045(12)70073-6. [DOI] [PubMed] [Google Scholar]
- 6.Corsini LR, Bronte G, Terrasi M, et al. The role of microRNAs in cancer: diagnostic and prognostic biomarkers and targets of therapies[J] Expert Opin Ther Targets. 2012;16 Suppl 2:S103–109. doi: 10.1517/14728222.2011.650632. [DOI] [PubMed] [Google Scholar]
- 7.张 霞, 王 旭东, 申 娴娟, et al. 多发性骨髓瘤患者外周血单个核细胞miR-202的表达及意义[J] 中华检验医学杂志. 2011;34(10):931–934. doi: 10.3760/cma.j.issn.1009-9158.2011.10.014. [DOI] [Google Scholar]
- 8.Shen X, Guo Y, Yu J, et al. miRNA-202 in bone marrow stromal cells affects the growth and adhesion of multiple myeloma cells by regulating B cell-activating factor[J] Clin Exp Med. 2016;16(3):307–316. doi: 10.1007/s10238-015-0355-4. [DOI] [PubMed] [Google Scholar]
- 9.Gao SM, Xing CY, Chen CQ, et al. miR-15a and miR-16-1 inhibit the proliferation of leukemic cells by down-regulating WT1 protein level[J] J Exp Clin Cancer Res. 2011;30:110. doi: 10.1186/1756-9966-30-110. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Fonseca R, Monge J, Dimopoulos MA. Staging and prognostication of multiple myeloma[J] Expert Rev Hematol. 2014;7(1):21–31. doi: 10.1586/17474086.2014.882224. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Fragioudaki M, Boula A, Tsirakis G, et al. B cell-activating factor: its clinical significance in multiple myeloma patients[J] Ann Hematol. 2012;91(9):1413–1418. doi: 10.1007/s00277-012-1470-x. [DOI] [PubMed] [Google Scholar]
- 12.Jiang P, Yueguo W, Huiming H, et al. B-Lymphocyte stimulator: a new biomarker for multiple myeloma[J] Eur J Haematol. 2009;82(4):267–276. doi: 10.1111/j.1600-0609.2008.01203.x. [DOI] [PubMed] [Google Scholar]
- 13.Ju S, Wang Y, Ni H, et al. Correlation of expression levels of BLyS and its receptors with multiple myeloma[J] Clin Biochem. 2009;42(4-5):387–399. doi: 10.1016/j.clinbiochem.2008.10.024. [DOI] [PubMed] [Google Scholar]
- 14.Podar K, Chauhan D, Anderson KC. Bone marrow microenvironment and the identification of new targets for myeloma therapy[J] Leukemia. 2009;23(1):10–24. doi: 10.1038/leu.2008.259. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Yu J, Qiu X, Shen X, et al. miR-202 expression concentration and its clinical significance in the serum of multiple myelomapatients[J] Ann Clin Biochem. 2014;51(Pt 5):543–549. doi: 10.1177/0004563213501155. [DOI] [PubMed] [Google Scholar]
- 16.Tai YT, Li XF, Breitkreutz I, et al. Role of B-cell-activating factor in adhesion and growth of human multiple myeloma cells in the bone marrow microenvironment[J] Cancer Res. 2006;66(13):6675–6682. doi: 10.1158/0008-5472.CAN-06-0190. [DOI] [PubMed] [Google Scholar]
- 17.Coppo R. Proteasome inhibitors in progressive renal diseases[J] Nephrol Dial Transplant. 2014;29(Suppl 1):i25–i30. doi: 10.1093/ndt/gft271. [DOI] [PubMed] [Google Scholar]
- 18.Wen J, Feng Y, Huang W, et al. Enhanced antimyeloma cytotoxicity by the combination of arsenic trioxide and bortezomib is further potentiated by p38 MAPK inhibition[J] Leuk Res. 2010;34(1):85–92. doi: 10.1016/j.leukres.2009.05.024. [DOI] [PubMed] [Google Scholar]
- 19.Xu G, Shen XJ, Pu J, et al. BLyS expression and JNK activation may form a feedback loop to promote survival and proliferation of multiple myeloma cells[J] Cytokine. 2012;60(2):505–513. doi: 10.1016/j.cyto.2012.06.317. [DOI] [PubMed] [Google Scholar]